2. 安徽省中医药科学院药物制剂研究所, 安徽 合肥 230012;
3. 安徽省教育厅现代药物制剂工程技术研究中心, 安徽 合肥 230012
2. Institute of Pharmaceutics, Anhui Academy of Chinese Medicine, Hefei 230012, China;
3. Engineering Technology Research Center of Modernized Pharmaceutics, Education Office of Anhui Province, Hefei 230012, China
多肽类药物[1-3]是两个至多个氨基酸通过肽键连接而成的化合物, 多为亲水性的极性大分子, 因其高活性低毒性, 已越来越多地用于各种疾病的治疗, 如多肽类抗生素[4, 5]; 多肽类疫苗[6, 7]; Urantide[8]、胰高血糖素样肽1[9]、Adipokines[10]等。醋酸去氨加压素(相对分子质量1 129.2)是一种合成的抗利尿激素类似物[11-13], 可用于治疗夜间多尿、尿崩症及控制出血, 去氨加压素和内源性血管加压素的抗利尿活性通过同一途径发挥作用, 主要作用于肾集合管和髓袢升支粗端, 血管升压作用远低于天然的加压素, 仅为其1/400, 并且不会对正常激素产生干扰。目前, 其临床常用剂型为注射剂和口服片剂, 由于静脉注射需在治疗期间每天给药, 给患者带来很大痛苦且给药不方便; 而口服给药顺应性较好, 但蛋白多肽类药物需要通过各种生物屏障(如肠上皮细胞膜、胃酸、各种消化酶、首过效应等), 不稳定[14], 因而一般生物利用度很低, 且对于婴幼儿, 口服片剂给药风险大。因此, 近年来多肽类药物的黏膜给药一直是剂型研究的热点, 如口腔黏膜[15]、鼻黏膜[16, 17]等。目前临床也有醋酸去氨加压素鼻喷剂, 但鼻黏膜给药时, 纤毛清除机制会影响药物的吸收[18]。
眼部给药是常用的黏膜给药途径, 但眼黏膜给药常用于局部疾病的治疗, 一般通过眼角膜渗透发挥作用[19], 角膜对亲脂性药物的渗透性较高。结膜吸收是眼部药物吸收的另一主要途径, 结膜表面积约为角膜的20倍, 对亲水性的大分子药物有相当高的渗透性, 药物经结膜吸收后, 可经结膜血管网进入体循环, 有研究显示, 滴眼液中约34%~79%的药物可经结膜进入全身循环[20-22]。Chiou等[23-25]也曾尝试将胰岛素等药物通过眼部实现全身转运, 结果显示这些小分子肽类药物可以进入全身循环。
因此, 本实验以醋酸去氨加压素为模型药物, 通过比较药物经家兔眼部给药、静脉注射以及灌胃给药后的药动学及药效学特征, 探索多肽类药物经眼部给药进入全身循环, 从而发挥全身治疗作用的可行性, 为相关制剂的研发提供理论依据。
材料与方法试剂和仪器 去氨加压素ELISA试剂盒(批号: 201905, 上海将来生物科技有限公司); 醋酸去氨加压素原料药(纯度 > 98.99, 批号: GT-D003, Go Top Peptide Biotech公司); SPECTRA MAX 190酶标仪(美国Molecular Devices公司); FA21021B十万分之一电子天平(上海越平科学仪器有限公司); TG16A-WS台式高速离心机(上海卢湘仪离心机仪器有限公司)。
实验动物 健康雄性家兔36只, 体重2.5~3 kg, 购自安徽省长临河医药科技有限公司, 合格证号为0002213, 动物许可证号为SCXK (皖) 2007-001, 饲养于安徽中医药大学药学院实验动物中心, 室温18~25 ℃, 相对湿度40%~70%。动物实验过程已通过安徽中医药大学动物伦理委员会批准。
ELISA测定法 分别设置标准孔、待测样品孔, 标准孔每孔加不同浓度标准溶液50 μL, 待测样品孔先加样品稀释液40 μL, 再加待测样品10 μL (相当于样品稀释5倍)。加样后, 每孔加酶标试剂100 μL, 用封板膜封板后, 置于37 ℃温育60 min; 揭掉封板膜, 弃去液体, 甩干, 每孔加满洗涤液(20倍浓缩洗涤液用蒸馏水20倍稀释后使用), 静置30 s后弃去, 重复5次, 甩干; 每孔先加入显色剂A 50 μL, 再加入显色剂B 50 μL, 轻轻震荡混匀, 37 ℃避光显色15 min; 每孔加终止液50 μL终止反应; 450 nm波长测定各孔的吸光度, 测定应在加终止液15 min以内进行。将样品吸光度代入线性方程, 计算样品浓度, 再乘以稀释倍数5, 即为样品的实际浓度。
线性关系 取48.0 pg·mL-1去氨加压素标准溶液依次稀释配制成1.0、3.0、6.0、12.0、24.0和48.0 pg·mL-1的系列标准溶液, 分别加入到设置好的ELISA试剂盒标准孔, 按照“ELISA测定法”项下的方法进行检测, 以标准溶液浓度为横坐标, 吸光度为纵坐标, 绘制标准曲线。
定量下限 取10份空白血浆样品, 按照“ELISA测定法”项下的方法测定其吸光度, 计算平均值及标准差(SD), 以10SD带入标准曲线计算的溶液浓度作为定量下限。
精密度及回收率 将家兔空白血浆离心取上清液, 加入适量的去氨加压素标准品, 配制成浓度为25.0、100.0和200.0 pg·mL-1的样品溶液各5份, 置-86 ℃冰箱保存备检。分别在6、12和24 h以及2、4和6天室温下冻融, 加入到设置好的待测样品孔, 按照“ELISA测定法”项下的方法检测其浓度, 计算日间、日内精密度, 同时计算实测值与理论值之间的比值。
家兔药动学实验 雄性家兔15只随机分成滴眼组(给药剂量为7.0 μg·kg-1)、静脉注射组(给药剂量为0.7 μg·kg-1)、灌胃组(给药剂量为7.0 μg·kg-1), 每组5只, 体重2 kg左右, 实验前禁食12 h, 正常饮水。家兔分别在给药后2、5、10、15、20、30、60、120、240、360、480和720 min心脏取血0.5 mL, 于肝素钠湿润过的离心管中, 混合10~20 min后, 2 500 r·min-1离心20 min, 取上清液, 保存于-86 ℃冰箱。按照“ELISA测定法”项下的方法测定血浆样品中的去氨加压素浓度。
家兔药效学实验 雄性家兔21只随机分成滴眼组(给药剂量为7.0 μg·kg-1)、静脉注射组(给药剂量为0.7 μg·kg-1)、灌胃组(给药剂量为7.0 μg·kg-1), 每组7只, 体重2 kg左右, 实验前禁食12 h, 正常饮水。家兔仰卧式固定, 用3%戊巴比妥钠麻醉, 导尿管甘油润滑之后缓缓插入家兔尿道至有尿液流出后再插入1 cm。实验前排尽膀胱内余尿, 导尿管法收集给药前3 h, 给药后0~3、3~6、6~9、9~12 h时间段尿量, 尿液早上7:00开始收集, 下午22:00收集结束。每个收集时段开始之前灌胃体重2%的37 ℃温水。
统计学分析 用统计学软件SPSS 23.0, 采用单因素方差分析对药动学数据进行检验, P < 0.05表示差异有统计学意义。
结果 1 方法学考察 1.1 标准曲线ELISA测定法测定去氨加压素的线性回归方程为Y = 0.025 1X + 0.034 7, R2 = 0.997, 线性范围为1.0~48.0 pg·mL-1。
1.2 定量下限测得10份空白血浆样品的吸光度平均值为0.045, SD为0.006, 将10倍SD代入标准曲线计算得定量下限为1.0 pg·mL-1。
1.3 精密度及回收率精密度及回收率实验结果见表 1, 由表可见该方法精密度良好, 准确度符合要求。
| 表 1 Precision and recovery of desmopressin in rabbit plasma. n = 5, x±s |
以取样时间为横坐标, 血浆中去氨加压素的平均血药浓度为纵坐标, 绘制血药浓度-时间曲线, 如图 1所示, 由图可见家兔眼部给药后在5.0 min时迅速达到最大血药浓度, 灌胃给药tmax为10.0 min。利用药动学软件DAS 3.2.8, 分别对静脉注射、灌胃给药以及滴眼给药的血药浓度数据进行非房室模型拟合, 主要药动学参数见表 2。
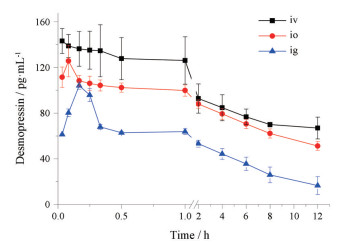
|
Figure 1 Mean plasma concentration of desmopressin vs time after intravenous (iv), intraocular (io) and intragastric (ig) administration in rabbits |
| 表 2 Pharmacokinetic parameters of desmopressin after iv, io and ig administration in rabbits. n = 5, x±s. *P < 0.05 vs iv, ΔP < 0.05 vs ig |
不同时间段尿量随时间的变化曲线如图 2所示, 由图可见, 静脉注射给药前3 h的初始尿量为53.0 mL, 在给药后的第1个收集时间段降为9.0 mL, 给药后第2个和第3个时间段尿量基本无变化, 最后一个时间段尿量为18.3 mL。眼部给药前3 h的初始尿量为42.5 mL, 在给药后的第1个3 h降为7.0 mL, 第2个3 h尿量为7.5 mL, 第3个3 h尿量为9.3 mL, 第4个3 h尿量为9.3 mL, 最后一个3 h尿量为19.0 mL。灌胃给药前3 h的初始尿量为37.7 mL, 在给药后的第1个收集时间段为7.0 mL, 但在之后的收集时间段中表现出上升趋势, 后面3个收集时间段尿量分别为22.3、30.3、45.3 mL。
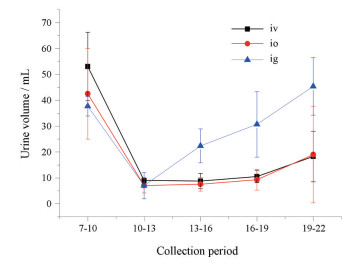
|
Figure 2 Urine volume after iv, io and ig administration |
本实验以醋酸去氨加压素为模型药物, 家兔为模型动物, 进行眼部给药、静脉注射以及灌胃给药后的药动学和药效学的比较性研究, 以探索多肽药物经眼部给药进入全身循环而达到治疗目的的可行性。药动学结果显示眼部给药与灌胃给药相比, 能快速达到最大血药浓度, 且峰浓度为121.6 pg·mL-1, 大于灌胃给药的104.1 pg·mL-1, 是其1.2倍。眼部给药的体内平均滞留时间(MRT)与静脉注射给药和灌胃给药的统计学分析结果显示无显著性差异。眼部给药的生物利用度是静脉注射途径(给药剂量为眼部给药的1/10)的87.3%, 且2 h后二者的血药浓度曲线基本在同一高度缓慢下降, 12 h后血药浓度下降至一半左右; 而与灌胃给药相比, 眼部给药的生物利用度是其1.9倍, 统计学结果显示有显著性差异。导致眼部给药与灌胃给药存在差异的主要原因, 可能是因为眼部给药无首过效应, 且药物直接经眼部毛细血管网吸收入血; 相对于灌胃给药, 需要通过的生物屏障较少。实验结果还显示家兔给药12 h后仍能检测到较高的血药浓度, 后续实验将延长取样时间点, 以得到更全面的药动学数据。药效学实验结果表明家兔眼部给药与静脉注射给药后(剂量为眼部给药的1/10), 整个尿液收集期间尿量变化基本相同, 且12 h尿量依然被抑制, 说明家兔眼部单剂量给药后, 药效持续12 h以上; 而灌胃给药的第1个3 h与静脉和眼部给药药效相似, 这与药动学实验结果相一致, 3 h后尿量逐渐上升, 给药后12 h显示已经没有抑制效果。由此可见, 醋酸去氨加压素经眼部给药后药效要明显优于灌胃给药。
综上所述, 醋酸去氨加压素作为小分子多肽药物, 经眼部给药吸收迅速, 生物利用度高, 且眼部给药简单方便, 无肝脏首过效应, 因此眼部给药可作为多肽类药物全身转运的新途径。但眼部给药实现全身转运还有很多问题有待深入研究, 如给药后药物通过哪些途径吸收入血; 哪些因素会影响其转运效率; 常规滴眼液滴入眼内, 因眨眼等动作导致大部分药液从眼角流失, 对给药剂量影响较大; 同时眼睛作为人类最重要、敏感的器官之一, 药物对眼睛的安全性如何等等, 因而研究眼部给药实现全身转运的工作任重而道远。
| [1] |
Otvos L. Current challenges in peptide-based drug discovery[J]. Front Chem, 2014, 2: 1-4. |
| [2] |
Mukherjee B, Karmakar SD, Hossain CM, et al. Peptides, proteins and peptide/ protein-polymer conjugates as drug delivery system[J]. Protein Peptide Lett, 2014, 21: 1121-1128. DOI:10.2174/0929866521666140804160907 |
| [3] |
Herring R. Lessons for modern insulin development[J]. Diabet Med, 2018, 35: 1320-1328. DOI:10.1111/dme.13692 |
| [4] |
Li C, Guan FL, Ren JJ, et al. The historical evolution and thinking of antibiotic[J]. Med Philos (医学与哲学), 2015, 36: 80-83. |
| [5] |
Sumi CD, Yang BW, Yeo IC, al et. Antimicrobial peptides of the genus bacillus: a new era for antibiotics[J]. Can J Microbiol, 2015, 61: 93-103. DOI:10.1139/cjm-2014-0613 |
| [6] |
Sable R, Parajuli P. Peptides, peptidomimetics, and polypeptides from marine sources: a wealth of natural sources for pharmaceutical applications[J]. Mar Drugs, 2017, 15: 218-242. DOI:10.3390/md15070218 |
| [7] |
Chen ZF, Bai L. Research progress in the source and mechanism of the anti-tumor polypeptide drugs[J]. J Immunol (免疫学杂志), 2018, 34: 1099-1104. |
| [8] |
Zhao J, Yu QX, Kong W, et al. The urotensin Ⅱ receptor antagonist, urantide, protects against at herosclerosis in rats[J]. Exp Ther Med, 2013, 5: 1765-1769. DOI:10.3892/etm.2013.1052 |
| [9] |
Nauck MA, Meier JJ, Cavender MA, et al. Cardiovascular actions and clinical outcomes with glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors[J]. Circulation, 2017, 13: 849-870. |
| [10] |
Andrade-Oliveira V, Câmara NO. Adipokines as drug targets in diabetes and underlying disturbances[J]. J Diabetes Res, 2015, 16: 1-11. |
| [11] |
Terho P. Desmopressin in nocturnal enuresis[J]. J Urol, 1991, 145: 818-820. DOI:10.1016/S0022-5347(17)38461-6 |
| [12] |
Cvetković RS. Desmopressin: in adults with nocturia[J]. Drugs, 2005, 65: 99-107. DOI:10.2165/00003495-200565010-00008 |
| [13] |
Kim SO, Yu HS. Efficacy of desmopressin to treat nocturnal polyuria in elderly men: effects on sleep quality[J]. Urol Int, 2016, 96: 438-442. DOI:10.1159/000443968 |
| [14] |
Qi YD, Su H, Chen L, et al. Research progress of peptide drugs[J]. Fujian Anal Test (福建分析测试), 2018, 27: 23-28. |
| [15] |
Zhu SJ, Li SM, Zhan CS. Research progress of oral mucosal drug delivery system[J]. Chin Tradit Pat Med(中成药), 2018, 40: 2266-2271. |
| [16] |
Pearson RG, Masud T, Blackshaw E, et al. Nasal administration and plasma pharmacokinetics of parathyroid hormone peptide PTH 1-34 for the treatment of osteoporosis[J]. Pharmaceutics, 2019, 11: 1-17. |
| [17] |
Balducci AG, Ferraro L, Bortolotti F, et al. Antidiuretic effect of desmopressin chimera agglomerates by nasal administration in rats[J]. Int J Pharm, 2013, 440: 154-160. DOI:10.1016/j.ijpharm.2012.09.049 |
| [18] |
Semenistaya E, Zvereva I, Thomas A, et al. Determination of growth hormone releasing peptides metabolites in human urine after nasal administration of GHRP-1GHRP-2, GHRP-6, hexarelin, and iamorelin[J]. Drug Test Anal, 2015, 7: 919-925. DOI:10.1002/dta.1787 |
| [19] |
Fangueiro JF, Veiga F, Silva AM, et al. Ocular drug delivery-new strategies for targeting anterior and posterior segments of the eye[J]. Curr Pharm Des, 2016, 22: 1135-1146. DOI:10.2174/1381612822666151216145900 |
| [20] |
Cunha-Vaz J, Marques FB, Fernandes R, et al. Drug transport across blood-ocular barriers and pharmacokinetics [M]//Velpandian T. Pharmacology of Ocular Therapeutics. Adis, Cham, 2016: 37-63.
|
| [21] |
Ramsay E, Del Amo EM, Toropainen E, et al. Corneal and conjunctival drug permeability: systematic comparison and pharmacokinetic impact in the eye[J]. Eur J Pharm Sci, 2018, 83-89. |
| [22] |
Zhang SY, Jiang YZ, Gao ZG. Research progress of new external intraocular delivery system[J]. Chin Med Biotechnol (中国医药生物技术), 2017, 12: 174-178. |
| [23] |
Chiou GCY. Systemic delivery of polypeptide drugs through ocular route[J]. J Ocul Pharmacol, 1994, 10: 93-99. DOI:10.1089/jop.1994.10.93 |
| [24] |
Chiou GCY. Improvement of systemic absorption of insulin through eyes with absorption enhancers[J]. J Pharm Sci, 1989, 78: 815-818. DOI:10.1002/jps.2600781007 |
| [25] |
Chiou GCY, Chuang CY. Systemic delivery of enkephalin peptide through eyes[J]. Life Sci, 1988, 43: 509-514. DOI:10.1016/0024-3205(88)90152-X |
 2020, Vol. 55
2020, Vol. 55


