2. 山西大学化学化工学院, 山西 太原 030006;
3. 中国医学科学院、北京协和医学院药物研究所, 北京 100050
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
随着人类预期寿命的大幅增长, 神经退行性疾病、心脑血管疾病、糖尿病、癌症等多种衰老相关疾病的发病率逐年增加, 导致医疗体系和社会经济的负担也日益沉重。而鉴于目前药物和手术治疗的局限性, 愈来愈多的研究者开始着眼于寻找有效的抗衰老药物, 以减少相关疾病的风险, 延长人的健康寿命, 其中部分研究者将目光聚焦在已有上千年临床应用历史的中药上, 并取得了许多进展[1]。
黄芩Scutellaria baicalensis Georgi为唇形科多年生草本植物, 根作为其传统药用部位, 是常用大宗药材之一, 具有抗菌抗病毒、解热镇痛抗炎、抗肿瘤、抗氧化等药理作用[2]。本小组前期研究发现黄芩根醇提物和主要单体成分黄芩素、汉黄芩素、汉黄芩苷等均具有抗衰老作用, 能够改善D-半乳糖致衰老大鼠的学习记忆能力, 延长果蝇寿命[3-7]。而黄芩茎叶作为地上部分, 生长茂盛且产量较大, 在中国北方部分地区有悠久的制茶饮用历史, 现代研究表明黄芩茎叶总黄酮具有如抗菌、抗炎、抗氧化、降血脂等多种与根相似的药理活性[8], 具有一定的临床药用价值和延缓衰老的潜力, 然而其抗衰老作用及机制研究却鲜有报道。
D-半乳糖致衰老大鼠模型是经典的衰老模型之一, 该模型通过在一定时间内连续注射大量D-半乳糖, 从而使大鼠表现出类似自然衰老的体征和症状, 如神经损伤、认知能力下降等, 由于造模简单、成本低、所需时间相对自然衰老较短、结果明显且稳定等优势, 被广泛应用于衰老机制研究和抗衰老药物筛选[9-12]。
代谢组学是系统生物学的最下游, 通过整体分析生物体内源性代谢物的动态变化和受影响的代谢通路, 研究药物或某些刺激因素的作用机制, 适合中医药复杂体系和衰老复杂过程的分析[13, 14], 而NMR技术因样品预处理简单、无损伤、无偏向性、重现性好、检测成本较低等优势, 在代谢组学研究中被广泛应用。血清是一种重要且易获取的生物流体, 流经生物体内的所有组织和器官, 是不同生理过程和应激反应产物的主要载体, 组织损伤、器官功能障碍、病理状态等均可影响其化学组成, 具有重要的临床意义[15]。肝脏是生物体的物质代谢中枢, 在调节糖类、脂质、蛋白质等代谢平衡中发挥重要作用; 《内经·灵枢》中记载:五十岁, 肝气始衰, 肝叶始薄, 胆汁始减, 目始不明, 认为肝脏功能衰退是衰老过程中进行性衰退的重要因素。
因此本实验采用D-半乳糖致衰老大鼠模型, 结合大鼠体重等外在表征、行为学试验以及血清生化指标, 评估黄芩叶醇提物的抗衰老作用, 并进一步应用1H NMR血清和肝脏代谢组学, 进行黄芩叶抗衰老代谢调节机制的整体分析, 为今后黄芩叶的药食资源开发提供可靠的实验依据。
材料与方法仪器与试剂 RE-52A旋转蒸发器(上海亚荣生化仪器厂); SCIENTZ-12N真空冷冻干燥机(宁波新芝生物科技股份有限公司); 自制旷场实验箱; TGL-16高速台式冷冻离心机(湖南湘仪离心机仪器有限公司); 电子超声组织匀浆器(宁波心之生物科技股份有限公司); SPT-24氮空吹扫浓缩仪(北京斯珀特科技有限公司); BSA124S分析天平(Sartorius, Germany); Bruker 600-MHz AVANCE Ⅲ核磁共振仪(Bruker, Germany)。无水乙醇(分析纯, 天津市风船化学试剂科技有限公司); D-半乳糖(Sigma-Aldrich, USA); 重水(Norell, Landisville, USA); 3-(三甲基硅基)丙酸钠-2, 2, 3, 3-D4 (TSP, Cambridge Isotope Laboratories Inc., USA); 丙二醛(malondialdehyde, MDA)、晚期糖基化终产物(advanced glycation end products, AGEs)试剂盒购自南京建成生物工程研究所, 按说明书操作。
黄芩叶醇提物的制备 黄芩叶样本购自山西佳辰中药材开发有限公司, 由山西大学秦雪梅教授鉴定为黄芩Scutellaria baicalensis Georgi的干燥叶并保存于山西大学中医药现代研究中心。取黄芩叶样本适量, 加10倍量的60%乙醇加热回流提取2次, 每次2 h, 合并提取液, 过滤取上清。经旋转蒸发仪浓缩, 真空冷冻干燥, 得到黄芩叶醇提物(Scutellaria baicalensis Georgi leaves extract, SLE), 产率为32.6%, 储存于4 ℃。
动物实验与样本收集 所有动物实验均通过山西大学科学研究伦理审查委员会审查。雄性SD大鼠(160~180 g)购自北京维通利华实验动物技术有限公司(许可证号SCKX-2016-0011), 在恒温(20~25 ℃)、恒湿(40%~70%)、12 h光暗循环的SPF级实验室中饲养, 实验过程中自由饮食、饮水。适应环境一周后, 40只雄性SD大鼠被随机分为4组, 包括空白组(Control)、模型组(Model)、黄芩叶低剂量组(LL, 生药量400 mg·kg-1)和高剂量组(LH, 生药量800 mg·kg-1), 每组各10只。模型组大鼠连续腹腔注射D-半乳糖(300 mg·kg-1) 7周, 复制衰老模型, 空白组注射等体积的生理盐水。黄芩叶低、高剂量组大鼠在造模同时分别灌胃给予相应剂量的黄芩叶醇提物, 空白组和模型组大鼠灌胃等体积的蒸馏水。
在实验中记录大鼠体重等外在表征变化, 并采用旷场实验评价衰老大鼠的自主活动能力和空间探索行为。旷场实验以大鼠直立次数和穿越格数作为评价指标, 实验时捏住大鼠的尾部将其轻轻放入自制旷场实验箱的中心位置, 松手后开始计时, 适应2 min后, 以大鼠两只前爪同时离地或趴墙为直立一次, 四足同时穿越白线为穿越格子一次, 观察并记录4 min内大鼠的直立次数和穿越格数。实验结束后, 所有大鼠禁食12 h, 用乌拉坦(20%, 5 mL·kg-1)麻醉, 股动脉取血, 静置30 min后, 4 ℃、3 500 r·min-1离心15 min取上清得大鼠血清, 保存于-80 ℃, 肝脏经液氮猝灭后储存于-80 ℃。
核磁备样方法 冰上冻融血清样本, 精密吸取450 μL, 加D2O 350 μL涡旋30 s混匀, 然后4 ℃、13 000 r·min-1离心20 min, 取上清液600 μL转移至5 mm核磁管中待测。取冰上解冻的肝脏样本200 mg, 加入蒸馏水300 μL、甲醇600 μL, 于冰水浴中超声匀浆1 min, 4 ℃、13 000 r·min-1离心20 min, 取上清液500 μL吹干, 再加入含TSP的混合磷酸盐缓冲液(pH 7.4) 600 μL复溶, 4 ℃、13 000 r·min-1离心15 min, 移取上清液550 μL至5 mm核磁管中待测[16]。
1 H NMR测试条件 所有样本均在Bruker 600 MHz AVANCE Ⅲ NMR共振波谱仪上采集数据。血清样品采用Carr-Purcell-Meiboom-Gill (CPMG)脉冲序列, 扫描次数为64, 谱宽12 019.2 Hz, 脉冲时间14 μs, 采样时间2.726 s, 弛豫时间1.0 s, 采样数据点32 768。肝脏样本采用noesygppr1d序列, 扫描次数为64, 谱宽12 345.7 Hz, 脉冲时间14 μs, 采样时间2.654 s, 弛豫时间1.0 s, 采样数据点32 768。
1 H NMR图谱处理与多元统计分析 使用MestRe Nova 12 (Mestrelab Research, Santiago de Compostella, Spain)进行1H NMR图谱相位和基线校正, 血清和肝脏图谱分别参考肌酐(δ 3.04)和TSP (δ 0.00)定标。以δ 0.01对所有图谱δ 0.80~9.00区域分段积分, 且去除δ 4.66~5.18和δ 1.21~1.126、δ 4.06~4.10区域以消除残留水峰和麻醉剂的影响, 此外肝脏图谱还去除δ 3.34~3.38区域以消除甲醇峰的影响。血清和肝脏图谱均以总峰面积归一化, 数据矩阵分别导入SIMCA-P 14.0 (Umetrics, Sweden)进行多元统计分析。
首先采用主成分分析(principal component analysis, PCA)通过数据降维, 直观表现所有样本之间的分组趋势; 其次采用正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)进行模型组和空白组比较, 采用CV-ANOVA (P < 0.05)评价模型质量, 并应用S-plot、VIP (variable importance in the projection)值(> 1)结合t检验寻找差异代谢物[17, 18], 代谢物的相对含量基于该代谢物最小重叠的特征NMR信号区域积分面积; 最后将所得差异代谢物的信息导入MetaboAnalyst 4.0 (https://www.metaboanalyst.ca/faces/ModuleView.xhtml)的Pathway Analysis模块, 该模块将通路富集分析与通路拓扑分析相结合, 以筛选关键的代谢通路。
血清生化指标 本实验通过连续注射大量D-半乳糖诱导大鼠快速衰老, 过量的D-半乳糖可通过半乳糖氧化酶导致过量氧自由基的生成, 进而导致脂质过氧化增加, MDA是脂质过氧化的终产物, 可衡量生物体的氧化应激水平; 过量的D-半乳糖也可通过蛋白质、脂质非酶促糖基化反应生成AGEs, 是衰老和许多退行性疾病的恶化因素[9]。因此本实验对上述血清生化指标进行测定, 以评估大鼠的衰老损伤程度和黄芩叶醇提物的保护作用。
统计学分析 实验结果采用OriginPro 2017 (OriginLab, USA)和GraphPad Prism 7.0 (San Diego, USA)进行绘图和统计分析, 通过oneway-ANOVA比较多组间差异, P < 0.05被认为具有显著性差异。
结果 1 黄芩叶醇提物对D-半乳糖致衰老大鼠的保护作用 1.1 外在表征造模7周后, 模型组的大鼠出现毛发蓬乱无光泽、易掉毛、背部皮肤松弛、尾部发黄、活动不灵活等衰老表征, 这可能与模型大鼠不同器官功能的进行性衰退有关; 而空白组和黄芩叶低、高剂量组大鼠无上述明显现象。造模7周大鼠体重如图 1所示, 模型组大鼠的体重与空白组相比略有增加, 但并无显著性差异; 黄芩叶低、高剂量组大鼠的体重与模型组相比亦无显著性差异, 表明D-半乳糖造模和黄芩叶低、高剂量给药对大鼠体重没有明显影响。
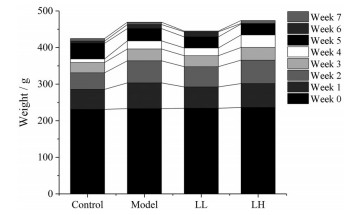
|
Figure 1 The effect of Scutellaria baicalensis Georgi leaves extract (SLE) on body weight of aging rats. n = 10, x±s. LL: 400 mg·kg-1, equivalent to the crude drug; LH: 800 mg·kg-1, equivalent to the crude drug |
黄芩叶醇提物对衰老大鼠旷场实验的影响如图 2所示, 模型组大鼠穿越格数(A)和直立次数(B)与空白组相比明显减少(P < 0.05), 表明D-半乳糖导致大鼠自主活动和空间探究能力下降。连续给予黄芩叶醇提物干预后, 大鼠的穿越格数和直立次数与模型组相比增加, 其中黄芩叶低剂量组的直立次数与模型组相比, 具有显著性差异(P < 0.05), 表明黄芩叶醇提物能改善衰老大鼠的自发活动行为。

|
Figure 2 The effect of SLE on open field test of aging rats. n = 10, x±s; A: Crossing, B: Rearing; #P < 0.05 vs Control; *P < 0.05 vs Model |
黄芩叶醇提物对衰老大鼠血清生化指标的影响如图 3所示, 模型组大鼠MDA (A)、AGEs (B)与空白组相比明显增加(P < 0.05, P < 0.001);连续给予低、高剂量黄芩叶醇提物后, 大鼠血清MDA、AGEs与模型组相比均显著降低(P < 0.05, P < 0.01, P < 0.001), 表明黄芩叶醇提物能改善大鼠的衰老损伤。

|
Figure 3 The effect of SLE on serum biochemical indexes of aging rats. n = 7, x±s; A: Malondialdehyde (MDA); B: Advanced glycation end products (AGEs); #P < 0.05, ###P < 0.001 vs Control; *P < 0.05, **P < 0.01, ***P < 0.001 vs Model |
空白组大鼠血清和肝脏典型1H NMR谱图如图 4所示, 结合HMDB (http://www.hmdb.ca/)和BMRB (http://www.bmrb.wisc.edu/)数据库, 对比化学位移、峰型和耦合常数, 分别在血清和肝脏中鉴定出35种和41种代谢物, 包括氨基酸、糖类、脂质、短链脂肪酸、糖酵解产物、三羧酸循环中间体、胆碱代谢物、嘌呤代谢物等, 见表 1。

|
Figure 4 Typical 1H NMR spectra of rat serum (A) and liver (B) obtained from control group (the No. 1-52 of metabolites were in agreement with those in Table 1) |
| 表 1 Assignments of 1H NMR spectra peaks obtained from serum and liver of rats. S: Serum; L: Liver |
为进一步研究黄芩叶醇提物对衰老大鼠的作用机制, 通过PCA和OPLS-DA分析大鼠整体代谢轮廓的变化并确定衰老大鼠的差异代谢物。
多元统计分析结果如图 5所示, 其中在血清(A, R2=0.873, Q2=0.802)和肝脏(B, R2=0.801, Q2=0.690)的PCA散点图中均观察到明显的分离, 表明模型组大鼠血清和肝脏中发生明显的代谢紊乱, 而黄芩叶低、高剂量给药可以改善大鼠代谢紊乱。图 5C (R2X=0.763, R2Y= 0.994, Q2=0.921, CV-ANOVA P < 0.05)和图 5D (R2X=0.793, R2Y=0.943, Q2=0.787, CV-ANOVA P < 0.05)分别为血清和肝脏的OPLS-DA散点图, 通过相应S-plot (图 5E和5F)、VIP值(> 1)以及代谢物相对积分面积t检验(图 6和图 7), 从血清和肝脏中均找出12个差异代谢物。
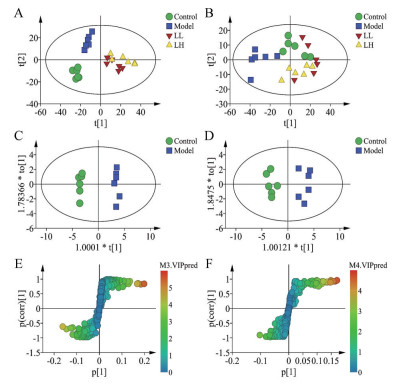
|
Figure 5 Multivariate statistical analysis of the effect of SLE on serum and liver metabolism. A, C, E: Serum; B, D, F: Liver; A, B: Principal component analysis (PCA); C, D: Orthogonal partial least squares discriminant analysis (OPLS-DA); E, F: S-plot |

|
Figure 6 The effect of SLE on the relative contents of serum differential metabolites. A: Leucine; B: Isobutyric acid; C: 3-Hydroxybutyric acid; D: Lactic acid; E: Threonine; F: Lysine; G: Glutamic acid; H: Glutamine; I: Acetone; J: Glycine; K: Glycerol; L: Guanidinoacetate; #P < 0.05, ##P < 0.01, ###P < 0.001 vs Control; *P < 0.05, **P < 0.01, ***P < 0.001 vs Model |
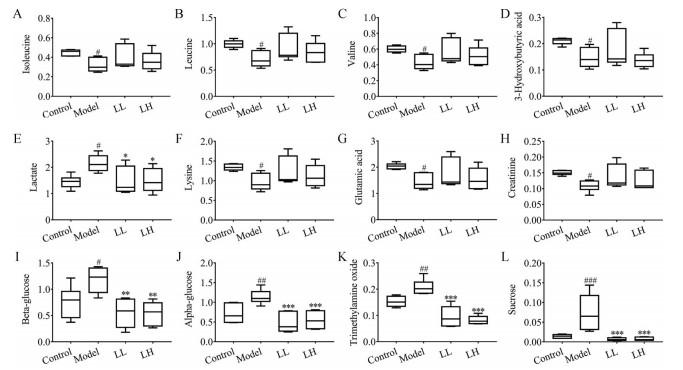
|
Figure 7 The effect of SLE on the relative contents of hepatic differential metabolites. A: Isoleucine; B: Leucine; C: Valine; D: 3-Hydroxybutyric acid; E: Lactic acid; F: Lysine; G: Glutamic acid; H: Creatinine; I: β-Glucose; J: α-Glucose; K: Trimethylamine oxide; L: Sucrose; #P < 0.05, ##P < 0.01, ###P < 0.001 vs Control; *P < 0.05, **P < 0.01, ***P < 0.001 vs Model |
图 8直观展示了在血清和肝脏中, 与空白组相比, 模型组显著上调或下调的差异代谢物, 其中乳酸、3-羟基丁酸、亮氨酸、赖氨酸和谷氨酸是血清和肝脏中共同的差异代谢物, 而亮氨酸、赖氨酸和谷氨酸在血清和肝脏中具有相反的调节方向。此外, 血清中氨基酸类差异代谢物基本呈现上调趋势, 而肝脏中氨基酸类差异代谢物基本呈现下调趋势。给予低、高剂量黄芩叶醇提物对上述差异代谢物具有不同程度的回调作用, 黄芩叶醇提物能回调所有的血清差异代谢物, 而仅对肝脏中显著上调的5个差异代谢物具有明显的下调作用, 其中α-葡萄糖、β-葡萄糖、蔗糖、乳酸均与糖代谢有关。
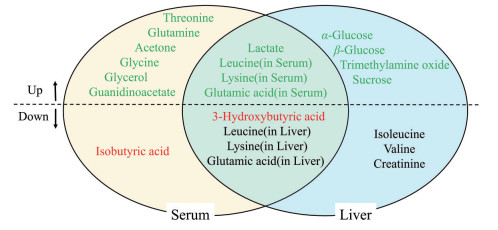
|
Figure 8 Differential metabolites in serum and liver. red font: Up-regulated in serum with SLE; green font: Down-regulated with SLE |
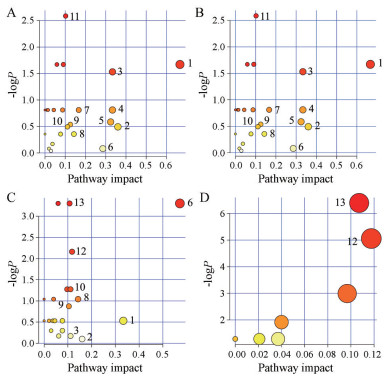
将模型组和黄芩叶醇提物显著影响的差异代谢物分别导入MetaboAnalyst 4.0进行通路分析(图 9), 其中pathway impact > 0.1的途径被认为是潜在的关键代谢通路。
|
Figure 9 Pathway analysis in serum and liver. A: Serum metabolic pathways associated with aging; B: Regulation of serum metabolic pathway by Scutellaria baicalensis Georgi; C: Hepatic metabolic pathways associated with aging; D: Regulation of hepatic metabolic pathway of Scutellaria baicalensis Georgi. 1: D-Glutamine and D-glutamate metabolism; 2: Alanine; aspartate and glutamate metabolism; 3: Nitrogen metabolism; 4: Cyanoamino acid metabolism; 5: Glycine; serine and threonine metabolism; 6: Valine; leucine and isoleucine biosynthesis; 7: Methane metabolism; 8: Synthesis and degradation of ketone bodies; 9: Aminoacyl-tRNA biosynthesis; 10: Butanoate metabolism; 11: Arginine and proline metabolism; 12: Glycolysis or gluconeogenesis; 13: Starch and sucrose metabolism |
图 9A表明, 模型组大鼠血清中D-谷氨酰胺和D-谷氨酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢等11个代谢通路受到干扰, 涉及氨基酸代谢、能量代谢、脂质代谢、糖代谢、遗传翻译等过程, 而黄芩叶醇提物能改善上述所有代谢通路紊乱(图 9B)。图 9C表明, 模型组大鼠肝脏中共有9条关键代谢通路受到干扰, 除缬氨酸、亮氨酸和异亮氨酸的生物合成、D-谷氨酰胺和D-谷氨酸代谢等与血清中相同的7条通路外, 还涉及糖酵解或糖异生、淀粉和蔗糖代谢通路, 而黄芩叶醇提物在肝脏中主要通过改善这两个通路的代谢紊乱发挥保护作用(图 9D)。
讨论衰老是涉及多系统、多组织的复杂退化过程, 因此本实验采用大鼠血清和肝脏样本进行非靶向代谢组学整合分析, 以综合反映生物体内与衰老相关的多种代谢变化, 有助于全面理解黄芩叶醇提物的作用机制[19]。通过代谢轮廓和代谢通路分析, 从衰老大鼠血清和肝脏中各筛选出12个差异代谢物, 血清和肝脏中分别有11个、9个代谢通路受到干扰; 在给予黄芩叶醇提物后, 所有血清差异代谢物和部分肝脏差异代谢物恢复到对照组水平, 表明黄芩叶醇提物可通过调节血清中所有受影响的代谢通路, 以及肝脏糖代谢通路发挥抗衰老作用。
在上述代谢通路中, D-谷氨酰胺和D-谷氨酸代谢, 丙氨酸、天冬氨酸和谷氨酸代谢, 氮代谢是衰老大鼠血清和肝脏中均出现异常且Pathway impact值较大的3条代谢通路, 谷氨酸和谷氨酰胺在其中都发挥着重要作用。谷氨酸是一种非必需氨基酸, 也是重要的中枢兴奋性神经递质, 能引起神经元兴奋性的长期变化, 与早期神经元形成、突触发育、学习认知功能相关, 谷氨酸还是抑制性神经递质γ-氨基丁酸的前体[20], 但其不易透过血脑屏障, 在脑内主要通过转氨基作用生成。谷氨酰胺可透过血脑屏障, 是氨的储存和运输形式, 并在肝脏中进行分解代谢, 在基因表达、细胞因子和激素生成、细胞增殖过程中发挥重要作用[21]。
文献研究表明在正常生理状态下, 体循环氨浓度保持在较低水平, 并通过谷氨酸-谷氨酰胺循环保护神经元免受氨损伤[22]。当肝脏代谢功能受损、尿素循环出现异常时, 氨浓度增加, 肝脏谷氨酰胺代谢异常, 而肝外组织中谷氨酰胺合成被激活, 最终可能导致血液、大脑等谷氨酰胺浓度增加, 过量的谷氨酰胺可介导氧化应激、线粒体膜通透性转变, 导致星形胶质细胞肿胀[23]; 同时, 脑中谷氨酰胺含量增加可通过影响谷氨酸-谷氨酰胺循环以及血脑屏障对于其他氨基酸如支链氨基酸的摄取, 从而影响脑内谷氨酸合成及其含量[24], 过量的谷氨酸具有兴奋性神经毒性, 可能会增加自由基生成, 诱导神经元损伤或凋亡, 介导脑损伤及多种神经退行性疾病, 也可能通过谷氨酸-丙氨酸转氨作用导致糖异生和葡萄糖耐受不良[24, 25]。
此外, α-酮戊二酸作为谷氨酸和谷氨酰胺合成的主要碳骨架来源, 大脑中谷氨酸和谷氨酰胺含量增加可能导致其含量降低, 从而影响三羧酸循环过程和能量生成[24]。同时, 支链氨基酸作为谷氨酸和谷氨酰胺的重要氨基供体, 肝外组织中谷氨酸和谷氨酰胺合成增加会激活其分解代谢, 而支链氨基酸主要经肝脏进入血循环后在肝外组织进行分解代谢[26], 因此最终导致支链氨基酸在肝脏中含量降低。支链氨基酸是必需氨基酸, 可通过磷脂酰肌醇-3激酶/蛋白激酶B/雷帕霉素靶蛋白(PI3K/AKT/mTOR)等信号通路调节葡萄糖、脂质和蛋白质合成[27], 在能量代谢和营养代谢中发挥关键作用, 其代谢异常与神经系统功能障碍、心血管疾病、免疫疾病、糖尿病、癌症等显著相关[28]。
差异代谢物和代谢通路分析证明, 模型组大鼠肝脏中谷氨酸含量显著降低, 血清中谷氨酸和谷氨酰胺含量显著增加, 血清和肝脏中相关代谢通路均发生明显异常; 同时, 模型组大鼠肝脏和血清中缬氨酸、亮氨酸、异亮氨酸生物合成通路也出现异常, 肝脏中支链氨基酸(亮氨酸、异亮氨酸和缬氨酸)含量显著降低, 均与文献报道相一致, 但血清中支链氨基酸(除亮氨酸)水平仍相对正常。这可能与血清能够较为全面地反映生物体内所有组织、器官的整体代谢变化有关。通路分析表明血清和肝脏中氨酰-tRNA生物合成发生异常, 该通路是蛋白质合成的起始阶段, 且血清中多种氨基酸代谢通路也出现异常, 提示衰老大鼠体内蛋白质分解与合成等生理过程可能受到干扰, 从而影响血清氨基酸含量, 血清中部分氨基酸含量异常增加可以佐证这一推论, 因此最终可能导致血清中支链氨基酸水平相对正常。本实验表明黄芩叶醇提物可以抑制血清谷氨酸、谷氨酰胺等差异代谢物含量异常, 调节氨基酸代谢、能量代谢、脂质代谢、遗传翻译等通路, 改善衰老大鼠血清代谢, 但是对衰老大鼠肝脏上述代谢通路并无显著改善作用。
分析表明, 在肝脏中衰老大鼠及黄芩叶醇提物的作用机制主要与糖代谢有关。葡萄糖是维持细胞活动的最基本的能量来源, 可通过糖酵解途径转化为丙酮酸并释放ATP, 并进一步通过无氧呼吸产生乳酸, 也可通过丙酮酸脱羧、三羧酸循环、氧化磷酸化供能, 还可通过糖酵解中间体6-磷酸葡萄糖转化为糖原、淀粉等贮存葡萄糖。糖异生是与糖酵解相反的过程, 可将乳酸、丙酮酸、氨基酸及甘油等前体物质转化为葡萄糖。
差异代谢物和代谢通路分析表明, 肝脏中α-葡萄糖、β-葡萄糖和蔗糖的含量显著增加, 糖代谢通路如糖酵解或糖异生、淀粉和蔗糖代谢出现明显异常, 同时血清和肝脏中乳酸含量显著增加。表明机体葡萄糖利用能力下降, 衰老机体很可能通过增加糖酵解以维持供能, 同时增加肝脏糖异生。此外, 肝脏中半乳糖代谢也出现异常(pathway impact = 0.097), 这与本实验通过连续注射大量D-半乳糖诱导大鼠衰老模型有关。正常浓度下D-半乳糖在肝脏中经Leloir途径最终转化为6-磷酸葡萄糖[29], 参与糖酵解过程; 而在高剂量下D-半乳糖通过氧化反应生成醛糖和过氧化氢, 并生成氧自由基, 导致细胞氧化损伤, 也易与蛋白质或脂质发生糖基化反应, 诱导多种衰老相关疾病[9]。在给予黄芩叶醇提物后, 通过调节肝脏糖酵解或糖异生、淀粉和蔗糖代谢, 抑制葡萄糖、蔗糖、乳酸的含量升高, 从而改善衰老大鼠肝脏糖代谢异常。
综上所述, 本实验结果表明黄芩叶醇提物具有抗衰老作用, 能够改善D-半乳糖致衰老大鼠外在表征、自主活动能力以及脂质过氧化、糖基化等衰老损伤, 可以通过调节血清氨基酸代谢、能量代谢、脂质代谢、糖代谢、遗传翻译等过程以及肝脏糖代谢紊乱, 改善衰老大鼠血清和肝脏代谢异常, 发挥抗衰老作用。
| [1] |
Shen CY, Jiang JG, Yang L, et al. Anti-ageing active ingredients from herbs and nutraceuticals used in traditional Chinese medicine: pharmacological mechanisms and implications for drug discovery[J]. Br J Pharmacol, 2017, 174: 1395-1425. DOI:10.1111/bph.13631 |
| [2] |
Xin WY, Song JK, He GR, et al. Progress in pharmacological study and the underlying mechanism of baicalein and baicalin[J]. Chin New Drug J (中国新药杂志), 2013, 22: 647-653. |
| [3] |
Chang YF. 1H NMR Based Metabonomic Study of the Anti-aging Effects of Scutellaria baicalensis Georgi (基于代谢组学的黄芩抗衰老作用评价及机制研究) [D]. Taiyuan: Shanxi University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10108-1017000195.htm
|
| [4] |
Duan DD, Gao L, Wang KX, et al. Baicalein prolongs the lifespan of Drosophila melanogaster through antioxidation activity[J]. Acta Pharm Sin (药学学报), 2016, 51: 1401-1406. |
| [5] |
Duan DD, Wang KX, Zhou YZ, et al. Baicalein exerts beneficial effects in D-galactose induced aging rats through attenuation of inflammation and metabolic dysfunction[J]. Rejuvenation Res, 2017, 20: 506-516. DOI:10.1089/rej.2017.1919 |
| [6] |
Yan ML. Metabonomics Study on Drosophila melanogaster Gender Gap in Aging Process and Scutellaria baicalensis Georgi Anti-aging Pharmacological Activity (基于代谢组学的果蝇衰老过程性别差异及黄芩醇提物抗衰老活性研究) [D]. Taiyuan: Shanxi University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10108-1017300248.htm
|
| [7] |
Xue LY. Study on Screening and Mechanism of Anti-aging Effective Ingredients of Scutellaria baicalensis (黄芩抗衰老有效成分筛选及其机制研究) [D]. Taiyuan: Shanxi University, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10108-1018312058.htm
|
| [8] |
Sa QE, Wu XJ. Advances in pharmacological studies of stems and leaves of Scutellaria baicalensis Georgi[J]. J Med Pharm Chin Minor (中国民族医药杂志), 2014, 20: 51-55. |
| [9] |
Haider S, Liaquat L, Shahzad S, et al. A high dose of short term exogenous D-galactose administration in young male rats produces symptoms simulating the natural aging process[J]. Life Sci, 2015, 124: 110-119. DOI:10.1016/j.lfs.2015.01.016 |
| [10] |
Shwe T, Pratchayasakul W, Chattipakorn N, et al. Role of D-galactose-induced brain aging and its potential used for therapeutic interventions[J]. Exp Gerontol, 2018, 101: 13-36. DOI:10.1016/j.exger.2017.10.029 |
| [11] |
Azman KF, Zakaria R. D-Galactose-induced accelerated aging model: an overview[J]. Biogerontology, 2019. DOI:10.1007/s10522-019-09837-y |
| [12] |
Zhao FF, Zhou YZ, Gao L, et al. Advances in the study of the rat model of aging induced by D-galactose[J]. Acta Pharm Sin (药学学报), 2017, 52: 347-354. |
| [13] |
Jia W, Jiang J, Liu P, et al. Application of metabolomics in complicated theory system research of traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2006, 31: 621-624. |
| [14] |
Soltow QA, Jones DP, Promislow DE. A network perspective on metabolism and aging[J]. Integr Comp Biol, 2010, 50: 844-854. DOI:10.1093/icb/icq094 |
| [15] |
Psychogios N, Hau DD, Peng J, et al. The human serum metabolome[J]. PLoS One, 2011, 6: e16957. DOI:10.1371/journal.pone.0016957 |
| [16] |
Stevens VL, Hoover E, Wang Y, et al. Pre-analytical factors that affect metabolite stability in human urine, plasma, and serum: a Review[J]. Metabolites, 2019, 9: 156. DOI:10.3390/metabo9080156 |
| [17] |
A JY. Analysis of metabolomic data: principal component analysis[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2010, 15: 481-489. |
| [18] |
A JY, He J, Sun RB. Multivariate statistical analysis for metabolomic data: the key points in principal component analysis[J]. Acta Pharm Sin (药学学报), 2018, 53: 929-937. |
| [19] |
Zhu C, Liang QL, Wang YM, et al. Integrated development of metabonomics and its new progress[J]. Chin J Anal Chem (分析化学), 2010, 38: 1060-1068. DOI:10.1016/S1872-2040(09)60057-8 |
| [20] |
Cooper AJ, Jeitner TM. Central role of glutamate metabolism in the maintenance of nitrogen homeostasis in normal and hyperammonemic brain[J]. Biomolecules, 2016, 6: 16. DOI:10.3390/biom6020016 |
| [21] |
Bak LK, Schousboe A, Waagepetersen HS. The glutamate/GABA-glutamine cycle: aspects of transport, neurotransmitter homeostasis and ammonia transfer[J]. J Neurochem, 2006, 98: 641-653. DOI:10.1111/j.1471-4159.2006.03913.x |
| [22] |
McKenna MC. The glutamate-glutamine cycle is not stoichiometric: fates of glutamate in brain[J]. J Neurosci Res, 2007, 85: 3347-3358. DOI:10.1002/jnr.21444 |
| [23] |
Jayakumar AR, Rao KV, ChR Murthy, et al. Glutamine in the mechanism of ammonia-induced astrocyte swelling[J]. Neurochem Int, 2006, 48: 623-628. DOI:10.1016/j.neuint.2005.11.017 |
| [24] |
Holecek M. Branched-chain amino acids and ammonia metabolism in liver disease: therapeutic implications[J]. Nutrition, 2013, 29: 1186-1191. DOI:10.1016/j.nut.2013.01.022 |
| [25] |
Holecek M. Ammonia and amino acid profiles in liver cirrhosis: effects of variables leading to hepatic encephalopathy[J]. Nutrition, 2015, 31: 14-20. DOI:10.1016/j.nut.2014.03.016 |
| [26] |
Platell C, Kong SE, McCauley R, et al. Branched-chain amino acids[J]. J Gastroenterol Hepatol, 2000, 15: 706-717. DOI:10.1046/j.1440-1746.2000.02205.x |
| [27] |
Kimball SR, Jefferson LS. Signaling pathways and molecular mechanisms through which branched-chain amino acids mediate translational control of protein synthesis[J]. J Nutr, 2006, 136: 227S-231S. DOI:10.1093/jn/136.1.227S |
| [28] |
Nie C, He T, Zhang W, et al. Branched chain amino acids: beyond nutrition metabolism[J]. Int J Mol Sci, 2018, 19: 954. DOI:10.3390/ijms19040954 |
| [29] |
Frey PA. The Leloir pathway: a mechanistic imperative for three enzymes to change the stereochemical configuration of a single carbon in galactose[J]. FASEB J, 1996, 10: 461-470. DOI:10.1096/fasebj.10.4.8647345 |
 2020, Vol. 55
2020, Vol. 55


