骨癌痛(cancer-induced bone pain, CIBP)是中晚期恶性肿瘤患者最常见的症状之一, 是由于肿瘤组织通过骨膜的伸展或感觉神经的侵犯在骨内扩张, 而表现出一种躯体疼痛及神经性疼痛[1]。目前临床上针对CIBP的治疗以“三阶梯药物止痛法”为主, 主要为阿片类药物和非甾体抗炎类辅助药物治疗。由于阿片类药物的耐受性、成瘾性、恶心呕吐等不良反应及非甾体抗炎类药物的胃肠道反应、肾毒性限制了其长期广泛使用[2]。因此, 探讨CIBP的发生发展机制, 开发新的治疗骨癌痛的有效药物是目前治疗骨癌痛的关键。
小胶质细胞是中枢神经系统的固有免疫细胞, 参与神经系统的修复、免疫活动和炎症反应[3]。正常情况下小胶质细胞处于静息状态, 当外界伤害性刺激产生时激活小胶质细胞, 产生和释放大量细胞因子如肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)、白细胞介素-1β (interleukin-1β, IL-1β)、白细胞介素-6 (interleukin-6, IL-6)、趋化因子2 (chemokine 2, CCL2)和神经活性物质等, 作用于脊髓背角痛觉传递神经元, 产生痛觉改变或痛觉过敏[3-6]。CCL2又称单核细胞趋化因子-1 (MCP-1), 可以特异性地使单核细胞向炎症、外伤感染、毒素暴露和缺血部位聚集, 可识别多个趋化因子受体(CCR1、CCR2和CCR4), 其中CCR2是首选受体, 在脊髓主要表达于小胶质细胞[7]。各种疼痛模型中可见脊髓胶质细胞内CCL2和CCR2表达增加[8-10]。在CIBP研究中发现, 模型组脊髓段CCL2表达升高, 并能引起小胶质细胞的增殖和活性的改变, 而鞘内注射其中和抗体后能抑制小胶质细胞的活化, 提高大鼠行为学痛阈值[11-13]。
华蟾素是蟾蜍科华大蟾蜍或黑眶蟾蜍的全皮水提物, 主要成分包括蟾毒色胺、蟾毒色胺内盐和去羟基蟾毒色胺, 具有清热解毒、消炎止痛等作用。临床常用于治疗肝癌、胰腺癌、食管鳞癌、肺癌和骨肉瘤等恶性肿瘤, 具有毒性低、使用安全、不良反应少、无成瘾性和戒断性等优点[14, 15]。华蟾素能调节脊髓段小胶质细胞的活化, 同时能抑制炎症介质和CCL2的释放[16]。本课题组前期研究发现, 华蟾素能通过抑制CIBP大鼠脊髓小胶质细胞的活化减少炎性介质释放, 从而发挥抗炎镇痛作用, 然而其具体机制尚不明确。基于此, 本实验进一步探讨华蟾素缓解骨癌痛的作用是否通过抑制CCL2/CCR2途径。
材料与方法实验细胞 Walker-256乳腺癌细胞由本实验室提供, 保存于-80 ℃冰箱中。
药物与试剂 华蟾素注射液(批号: Z34020274, 安徽华润金蟾药业股份有限公司); 离子钙接头蛋白抗原(ionized calcium binding adaptor molecule-1, Iba-1)抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体、山羊抗兔二抗、CCR2抑制剂RS102895 (Abcam公司); 米诺环素、山羊血清、大鼠TNF-α、IL-1β、IL-6试剂盒、DAPI、BCIP/NBT碱性磷酸酯酶显色试剂盒(碧云天生物科技有限公司); 10×TBS缓冲液、Tween 80 (捷世康生物科技有限公司), TBST缓冲液(10×TBS缓冲液100 mL+1 mL Tween 20, 用蒸馏水定容至1 L); 硫化钠、甲醛、醋酸、无水乙醇、二甲苯、石蜡、Mayer氏苏木素染液、伊红染液(国药集团化学试剂有限公司)。
主要仪器 热辐射刺痛仪(PL-200, 成都泰盟科技有限责任公司); Von Frey电子测痛仪(2390, 美国IITC公司); 倒置荧光显微镜(TE2000, 日本Nikon公司); 微量注射器(WLJYQ2344, 上海安亭有限公司); 石蜡包埋机(EG1150, 德国Leica公司); 高速离心机(C2500-R-230V, 美国Labnet公司); 垂直电泳槽(DYCZ-24DN)、电泳仪电源(DYCZ-40) (北京六一仪器厂)。
动物 雌性SD大鼠, 体重(180 ± 20) g, SPF级, 由三峡大学医学院实验动物中心提供。大鼠自由饮水进食。饲养环境温度(25 ± 2) ℃, 湿度(45 ± 15)%, 12 h明暗周期。实验方案经三峡大学医学院医学实验动物伦理委员会审议同意并批准。
骨癌痛模型制备及给药 15只雌性大鼠, 随机分成正常组、假手术组和模型组, 每组5只。除正常组外, 另两组大鼠腹腔注射10%水合氯醛(剂量为3.5 mL·kg-1)麻醉大鼠, 采用前期研究[17]报道的方法制备乳腺癌骨转移模型, 将Walker-256细胞悬液调整为每毫升2×105个细胞, 用微量注射器缓慢注射0.01 mL至大鼠左后肢骨髓腔内, 9天后X射线检测大鼠骨质破坏, 验证是否造模成功。前期造模探索出的Walker-256细胞悬液用量及时间, 虽能造模成功, 但后期死亡率超过75%, 与临床病理模型有些出入, 为保证研究的严谨性, 本实验重新摸索了实验条件。假手术组骨髓腔内注射等体积的灭活Walker-256细胞悬液, 其余操作与上述相同。
鞘内插管模型制备及给药 80只雌性大鼠, 随机分成假手术组、模型组(骨癌痛组)、华蟾素组、吗啡组(阳性药物组)、生理盐水组(鞘内插管对照组)、RS102895组(CCR2抑制剂组)、米诺环素组(小胶质细胞抑制剂组)和联合用药组(华蟾素+米诺环素组), 每组10只。大鼠骨癌痛模型造模成功后(即第9天)开始腹腔注射(i.p.)给药:华蟾素组及联合用药组给予华蟾素注射液5 mL·kg-1, 吗啡组给予吗啡8 mg·kg-1, 1天1次, 连续给药至第21天处理大鼠; 除假手术组和骨癌痛组外其余各组第9天按照本课题组前期研究[17]进行鞘内插管(i.t.)给药模型造模, 造模成功后(即第12天)开始鞘内给药:生理盐水组(20 μL)、RS102895组(1.5 μg·μL-1, 20 μL)、米诺环素组(2.5 μg·μL-1, 20 μL)、联合用药组腹腔注射华蟾素注射液同时鞘内给药米诺环素(2.5 μg·μL-1, 20 μL), 1天1次, 连续给药至第21天处理大鼠。
X射线评估骨质的破坏 在大鼠骨癌痛造模后第9天, 为了确定造模成功及肿瘤生长对骨质的破坏, 将正常组、假手术组、模型组大鼠左后肢进行胫骨X射线检测。将麻醉大鼠放在X光机前, 暴露在30千伏峰值(KVP)强度的X射线下1 min, X光片在显影剂(Konica SRX-101)下显影并进行评分。0分:骨的结构完整, 未检测到任何骨质损坏的迹象; 1分:在胫骨注射部位周围可见极少数较小的骨质损坏病灶(数量应不多于3个); 2分:胫骨的髓质骨缺损较多, 病灶数量明显增多(不少于4个); 3分:胫骨髓质骨缺失, 同时可以检测胫骨的皮质骨破坏; 4分:可以发现单侧胫骨的骨皮质完全缺失; 5分:胫骨两侧的骨皮质出现缺失, 表现为移位性骨折。
H & E观察大鼠胫骨骨损伤 末次大鼠疼痛行为学检测结束后, 每只大鼠一次性腹腔注射10%水合氯醛1.5 mL麻醉处死大鼠, 取大鼠左后肢, 进行脱钙处理。采用常规方法脱水、石蜡包埋、切片、染色和封片, 显微镜观察大鼠左后肢胫骨组织形态的变化。
大鼠热痛和机械痛行为检测 分别于造模前、造模第2、5、7、9、12、14、17、20天检测各组大鼠左后肢热痛阈值和机械痛阈值。热痛阈值测定:将大鼠处于有机玻璃格内, 安静后强热光束照射大鼠左后足脚掌中心皮肤, 记录大鼠缩爪反应时间, 代表热痛阈值(为避免强热辐射烫伤大鼠, 将缩爪反应时间的最大值设置为20 s, 强度30%)。机械痛阈值测定:将大鼠置于底有特制网格的有机玻璃内, 安静后用von Frey 2391的探针刺激大鼠左后足脚掌中部皮肤, 观察大鼠缩足反应并记录大鼠的机械性阈值。以上操作每只大鼠测定3次, 每次间隔10 min, 取平均值。
免疫荧光检测小胶质细胞活化情况 末次大鼠疼痛行为学检测结束后, 麻醉大鼠, 多聚甲醛先固定, 取L4~6段脊髓, 30%蔗糖脱水后冰冻冠状切片, 收集切片于0.01 mol·L-1磷酸盐缓冲溶液(PBS)中, 封闭30 min, 弃山羊血清, Iba-1一抗孵育过夜; PBS漂洗3次, 荧光二抗避光室温孵育1 h, PBS漂洗3次, DAPI染色, 封片, 倒置显微镜下观察, 采集图片。
Western blot检测小胶质细胞表达的情况 末次大鼠疼痛行为学检测结束, 麻醉大鼠, 取L4~6段脊髓, 提取细胞总蛋白, 组织中加入电泳裂解缓冲液, 取变性裂解蛋白20 g进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE), 电转移至硝酸纤维素膜, 封闭后加入Iba-1一抗, 室温下作用2 h, TBST清洗后加入二抗, 室温下作用1 h加入BCIP/NBT, 10~20 min后显色。使用V3.0图分析软件分析, 分别计算灰度值及内参GAPDH灰度值。
ELISA检测相关炎性因子表达情况 末次大鼠疼痛行为学检测结束后, 麻醉大鼠, 取L4~6段脊髓, PBS冲洗, 称重后剪碎, 匀浆, 离心(1 000 r·min-1, 10 min), 取上清。按ELISA试剂盒的说明测定相关炎性因子(TNF-α、IL-1β、IL-6)。
统计学处理 计量资料以均数±标准差(x±s)表示。单变量两组资料间的比较采用t检验, 多组资料之间的比较采用单因素方差分析, P < 0.05具有显著性差异。采用SPSS 19.0统计软件分析。
结果 1 大鼠胫骨的影像学变化从X射线检查结果(图 1)可以看出, 正常组无任何骨质破坏的征象, 为0分; 假手术组可见极少数的较小骨质损坏, 为1分; 模型组双面的骨皮缺失, 并且胫骨上端关节处骨质明显受到破坏, 边缘有增生状, 可能为癌细胞生长所致, 为5分。由此表明, 本方法可成功构建大鼠骨癌痛模型。
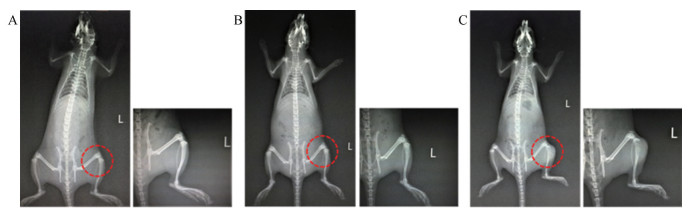
|
Figure 1 X-ray results of bone cancer pain rats. A: Normal group; B: Sham group; C: Model group |
H & E实验结果可见, 细胞核呈蓝色, 细胞浆、肌纤维、胶原纤维和红细胞呈不同程度的红色; 假手术组大鼠骨髓腔完整, 细胞排列整齐; 模型组大鼠骨髓腔破环明显; 华蟾素组大鼠骨髓腔破坏明显减轻(图 2)。提示华蟾素能有效抑制骨癌痛大鼠骨髓腔的破坏。
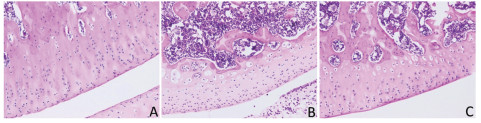
|
Figure 2 Effect of cinobufagin on tibia bone marrow cavity in rats with bone cancer pain (400×). A: Sham group; B: Model group; C: Cionbufagin group (5 mL·kg-1, i.p.) |
行为学结果显示:与正常组相比, 假手术组的机械痛阈值和热痛阈值无明显差异, 故后期研究只用假手术组, 与假手术组相比, 模型组大鼠机械痛阈值和热痛阈值均有显著降低(P < 0.01, 图 3A、B); 造模前各组大鼠机械痛阈值和热痛阈值均无明显差异, 造模后各组大鼠机械痛阈值和热痛阈值均显著低于假手术组(P < 0.01)。与模型组相比, 华蟾素组、吗啡组和联合用药组大鼠分别在第9天腹腔注射华蟾素注射液和吗啡后机械痛阈值、热痛阈值均逐渐上升(P < 0.01或P < 0.05);在造模第12天进行鞘内插管给药后, 与模型组相比, 生理盐水组大鼠的机械痛阈值和热痛阈值均未见显著性差异。RS102895组、米诺环素组和联合用药组大鼠鞘内给药后机械痛阈值较生理盐水组显著升高(P < 0.01), 其中联合用药组在实验第17~21天与其他各给药组相比作用效果更佳(P < 0.01, 图 3C、D)。
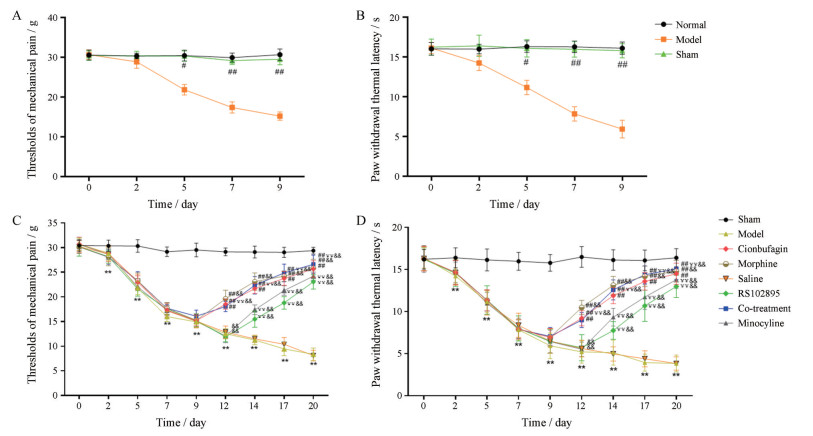
|
Figure 3 Effect of cinobufagin (5 mL·kg-1, i.p.) on behavior of rats with bone cancer pain. A: Effect of cinobufagin on mechanical pain threshold in rats with bone cancer pain; B: Effect of cinobufagin on heat pain threshold in rats with bone cancer pain; C: Effect of cinobufagin on mechanical pain threshold in rats with bone cancer pain; D: The effect of cinobufagin on the thermal pain threshold of bone cancer pain rats. n = 3, x±s. **P < 0.01 vs sham group; ##P < 0.01 vs model group; & & P < 0.01 vs cionbufagin group; YYP < 0.01 vs saline group. Co-treatment group: Cionbufagin with minocycline (2.5 μg·μL-1, 20 μL, i.t.) |
末次大鼠疼痛行为学检测结束后麻醉大鼠, 进行心脏灌注, 取各组大鼠L4~6段脊髓, 采用荧光单标的方法检测Iba-1的表达情况。结果显示, 假手术组Iba-1表达较低, 模型组和生理盐水组Iba-1表达明显增加, 各给药组Iba-1表达均降低, 其中联合用药组抑制Iba-1表达效果最佳(图 4)。
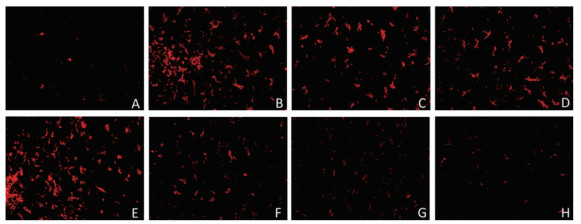
|
Figure 4 Effect ofechin on the expression of Iba-1 in spinal cord small gliocyte in rats with osteocellular carcinoma (400×). A: Sham group; B: Model group; C: Cionbufagin group; D: Morphine group; E: Saline group; F: RS102895 group; G: Minocyline group; H: Co-treatment group |
采用Western blot检测各组大鼠L4~6段脊髓中Iba-1蛋白表达情况。与假手术组相比, 模型组和生理盐水组大鼠脊髓中Iba-1蛋白表达明显上调(P < 0.01)。与模型组相比, 腹腔注射华蟾素及吗啡后, 大鼠脊髓中Iba-1蛋白表达降低(P < 0.05)。与生理盐水组相比, RS102895组、米诺环素组和联合用药组Iba-1蛋白表达降低(P < 0.01)。与华蟾素组相比, RS102895组、米诺环素组和联合用药组Iba-1蛋白表达降低(P < 0.05)。见图 5。

|
Figure 5 Effect of cinobufagin on the expression of microglia labeling protein Iba-1 in spinal cord of rats with bone cancer pain. n = 3, x±s. **P < 0.01 vs sham group; #P < 0.05 vs model group; & P < 0.05 vs cionbufagin group; $P < 0.05 vs saline group |
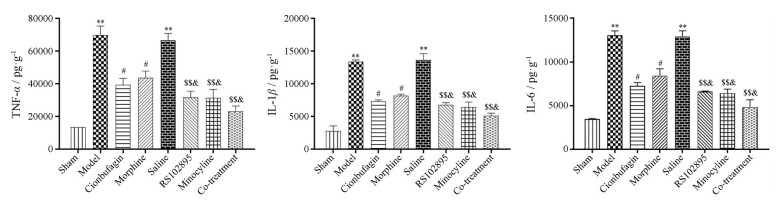
ELISA检测结果表明:与假手术组大鼠相比, 模型组及生理盐水组大鼠脊髓中相关细胞因子TNF-α、IL-1β和IL-6的表达均明显上调(P < 0.01);与模型组相比, 华蟾素组及吗啡组大鼠脊髓中TNF-α、IL-1β和IL-6的含量均降低(P < 0.05)。与生理盐水组相比, RS102895组、米诺环素组和联合用药组大鼠脊髓中TNF-α、IL-1β和IL-6的含量均降低(P < 0.01)。与华蟾素组相比, RS102895组、米诺环素组和联合用药组大鼠脊髓中TNF-α、IL-1β、IL-6的含量均降低(P < 0.05)。见图 6。
|
Figure 6 Effect of cinobufagin on the expression of inflammatory factors (TNF-α, IL-1β, IL-6) in spinal cord of rats with bone cancer pain. n = 3, x±s. **P < 0.01 vs sham group; #P < 0.05 vs model group; & P < 0.05 vs cionbufagin group; $$P < 0.01 vs saline group |
CIBP区别于一般的炎性疼痛及神经病理性疼痛, 是一种持续性、突破性的疼痛, 其产生是由于骨癌本身的生长或肿瘤细胞的分泌物如细胞因子、趋化因子及生长因子等刺激邻近的伤害感受器[18-21], 这些伤害感受器将刺激转化为神经冲动, 通过Aδ或c纤维传至脊髓胶质区活化胶质细胞[22]并产生大量的炎性因子(TNF-α、IL-1β、IL-6)及趋化因子(CCL2)改变脊髓区的神经可塑性, 易化和扩散疼痛信息, 上传至中枢感知疼痛[23]。在CIBP模型中, 小胶质细胞会大量活化, 鞘内注射米诺环素能明显提高CIBP大鼠的机械痛阈值和热痛阈值, 缓解骨癌痛[24, 25]。在CIBP研究中, 模型组脊髓段CCL2表达升高, 并能引起小胶质细胞的增殖和活性的改变, 鞘内注射CCL2中和抗体后能降低小胶质细胞的活化, 提高大鼠行为学痛阈值[11-13], 相反鞘内给予外源性CCL2, 可以引发大鼠机械痛觉超敏[26]。在CCR2基因敲除的小鼠中, 很难产生机械性痛觉超敏[27]。由此推测, CCL2/CCR2轴在骨癌痛大鼠脊髓小胶质细胞的激活中发挥重要作用, 抑制脊髓小胶质细胞的活化可缓解骨癌痛。本实验发现, 鞘内给予CCR2抑制剂RS102895能有效地抑制小胶质细胞的活化, 减少炎性因子的释放, 提高大鼠机械痛阈值及热痛阈值, 缓解骨癌痛。
在预实验中, 探讨了华蟾素腹腔注射液的给药浓度, 将临床最大用药剂量按照人鼠体表面积公式进行换算, 得到本实验中大鼠腹腔注射的最大剂量(5 mL·kg-1), 在此剂量上对半稀释为两个浓度:中剂量组(2.5 mL·kg-1)和低剂量组(1.25 mL·kg-1), 预实验中发现, 高、中、低3个剂量组的华蟾素干预均可提高大鼠机械痛阈值和热痛阈值, 且呈剂量依赖性, 故采用最大剂量华蟾素进行腹腔注射。在本实验中, 通过胫骨注射Walker256细胞构建CIBP模型, 9天X射线检测骨质破坏, 发现模型组大鼠较正常组或假手术组大鼠, 骨质破坏明显, 说明造模成功。鞘内插管实验中, 行为学检测结果表明, 华蟾素可明显提高CIBP大鼠机械痛阈值及热痛阈值, 缓解骨癌痛, 其联合用药组效果最佳; 末次大鼠疼痛行为学检测结束后处理动物发现, 华蟾素可减轻CIBP大鼠胫骨骨髓腔的破坏, 下调脊髓Iba-1的表达, 抑制脊髓小胶质细胞的活化, 减少脊髓小胶质细胞相关炎性介质的释放, 表明华蟾素对CIBP大鼠有较好的镇痛效应。通过比较行为学指标发现:短期用药吗啡效果更为明显, 第17天开始华蟾素作用效果比吗啡更佳(P < 0.01), 其可能机制是大鼠开始对吗啡产生耐药导致。在比较Iba-1蛋白表达时发现, 单一通道CCR2抑制剂RS102895组与整个小胶质细胞活化抑制剂米诺环素组相比未见明显差异, 提示CCR2可能是小胶质细胞活化的主要受体; ELISA结果显示, 米诺环素组与联合用药组中3类炎性因子表达量相比(P < 0.01), 提示华蟾素不仅通过抑制小胶质细胞活化减少炎性因子的释放, 可能通过其他途径减少炎性因子的释放, 从而发挥抗炎镇痛作用。综上推测, 华蟾素能有效缓解骨癌痛, 其机制之一可能是通过抑制CCL2/CCR2途径抑制脊髓小胶质细胞活化, 减少炎症介质的释放发挥抗炎镇痛作用。
| [1] |
Buga S, Sarria JE. The management of pain in metastatic bone disease[J]. Cancer Control, 2012, 19: 154-166. DOI:10.1177/107327481201900210 |
| [2] |
Colonna M, Butovsky O. Microglia function in the central nervous system during health and neurodegeneration[J]. Ann Rev Immunol, 2017, 35: 441-444. DOI:10.1146/annurev-immunol-051116-052358 |
| [3] |
Hains BC, Waxman SG. Activated microglia contribute to the maintenance of chronic pain after spinal cord injury[J]. J Neurisci, 2006, 26: 4308-4317. DOI:10.1523/JNEUROSCI.0003-06.2006 |
| [4] |
Jiang JJ, Yao P, Wu XY, et al. Expression and significance of spinal microglia and IL-1β in cancer-induced bone pain[J]. Anat Res (解剖学研究), 2016, 38: 44-47. |
| [5] |
Song ZP, Xiong BR, Guan XH, et al. Minocycline attenuates bone cancer pain in rats by inhibiting NF-κB in spinal astrocytes[J]. Acta Pharmacol Sin, 2016, 37: 753-762. DOI:10.1038/aps.2016.1 |
| [6] |
Tang Y, Le W. Differential roles of M1 and M2 microglia in neurodegenerative diseases[J]. Mol Neurobiol, 2016, 53: 1181-1194. DOI:10.1007/s12035-014-9070-5 |
| [7] |
Tikka TM, Koistinaho JE. Minocycline provides neuroprotection against N-methyl-D-aspartate neurotoxicity by inhibiting microglia[J]. J Immunol, 2001, 166: 7527-7530. DOI:10.4049/jimmunol.166.12.7527 |
| [8] |
Xu J, Dong H, Qian Q, et al. Astrocyte-derived CCL2 participates in surgery-induced cognitive dysfunction and neuroinflammation via evoking microglia activation[J]. Behav Brain Res, 2017, 332: 145-153. DOI:10.1016/j.bbr.2017.05.066 |
| [9] |
Zhang Z, Dong Y, Lu Y, et al. Chemokine CCL2 and its receptor CCR2 in the medullary dorsal horn are involved in trigeminal neuropathic pain[J]. J Neuroinflamm, 2012, 9: 136-139. |
| [10] |
Zhang H, Boyette-Davis JA, Kosturakis AK, et al. Induction of monocyte chemoattractant protein-1 (MCP-1) and its receptor CCR2 in primary sensory neurons contributes to paclitaxel-induced peripheral neuropathy[J]. J Pain, 2013, 14: 1031-1044. DOI:10.1016/j.jpain.2013.03.012 |
| [11] |
Hu JH, Zheng XY, Yang JP, et al. Involvement of spinal monocyte chemoattractant protein-1 (MCP-1) in cancer-induced bone pain in rats[J]. Neurosci Lett, 2012, 517: 60-63. DOI:10.1016/j.neulet.2012.04.026 |
| [12] |
Hu JH, Wu MY, Tao M, et al. Changes in protein expression and distribution of spinal CCR2 in a rat model of bone cancer pain[J]. Brain Res, 2013, 1509: 1-7. DOI:10.1016/j.brainres.2013.03.002 |
| [13] |
Ji Z, Xiang QS, Stefania E, et al. Expression of CCR2 in both resident and bone marrow-derived microglia plays a critical role in neuropathic pain[J]. J Neurosci, 2007, 27: 12396-12406. DOI:10.1523/JNEUROSCI.3016-07.2007 |
| [14] |
Wen LL, Xie XB, Huang W, et al. Anti-inflammatory and analgesic activities of bufalin and its effect on NF-κB signaling[J]. J Sun Yat-Sen Univ(中山大学学报), 2014, 35: 680-684. |
| [15] |
Wang Y. Pharmacological effects of cionbufagin[J]. Nei Mongol J Tradit Chin Med (内蒙古中医药), 2012, 31: 76-79. |
| [16] |
Thacker MA, Clark AK, Bishop T, et al. CCL2 is a key mediator of microglia activation in neuropathic pain states[J]. Eur J Pain, 2009, 13: 263-272. DOI:10.1016/j.ejpain.2008.04.017 |
| [17] |
Liu D, Zhang W, Wang XY, et al. Treatment of cionbufagin on analgesic effect and activation of glial cells in the spinal cord of cancer-induced bone pain rats[J]. Tertogen Carcin Mut (癌变·畸变·突变), 2018, 30: 302-306. |
| [18] |
Kerba M, Wu JS, Duan Q, et al. Neuropathic pain features in patients with bone metastases referred for palliative radiotherapy[J]. J Clin Onco, 2010, 28: 4892-4899. DOI:10.1200/JCO.2010.28.6559 |
| [19] |
Kane CM, Hoskin P, Bennett MI. Cancer induced bone pain[J]. BMJ, 2015, 350: h315. DOI:10.1136/bmj.h315 |
| [20] |
Ji D, Liang Z, Liu G, et al. Bufalin attenuates cancer-induced pain and bone destruction in a model of bone cancer[J]. Naunyn Schmiedebergs Arch Pharmacol, 2017, 390: 1211-1219. DOI:10.1007/s00210-017-1419-7 |
| [21] |
Liviu F, Razia A, Michael B, et al. Pain: persistent postsurgery and bone cancer-related pain[J]. J Int Med Res, 2019, 47: 528-543. DOI:10.1177/0300060518818296 |
| [22] |
Xu YM, Shen W, Cheng Y, et al. Role of chemokine CCL2 antibody in the treatment of tibia cancer pain in rats[J]. J Clin Anesthesiol (临床麻醉学杂志), 2012, 28: 81-83. |
| [23] |
Milligan E, Watkins L. Pathological and protective roles of glia in chronic pain[J]. Nat Rev Neurosci, 2009, 10: 23-30. DOI:10.1038/nrn2533 |
| [24] |
Li XS, Yuan N, Meng CY. Glial cells: participants in neuropathic pain[J]. Orthop J China (中国矫形外科杂志), 2018, 3: 1479-1482. |
| [25] |
Tian L, Wei H, Piirainen S, et al. Spinal versus brain microglial and macrophage activation traits determine the differential neuroinflammatory responses and analgesic effect of minocycline in chronic neuropathic pain[J]. Brain Behav Immun, 2016, 58: 107-117. DOI:10.1016/j.bbi.2016.05.021 |
| [26] |
Ji Z, Yves DK. Spatial and temporal relationship between monocyte chemoattractant protein-1 expression and spinal glial activation following peripheral nerve injury[J]. J Neurochem, 2010, 97: 772-783. |
| [27] |
Catherine A, Lindia JA, Anne Marie C, et al. Impaired neuropathic pain responses in mice lacking the chemokine receptor CCR2[J]. Proc Natl Acad Sci U S A, 2003, 100: 7947-7952. DOI:10.1073/pnas.1331358100 |
 2020, Vol. 55
2020, Vol. 55


