2. 成都中医药大学附属医院中心实验室, 四川 成都 610072;
3. 四川护理职业学院, 四川 成都 610100;
4. 四川大学化学学院, 四川 成都 610064;
5. 成都市三勒浆药业集团, 四川 成都 610000;
6. 江西中医药大学, 江西 南昌 330004
2. Central Laboratory, Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610072, China;
3. Sichuan Nursing Vocational College, Chengdu 610100, China;
4. College of Chemistry, Sichuan University, Chengdu 610064, China;
5. Sanajon Pharmaceutical Group, Chengdu 610000, China;
6. Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
多酚(polyphenol)是广泛存在于植物体内的一类具有多元酚结构的次生代谢产物[1], 在自然界中普遍存在。多酚因分布广、活性强、含量高, 拥有大量的活性酚羟基而具有独特的生理活性, 在药品、天然产物、生物化学、食品和化妆品等领域中也不乏其身影[2], 70%以上的中草药都含有丰富的多酚类成分[3]。随着现代医学对多酚生物活性和作用机制的深入研究, 发现其具有较强的抗菌[4]、抗病毒[5]、抗炎[6]、抗肿瘤[7]、抗衰老[8], 以及改善心血管疾病[9]等作用, 如茶叶中的表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)、鞣花酸(ellagic acid, EA)等[10, 11]。多酚的生物活性得益于分子中丰富的羟基与生物体内蛋白质、酶、多肽及核酸等大分子物质高度立体选择性的相互作用[12], 使其对癌症[13]、艾滋病[14]及糖尿病[15]等重大疾病也表现出良好的治疗潜力。
天然多酚常被制成液体制剂, 具有服用方便、易吸收和起效快等优点[16, 17]。随着天然多酚液体制剂的不断开发, 稳定性与澄清度问题愈发突出[18]。多酚液体制剂具有复杂的相态变化及化学成分[19, 20], 会发生复杂的理化变化[21], 贮藏过程极易产生沉淀, 影响外观性状, 降低药效[22, 23]。这使得该问题一直未能得到有效解决, 成为困扰植物多酚高效开发利用的瓶颈问题。究其根源在于, 无法科学回答多酚液体制剂沉淀是什么、沉淀形成的途径与机制、不同形成途径有无关联性、沉淀能否有效控制等问题。
本文以典型的多酚液体制剂—三勒浆口服液(Sanlejiang oral liquid, SOL)为例, 综述其多元沉淀的化学组成、形成途径与机制, 围绕多条沉淀途径的交汇“枢纽”——多酚缔合胶体, 探讨了多酚缔合胶体的自组装、陈化与稳态重构的微观机制, 探索多酚液体制剂稳态重构的关键控制工艺, 以期为多酚类液体制剂的研发、品质优化与精细制造提供参考。
1 多酚类液体制剂的澄清度问题三勒浆处方源于三果汤(Triphala), 是印度阿育吠陀医学[24]与藏医学经典医学名方, 也是国际知名的传统配方, 由余甘子、诃子与毛诃子组成。大量文献表明, 三果汤具有显著的抗氧化[25]、抗肿瘤[26]、抗牙龈炎[27]、降血脂[28]及免疫调节等作用。以三果汤制备成的提取物、提取液、胶囊和片剂等在印度、欧美国家有较大的消费群体。
SOL是在我国上市销售的三果汤系列产品, 总酚含量高达30 mg·mL-1, 属于典型的多酚口服液。通常, 常温贮藏1~2个月就会产生大量黑褐色沉淀(约20 mg, 占总酚2.2%), 贮藏2年每瓶(30 mL)产生的沉淀量最多可达0.6 g (约占总酚66.7%), 沉淀问题严重。尽管不同的药物或产品的多酚组成、比例有异, 但相同的基本结构和大类组成, 使得SOL的稳定性问题具有一定典型性与代表性。
2 沉淀物的基础研究多酚类化合物结构非常复杂, 除基本的构成不同外, 其聚合度、分子立体构型和构象等的差异也造成其结构千变万化。根据多酚的结构特点, 主要可分为简单酚酸类、类黄酮类、水解鞣质类和原花青素类(或缩合鞣质类), 其相对分子质量一般在200~3 000左右[2]。水解鞣质根据水解后生成的物质的不同(没食子酸和鞣花酸), 又可进一步分为没食子鞣质和鞣花鞣质, 其具体分类如图 1所示。

|
Figure 1 Structural classification of polyphenolic compounds |
为了解沉淀物质构成, 分析其形成机制, 需明确上清液和沉淀的物质基础。采用高分辨率飞行时间质谱解析上清液的成分组成。通过该方法, 在上清液中鉴定出了61种化学成分[29], 分为鞣质类、酚酸类、黄酮类、有机酸类、氨基酸类和脂肪酸类, 以及少数的糖苷类、多元醇和酚类成分。其中多酚类成分较多, 有23种, 包括12种鞣花鞣质和11种没食子鞣质。同时, 上清液中存在多种儿茶素类成分和原花青定——一种二聚体缩合鞣质, 是高聚体缩合鞣质及鞣红形成的前体物质。由此推测, 溶液内可能存在儿茶素氧化聚合反应途径, 生成鞣红沉淀。
采用同样的方法, 在沉淀中发现了15种化合物[29]。除几种糖类、脂肪酸外, 均为多酚类成分。这些化合物均为上清液的共有化合物, 部分可能直接来源于上清液。其中蔗糖来源于辅料; 脂肪酸类主要来源于药材种核; 而鞣花酸含量最高, 是构成沉淀的主要成分。同时还观察到一些大分子物质的存在, 推断可能和缩合鞣质有关, 但尚未确定。这是由于缩合鞣质本身结构复杂, 难以直接鉴定。根据以上分析, SOL沉淀很可能是由鞣花酸和鞣红组成的多元沉淀, 但该假设还需进一步研究。沉淀中, 鞣花酸以极高的丰度而最具代表性。鞣花酸被视为良好的抗氧化剂和凝血剂, 且具有较好的抗癌作用[30]。鞣花酸属Biopharmaceutics Classification System Ⅳ类物质, 是典型的难溶物, 纯水中溶解度小于9.7 μg·mL-1。其大量的沉淀会导致口服液相关活性的降低[31]。有趣的是, 鞣花酸在制备初期并未沉淀, 且大量存在于上清液中, 含量高于0.5 mg·mL-1, 是纯水中的50倍以上[32]。但与鞣红类似[33], 鞣花酸贮藏一段时间后稳定性也会降低, 逐渐析出。因此, 为寻找合理的调控手段, 有必要进一步阐释鞣花酸在液体制剂中的增溶与沉淀机制。
3 多元沉淀的发现与确认化学成分解析推测, SOL沉淀可能是由鞣花酸和鞣红组成的多元沉淀。由于这些沉淀自身结构性质的不同, 最终形成的沉淀物形态并不一致。为此, 使用扫描电镜(scanning electron microscope, SEM)对SOL沉淀的微观形态进行观察, 发现SOL沉淀为两种截然不同的沉淀形态混合物(图 2A)[31]。

|
Figure 2 Scanning electron microscope (SEM) observation results of precipitation morphology, two precipitation mixing forms (A), crystalline precipitate (B), irregular precipitate (C) in Sanlejiang oral liquid (SOL) |
SEM可观察到SOL的沉淀物是一种明显的二元沉淀混合形态(图 2A)。其中一种为较为规则的晶体状沉淀, 且存在许多规则的层状结构(图 2B)。由于鞣花酸分子为平面结构, 苯环与苯环间容易形成疏水键, 而酚羟基在鞣花酸分子间形成了氢键作用[34]。这使得鞣花酸分子排列较为整齐, 能形成规则晶体状沉淀[34, 35]。而鞣红是一类物质总称, 结构复杂、变化较大, 没有固定的形态, 其沉淀形态与观测结果(图 2C)相符。因此, 不规则沉淀物应为鞣红, 晶体状沉淀应为鞣花酸, 其晶体结构如图 3所示。由于沉淀物中这两种沉积物难以分离鉴定[33], 故借助能谱仪(Energy Dispersive Spectrometer, EDS)对两种沉淀物C/O比理论值和实测值进行比对[31], 进一步确定了两类沉淀的物质归属。

|
Figure 3 Ellagic acid precipitation crystallization (A) and molecular accumulation schematic diagram (B) of ellagic acid in crystals |
在SOL贮藏过程成分变化研究中, 对鞣花酸在上清液和沉淀中的转移情况进行分析。通过HPLC对上清液和沉淀的含量测定发现, 在贮藏90天后沉淀中生成的鞣花酸约为14.02 mg, 但上清液中鞣花酸损失量仅为7.46 mg, 沉淀中的鞣花酸含量远高于上清液转移的鞣花酸, 约为上清液鞣花酸损失量的2倍, 这表明鞣花酸沉淀有多种来源途径。除了上清液鞣花酸沉淀外, 其余部分应来自于溶液中其他成分化学转化。因此, 将该部分定义为鞣花酸的化学沉淀量, 而上清液损失的部分为鞣花酸溶解度降低而析出的部分, 定义为鞣花酸的物理沉淀量。据此, 实验[31]统计并计算了3个月内不同沉淀量变化情况(图 4)。从图中对3种途径的沉淀分析发现, 鞣花酸在短期内会快速生成, 占沉淀总量75%以上, 其中物理沉淀略多于化学沉淀; 鞣红则较少, 其形成过程也相对更为缓慢。故该实验周期内, 鞣花酸的不稳定性是导致沉淀的重要因素。

|
Figure 4 Statistical result of multivariate precipitation content in 3 months. n = 3, x±s. EA: Ellagic acid |
胶体的陈化聚集是沉淀产生的重要原因之一。沉淀的形成通常伴随着溶液的相变及沉积物的聚集, 其形成过程是整个溶液的系统变化。不同的是, 多酚类物质在水溶液中常以特殊的缔合胶体的状态存在。因此, 根据上述特征, 研究中引入了Turbiscan lab多重光散射仪对SOL溶液体系的复杂物理相态变化进行跟踪表征。该仪器可实时获得样品透射光强度(transmission, T)、背散射光强度(backscattering, BS)、稳定性指数(turbiscan stability index, TSI)和粒径等重要的物理参数。TSI是反映样品稳定性的重要参数, TSI上升表示稳定性变差。从研究结果发现[36], SOL储存的过程中透光率从73%降低到68%, TSI指数不断升高。同时, 粒径结果显示, SOL的粒径从117 nm增加到125 nm, 与TSI值呈高度正相关。基于上述数据计算得到溶液中的平均颗粒迁移率为240 μm·h-1[36]。这表明, 缔合胶体体系始终处于不稳定状态, 溶液相态在不断发生变化, 这便是缔合胶体的陈化现象。SOL在贮藏过程中溶液粒径不断增加, 胶体粒子之间开始聚集, 为鞣花酸分子的相互接触、聚集、沉淀过程提供了有利条件。因此, SOL从多酚缔合胶体溶液变为非均相溶液, 最终形成沉淀。因此, 缔合胶体的陈化是鞣花酸物理沉淀的主要原因。
4.3 鞣质的酸水解中药口服液在贮存过程中非常容易产生一系列的化学变化。因此, 如果只关注沉淀物的物理沉淀过程, 而忽略溶液化学性质的同步变化, 则很难揭示沉淀物形成的微观机制。如一些苷类可在较低的pH值或酶的作用下水解, 形成糖基和苷元。但大多数苷元属脂溶性成分, 在水中溶解度很小, 极易析出形成沉淀[37]。据此, 通过测定沉淀物中各类成分的含量发现[31], 鞣花酸不仅来源于上清液的物理沉淀, 同时还可能来自某些物质的水解反应。在研究过程中[31, 36], 采用偏最小二乘判别分析(partial least squares discrimination analysis, PLS-DA)和S曲线(s-plot)等方法对SOL贮藏前后的化学轮廓变化进行分析。从结果可知[31, 36], 诃黎勒酸和柯里拉京等水解鞣质显著减少, 但没食子酸和沉淀物中鞣花酸化学沉淀等小分子物质明显增加。有文献报道显示, 诃黎勒酸可水解产生柯里拉京和诃子次酸[38, 39], 并通过验证实验得以证实[36]。因此, 诃黎勒酸、柯里拉京的减少和没食子酸、鞣花酸的增加是该水解反应存在的直接证据。诃黎勒酸、柯里拉京等鞣质水解产生没食子酸和鞣花酸的原因与其自身结构相关[40]。诃黎勒酸和柯里拉京属于鞣花鞣质, 从图 5可见, 柯里拉京结构中含有没食子酰基结构及1个六羟基联苯二甲酰基结构, 这两种结构与葡萄糖分子形成的酯键在水解后可分别生成没食子酸及鞣花酸[38]。诃黎勒酸(图 5)为1分子柯里拉京与1分子诃子次酸[39]缩合而成。在水解过程中, 诃黎勒酸首先分解为柯里拉京和诃子次酸, 前者可继续水解生成鞣花酸和没食子酸。相关成分变化趋势统计结果与预测结果相符[31], 同时SOL的pH值约为3, 符合水解的条件。据此认为, SOL内存在“鞣花鞣质-水解-鞣花酸沉淀”的途径。进一步说明除鞣花酸自身沉淀外, 还伴有鞣花鞣质降解产生的大量鞣花酸, 致使溶液过饱和而共同导致沉淀。
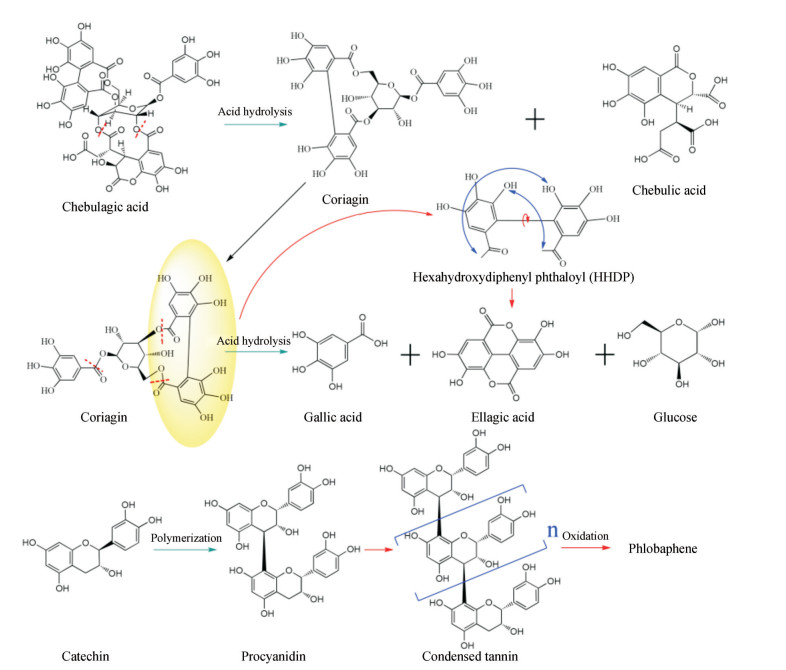
|
Figure 5 Schematic diagram of tannin hydrolysis |
儿茶素类化合物聚合氧化形成鞣红沉淀是多酚类液体制剂沉淀常见原因, 是目前公认的沉淀原因之一。儿茶素类是合成缩合单宁的前体, 鞣红是缩合鞣质的氧化聚合产物, 可大致推测“儿茶素—缩合鞣质—鞣红”变化途径的存在。但鞣红的形成是以缩合鞣质还是以儿茶素为起点的连续变化机制需明确。分析发现, 在提取过程中, 药材所含多种组分被大量提取。经过大量过滤及澄清工艺后, 各种缩合鞣质、果胶、植物蛋白已被大量去除; 但大部分水解鞣质与儿茶素类成分得以进入成品中。因此, 可以确定鞣红的形成是以儿茶素为起点的连续变化。儿茶素类化合物形成缩合鞣质的过程十分复杂[41], 分为酶促与非酶促氧化聚合两类。植物中往往同时含有儿茶素类与儿茶酚氧化酶, 该酶能够在氧参与反应时催化儿茶素邻二酚羟基结构底物形成邻二醌。该氧化-还原体系, 能形成二儿茶素结构、直接氧化偶联结构以及各种分子内重排产物等多种缩合鞣质[41-43]。溶液体系pH值、氧化还原能力、底物种类与/和含量、氧化酶的特性44]、产物的比例等具有差异, 导致了缩合鞣质具体结构难以确定。儿茶酚氧化酶适宜反应温度为40 ℃~65 ℃, 至80 ℃时完全失去活性[41]。然而, 在没有酶或酶已失活条件下, 儿茶素类仍能通过酸性条件下Fe3+催化的非酶促氧化聚合生成缩合鞣质[45]。但反应速率仅为酶促反应的1/800[46], 这也是SOL中沉淀形成需要数月的可能原因。当缩合鞣质在溶液中形成后, 在氧气、金属离子影响下, 很容易形成三聚体、四聚体乃至多聚体, 聚合物水溶性降低, 最终形成鞣红沉淀。对比贮藏前后SOL化学轮廓变化发现[31, 36], 儿茶素、没食子儿茶素、没食子儿茶素等成分在贮藏90天后, 含量均有不同程度降低。而EDS发现鞣红沉淀中的Fe3+, 直接表明儿茶素类成分参与了鞣红沉淀的形成。因此, 鞣红的形成的主要路线是“儿茶素类-缩合鞣质(二聚物-多聚物)-鞣红沉淀”。在整个鞣红沉淀形成过程中, 小分子的儿茶素类成分如同逃过层层拦截的“漏网之鱼”, 成为引发鞣红沉淀形成的关键前体物质。
4.5 三条沉淀途径的总结SOL沉淀的微观机制可总结为“一类物质(多酚类)、两种沉淀(鞣花酸和鞣红)和三条途径(水解、胶体陈化、儿茶素非酶氧化聚合)” (图 6)。
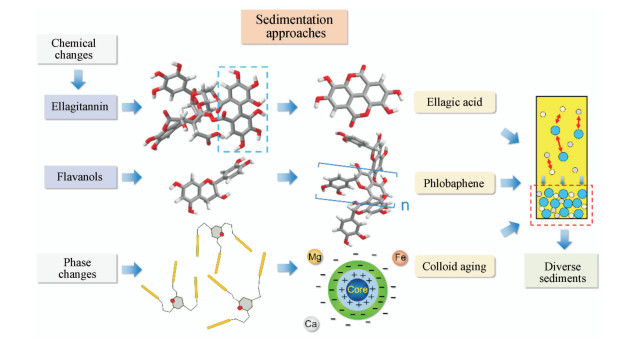
|
Figure 6 Schematic diagram of multi-precipitationapproaches of polyphenol liquid preparation |
多酚的化学结构决定了其在水溶液中是以真溶液和胶体状态并存, 而并非简单真溶液或胶体的形式。因其结构中同时存在亲水端(羟基等)与疏水端(苯环等), 使得多酚自组装形成缔合胶体[47] (associated colloids)。这是一种分子间可逆结合, 缔合分子约几十个甚至更多[47]。因此, 多酚液体制剂是一种真溶液与缔合胶体并存的混相体系。当浓度较低、温度较高或pH值较高时, 氢键被破坏, 缔合度降低, 平衡向真溶液方向移动; 反之, 分子间氢键大量形成, 平衡向缔合胶体方向移动。SOL含有几十种多酚, 这些多酚根据自身特殊理化性质, 能自发组装形成缔合胶体。苯环形成疏水端, 而含羟基较多的葡萄糖基为亲水端, 这使得多酚类物质具有一定的表面活性[48]。由SOL指纹图谱可知, 口服液中多酚亲水性从左到右逐步降低(图 7)[31]。由于自身性质差异, 各成分所处位置有所不同。难溶疏水性成分构成胶体核心部分, 自内向外根据其水溶性而自发排列构成复杂胶体[49]。
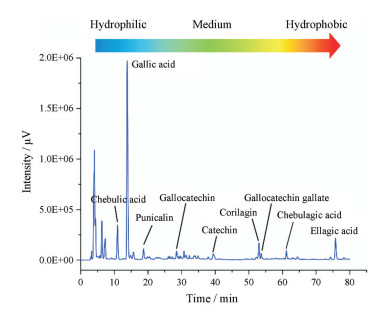
|
Figure 7 Fingerprint of SOL supernatant and hydrophilic and hydrophobic properties of its main components |
这种多酚特殊的表面活性作用, 对鞣花酸这样的难溶性成分起到了天然的增溶作用。鞣花酸分子在三维空间内呈平面结构, 是典型的难溶性物质, 其在纯水中极为难溶[50]。有文献报道, 采用β-环糊精[51]、纳米囊泡[52]和固体分散体[53]等方式能将溶解度提高到39 μg·mL-1以上。而SOL中鞣花酸含量高达500 μg·mL-1以上, 其溶解度是纯水中的51倍以上, 这是缔合胶体增溶作用的直接证据。
5.2 不同沉淀途径的相互作用规律目前已知胶体陈化是鞣花酸沉淀的原因之一, 但这并不能完美解释为何鞣花酸在贮藏初期能被稳定增溶, 而在贮藏后却逐渐析出。研究显示, 多酚易发生氧化[54]、水解[55]和聚合等反应[56, 57]。伴随这些复杂反应, 缔合胶体结构也会发生动态变化, 逐步瓦解。因此, 多酚由于内外因素导致的化学变化, 是造成增溶体系被破坏并启动沉淀的关键。而不同的沉淀途径可能存在相互作用, 进一步促进了沉淀的产生。SOL中存在大量的Ca2+、Mg2+, 分别达到260和150 μg·mL-1, 以及少量Fe3+ (约5 μg·mL-1)[31]。这些金属离子严重的压缩了胶体电动层, 其zeta电位仅为3~6 mV左右[36]。此时多酚分子的表面活性作用起到了关键作用, 依然维持着该体系平衡稳定。但外界因素如氧化、光照等, 使缔合胶体表面成分逐渐反应剥离, 鞣花酸等物质失去保护。依据真溶液-缔合胶体平衡移动理论, 暴露在真溶液中的成分会首先遭到周围环境因素的进攻。游离的水解鞣质受到H+攻击, 则会启动鞣质的化学降解途径; 游离的儿茶素受到H+和Fe3+的进攻, 则启动鞣红的氧化聚合途径。随着游离成分的损耗, 导致缔合胶体缓慢解离, 加之溶液中金属离子影响, 增溶体系逐步瓦解, 胶体间碰撞几率增大, 受保护的鞣花酸物理沉降途径便启动。此时鞣花酸分子碰撞加剧, 晶核逐渐形成; 而真溶液中因原有的游离鞣花酸加上水解新增的鞣花酸, 已处于饱和或过饱和状态; 晶核掉入饱和溶液中, 引发鞣花酸的大规模结晶沉降[58, 59]。同时, 鞣花酸结晶又为鞣红的吸附提供了载体, 使沉淀规模继续扩大。整个溶液体系如此循环往复, 直到某些成分最终耗竭, 难以触发任何一条沉淀途径。
综上所述, 多酚缔合胶体呈现出有利于稳定性和药效发挥的特殊相态, 对SOL乃至其他多酚液体制剂都具有重要意义。主要表现在:一方面, 多酚缔合胶体一定程度上阻断了沉淀途径, 保护了鞣花酸、诃黎勒酸及儿茶素等分子, 提高了SOL的稳定性; 另一方面, 该缔合胶体使难溶性有效成分维持分子态, 有利于吸收及药效的发挥。因此, 如何保护多酚缔合胶体免遭破坏, 是提高多酚液体制剂品质的核心。
6 稳态重构的工艺要素以往的澄清工艺研究因不清楚沉淀途径、机制与相互作用规律, 容易导致工艺干预顾此失彼, 难达理想效果。因此, 寻找既能增强缔合胶体稳定性, 又能抑制两条化学不稳定性途径的共性因素组合, 是综合抑制多元沉淀启动与形成的关键, 也是缔合胶体稳态重构的核心。
儿茶素非酶氧化聚合成鞣红要经历“儿茶素类-缩合鞣质”与“缩合鞣质-鞣红沉淀”两个阶段, 其中前者是限速过程, 儿茶素浓度、温度、pH值、电解质、缔合胶体与表面活性剂是重要的影响因素[31, 36, 47]。水解鞣质的水解是典型的吸热反应, 其主要影响因素是温度和pH值, 该过程符合范特霍夫(Varit Hoff)规则[40, 60]; 降低温度贮存有利于抑制水解。多酚缔合胶体的稳定性与多酚浓度、温度、pH值、电解质、表面活性剂及游离氧密切相关。寻求三条途径控制元素的交集(图 8), 可发现降低贮藏温度[36]、加入乙二胺四乙酸络合金属离子、驱除溶液中的游离氧是构建多酚液体制剂稳态的共性因素组合。实验结果证实, 上述工艺组合能使SOL稳定贮藏3个月以上。
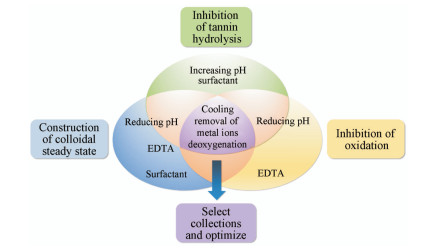
|
Figure 8 Common factors for controlling the multiple precipitation approaches of polyphenol liquid preparation |
本文以多酚口服液—SOL的研究为例, 发现并揭示了多酚类液体制剂“一类物质(多酚), 两种沉淀(鞣花酸及鞣红), 三条途径(缔合胶体陈化、水解鞣质水解及儿茶素非酶氧化聚合)”的稳定性变化微观机制, 基于缔合胶体的特殊相态平衡, 探讨了三条沉淀途径的相互作用规律、沉淀链式反应的启动因素与触发条件, 总结了沉淀控制的关键工艺因素, 这对于指导天然多酚的高效利用、精细制造与品质优化具有一定的理论价值和实践意义。
| [1] |
Berli FJ, Fanzone M, Piccoli P, et al. Solar UV-B and ABA are involved in phenol metabolism of Vitis vinifera L. increasing biosynthesis of berry skin polyphenols[J]. J Agric Food Chem, 2011, 59: 4874-4884. DOI:10.1021/jf200040z |
| [2] |
Bravo L. Polyphenols: chemistry, dietary sources, metabolism, and nutritional significance[J]. Nutr Res, 1998, 56: 317-333. |
| [3] |
Liu J, Henkel T. Traditional Chinese medicine (TCM): are polyphenols and saponins the key ingredients triggering biological activities?[J]. Curr Med Chem, 2002, 9: 1483-1485. DOI:10.2174/0929867023369709 |
| [4] |
Wei L, Yang M, Huang L, et al. Antibacterial and antioxidant flavonoid derivatives from the fruits of metaplexis japonica[J]. Food Chem, 2019, 289: 308-312. DOI:10.1016/j.foodchem.2019.03.070 |
| [5] |
Calland N, Sahuc ME, Belouzard S, et al. Polyphenols inhibit hepatitis C virus entry by a new mechanism of action[J]. J Virol, 2015, 89: 10053. DOI:10.1128/JVI.01473-15 |
| [6] |
Cruciani S, Santaniello S, Garroni G. Myrtus polyphenols, from antioxidants to anti-inflammatory molecules: exploring a network involving cytochromes P450 and vitamin D[J]. Molecules, 2019, 24: 1515. DOI:10.3390/molecules24081515 |
| [7] |
Abdal DA, Choi HY, Yang GM, et al. The anti-cancer effect of polyphenols against breast cancer and cancer stem cells: molecular mechanisms[J]. Nutrients, 2016, 8: 581. DOI:10.3390/nu8090581 |
| [8] |
Roh E, Kim JE, Kwon JY, et al. Molecular mechanisms of green tea polyphenols with protective effects against skin photoaging[J]. CRC Crit Rev Food Technol, 2015, 57: 1631-1637. |
| [9] |
Quiñones M, Miguel M, Aleixandre A. Beneficial effects of polyphenols on cardiovascular disease[J]. Pharmacol Res, 2013, 68: 125-131. DOI:10.1016/j.phrs.2012.10.018 |
| [10] |
Jin L, Lin C, Liang Z, et al. Preparation, characterization, and in vitro antitumor activity of folate conjugated chitosan coated EGCG nanoparticles[J]. Food Sci Biotechnol, 2014, 23: 569-575. DOI:10.1007/s10068-014-0078-4 |
| [11] |
Wang N, Wang Q, Tang H, et al. Direct inhibition of ACTN4 by ellagic acid limits breast cancer metastasis via regulation of β-catenin stabilization in cancer stem cells[J]. J Exp Clin Cancer Res, 2017, 36: 172. DOI:10.1186/s13046-017-0635-9 |
| [12] |
Khalifa I, Peng J, Jia Y, et al. Anti-glycation and anti-hardening effects of microencapsulated mulberry polyphenols in high-protein-sugar ball models through binding with some glycation sites of whey proteins[J]. Int J Biol Macromol, 2018, 123: 10-19. |
| [13] |
Chandran U, Mehendale N, Tillu G, et al. Network pharmacology of ayurveda formulation triphala with special reference to anti-cancer property[J]. Comb Chem High Throughput Screen, 2015, 18: 846-854. DOI:10.2174/1386207318666151019093606 |
| [14] |
Rivero-Buceta E, Carrero P, Doyagüez EG, et al. Linear and branched alkyl-esters and amides of gallic acid and other (mono-, di- and tri-) hydroxy benzoyl derivatives as promising anti-HCV inhibitors[J]. Eur J Med Chem, 2015, 92: 656-671. DOI:10.1016/j.ejmech.2015.01.033 |
| [15] |
Teles CV, Sousa CRMRD, Simões GR, et al. Protective effects of a polyphenol-rich extract from Syzygium cumini (L.) skeels leaf on oxidative stress-induced diabetic rats[J]. Oxid Med Cell Longevity, 2018: 2018: 5386079. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC6038589/
|
| [16] |
Chowdhury MR, Moshikur RM, Wakabayashi R, et al. Ionic-liquid-based paclitaxel preparation: a new potential formulation for cancer treatment[J]. Mol Pharmaceut, 2018, 15: 2484-2488. DOI:10.1021/acs.molpharmaceut.8b00305 |
| [17] |
Tang G, Hongliang Z, Huan X, et al. Novel self-assembled organic nanoprobe for molecular imaging and treatment of gram-positive bacterial infection[J]. Theranostics, 2018, 8: 1911-1922. DOI:10.7150/thno.22534 |
| [18] |
Bindes MMM, Reis MHM, Cardoso VL, et al. Ultrasound-assisted extraction of bioactive compounds from green tea leaves and clarification with natural coagulants (chitosan and Moringa oleífera seeds)[J]. Ultrason Sonochem, 2019, 51: 111-119. DOI:10.1016/j.ultsonch.2018.10.014 |
| [19] |
Xu XF, Xu SY, Zhang Y, et al. Chemical comparison of two drying methods of mountain cultivated ginseng by UPLC-QTOF-MS/MS and multivariate statistical analysis[J]. Molecules, 2017, 22: 717. DOI:10.3390/molecules22050717 |
| [20] |
Liu C, Ju A, Zhou D, et al. Simultaneous qualitative and quantitative analysis of multiple chemical constituents in Yiqifumaiinjection by ultra-fast liquid chromatography coupled with ion trap time-of-flight mass spectrometry[J]. Molecules, 2016, 21: 640. DOI:10.3390/molecules21050640 |
| [21] |
Anja R, Leifh S, Mogensl A. The role of phenolic compounds during formation of turbidity in an aromatic bitter[J]. Food Chem, 2010, 123: 1035-1039. DOI:10.1016/j.foodchem.2010.05.056 |
| [22] |
Huang HZ, Zhao SY, Ke XM, et al. Study on the stability control strategy of triphala solution based on the balance of physical stability and chemical stabilities[J]. J Pharm Biomed Anal, 2018, 158: 247. DOI:10.1016/j.jpba.2018.06.008 |
| [23] |
Gui F, Wu J, Chen F, et al. Change of polyphenol oxidase activity, color, and browning degree during storage of cloudy apple juice treated by supercritical carbon dioxide[J]. Eur Food Res Technol, 2006, 223: 427-432. DOI:10.1007/s00217-005-0219-3 |
| [24] |
Peterson CT, Denniston K, Chopra D. Therapeutic uses of triphala in ayurvedic medicine[J]. Altern Complement Med, 2017, 23: 607-614. DOI:10.1089/acm.2017.0083 |
| [25] |
Parveen R, Shamsi TN, Singh G, et al. Phytochemical analysis and in-vitro biochemical characterization of aqueous and methanolic extract of triphala, a conventional herbal remedy[J]. Biotechnol Rep, 2018, 126-136. |
| [26] |
Zhao Y, Wang M, Tsering J, et al. An integrated study on the antitumor effect and mechanism of triphala against gynecological cancers based on network pharmacological prediction and in vitro experimental validation[J]. Integr Cancer Ther, 2018, 17: 894. DOI:10.1177/1534735418774410 |
| [27] |
Baratakke SU, Raju R, Kadanakuppe S, et al. Efficacy of triphala extract and chlorhexidine mouth rinse against plaque accumulation and gingival inflammation among female undergraduates: a randomized controlled trial[J]. Indian J Dent Res, 2017, 28: 49-54. DOI:10.4103/0970-9290.203622 |
| [28] |
Peterson CT, Denniston K, Chopra D. Therapeutic uses of triphala in ayurvedic medicine[J]. J Altern Complement Med, 2017, 23: 607-614. DOI:10.1089/acm.2017.0083 |
| [29] |
Huang HZ. Study on the Formation Mechanism of Multiple Sedimentation and the Stable Storage Mechanism of Ellagic Acid in TCM Polyphenol Oral Liquid: A Case Study of Sanlejiang Oral Liquid (中药多酚口服液多元沉淀形成机制及鞣花酸贮藏稳定机制研究: 以三勒浆为例)[D]. Chengdu: Chengdu university of TCM, 2019.
|
| [30] |
Li L, Na C, Tian S, et al. Ellagic acid induces HeLa cell apoptosis via regulating signal transducer and activator of transcription 3 signaling[J]. Exp Ther Med, 2018, 16: 29-36. |
| [31] |
Huang HZ, Feng B, Lin JZ. Exploration on the approaches of diverse sedimentations in polyphenols solutions: an integrated chain of evidence based on the physical phase, chemical profile and sediment elements[J]. Frontiers, 2019. DOI:10.3389/fphar.2019.01060_Zhang |
| [32] |
Jiang H, Zhao SY, Huang HZ, et al. HPLC fingerprint of Sanlejiang oral liquid and content determination of multi-components[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 3741-3747. |
| [33] |
Uchida K, Ogawa K, Yanase E. Structure determination of novel oxidation products from epicatechin: thearubigin-like molecules[J]. Molecules, 2016, 21: 273. DOI:10.3390/molecules21030273 |
| [34] |
Rossi M, Erlebacher J, Zacharias DE, et al. The crystal and molecular structure of ellagic acid dihydrate: a dietary anti-cancer agent[J]. Carcinogenesis, 1991, 12: 2227-2232. DOI:10.1093/carcin/12.12.2227 |
| [35] |
Mathieson AM, Poppleton BJ. The crystal structure of ellagic acid[J]. Acta Crystallogr B, 1968, 24: 1456-1461. DOI:10.1107/S0567740868004474 |
| [36] |
Huang HZ, Lin JZ, Wei XC, et al. Pharmaceutical mechanism and control strategy for storage of ellagic acid stably in traditional Chinese medicine oral liquid[J]. Acta Pharm Sin (药学学报), 2019, 53: 737-745. |
| [37] |
Lewin G, Maciuk A, Moncomble A, et al. Enhancement of the water solubility of flavone glycosides by disruption of molecular planarity of the aglycone moiety[J]. J Nat Prod, 2013, 76: 8-12. DOI:10.1021/np300460a |
| [38] |
Mao X, Wu LF. Transport of corilagin, gallic acid, and ellagic acid from fructus phyllanthi tannin fraction in Caco-2 cell monolayers[J]. Evid Based Complement Alternat Med, 2016, 2016: 9205379. |
| [39] |
Yoshida T, Fujii R, Okuda T. Revised structures of chebulinic acid and chebulagic acid[J]. Chem Pharm Bull, 28: 3713-3715. DOI:10.1248/cpb.28.3713 |
| [40] |
Avula B, Wang YH, Wang M, et al. Simultaneous determination and characterization of tannins and triterpene saponins from the fruits of various species of terminalia and phyllantus emblica using a UHPLC-UV-MS method: application to triphala[J]. Planta Med, 2013, 79: 181-188. DOI:10.1055/s-0032-1328089 |
| [41] |
Ding YP, Lu CQ, Hou HX, et al. Progress in catechins oxidation products and their formation mechanism[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 239-253. |
| [42] |
Uyama H, Kurioka H, Sugihara J, et al. Cheminform abstract: peroxidase-catalyzed oxidative polymerization of cresols to a new family of polyphenols[J]. Bull Chem Soc Jpn, 1995, 68: 3209-3214. DOI:10.1246/bcsj.68.3209 |
| [43] |
Sang S, Yang I, Buckley B, et al. Autoxidative quinone formation in vitro and metabolite formation in vivo from tea polyphenol (-)-epigallocatechin-3-gallate: studied by real-time mass spectrometry combined with tandem mass ion mapping[J]. Free Radical Biol Med, 2007, 43: 362-371. DOI:10.1016/j.freeradbiomed.2007.04.008 |
| [44] |
He JB, Meng FS, Zhou Y, et al. In situ spectroelectrochemical study of pH effects on (+)-catechin oxidation[J]. Food Sci (食品科学), 2009, 30: 11-15. |
| [45] |
Sang S, Lambert JD, Tian S, et al. Enzymatic synthesis of tea theaflavin derivatives and their anti-inflammatory and cytotoxic activities[J]. Bioorg Med Chem, 2004, 12: 459-467. DOI:10.1016/j.bmc.2003.10.024 |
| [46] |
Zhang LY, Hao HY. Oxidation browning of cider with and without polyphenoloxidase[J]. Food Ferm Ind (食品与发酵工业), 2008, 34: 26-29. |
| [47] |
Shi B, Di Y. Plant Polyphenol (植物多酚)[M]. Beijing: Beijing Science Press, 2000.
|
| [48] |
Akhtar M, Murray BS, Afeisume EI, et al. Encapsulation of flavonoid in multiple emulsion using spinning disc reactor technology[J]. Food Hydrocolloid, 2014, 34: 62-67. DOI:10.1016/j.foodhyd.2012.12.025 |
| [49] |
Huang Y, Li A, Qiu C, et al. Self-assembled colloidal complexes of polyphenol-gelatin and their stabilizing effects on emulsions[J]. Food Funct, 2017, 8: 3145-3154. DOI:10.1039/C7FO00705A |
| [50] |
Bala I, Bhardwaj V, Hariharan S, et al. Analytical methods for assay of ellagic acid and its solubility studies[J]. J Pharm Biomed Anal, 2006, 40: 206-210. DOI:10.1016/j.jpba.2005.07.006 |
| [51] |
Bulani VD, Kothavade PS, Kundaikar HS, et al. Inclusion complex of ellagic acid with β-cyclodextrin: characterization and in vitro anti-inflammatory evaluation[J]. J Mol Struct, 2016, 1105: 308-315. DOI:10.1016/j.molstruc.2015.08.054 |
| [52] |
Junyaprasert VB, Singhsa P, Suksiriworapong J, et al. Physicochemical properties and skin permeation of Span 60/Tween 60 niosomes of ellagic acid[J]. Int J Pharmaceut, 2012, 423: 303. DOI:10.1016/j.ijpharm.2011.11.032 |
| [53] |
Li B, Harich K, Wegiel L, et al. Stability and solubility enhancement of ellagic acid in cellulose ester solid dispersions[J]. Carbohydr Polym, 2013, 92: 1443-1450. DOI:10.1016/j.carbpol.2012.10.051 |
| [54] |
Makhotkina O, Kilmartin PA. Uncovering the influence of antioxidants on polyphenol oxidation in wines using an electrochemical method: cyclic voltammetry[J]. J Electroanal Chem, 2009, 633: 165-174. DOI:10.1016/j.jelechem.2009.05.007 |
| [55] |
Prigione V, Spina F, Tigini V, et al. Biotransformation of industrial tannins by filamentous fungi[J]. Appl Microbiol Biot, 2018, 102: 10361-10375. DOI:10.1007/s00253-018-9408-4 |
| [56] |
Leppä MM, Karonen M, Tähtinen P, et al. Isolation of chemically well-defined semipreparative liquid chromatography fractions from complex mixtures of proanthocyanidin oligomers and polymers[J]. J Chromatogr A, 2018, 1576: 67-79. DOI:10.1016/j.chroma.2018.09.034 |
| [57] |
Yin SL, Pu YQ, Zhang T, et al. Determination of hydrolysate gallic acid in Yinzhihuang injection by HPLC[J]. Chin Tradit Herb Drugs (中草药), 2011, 42: 288-290. |
| [58] |
Li B, Harich K, Wegiel L, et al. Stability and solubility enhancement of ellagic acid in cellulose ester solid dispersions[J]. Carbohyd Polym, 2013, 92: 1443-1450. DOI:10.1016/j.carbpol.2012.10.051 |
| [59] |
Garrido VM, Sims CA, Marshall MR, et al. Factors influencing ellagic acid precipitation in muscadine grape juice during storage[J]. J Food Sci, 2010, 58: 193-196. |
| [60] |
Lai ZY, Dai HF, Xiao WQ, et al. Study on several health care components in flesh of four emblic varieties[J]. J Huazhong Agric Univ (华中农业大学学报), 2009, 28: 97-101. |
 2020, Vol. 55
2020, Vol. 55


