2. 江西中医药大学中医基础理论分化发展研究中心, 江西 南昌 330004
2. Research Center for Differentiation and Development of TCM Basic Theory, Jiangxi University of TCM, Nanchang 330004, China
一氧化氮(nitric oxide, NO)是一种多效分子, 对许多生理和病理过程至关重要。NO对肿瘤增殖、凋亡和转移的作用, 为抗肿瘤药物研发开辟了新的思路和方法, 使得新机制和新剂型NO供体型抗肿瘤药物不断涌现。然而, 不同浓度NO与肿瘤进展的相互作用显示出明显的矛盾, 基于抗NO和NO的抗癌策略在几种临床前模型中都是有效的。因此, 确定NO对癌症行为的影响, 并确定以NO为中心的抗癌策略的治疗作用显得尤为重要。只有全面、动态地分析肿瘤生物学中受NO影响的分子和细胞事件的级联反应, 才能利用干扰NO代谢的药物潜在地发挥抗肿瘤特性。本综述总结了NO对肿瘤细胞的浓度依赖及化疗增敏的作用机制, 不同浓度NO对肿瘤的作用及增加化学治疗敏感性的机制, 为NO供体等药物在抗肿瘤领域中安全有效的运用和新药开发提供论据。
1 NO促进肿瘤细胞增殖 1.1 NO通过NO/sGC/cGMP轴促进细胞增殖NO浓度小于30 nmol·L-1时, 主要通过NO/sGC/cGMP依赖性途径发挥作用, 促进细胞增殖。可溶性鸟苷酸环化酶(soluble guanylate cyclase, sGC)触发级联反应, 导致从鸟苷三磷酸合成环鸟苷酸(cyclic guanosinc monophosphate, cGMP)[1]。反过来通过减少细胞内储存的Ca2+释放, 内质网钙腺苷5-三磷酸酶介导的Ca2+内流和Ca2+摄取来消耗细胞内Ca2+水平。这些作用通过细胞外信号调节激酶(extracellular regulated protein kinases, ERK)的磷酸化, 调节肿瘤细胞增殖和保护作用。另有文献[2]报道, 50 nmol·L-1 NO与cGMP介导的ERK磷酸化增加有关。同时sGC途径是内源性NO介导的细胞迁移反应所必需的。
1.2 NO通过AKT磷酸化保护肿瘤细胞NO浓度在30~60 nmol·L-1时, NO诱导蛋白激酶B (AKT)的磷酸化。在小鼠纤维肉瘤模型中, NO通过该酶869位半胱氨酸的硫醇氧化还原机制抑制细胞凋亡信号调节激酶-1的活性, 随后可启动细胞凋亡保护。研究发现, 肿瘤诱导型一氧化氮合酶2 (NOS 2)表达与AKT通路激活之间存在正相关[3]。
1.3 NO通过稳定HIF-1α的结构, 导致PI3K活化和癌细胞存活和增殖缺氧诱导因子1 (hypoxia inducible factor-1, HIF-1)在多数肿瘤组织中高表达, 是最具攻击性肿瘤的关键介质, 与肿瘤转移、血管生成和患者预后不良等之间存在强烈相关性。HIF-1通过增加遗传不稳定性, 改变细胞代谢和下调促凋亡蛋白来促进耐药性。HIF-1α在含氧量正常的条件下快速降解[4]:泛素与HIF-1α发生依赖于ATP的反应, 致使其末端与HIF-1α的赖氨酸氨基缩合, 这是HIF-1α降解第一步。HIF-1α底物脯氨酰-4-羟化酶可致HIF-1α结构域中吡咯氨酸羟基化, 从而增强HIF-1α与泛素结合导致HIF-1α降解。然而脯氨酰-4-羟化酶羟基化作用仅在有足够量氧气时才会发生。在肿瘤环境的低氧条件下, 赖氨酸残基的酶乙酰化活性不依赖于氧。但赖氨酸残基的表达在缺氧条件下降低, 使得HIF-1α的泛素化作用受到抑制。
NO浓度在100~400 nmol·L-1时, 肿瘤细胞的HIF-1α脯氨酸和赖氨酸残基的羟基化和乙酰化都不会发生, 使得HIF-1α结构的稳定化[5], 导致胞内磷脂酰肌醇激酶(PI3K)活化和癌细胞存活和增殖。
1.4 NO通过促成p53突变, 抑制细胞凋亡p53可调节氧化还原应激的能力, 诱导细胞死亡, 抑制细胞迁移和血管生成, 限制干细胞更新从而抑制肿瘤的生成[6]。p53受泛素连接酶(murine double minute 2, Mdm2)调控, Mdm2靶向p53降解并通过与转录激活结构域结合直接抑制p53活性。人类恶性肿瘤中肿瘤抑制基因p53突变率为30%~50%, 在不同组合的p53四聚体中, 如果存在1个突变的p53蛋白就会有效地干扰整个四聚体的功能, 使其凋亡功能完全失活[7]。因此, 突变的p53不仅消除野生型P53功能, 而且显著损害野生型p53功能。
NO浓度低于400 nmol·L-1导致p53突变, NO促成p53突变后, 突变的p53对肿瘤无抑制活性, 且损伤野生型p53功能, 从而导致细胞存活[8]。NO通过清除p53突变细胞的线粒体中产生的超氧阴离子、阻碍bcl-xL下调、诱导线粒体膜电位去极化、释放细胞色素C及最终活化caspase-3等途径,也可以有效地抑制细胞凋亡。
1.5 NO通过DNA损伤, 修复抗细胞凋亡程序性细胞死亡是由半胱氨酸蛋白酶激活介导的, NO浓度大于400 nmol·L-1时, 通过活性位点半胱氨酸的S-亚硝基化抑制半胱天冬酶活性, 抑制肝细胞、内皮细胞和一些肿瘤细胞系的凋亡。此外, 活性氮(reactive nitrogen species, RNS)作为清除剂也可发挥抗细胞凋亡作用。
2 NO诱导促细胞凋亡 2.1 NO稳定p53, 导致细胞周期停滞和细胞生长抑制NO浓度大于400 nmol·L-1时称为NO高浓度, 此时NO的抗肿瘤作用涉及细胞周期调节因子p53发生磷酸化和乙酰化。其他报道定义发生磷酸化的NO高浓度在700~800 nmol·L-1[9]或500~1 000 nmol·L-1的持续水平[10]。p53的磷酸化阻止了其与Mdm2结合并使p53不能被泛素化和降解。NO可通过丝氨酸/苏氨酸部分的磷酸化来稳定p53, 导致高水平的野生型p53; ERK磷酸酶MKP-1也被激活, 阻止细胞增殖, 使细胞凋亡。
p53的积累最终抑制NOS 2启动子活性, 增加NOS 2表达和抑制野生型p53的表达[11]。过高NO浓度会导致过氧亚硝酸盐形成, 过氧亚硝酸盐可以通过酪氨酸硝化来灭活p53[1]。在缺乏p53基因突变的肿瘤中观察到p53途径的失活。细胞周期蛋白依赖性激酶抑制剂p21可以阻止细胞周期。p53诱导的细胞周期停滞, 尤其是诱导p21表达增加与细胞存活相关, 诱导p21失败通常导致细胞凋亡[12]。因此, 在NO生成和p53积累之间形成负反馈(图 1), 这可能构成对DNA损伤的生理机制的一部分。
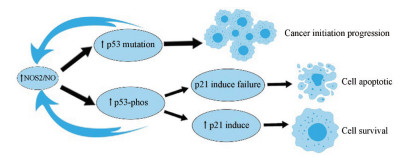
|
Figure 1 A concentration of nitric oxide (NO) less than 400 nmol·L-1 mutates p53, resulting in cell survival. After p53 mutation, the mutated p53 has no inhibitory activity on tumors and increases nitric oxide synthase (NOS) 2 expression. High concentrations of NOS2/NO phosphorylate p53, leading to cell cycle arrest and cell growth inhibition. Accumulation of p53 ultimately inhibits iNOS promoter activity, resulting in increased iNOS expression and p53 inhibition |
NO的浓度接近或超过1 μmol·L-1时, 通过蛋白质亚硝化、硝化和烷基化导致细胞凋亡[13]。NOS 2在1 mol·L-1浓度下产生NO通常持续数天[14], 非生理高浓度的NO/S-亚硝基硫醇(RSNO)将促进细胞凋亡[15]。NO亚硝化不仅依赖于酶活性, 还包括其翻译后磷酸化修饰, 其效率由氧化还原对氧化型谷胱甘肽/还原型谷胱甘肽和氧化硫氧还蛋白/还原型硫氧还蛋白调节的细胞内氧化还原环境决定[16]。
2.2.1 亚硝基化、硝化和烷基化损伤DNANO与O2或超氧阴离子(O2-)作用形成RNS, 如:二氧化氮(NO2)、三氧化二氮(N2O3)和过氧化亚硝酸盐(ONOO-)。N2O3是一种强亚硝化剂, 可以使DNA碱基脱氨基, 导致DNA突变。N2O3也会通过烷基化与仲胺反应形成致癌的N-亚硝胺, 破坏DNA。强氧化剂ONOO-氧化硫醇和硫醚, 硝化酪氨酸残基, 硝化氧化鸟苷, 降解碳水化合物, 并引发脂质过氧化和裂解DNA。
2.2.2 亚硝基化破坏基因组完整性和抑制特定的DNA修复系统NO介导的活性位点半胱氨酸亚硝化可抑制几种关键的DNA修复酶[17]。细胞色素P450氧化致癌亚硝胺形成DNA烷化代谢物导致DNA损伤, 这种损害由烷基转移酶修复, 烷基转移酶的亚硝化使酶失活, 从而阻止DNA修复, 增加潜在的突变。NO可以抑制特定的DNA修复系统, 特别是依赖硫醇系统, 如烷基转移酶和锌指蛋白[18]。RNS可使蛋白质上易受影响的巯基亚硝基化, 导致其催化活性丧失。这通常是可逆反应, 但在含有锌、铜或铁的蛋白质中, 亚硝基化导致金属的不可逆排出和蛋白质变性。抗氧化剂和亚硝化抑制剂如叠氮化物、还原型谷胱甘肽、尿酸盐和抗坏血酸盐会减少NO信号传导。
2.2.3 亚硝基化使能量代谢障碍及线粒体生理的破坏NO与铁硫基团(Fe-S)形成铁-亚硝酰复合物, 引起Fe-S辅基降解, 使顺乌头酸酶、还原型辅酶Ⅱ-氢醌氧化还原酶和琥珀酸-氢醌氧化还原酶的活性丧失; NO与O2-反应形成ONOO-, 也抑制顺乌头酸酶, 破坏肿瘤细胞的三羧酸循环; 聚ADP-核糖合成酶可被损伤的DNA激活, 激活的ADP-核糖合成酶可排空烟酰胺腺嘌呤二核苷酸(NAD)和ATP, 且影响肿瘤细胞DNA复制。总之, 这些反应均可使肿瘤细胞能量代谢障碍而死亡。
NO通过细胞色素C的血红素亚硝基化而诱导细胞凋亡, 其促凋亡功能导致胱天蛋白酶-3活化增加[19]。一氧化氮供体中NO通过与细胞色素C氧化酶及复合体Ⅰ、Ⅱ、Ⅳ的结合可抑制线粒体呼吸, 降低细胞内线粒体对氧的消耗, 从而增加细胞内氧的重新分布和细胞内氧的利用率。氧的增多使脯氨酰羟化酶激活, 使HIF-1α被蛋白酶降解而增强肿瘤细胞对放化疗的敏感性。进入胞浆的细胞色素C在dATP的协助下结合凋亡酶激活因子1活化半胱天冬酶, 引起细胞凋亡。
2.3 NO通过pERK和pAkt去磷酸化导致细胞凋亡乳腺癌细胞长时间暴露于1 mmol·L-1 DETA/NO导致蛋白激酶磷酸酶-1介导的pERK和pAkt去磷酸化, 诱导细胞凋亡。
3 NO介导的抗肿瘤细胞化学免疫致敏作用化疗药物导致的耐药性及多药耐药性是临床面临的严重问题。除通过上调野生型p53及亚硝基化、硝化和烷基化损伤DNA而增加化疗药物敏感性外, NO还可通过对肿瘤血管功能调节、基质金属蛋白酶9调节及NF-κB/Snail/YY1/RKIP/PTEN环作用, 诱导细胞凋亡。
3.1 NO对肿瘤血管功能调节血管生成抑制剂通过特异性或部分地阻断血管内皮生长因子(vascular endothelial growth factor, VEGF)途径的血管生成活性而被美国食品和药品管理局批准用于临床。这种策略导致血管生长因子代偿性增高并促进肿瘤生长, 且缺乏血管使得药物无法有效输送。最近研究表明, 在血管正常期间给予肿瘤细胞毒性治疗能够达到更好的治疗效果[20]。血管正常化提高了肿瘤内部血液灌流和氧气的运输, 使化学治疗和免疫治疗的效果显著提升, 是一个非常有希望的治疗肿瘤的方法。NO在正常供氧和缺氧状态下均可增加血管新生。NO在依赖NO/sGC/cGMP途径调控, 内皮产生的NO扩散到血管壁中并使动脉中血管平滑肌细胞松弛, 从而增加血管直径, 降低阻力并增强组织的血流量。NO浓度接近100 nmol·L-1时, 在肿瘤低氧条件下HIF-1α稳定表达, 进入细胞核与VEGF靶基因结合, 上调VEGF表达以促进血管新生。高浓度NO在正常供氧的状态下, HIF-1α可发生巯基亚硝基化修饰并加强自身的稳定性, 导致正常供氧的状态下HIF-1α仍可与VEGF基因结合, 促进VEGF表达进而调控血管舒张及内皮细胞功能, 增加血管新生, 最终增加了肿瘤内部化疗药物的有效输送。
3.2 NO对MMP-9的双相调节作用基质金属蛋白酶9 (matrix metalloproteinase-9, MMP-9)可促进免疫抑制、肿瘤血管生成和肿瘤微环境内侵袭。MMP-9可通过释放VEGF参与血管生成。金属蛋白酶组织抑制因子-1与MMP-9的酶原或活化后酶催化区的羧基末端特异性结合, 形成复合物特异性抑制MMP-9的活性。NO/RNS在300~500 nmol·L-1浓度时[21]与其他亲电试剂可通过攻击潜在蛋白质的硫醇锌键来激活MMP[22]。在巨噬细胞和小胶质细胞中, NO通过cGMP依赖性抑制金属蛋白酶组织抑制因子-1, 增加MMP-9活性[23, 24]。随着NO浓度增加到激活p53的更高水平, MMP-9活性减少, 表明NO对MMP-9的双相调节作用。
3.3 NO作用于NF-κB/Snail/YY1/RKIP/PTEN环NO介导的NF-κB活性抑制和其抗凋亡基因靶标下游的抑制, 使肿瘤细胞对化学治疗药物的细胞凋亡敏感[25]。在肿瘤细胞中, NF-κB、Snail和YY1的表达上调, RKIP和PTEN的表达下调。采用大于500 mmol·L-1 NO供体DETA-NONOate的NO处理肿瘤细胞, 可将抗凋亡的NF-κB/Snail/YY1/RKIP/PTEN抗性环转化为敏感的促凋亡环(图 2)。
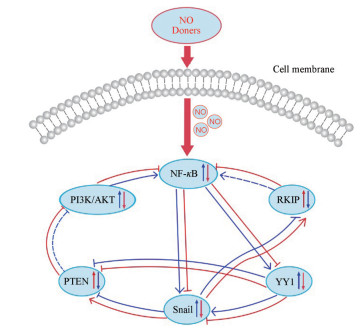
|
Figure 2 NO donors transforms the anti-apoptotic NF-κB/Snail/YY1/RKIP/PTEN resistant loop into a sensitive pro-apoptotic loop. In cancer cells, the expression and the activities of NF-κB, Snail, YY1 are up-regulated, while the expression and activity of RKIP and PTEN are down-regulated. The cycle is the result of target Snail and YY1 mediated by NF-κB, while Snail inhibits RKIP and YY1 inhibits PTEN. In addition, YY1 activates Snail. In the presence of NO donors, the activities of NF-κB, Snail and YY1 are inhibited and leading to the de-inhibition of RKIP and PTEN. Conversely, RKIP potentiates its inhibitory activity on NF-κB and its targets and, likewise, PTEN inhibits the PI3K/Akt pathway which controls NF-κB. Overall, NO treatment inhibits tumor cell viability, proliferation, and sensitizes cells to chemical immunotherapy-induced apoptosis[25] |
NO通过S-亚硝基化NF-κB及抑制IκBα的磷酸化和降解来抑制NF-κB活性[26], 减少NF-κB进入细胞核诱发P-糖蛋白的过度表达而导致药物多药耐药。NO通过抑制NF-κB及其靶基因Snail、YY1、S-亚硝基化肿瘤细胞p50和p65, 抑制Snail表达。NO导致YY1的S-亚硝基化并进一步抑制其DNA结合活性[27]。NO抑制NF-κB及NF-κB靶向RKIP阻遏物Snail, 导致RKIP表达显著上调。NO对NF-κB、Snail和YY1的抑制导致肿瘤抑制基因PTEN的去阻遏及其上调, 阻断PI3K/AKT细胞增长途径, 从而调节细胞增殖和凋亡[28]。总之, NO治疗能抑制肿瘤细胞活性和增殖, 诱导细胞凋亡敏感[29]。
4 总结和展望NO作为肿瘤治疗的一个佐剂具有较强的浓度依赖性, 低浓度时促进肿瘤生长, 高浓度时发挥抗肿瘤的作用。控制NO输送部位、NO浓度和NO释放速率等参数是开发NO的关键[30]。NO不仅本身具有抗肿瘤作用, 还可通过多个环节提高化学治疗的敏感性, 随着NO对于癌症的分子构成和常规抗肿瘤药物相互作用的深入探究, NO将在恶性肿瘤领域得到更合理和广泛的应用。
| [1] |
Mocellin S, Bronte V, Nitti D. Nitric oxide, a double edged sword in cancer biology: searching for therapeutic opportunities[J]. Med Res Rev, 2007, 27: 317-352. DOI:10.1002/med.20092 |
| [2] |
Vahora H, Khan MA, Alalami U, et al. The potential role of nitric oxide in halting cancer progression through chemoprevention[J]. J Cancer Prev, 2016, 21: 1-12. DOI:10.15430/JCP.2016.21.1.1 |
| [3] |
Prueitt RL, Boersma BJ, Howe TM, et al. Inflammation and IGF-I activate the Akt pathway in breast cancer[J]. Int J Cancer, 2007, 120: 796-805. DOI:10.1002/ijc.22336 |
| [4] |
Lai HH, Li JN, Wang MY, et al. HIF-1α promotes autophagic proteolysis of Dicer and enhances tumor metastasis[J]. J Clin Invest, 2018, 128: 625-643. |
| [5] |
Coneski PN, Schoenfisch MH. Nitric oxide release: part Ⅲ. measurement and reporting[J]. Chem Soc Rev, 2012, 41: 3753-3758. DOI:10.1039/c2cs15271a |
| [6] |
Kruiswijk F, Labuschagne CF, Vousden KH. p53 in survival, death and metabolic health: a lifeguard with a licence to kill[J]. Nat Rev Mol Cell Biol, 2015, 16: 393-405. DOI:10.1038/nrm4007 |
| [7] |
Weinberg RA, Zhan QM, Liu ZH, et al. P53 and apoptosis: patronus and executioner//The Biology of Cancer[M]. 2nd Ed. Beijing: Science Press, 2018: 351-358.
|
| [8] |
Chang CF, Diers AR, Hogg N. Cancer cell metabolism and the modulating effects of nitric oxide[J]. Free Radic Biol Med, 2015, 79: 324-336. DOI:10.1016/j.freeradbiomed.2014.11.012 |
| [9] |
Thomas DD, Espey MG, Ridnour LA, et al. Hypoxic inducible factor 1alpha, extracellular signal-regulated kinase, and are regulated by distinct threshold concentrations of nitric oxide[J]. Proc Natl Acad Sci U S A, 2004, 101: 8894-8899. DOI:10.1073/pnas.0400453101 |
| [10] |
Somasundaram V, Basudhar D, Bharadwaj G, et al. Molecular mechanisms of nitric oxide in cancer progression, signal transduction and metabolism[J]. Antioxid Redox Signal, 2019, 30: 1124-1143. DOI:10.1089/ars.2018.7527 |
| [11] |
Gallo O, Schiavone N, Papucci L, et al. Down-regulation of nitric oxide synthase-2 and cyclooxygenase-2 pathways by p53 in squamous cell carcinoma[J]. Am J Pathol, 2003, 163: 723-732. DOI:10.1016/S0002-9440(10)63699-1 |
| [12] |
Hsieh JK, Kletsas D, Clunn G, et al. p53, p21(WAF1/CIP1), and MDM2 involvement in the proliferation and apoptosis in an in vitro model of conditionally immortalized human vascular smooth muscle cells[J]. Arterioscler Thromb Vasc Biol, 2000, 20: 636-644. DOI:10.1161/01.ATV.20.3.636 |
| [13] |
Borutaite V, Brown GC. S-nitrosothiol inhibition of mitochondrial complex I causes a reversible increase in mitochondrial hydrogen peroxide production[J]. Biochim Biophys Acta, 2006, 1757: 562-566. DOI:10.1016/j.bbabio.2006.02.014 |
| [14] |
Singh S, Gupta A. Nitric oxide: role in tumour biology and iNOS/NO-based anticancer therapies[J]. Cancer Chemother Pharmacol, 2011, 67: 1211-1224. DOI:10.1007/s00280-011-1654-4 |
| [15] |
Monteiro HP, Costa PE, Reis AK, et al. Nitric oxide: protein tyrosine phosphorylation and protein S-nitrosylation in cancer[J]. Biomed J, 2015, 38: 380-388. DOI:10.4103/2319-4170.158624 |
| [16] |
Monteiro HP, Arai RJ, Travassos LR. Protein tyrosine phosphorylation and protein tyrosine nitration in redox signaling[J]. Antiox Redox Signal, 2008, 10: 843-889. DOI:10.1089/ars.2007.1853 |
| [17] |
Rapozzi V, Della Pietra E, Bonavida B. Dual roles of nitric oxide in the regulation of tumor cell response and resistance to photodynamic therapy[J]. Redox Biol, 2015, 6: 311-317. DOI:10.1016/j.redox.2015.07.015 |
| [18] |
Laval F, Wink DA. Inhibition by nitric oxide of the repair protein, O6-methylguanine-DNA-methy ltransferase[J]. Carcinogenesis, 1994, 15: 443-447. DOI:10.1093/carcin/15.3.443 |
| [19] |
Xu W, Liu L, Charles IG, et al. Nitric oxide induces coupling of mitochondrial signalling with the endoplasmic reticulum stress response[J]. Nat Cell Biol, 2004, 6: 1129-1134. DOI:10.1038/ncb1188 |
| [20] |
Martin JD, Seano G, Jain RK. Normalizing function of tumor vessels: progress, opportunities, and challenges[J]. Annu Rev Physiol, 2019, 81: 505-534. DOI:10.1146/annurev-physiol-020518-114700 |
| [21] |
Krishnatry AS, Fung SM, Brazeau DA, et al. Nitroglycerin alters matrix remodeling proteins in THP-1 human macrophages and plasma metalloproteinase activity in rats[J]. Nitric Oxide, 2011, 24: 66-76. DOI:10.1016/j.niox.2010.12.002 |
| [22] |
Ridnour LA, Dhanapal S, Hoos M, et al. Nitric oxide-mediated regulation of beta-amyloid clearance via alterations of MMP-9/TIMP-1[J]. J Neurochem, 2012, 123: 736-749. DOI:10.1111/jnc.12028 |
| [23] |
Basudhar D, Somasundaram V, de Oliveira GA, et al. Nitric oxide synthase-2-derived nitric oxide drives multiple pathways of breast cancer progression[J]. Antioxid Redox Signal, 2017, 26: 1044-1056. DOI:10.1089/ars.2016.6813 |
| [24] |
Chen M, Wu ML, Fan Y, et al. Nitric oxide-releasing drug delivery systems for overcoming drug resistance in chemotherapy[J]. Acta Pharm Sin (药学学报), 2018, 53: 1630-1636. |
| [25] |
Bonavida B, Garban H. Nitric oxide-mediated sensitization of resistant tumor cells to apoptosis by chemo-immunotherapeutics[J]. Redox Biol, 2015, 6: 486-494. DOI:10.1016/j.redox.2015.08.013 |
| [26] |
Garban HJ, Bonavida B. Nitric oxide disrupts H2O2-dependent activation of nuclear factor kappa B. Role in sensitization of human tumor cells to tumor necrosis factor-alpha-induced cytotoxicity[J]. J Biol Chem, 2001, 276: 8918-8923. DOI:10.1074/jbc.M008471200 |
| [27] |
Bonavida B, Baritaki S. The novel role of Yin Yang 1 in the regulation of epithelial to mesenchymal transition in cancer via the dysregulated NF-κB/Snail/YY1/RKIP/PTEN circuitry[J]. Crit Rev Oncog, 2011, 16: 211-226. DOI:10.1615/CritRevOncog.v16.i3-4.50 |
| [28] |
Zhu Q, Huang C, Meng X, et al. CYP1A2 contributes to alcohol-induced abnormal lipid metabolism through the PTEN/AKT/SREBP-1c pathway[J]. Biochem Biophy Res Commun, 2019, 513: 509-514. DOI:10.1016/j.bbrc.2019.04.034 |
| [29] |
Ridnour LA, Windhausen AN, Isenberg JS, et al. Nitric oxide regulates matrix metalloproteinase-9 activity by guanylyl-cyclase-dependent and -independent pathways[J]. Proc Natl Acad Sci U S A, 2007, 104: 16898-16903. DOI:10.1073/pnas.0702761104 |
| [30] |
Vahora H, Khan MA, Alalami U, et al. The potential role of nitric oxide in halting cancer progression through chemoprevention[J]. J Cancer Prev, 2016, 21: 1-12. DOI:10.15430/JCP.2016.21.1.1 |
 2020, Vol. 55
2020, Vol. 55


