2. 河南科技大学医学院, 河南 洛阳 471023
2. Medical School, Henan University of Science and Technology, Luoyang 471023, China
多肽作为新型的治疗分子和优良的药物载体, 近年来被广泛应用到癌症治疗、肿瘤成像和免疫治疗等多个领域[1]。作为基因/药物载体, 多肽具有低毒性、低免疫原性、高的组织渗透性和容易合成及修饰等优点[2]。但由于多肽容易被多种蛋白酶所降解, 并且具有很高的血液、肾脏清除率, 导致其体内稳定性差, 在实际应用中存在许多局限性[3, 4]。因此, 研究者尝试多种方法来提高多肽在生物体内参与循环的稳定性。本论文旨在总结目前提高多肽稳定性的方法, 以期对多肽的应用提供参考。
1 多肽结构的改造多肽之所以在生物体内不稳定, 是因为其特殊的分子结构。多肽主链上容易发生脱酰胺反应, 特别是位于分子表面的酰胺基团容易被蛋白酶识别和水解。侧链上氨基酸残基容易发生构象变化, 例如α-螺旋的解离和盐桥的断裂等。这些因素都导致多肽在体内不能长期稳定存在。为了解决多肽在结构上的不稳定性, 许多研究者致力于对多肽的结构进行改造[5]。这些改造主要思路是降低多肽结构参与降解反应的活泼性, 例如将多肽首尾相连或侧链与侧链相连形成环肽, 将天然的L-型氨基酸替换为蛋白酶不容易识别的D-型氨基酸, 改变多肽中氨基酸的序列等。
1.1 形成环肽与直链肽相比, 环肽具有更好的结构稳定性。通过二硫键将多肽首尾相连形成环肽或者利用半胱氨酸形成分子内小环, 使肽链失去游离的氨基和羧基, 避免被特异性识别端基氨基和羧基的蛋白酶降解。而且, 成环的多肽分子内会形成二硫键或者盐桥, 这些相互作用会进一步提高多肽的稳定性。Bogdanowich-Knipp等[6]对比了直链RGD与环状RGD的稳定性发现, 天冬氨酸是RGD肽的降解位点, 其侧链容易与肽链的C-端或N-端发生分子内反应。当RGD为线性时分子柔性较大导致参与反应的两个原子之间距离较短, 容易发生降解反应。当RGD成环以后, 分子结构的刚性得到增强, 使得参与反应的原子之间的距离增大, 不能发生降解反应。另一个使环状RGD稳定性增加的原因是精氨酸中的胍基与天冬氨酸的羧基之间形成了盐桥, 盐桥的存在也可以防止天冬氨酸的侧链参与降解反应。直链RGD与环状RGD的结构如图 1所示。
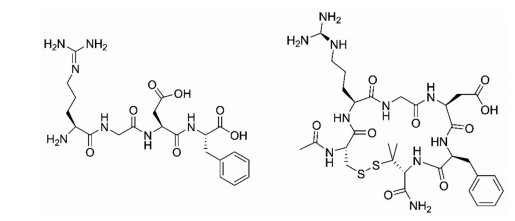
|
Figure 1 Molecular structures of linear RGD and cyclic RGD |
Gomesin是一种由18个氨基酸组成的肽链, 其序列为ZCRRLCYKQRCVTYCRGR, 其中, Z为焦谷氨酸。该肽链具有抗肿瘤、抗病原微生物、抗真菌、抗利什曼原虫和抗疟疾作用。为了改善Gomesin在胃蛋白酶中的稳定性, Chan等[7]将Gomesin中处于N-末端的焦谷氨酸用甘氨酸替代, 然后将Gomesin首尾相连形成环肽。研究发现环肽折叠时半胱氨酸之间生成了二硫键使多肽结构更加稳定, 环化的Gomesin对HaLa细胞的毒性增加3倍, 并且抗疟原虫和抗菌活性都有显著提高。
Hymenochirin-1B是一种具有α-螺旋结构的多肽, 具有广泛的生物活性, 如抗病原微生物、抗癌、免疫调节和抗糖尿病活性。天然α-螺旋线性肽通常不能保持其预期的构象和与预期靶标的结合能力。Li等[8]利用钌催化的烯烃复分解的方法共价连接两个氨基酸的侧链使多肽形成分子内小环, 达到了使多肽hymenochirin-1B稳定的目的。研究者共合成了10种hymenochirin-1B肽类似物, 在胰蛋白酶环境中检测其稳定性。结果发现所有含有环形肽的序列显示出比hymenochirin-1B原序列更好的蛋白酶稳定性, 其中, H-10的蛋白酶抗性最好, 半衰期为3.5 h, 并且H-10显示出更好的肿瘤细胞抑制活性。hymenochirin-1B和H-10的序列如图 2所示。

|
Figure 2 Sequence of hymenochirin-1B and H-10 [S5 = (S)-N-Fmoc-2-(4'-pentenyl)alanine] |
多肽分子内或分子间的二硫键、α-螺旋和疏水缔合作用对于多肽的蛋白酶稳定性具有非常重要的影响。Chen等[9]尝试将多肽中距离相等的两个位置引入半胱氨酸, 通过两个二硫键将两条α-螺旋肽中相对应的半胱氨酸平行或反平行连接, 成为一个α-螺旋二聚体(图 3)。这种结构不仅能够将多肽维持在α-螺旋构象, 并且可以调节α-螺旋二聚体之间的疏水相互作用。研究者使用胰蛋白酶或胰凝乳蛋白酶检测多肽的稳定性。结果发现所有单体肽在0.02 μmol·L-1胰蛋白酶或胰凝乳蛋白酶中被快速降解, 半衰期为0.1~1 h。研究者们增加了蛋白酶浓度, 发现即使在7 μmol·L-1蛋白酶浓度中2 h, 7=7二聚体仍然保持活性。整体来说6=6、7=7和8=8三个二聚体的稳定性都得到了明显的改善。有趣的是, 本研究并没有观察到肽链的α-螺旋构象与稳定性之间存在关系。但是发现7=7和8=8的二聚体的水溶性明显增加, 也许是由于肽链的疏水性残基被掩埋在两条肽链之间的界面处导致的。由此可以推断, 疏水相互作用对二聚体在蛋白酶中的稳定性具有重要作用。研究者进一步探讨了7=7具有如此优异的稳定性的原因。观察到反平行7=7分子二聚时, 容易被胰凝乳蛋白酶识别的苯丙氨酸(F)、酪氨酸(Y)和色氨酸(W) 3个裂解位点位于二硫键同侧, 也就是二聚体的内侧, 规避了胰凝乳蛋白酶的降解。
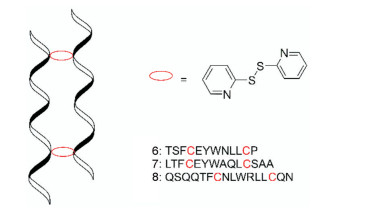
|
Figure 3 Structure of alpha-helical dimer and the sequence of peptides (No. 6, 7, 8) |
由于体内蛋白酶所能识别的氨基酸为天然的L-型氨基酸, 所以研究者们尝试用D-型氨基酸来替代多肽链中的L-型氨基酸[10]。有些研究者仅将多肽链的C端和N端的氨基酸用D-型氨基酸替代, 而有的则将多肽链中所有氨基酸改变为D-型氨基酸。Tugyi等[11]选取MUC2黏蛋白中的一段抗原决定簇(15TPTPTGTQTPT25), 分别将C端和N端3个氨基酸替换为D-型氨基酸或者将两端3个氨基酸同时替换为D-型氨基酸, 研究它们在人血清中的稳定性。结果发现N端替换成D-型氨基酸(Pep2和Pep3)后对多肽的稳定性具有很大提升。如Pep2, 在10%和50%血清中的降解率分别为16%和45%。在N和C末端同时具有3个D-型氨基酸的肽链即使在50%人血清中96 h后也是稳定的。其中Pep4和Pep5这两条肽链既具有很高的蛋白酶稳定性, 又具有很好的特异性识别抗体的能力。15TPTPTGTQTPT25的两端替换情况如表 1所示。
| Table 1 Amino acid residue substitution at terminals of TPTPTGTQTPT peptide |
另有研究发现, 由天然L-型氨基酸组成的七肽GICP (SSQPFWS)对在胶质瘤细胞中高表达的VAV3蛋白具有高亲和力。由于其独特的氨基酸序列, 不能对其进行D-型氨基酸取代, 但是将其与D-型肽相连可以改善肽的蛋白酶稳定性。DA7R (DRDPDPDLDWDTDA)是血管内皮生长因子受体-2 (VEGFR2)和神经纤毛蛋白-1 (NRP-1)的配体。Zhang等[12]设计将GICP与DA7R通过几个甘氨酸相连形成多肽结合体DA7R-GICP (DRDPDPDLDWDTDAGGGCGGGSSQPFWS)。通过对比GICP、DA7R和DA7R-GICP三种肽, 发现DA7R-GICP是一种既不影响两种肽各自的结合位点又能改善其蛋白酶稳定性的靶向肽。
1.3 改变多肽中单个或多个氨基酸多肽链主链与主链之间、侧链与侧链之间主要靠静电作用维系结构稳定, 可以通过替换掉其中几个氨基酸来增强多肽链之间的静电作用。Chen等[13]将裂解肽PTP-7中部分或所有赖氨酸替换为组氨酸, 合成了4种肽, 分别是PTP-7 (FLGALFKALSKLL)、PTP-7a (FLGALFHALSKLL)、PTP-7b (FLGALFKALSHLL)和PTP-7c (FLGALFHA LSHLL)。研究发现将两个赖氨酸全部替换为组氨酸的PTP-7c肽在100%人血清中的半衰期最长, 为11 h。与PTP-7相比, 所有含组氨酸的肽对正常细胞的毒性显著降低。含有组氨酸的肽PTP-7a和PTP-7b对癌细胞保持了良好活性。可以推测组氨酸的存在对于改善肽的稳定性以及降低肽的细胞毒性起到了关键作用。
将多肽的N-端和C-端进行结构改造可以躲避氨肽酶和羧肽酶的识别。Seebach等[14]对神经降压素(NT)的两端进行了同系化改变。将多肽N-端和C-端分别插入一个-CH2基团, 将α-氨基酸替换为β-氨基酸, 并且改变两端氨基酸中心碳原子的(R)/(S)构型。研究发现, 其中一个NT类似物(H-(S)-β2hR-RPYI-β3hL-OH)在人血清中显示出独特的、优异的稳定性, 可以在人血清中保持7天的生物活性。NT和NT类似物的分子结构如图 4所示。
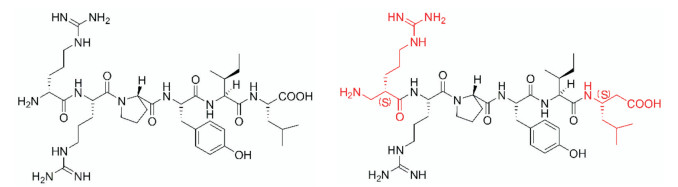
|
Figure 4 Molecular structures of NT and NT analogues |
CTT肽(CTTHWGFTLC)是一种明胶酶抑制肽, 研究发现CTT肽具有特异性靶向肿瘤的能力[15]。Björklund等[16]利用丙氨酸逐个替换CTT肽中氨基酸残基来寻找影响明胶酶抑制活性的关键残基, 发现色氨酸对于明胶酶抑制活性至关重要。用色氨酸类似物5-羟色氨酸、5F-色氨酸和6F-色氨酸来替代色氨酸。结果发现, 5F-CTT在血清中半衰期为3 h, 显示出比天然CTT高出6倍的血清稳定性。同时, 5F-CTT还具有更加优良的抑制肿瘤细胞迁移的能力。5F-CTT在血清中更稳定可能是由于疏水性氟原子引起的肽的聚集使其构象变得更紧凑。色氨酸及其类似物的分子结构如图 5所示。
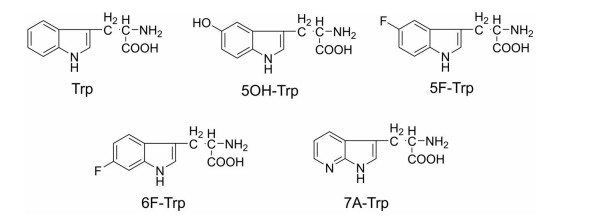
|
Figure 5 Molecular structures of Trp and Trp analogues |
将多肽两端进行修饰是保护多肽免于蛋白酶降解的有效策略。将多肽两端进行脂肪链修饰, 由于疏水作用的增加, 可以增强多肽的结构稳定性。用PEG来修饰多肽, 则可以让多肽达到隐形的目的。将多肽与无机化合物结合并自组装成纳米粒子则可以隐藏多肽的C-端和N-端, 从而具有抗氨肽酶和羧肽酶降解的作用。
2.1 对多肽进行疏水修饰胰高血糖素样肽-1 (GLP-1)是治疗Ⅱ型糖尿病的一种有效激素, 但在生理条件下容易被代谢酶如二肽基肽酶Ⅳ (DPP-Ⅳ)和中性内肽酶(NEP)快速灭活[17, 18]。近年来, 研究者们致力于开发长效GLP-1衍生物。Han等[19]首先将半胱氨酸引入第8位上含有甘氨酸的GLP-1 (7-36)-NH2 (HGEGTFTSDVSSYLEGQAAKEFIAWLVKGR)中, 然后将带有马来酰亚胺的多条脂肪链与半胱氨酸的巯基相连, 生成多个脂肪链修饰的多肽衍生物。研究发现, 37 ℃时, G8-GLP-1 (7-36)-NH2在大鼠血浆中的半衰期仅有约0.5 h。多数衍生物的半衰期都有所增加。实验进一步发现脂肪链的长度与半衰期有密切关系。同样条件下, C8脂肪链的半衰期为5.9 h, C12脂肪链为24 h, C16脂肪链为45.4 h。研究者分析体外稳定性实验和白蛋白结合实验后得出G8-GLP-1 (7-36)-NH2衍生物的体外稳定性与其白蛋白结合能力有关, 推测脂肪链促进了多肽衍生物与血清白蛋白之间的非共价结合, 提高了多肽的稳定性。
抗菌肽(antimicrobial peptide, AMP)作为新型抗肿瘤药物具有重要价值, 该多肽具有很高的细胞特异性和对肿瘤细胞抗多药耐药(multiple drug resistance, MDR)的特性。将脂肪酸与AMP结合可以增加多肽的疏水性, 使多肽的螺旋结构更稳定, 并且有助于提高多肽的抗菌活性。B1 (VKRFKKFFRKLKKSV)属于AMP的一种, 具有对抗MCF-7乳腺癌和K562白血病细胞系的活性, 对正常细胞系GES-1的毒性低。Deng等[20]将脂肪酸与B1相连后设计出了B1-C16和B1-GG-C16两种脂肪酸缀合肽。对比3种肽的稳定性发现, 与B1相比, B1-C16和B1-GG-C16在血清中的半衰期明显得到改善, 分别为3 h和3.5 h。B1-C16和B1-GG-C16显示出比B1更好的抗肿瘤活性, 对正常细胞的毒性更小。此外, 缀合肽不仅保持了对MDR细胞的敏感性, 并且还表现出对MDR细胞的逆转活性。
构建肽纳米颗粒是提高多肽生物利用度的有效方法[21]。C16Y (DFKLFAVYIKYR)是一种整合素靶向肽。Ding等[22]将C16Y设计为两亲性嵌合肽DEAP-C16Y。DEAP-C16Y的疏水端由4个功能性DEAP (3-二乙氨基丙基异硫氰酸酯)疏水分子和8个亮氨酸残基组成, 利用3个赖氨酸提供与DEAP连接的伯氨基, C16Y作为亲水端, 其两端连接甘氨酸来消除末端电荷。DEAP-C16Y的结构如图 6所示。在生理pH条件下, DEAP-C16Y可以组装成纳米胶束。在肿瘤部位pH值约6.8时, 胶束结构解离释放出C16Y肽。DEAP-C16Y胶束比游离的C16Y肽具有更好的抑制血管生成、肿瘤生长和转移的作用, 原因可能是疏水性的DEAP与亮氨酸出现在C16Y肽的N-端, 增强了C16Y肽的稳定性。
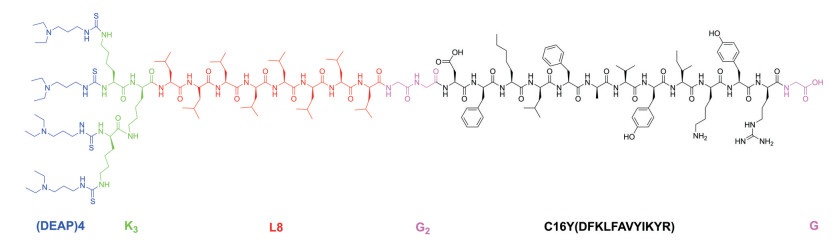
|
Figure 6 Molecular structure of DEAP-C16Y |
RWR (RGDWR)是一种新型的抗血栓肽, 在体外非常容易被蛋白酶降解, 半衰期短。Yang等[23]在RWR的N-端连接ω-氨基辛酸, 得到ωRWR (H2N(CH2)7-CO-RGDWR)。研究发现, 在大鼠血浆中4 h后, RWR的浓度降低了32%至48%, ωRWR的浓度变化仅在6.2%以内。连接ω-氨基辛酸后的小分子肽可以避免被氨肽酶识别和降解, 并且不影响其抗血小板聚集活性。
2.2 对多肽进行亲水修饰肿瘤相关巨噬细胞(TAM)是辅助癌症治疗的潜在靶标, 因为它们在促进癌细胞增殖、血管生成和转移中具有重要的作用。M2巨噬细胞属于TAM的一种。巨噬细胞靶向肽(M2pep)可以与M2细胞特异性结合, 但由于M2pep的水溶性差, 不易在体内发挥效力。为了提高M2pep在体内的稳定性, Ngambenjawong等[24]将M2pep连接到一种聚合物上。该聚合物主要由N-(2-羟丙基)甲基丙烯酰胺(HPMA)和N-(3-氨基丙基)甲基丙烯酰胺(APMA)组成。HPMA具有较好的亲水性和生物相容性, 而APMA的作用主要是提供可以与多肽相结合的氨基。研究者将3种M2pep肽类似物与聚合物连接, 分别形成M2pep-SH、(Ac) M2pep (RY)-SH和DFBP-cyclized M2pep (RY)-Alkyne。研究后发现, 与聚合物相结合后, 多肽在血清中即使是24 h后也保持稳定, 而3种游离肽类似物在相同时间内活性减半。特别是将环化的M2pep (RY)与聚合物相结合后既保留了靶向性, 又增强了多肽在体内的稳定性。
R8 (RRRRRRRR)是典型的细胞穿膜肽, 它可以介导药物、核酸和高分子纳米颗粒等进入细胞。但由于R8序列是由带正电荷的氨基酸构成, 导致其容易与血浆蛋白结合, 稳定性差[25]。Zhang等[26]将R8与PEG相连, PEG可以屏蔽R8上的正电荷, 防止其与血浆蛋白结合, 提高了R8的稳定性, 使其可以顺利到达特定部位。Cheng等[27]将KLAK肽与PEG相连, 保护多肽免于酶降解。Wu等[28]通过PEG将穿膜肽R8/环状RGD与磷脂DSPE相连, 然后嵌入负载麦角甾醇(ERG)和顺铂(DDP)的脂质体上。研究发现RGD/R8-DDP/ERG-LIP在体内的半衰期达到24 h。稳定性如此好的原因可能是PEG屏蔽了穿膜肽R8的正电荷, 而且环状RGD不容易被蛋白酶识别。
3 生物大分子对多肽的修饰与其他蛋白质相比, 血浆中的白蛋白和IgG的半衰期相对较长, 因此将多肽与这些蛋白结合后能够延长多肽的半衰期。Tian等[29]设计将两个白蛋白连接形成一个空腔, 再将GLP-1激动剂exendin-4肽与空腔部分连接形成白蛋白-多肽-白蛋白的夹心结构。Exendin-4肽含有一个精氨酸和两个赖氨酸残基, 它们是胰蛋白酶的切割位点, 这样的结构可以保护多肽免于酶促降解。研究者使用Evans Blue (EB)衍生物作为连接两个白蛋白和多肽的枢纽, 设计了两种缀合物N (tEB)2-exendin-4和NtEB-exendin-4。胰蛋白酶消化研究结果显示, 10 min后exendin-4-白蛋白复合物完全被降解, 即使是50 min后, N (tEB)2-exendin-4-白蛋白复合物仍然有70%的保留。Osborn等[30]将人血清白蛋白与干扰素-α (IFN-α)连接来改善IFN-α的药代动力学。未修饰的IFN-α在人体中的半衰期为2~3 h。人血清白蛋白修饰的IFN-α半衰期延长18倍。
有研究发现, 当GLP-1与免疫球蛋白的Fc结构域融合时, GLP-1的血浆半衰期将大大延长[31]。因此, Glaesner等[32]开发了具有增强的药代动力学和活性的GLP-1免疫球蛋白G (IgG4) Fc融合蛋白。测其在动物体内的半衰期得出GLP-1-Fc融合蛋白在大鼠体内半衰期约为1.5天, 在食蟹猴体内半衰期约为2天。而游离GLP-1肽在体内的半衰期一般只有几分钟。
4 对多肽进行物理包裹除了对多肽本身进行修饰, 还可以使用高分子物质包裹多肽, 在多肽与蛋白酶之间形成屏障从而保护其免于蛋白酶切割。Qu等[33]设计了一种纳米级药物传递系统, 用于口服递送GLP-1。其策略是将肽附着在固体纳米颗粒二氧化硅上, 然后再用pH敏感聚合物丙烯酸树脂包裹(SPN-GLP-1)。当pH为7.4时GLP-1释放了80%, 而当pH为1.0时GLP-1也只有30%左右的释放, 因此pH敏感丙烯酸树脂很好的保护了GLP-1在胃等酸性条件下的稳定性。在肠酶稳定性方面, 研究者将游离GLP-1和SPN-GLP-1与肠液混合。由于存在高浓度的消化酶和刷状缘肽酶, GLP-1迅速降解, 半衰期为(2 ± 0.02) min, 即使在第4 min, SPN-GLP-1还有70%完整的GLP-1。Zhao等[34]的策略是使用具有自组装活性的疏水蛋白将GLP-1分子包裹在自组装腔内, 从而防止GLP-1被蛋白酶降解。疏水蛋白包裹GLP-1的过程如图 7所示。为了研究疏水蛋白形成的壳是否保护GLP-1免受蛋白酶降解, 研究者向雄性大鼠皮下注射pPIC 9-hgfI/GLP-1和pPIC-hgfI E24K/GLP-1两种复合物, 在不同的时间节点取静脉血测GLP-1含量。4 h后, 游离GLP-1组检测不到完整GLP-1的存在。96 h后, pPIC 9-hgfI/GLP-1组仍能检测到GLP-1存在, 但pPIC-hgfI E24K/ GLP-1组未检测到。这些数据表明, pPIC 9-hgfI/GLP-1复合物能够显着延长大鼠体内GLP-1的半衰期。
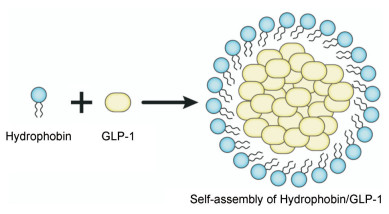
|
Figure 7 Composite process between GLP-1 and hydrophobin |
GB病毒C (GBV-C)中的E1片段被发现可以抑制HIV的复制, 因此研究者使用E1来开发对抗HIV-1的新策略。然而E1与其他肽一样, 也存在口服生物利用度低、半衰期短和清除率快等缺点。Ariza-Sáenz等[35]使用双乳液法制备一种W/O/W的载药体系, 将E1包封在内部, 以达到提高E1的血清稳定性的目的。油相载体为聚(D, L-乳酸-乙醇酸共聚物) (PLGA), 最外层水相载体为乙二醇壳聚糖(GC)。研究者对比了E1和E1NPs在血清中的稳定性得出, 游离的E1肽的半衰期约为8 h, 然而, 对于包裹在NP中的E1肽, 观察到增强的稳定性, 半衰期延长至24 h。分析原因得出, 与肽从体系中缓慢释放有关。Wang等[36]则设计了一种W/O/O体系, 外层油相为硅油, 内层油相为PLGA, 将艾塞那肽包封在中间。比较了艾塞那肽组和艾塞那肽微球组的血浆药物浓度后发现, 艾塞那肽组在药物注射后0.75 h后浓度达到最大值, 随后在2 h后消失。而艾塞那肽微球组的血浆药物能持续30天。将多肽包封在微囊内部可以避免多肽暴露在血浆环境中, 同时控制多肽的释放, 从而达到长效的目的。
5 多种修饰联合使用联合使用多种方法对多肽结构进行改造, 不仅可以改善多肽的稳定性, 而且可以增强多肽的细胞结合能力、抗肿瘤能力以及克服血脑屏障的能力。
M2肽(YEQDPWGVKWWYGGGSKK (K-Biotin))可以在CT-26结肠癌模型中成功的靶向M2巨噬细胞。但是, M2肽的血清稳定性差, 这限制了M2肽在体内的作用。研究者发现, M2肽血清稳定性差主要是因为其肽链N末端的溶解性切割和W10/W11和S16/K17位点的内切裂解。Ngambenjawong等[37]对M2肽进行N-末端乙酰化、D-氨基酸取代和环化等改变后, 合成了一种M2肽的衍生物Cyclic-M2pep (RY)Biotin肽(CGYEQDPWGVRYWYGCDKDKDK (K-Biotin))。此肽通过将M2肽进行环化来消除N-末端的切割, 将末端3个赖氨酸替换为D-型氨基酸, 改善了S16/K17位点处的血清稳定性。改造后的M2肽在血清中即使是48 h后仍可被检测到, 显示出非常好的血清蛋白酶稳定性, 并且与受体结合的能力也得到了很好的改善。
CTT2肽是参与肿瘤血管生成和迁移的明胶酶和基质金属蛋白酶MMP-9和MMP-2的选择性抑制剂。由于MMP-9和MMP-2几乎只存在于肿瘤血管生成中并起着重要作用, 所以这些蛋白酶是肿瘤靶向药的靶标[15, 38]。Haikola等[39]将环状CTT2肽的N-端与聚乙二醇(PEG)化的脂链羧基端相连, 形成一个两亲性的结构DSPE-PEG (3400)-CTT2[40], 其分子结构式如图 8所示。DSPE-PEG (3400)-CTT2的半衰期得到了明显改善。
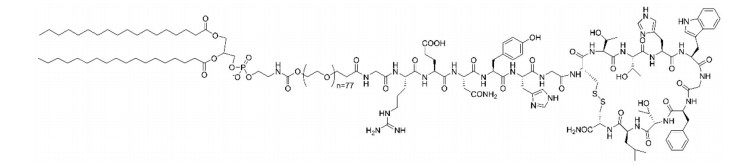
|
Figure 8 Molecular structure of DSPE-PEG (3400)-CTT2 |
DCDX是能够绕过血脑屏障(BBB)的尼古丁乙酰胆碱受体(nAChRs)的D-肽配体, DA7R是血管内皮生长因子受体2 (VEGFR-2)和神经毡蛋白-1 (NRP-1)在血管生成中过表达的D-肽配体。D-型氨基酸组成的多肽DCDX相较于CDX在蛋白酶中具有明显的稳定性[2, 41]。Ying等[42]将DCDX和DA7R和PEG相连, 然后再与DSPE连接形成两亲性单体, 将该单体嵌入脂质体中。研究发现, 脂质体在体内的稳定性得到了改善, 并且成功绕过了血脑屏障(BBB)和血脑肿瘤屏障(BBTB)。该课题组还研究了CDX、DCDX和c(RGDyK)的血清稳定性, 发现L-型多肽在血清蛋白中的半衰期只有约0.25 h, D-型CDX和c(RGDyK)即使在24 h后依然保持90%以上的活性。
YSV是一种通过阻断细胞周期和抑制组蛋白去乙酰化酶活性的具有抗癌作用的小短肽[43, 44]。Ren等[45]将YSV与D-型氨基酸结合并自组装成纳米纤维。通过对比GDFDFDYGYSV (D-YSV)和GFFYGYSV (L-YSV)水凝胶的稳定性以及抗肿瘤能力等发现, 在蛋白酶K溶液中, 游离的YSV小肽在0.5 h后完全降解, GFFYGYSV (L-YSV)虽然比游离的YSV稳定性稍好, 但在4 h后也被完全降解。而GDFDFDYGYSV (D-YSV)即使是在24 h后仍然保持初始结构, 表现出了极好的稳定性。
6 展望与发展多肽作为治疗分子和药物/基因载体, 在多个领域备受关注。但是由于多肽的不稳定性, 许多应用受到限制。目前, 对多肽进行结构改造是提高其稳定性的有效手段。然而, 对多肽进行结构改造也存在一些困难, 例如非天然氨基酸取代和环化在合成上很费力或是难以实施。另一个实际的问题是, 如果只考虑多肽稳定性方面的因素, 容易忽视多肽生物活性方面的影响, 所以需要在改善多肽稳定性的同时保留或提高多肽的生理活性, 这就对结构改造提出了更高的要求。作者认为根据每种肽的特点, 选择合适的改造或修饰方法可能是目前比较可靠、比较理想的策略。
| [1] |
Sarkar S, Bhatt N, Ha YS, et al. High in vivo stability of (64)Cu-labeled cross-bridged chelators is a crucial factor in improved tumor imaging of RGD peptide conjugates[J]. J Med Chem, 2018, 61: 385-395. DOI:10.1021/acs.jmedchem.7b01671 |
| [2] |
Wei XL, Zhan CY, Shen Q, et al. A D-peptide ligand of nicotine acetylcholine receptors for brain-targeted drug delivery[J]. Angew Chem Int Ed, 2015, 54: 3023-3027. DOI:10.1002/anie.201411226 |
| [3] |
Nischan N, Chakrabarti A, Serwa RA, et al. Stabilization of peptides for intracellular applications by phosphoramidate-linked polyethylene glycol chains[J]. Angew Chem Int Ed, 2013, 52: 11920-11924. DOI:10.1002/anie.201303467 |
| [4] |
Ruttekolk IR, Witsenburg JJ, Glauner H, et al. The intracellular pharmacokinetics of terminally capped peptides[J]. Mol Pharm, 2012, 9: 1077-1086. DOI:10.1021/mp200331g |
| [5] |
Gao DM, Liu JF, Wang FS. Advances in research on structural stability of peptide drugs[J]. Chin Med Biotechnol, 2007, 2: 380-382. |
| [6] |
Bogdanowich-Knipp SJ, Jois DS, Siahaan TJ. The effect of conformation on the solution stability of linear vs. cyclic RGD peptides[J]. J Peptide Res, 1999, 53: 536-529. |
| [7] |
Chan LY, Zhang VM, Huang YH, et al. Cyclization of the antimicrobial peptide gomesin with native chemical ligation: influences on stability and bioactivity[J]. Chembiochem, 2013, 14: 617-624. DOI:10.1002/cbic.201300034 |
| [8] |
Li YL, Wu MH, Chang Q, et al. Stapling strategy enables improvement of antitumor activity and proteolytic stability of host-defense peptide hymenochirin-1B[J]. RSC Adv, 2018, 8: 22268-22275. DOI:10.1039/C8RA03446J |
| [9] |
Chen YQ, Yang CQ, Li T, et al. The interplay of disulfide bonds, alpha-helicity, and hydrophobic interactions leads to ultrahigh proteolytic stability of peptides[J]. Biomacromolecules, 2015, 16: 2347-2355. DOI:10.1021/acs.biomac.5b00567 |
| [10] |
Kim JW, Kim TD, Hong BS, et al. A serum-stable branched dimeric anti-VEGF peptide blocks tumor growth via anti-angiogenic activity[J]. Exp Mol Med, 2010, 42: 514-523. DOI:10.3858/emm.2010.42.7.052 |
| [11] |
Tugyi R, Uray K, Ivan D, et al. Partial D-amino acid substitution: improved enzymatic stability and preserved Ab recognition of a MUC2 epitope peptide[J]. Proc Natl Acad Sci U S A, 2005, 102: 413-418. DOI:10.1073/pnas.0407677102 |
| [12] |
Zhang MF, Lu WY. Enhanced glioma-targeting and stability of (L)GICP peptide coupled with stabilized peptide (D)A7R[J]. Acta Pharm Sin B, 2018, 8: 106-115. DOI:10.1016/j.apsb.2017.11.004 |
| [13] |
Chen L, Tu ZG, Voloshchuk N, et al. Lytic peptides with improved stability and selectivity designed for cancer treatment[J]. J Pharm Sci, 2012, 101: 1508-1517. DOI:10.1002/jps.23043 |
| [14] |
Seebach D, Lukaszuk A, Patora-Komisarska K, et al. On the terminal homologation of physiologically active peptides as a means of increasing stability in human serum-neurotensin, opiorphin, B27-KK10 epitope, NPY[J]. Chem Biodiv, 2011, 8: 711-739. DOI:10.1002/cbdv.201100093 |
| [15] |
Koivunen E, Arap W, Valtanen H, et al. Tumor targeting with a selective gelatinase inhibitor[J]. Nat Biotechnol, 1999, 17: 768-774. DOI:10.1038/11703 |
| [16] |
Björklund M, Valtanen H, Savilahti H, et al. Use of intein-directed peptide biosynthesis to improve serum stability and bioactivity of a gelatinase inhibitory peptide[J]. Comb Chem High Throughput Screen, 2003, 6: 29-35. DOI:10.2174/1386207033329869 |
| [17] |
Mentlein R, Gallwitz B, Schmidt WE. Dipeptidylpeptidase-Ⅳ hydrolyzes gastric-inhibitory polypeptide, glucagon-like peptide-1 (7-36) amide, peptide histidine methionine and is responsible for their degradation in human serum[J]. Eur J Biochem, 1993, 214: 829-835. DOI:10.1111/j.1432-1033.1993.tb17986.x |
| [18] |
HupeSodmann K, Goke R, Goke B, et al. Endoproteolysis of glucagon-like peptide (GLP)-1(7-36) amide by ectopeptidases in RINm5F cells[J]. Peptides, 1997, 18: 625-632. DOI:10.1016/S0196-9781(97)00123-X |
| [19] |
Han J, Huang X, Sun LD, et al. Novel fatty chain-modified glucagon-like peptide-1 conjugates with enhanced stability and prolonged in vivo activity[J]. Biochem Pharmacol, 2013, 86: 297-308. DOI:10.1016/j.bcp.2013.05.012 |
| [20] |
Deng X, Qiu QQ, Ma K, et al. Aliphatic acid-conjugated antimicrobial peptides-potential agents with anti-tumor, multidrug resistance-reversing activity and enhanced stability[J]. Org Biomol Chem, 2015, 13: 7673-7680. DOI:10.1039/C5OB00752F |
| [21] |
Qiao ZY, Lin YX, Lai WJ, et al. A general strategy for facile synthesis and in situ screening of self-assembled polymer-peptide nanomaterials[J]. Adv Mater, 2016, 28: 1859-1867. DOI:10.1002/adma.201504564 |
| [22] |
Ding YP, Ji TJ, Zhao Y, et al. Improvement of stability and efficacy of C16Y therapeutic peptide via molecular self-assembly into tumor-responsive nanoformulation[J]. Mol Cancer Ther, 2015, 14: 2390-2400. DOI:10.1158/1535-7163.MCT-15-0484 |
| [23] |
Yang L, Zhang L, Yan L, et al. Stability assessment of a new antithrombotic small peptide, Arg-Gly-Asp-Trp-Arg (RGDWR), and its derivative[J]. Biotechnol Lett, 2017, 39: 1183-1190. DOI:10.1007/s10529-017-2346-x |
| [24] |
Ngambenjawong C, Pun SH. Multivalent polymers displaying M2 macrophage-targeting peptides improve target binding avidity and serum stability[J]. ACS Biomater Sci Eng, 2017, 3: 2050-2053. DOI:10.1021/acsbiomaterials.7b00332 |
| [25] |
Tang J, Fu H, Kuang QF, et al. Liposomes co-modified with cholesterol anchored cleavable PEG and octaarginines for tumor targeted drug delivery[J]. J Drug Target, 2014, 22: 313-326. DOI:10.3109/1061186X.2013.875029 |
| [26] |
Zhang L, Wang Y, Gao Hl, et al. The construction of cell-penetrating peptide R8 and pH sensitive cleavable polyethylene glycols co-modified liposomes[J]. Acta Pharm Sin B, 2015, 5: 760-766. |
| [27] |
Cheng DB, Yang PP, Cong Y, et al. One-pot synthesis of pH-responsive hyperbranched polymer-peptide conjugates with enhanced stability and loading efficiency for combined cancer therapy[J]. Polym Chem, 2017, 8: 2462-2471. DOI:10.1039/C7PY00101K |
| [28] |
Wu MJ, Huang T, Wang J, et al. Antilung cancer effect of ergosterol and cisplatin-loaded liposomes modified with cyclic arginine-glycine-aspartic acid and octa-arginine peptides[J]. Medicine, 2018, 97: e11916. DOI:10.1097/MD.0000000000011916 |
| [29] |
Tian R, Zhu SJ, Zeng Q, et al. An albumin sandwich enhances in vivo circulation and stability of metabolically labile peptides[J]. Bioconjug Chem, 2019, 30: 1711-1723. DOI:10.1021/acs.bioconjchem.9b00258 |
| [30] |
Osborn BL, Olsen HS, Nardelli B, et al. Pharmacokinetic and pharmacodynamic studies of a human serum albumin-interferon-alpha fusion protein in cynomolgus monkeys[J]. J Pharmacol Exp Ther, 2002, 303: 540-548. DOI:10.1124/jpet.102.037002 |
| [31] |
Picha KM, Cunningham MR, Drucker DJ, et al. Protein engineering strategies for sustained glucagon-like peptide-1 receptor-dependent control of glucose homeostasis[J]. Diabetes, 2008, 57: 1926-1934. DOI:10.2337/db07-1775 |
| [32] |
Glaesner W, Vick AM, Millican R, et al. Engineering and characterization of the long-acting glucagon-like peptide-1 analogue LY2189265, an Fc fusion protein[J]. Diabetes Metab Res Rev, 2010, 26: 287-296. DOI:10.1002/dmrr.1080 |
| [33] |
Qu W, Li Y, Hovgaard L, et al. A silica-based pH-sensitive nanomatrix system improves the oral absorption and efficacy of incretin hormone glucagon-like peptide-1[J]. Int J Nanomed, 2012, 7: 4983-4994. |
| [34] |
Zhao LQ, Xu HJ, Li Y, et al. Novel application of hydrophobin in medical science: a drug carrier for improving serum stability[J]. Sci Rep, 2016, 6: 9. DOI:10.1038/s41598-016-0002-7 |
| [35] |
Ariza-Sáenz M, Espina M, Calpena A, et al. Design, characterization, and biopharmaceutical behavior of nanoparticles loaded with an HIV-1 fusion inhibitor peptide[J]. Mol Pharm, 2018, 15: 5005-5018. DOI:10.1021/acs.molpharmaceut.8b00609 |
| [36] |
Wang YT, Sun T, Zhang Y, et al. Exenatide loaded PLGA microspheres for long-acting antidiabetic therapy: preparation, characterization, pharmacokinetics and pharmacodynamics[J]. RSC Adv, 2016, 6: 37452-37462. DOI:10.1039/C6RA02994A |
| [37] |
Ngambenjawong C, Gustafson HH, Pineda JM, et al. Serum stability and affinity optimization of an M2 macrophage-targeting peptide (M2pep)[J]. Theranostics, 2016, 6: 1403-1414. DOI:10.7150/thno.15394 |
| [38] |
Medina OP, Soderlund T, Laakkonen LJ, et al. Binding of novel peptide inhibitors of type Ⅳ collagenases to phospholipid membranes and use in liposome targeting to tumor cells in vitro[J]. Cancer Res, 2001, 61: 3978-3985. |
| [39] |
Haikola M, Hirvonen J, Medina OP, et al. Stability and CMC determinations of amphiphilic (DSPE-PEG(3400)-CTT2) peptide constructs by microtensiometry[J]. J Drug Deliv Sci Technol, 2011, 21: 183-188. DOI:10.1016/S1773-2247(11)50020-6 |
| [40] |
De Cuyper M, Lievens S, Flo G, et al. Receptor-mediated biological responses are prolonged using hydrophobized ligands[J]. Biosens Bioelectron, 2004, 20: 1157-1164. DOI:10.1016/j.bios.2004.03.038 |
| [41] |
Zhan CY, Li C, Wei XL, et al. Toxins and derivatives in molecular pharmaceutics: drug delivery and targeted therapy[J]. Adv Drug Deliv Rev, 2015, 90: 101-118. DOI:10.1016/j.addr.2015.04.025 |
| [42] |
Ying M, Zhan CY, Wang SL, et al. Liposome-based systemic glioma-targeted drug delivery enabled by All-D peptides[J]. ACS Appl Mater Interf, 2016, 8: 29977-29985. DOI:10.1021/acsami.6b10146 |
| [43] |
Zheng M, Lu R, Che XC, et al. Tyroservatide therapy for tumor growth, invasion and metastasis of Lewis lung carcinoma and human lung carcinoma A549[J]. Oncology, 2006, 70: 418-426. DOI:10.1159/000098954 |
| [44] |
Huang YT, Zhao L, Fu Z, et al. Therapeutic effects of tyroservatide on metastasis of lung cancer and its mechanism affecting integrin-focal adhesion kinase signal transduction[J]. Drug Des Devel Ther, 2016, 10: 649-663. |
| [45] |
Ren CH, Gao Y, Liu JJ, et al. Anticancer supramolecular hydrogel of D/L-peptide with enhanced stability and bioactivity[J]. J Biomed Nanotechnol, 2018, 14: 1125-1134. DOI:10.1166/jbn.2018.2564 |
 2020, Vol. 55
2020, Vol. 55


