肿瘤心脏病学作为新兴交叉学科, 在近年来取得了飞跃性发展, 揭示了肿瘤和心血管疾病之间密切关联。心血管系统疾病与恶性肿瘤是我国乃至全球范围内严峻的公共卫生负担。据推算, 截至2018年, 我国约2.9亿居民患有各种心血管疾病, 心血管系统疾病导致的死亡约占疾病死亡构成的40%以上[1]; 根据2019年公布的数据, 2015年我国新发癌症约392.9万例, 癌症死亡案例约233.8万例[2]。常见的心血管系统疾病包括高血压、冠心病、动脉粥样硬化、血栓和心力衰竭等, 通常需要长期服药进行病情控制。恶性肿瘤的五年生存率在近年来得到不断提高, 但仍不容乐观, 癌症治疗对患者造成极大的经济和健康负担。心血管系统疾病与恶性肿瘤具有高度重合的危险因素以及相似的发生、发展机制。合并患有两种疾病的患者数量逐年上升, 治疗具有较大难度, 预后大多不良[3]。了解心血管疾病与恶性肿瘤之间的相互关系可以加深对心血管疾病与癌症病因的认识, 为这两种疾病的一级预防、二级预防提供指导。
1 心血管疾病与恶性肿瘤中重合的危险因素大量的报道显示, 心血管疾病与恶性肿瘤常常相伴发生或相继出现, 众多流行病学研究表明心血管疾病与恶性肿瘤的危险因素具有很大程度的重合。为了进一步探讨心血管疾病与恶性肿瘤背后的病理生理机制, 对这些共同的危险因素进行了总结和概述。
1.1 性别与年龄除了前列腺癌、卵巢癌等不同性别所特有的疾病外, 性别差异普遍存在于心血管系统疾病和癌症患者中, 并影响患病率与死亡率。不论是心血管疾病还是恶性肿瘤, 男性都具有更高的患病风险和死亡率[4]。新发心血管疾病与癌症患者的年龄正在不断提前, 成为全球公共卫生的重大挑战。以心衰为例, 根据流行病学调查, 多数新发恶性肿瘤患者集中在55岁以上的年龄段, 而多数心衰患者年龄在65岁以上[5]。
1.2 生活习惯久坐、吸烟和饮食等生活习惯因素是广泛认可并已确立的心血管疾病和恶性肿瘤危险因素[4, 5]。吸烟大大提高了肺癌、膀胱癌和前列腺癌等的风险, 并与约1/3的心衰事件有关。久坐、高盐高胆固醇的饮食等则可以导致高血压、动脉粥样硬化和冠心病等心血管疾病, 最终可能进展为心衰。运动和地中海式饮食可以预防高血压、高脂血症和糖尿病等慢性疾病, 建立心脏储备, 实现对心血管疾病和癌症的预防, 并降低癌症治疗带来的心脏毒性影响。这些常见的行为危险因素大多可以在医师指导下有效避免, 从而有效实现心血管疾病与恶性肿瘤的一级预防。
1.3 高血压、糖尿病、高脂血症与肥胖高血压患者是各类心血管系统疾病患者中最大的群体, 没有得到良好控制的高血压也是普遍共识的心衰危险因素[4-6]。肾素-血管紧张素-醛固酮系统(RAAS)失调是高血压发生的主要原因, 而高血压进一步引发心血管系统持续的氧化应激、慢性炎症和交感神经系统激活, 最终导致心肌重构, 引起心脏功能紊乱和失常。癌症与高血压之间也存在着密切关联:一方面, 癌症的治疗药物可以引起继发性高血压[7, 8]; 另一方面, 回顾性队列研究表明, 在癌症患者中, 高血压的确诊率也出现了明显的升高[4]。血压对癌症的影响过去缺少关注, 针对欧洲人群的大型队列研究[9]揭示二者之间存在明显关联, 在12年的随访中, 男性和女性患者的血压升高相应地提高了肝癌、肺癌、胰腺癌和恶性黑色素瘤等恶性肿瘤的发病率。
糖尿病可以显著增加各类心血管疾病的风险, 糖尿病患者发生心衰的预后不良, 死亡风险更大。此外, 糖尿病患者群体还面临更高的癌症风险, 包括肾癌、白血病、子宫内膜癌和食管癌等。血浆中升高的胰岛素样生长因子-1 (IGF-1)浓度被认为是糖尿病患者心血管疾病和癌症风险升高的原因之一。在心血管系统中, IGF-1促进平滑肌的增生和迁移[5]。而在恶性肿瘤组织中, 由于乳腺瘤1号基因(BRCA1)、BRCA2、TP53和VHL等抑癌基因下调和促癌基因上调表达, 细胞膜上的IGF-1受体(IGF-1R)的启动子失去调控而过表达, 同时IGF-1R的酪氨酸激酶结构域激活, 信号转导功能增强, 促进肿瘤细胞的分裂和转移, 提升细胞抗凋亡能力[10, 11]。糖尿病建立了心血管疾病与恶性肿瘤之间的联系, IGF或许可以作为生物标志物进行疾病的预防和诊断。
肥胖是广为人知的心血管疾病危险因素, 根据流行病学调查, 20%癌症发生与肥胖有关。在体重超重甚至是肥胖的群体中, 持续而低水平的炎症状态[4]、氧化应激、升高的IGF-1和瘦素水平[5]被认为是升高心血管疾病和恶性肿瘤风险的原因。根据动物模型研究, 高脂血症状态下, 除了动脉粥样硬化等心血管疾病风险升高, 乳腺癌、结肠癌等的发病率也明显上升, 肿瘤生长迅速, 具有更强的侵袭性[5]。这也启发了通过他汀类药物干扰肿瘤细胞脂质代谢, 进行抗癌治疗的研究[12]。另一方面, 具有脂质运输功能的载脂蛋白(apolipoprotein, Apo)除了参与心血管疾病的保护或进展, 在近年来的研究中被发现与癌症风险存在一定的关联。在20多种载脂蛋白中, 流行病学研究和动物模型研究发现, 参与构成高密度脂蛋白的Apo A1具有保护作用, 可降低肾细胞癌、肺癌、肝癌、前列腺癌等的发病风险, 可能通过调节肿瘤细胞内胆固醇含量从而抑制肿瘤细胞增殖和诱导自噬[13-15]; Apo C1被发现在胃癌、结直肠癌等患者体内过表达, 体外实验发现Apo C1具有调节Rb/p21/caspase-3通路以及MAPK通路促进肿瘤细胞增殖和迁移的效应[16, 17]; Apo E在肿瘤相关巨噬细胞外泌体和肿瘤微环境中被发现, 促进癌症转移、血管生成和细胞黏附[18, 19]; Apo B与Apo D对肿瘤的作用尚不明确。载脂蛋白也可能成为早期肿瘤筛查的指标和抗肿瘤治疗的潜在靶点。
2 心血管疾病与恶性肿瘤的病理生理学机制心脏需要长时间地维持收缩功能, 肿瘤保持旺盛的分裂增殖, 都表现出对能量代谢的优化和需要。心房钠尿肽、CA-125等的生物标志物可以同时预测心衰和恶性肿瘤的发生[4, 20, 21]。根据多项流行病学调查, 癌症患者中心血管疾病的发病率明显升高, 是患者的主要死因之一; 心血管疾病患者似乎也面临着相对较高的癌症确诊率[22-26]。因此, 深入研究心血管疾病和恶性肿瘤的发病机制和相互作用(图 1)对于解释两种疾病大量重合的危险因素、认识治疗药物的药理作用与不良反应、提供预防和治疗的指导具有重要价值。

|
Figure 1 Possibleinteractions between malignant tumor and cardiovascular system. The activation of SNS and RAAS in CVD increases the risk of malignant tumors; cardiac toxicity induced by anticancer therapies and the hypercoagulability resulting from cancer are risk factors of CVD in turn; tumor stroma and cardiac extracellular matrix are similar in components and structures, where chronic inflammation, oxidative stress and the secretion of cytokines arequite common; nevertheless, there are a series of common risk factors for both diseases. SNS: Sympathetic nervous system; RAAS: Renin-angiotensin-aldosterone system; CVD: Cardiovascular diseases |
如前文所述, 慢性炎症状态、持续的氧化应激同时共存于心血管疾病和恶性肿瘤的发生和进展过程中, 如动脉粥样硬化的本质是慢性炎症疾病, 肿瘤组织中浸润丰富多样的淋巴细胞和巨噬细胞, 也处于炎症状态。心血管疾病患者体内的慢性炎症状态通常呈现恶性循环[8, 27, 28]:单核细胞的浸润、升高的肿瘤坏死因子-α (TNF-α)等细胞因子导致的炎症造成内皮损伤; 内皮、心肌的损伤会激活免疫系统, 进一步增强炎症状态; 促炎因子是启动心肌重构的重要因素。在慢性炎症状态下, 肿瘤组织中幼稚T细胞大量减少, 白介素-6, 8 (IL-6, 8)的水平升高[29], 免疫系统的监视、清除功能被削弱, 导致肿瘤逃逸, 产生耐药性, 间接诱发癌症。血管内皮的氧化应激导致平滑肌增生和斑块形成; 细胞内的氧化应激可能导致DNA的损伤、基因突变, 也是癌变的主要促进因素。
2.2 交感神经系统与RAAS系统高血压、心衰等心血管疾病的典型表现是交感神经系统(SNS)和RAAS过度激活[8], 需要使用β-受体阻断剂、血管紧张素转化酶抑制剂(ACEI)与血管紧张素Ⅱ受体阻断剂(ARB)等药物进行治疗, 减轻心脏前负荷与后负荷, 逆转心肌重构, 降低交感毒性, 改善预后。体内和体外的研究证据表明SNS与RAAS通过多种机制参与了恶性肿瘤的发生、增殖和转移[27, 30, 31]。肿瘤血管大量表达Ang Ⅱ受体获得更强的侵袭性; β-受体增强了肿瘤细胞抗凋亡能力、加速细胞分裂增殖、促进血管和淋巴管生成, 招募肿瘤相关的巨噬细胞等发挥免疫抑制效应, 改变肿瘤微环境, 解释了抗高血压药物的辅助抗癌效应。
2.3 代谢衰竭的心肌细胞与肿瘤细胞在代谢方面具有惊人的相似性[32], 如升高的葡萄糖利用率、增强的脂肪酸氧化分解。在衰竭的心肌细胞中, 糖酵解优先于脂肪酸氧化。由于活性氧大量积蓄, 3-磷酸甘油醛脱氢酶(GAPDH)活性下降; 氧气供应不足, 加剧了脂肪酸的毒性, 形成恶性循环, 更加剧心功能障碍。肿瘤细胞为了满足生物合成和旺盛的细胞分裂需要, 通过瓦博格效应增强糖酵解反应; 上调脂肪酸合成酶(FASN)的表达, 大量合成并吸收脂肪酸转化为磷脂。因此, 从代谢角度着手进行治疗, 应该将葡萄糖转运、糖酵解、脂肪酸氧化和线粒体呼吸等作为靶点, 纠正心衰后的心肌细胞失常的代谢状态, 抑制肿瘤细胞代谢, 控制分裂增殖, 是药理学颇有潜力的研究方向。
2.4 细胞外基质与肿瘤间质在心血管疾病的病理过程中, 除了心肌细胞, 研究发现心脏的间质细胞也在疾病的发生、进展中起到了重要作用[4, 33]。间充质干细胞、成纤维细胞、免疫细胞及其分泌的细胞因子、蛋白质等共同组成了间质组织。在受到心力衰竭等刺激后, 成纤维细胞转化为肌成纤维细胞, 并大量分泌胶原纤维, 细胞外基质的组成和结构产生显著改变。而通过旁分泌、内分泌产生的细胞因子, 如IL-6、血管内皮生长因子(VEGF)、转化生长因子(TGF)等不仅在心脏或心血管系统中发挥作用, 也通过血液循环参与了远隔器官正常功能的维持, 或癌症的发生、进展, 并因此建立起了心血管系统和恶性肿瘤全身性的联系。肿瘤间质也由大量的成纤维细胞、淋巴细胞和巨噬细胞等构成, 通过旺盛的合成分泌大量的蛋白质成分、微泡和外泌体及其运输的miRNA等物质[34], 形成了复杂的分子环境[35], 通常处于缺氧状态[36], 在信号转导、血管生成、细胞增殖、肿瘤转移和免疫逃逸中发挥重要作用[37]。蛋白质组学和生物信息学在研究心血管系统和肿瘤组织微环境的组成及动态变化时具有很大潜力[38], 可以为药物治疗和新药研究提供大量可能的靶点。
3 恶性肿瘤治疗的心脏毒性以蒽环类药物为代表的肿瘤治疗的心脏毒性, 开启了针对肿瘤心脏病学这一新兴领域的研究。共患心血管疾病和恶性肿瘤两种疾病的患者通常只能采用次优级的疗法, 导致预后不良; 先发心血管疾病的患者在进行抗癌治疗时受到诸多限制, 以避免肿瘤治疗的心脏毒性。近年来发展的新兴抗癌治疗一方面提升了患者的5年生存率; 另一方面新发的心脏毒性也相应地增加了更多心血管系统疾病风险。下面对经典和新型恶性肿瘤治疗措施的心脏毒性进行了总结和阐述(图 2)。
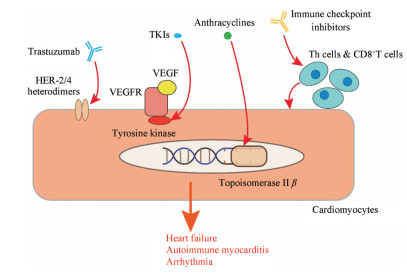
|
Figure 2 Cardiac toxicity mechanism of anticancer therapies. Trastuzumab blocks the HER-2/4 heterodimers, reducing the resistance against stress. TKIs directly induce the apoptosis of cardiomyocytes and cause dysfunction of vascular epithelial cells, resulting in a chain of cardiovascular diseases including hypertension, thrombosis, and heart failure. Anthracycline inhibits the topoisomerase Ⅱ β expressed in cardiomyocytes and interferes DNA repairing, leading to dysfunction of cardiomyocytes and even heart failure and arrhythmia. It is reported that immune checkpoint inhibitors are responsible for autoimmune myocarditis by stimulating the proliferation and infiltration of CD8+T cells, Th cells. TKIs: Tyrosine kinase inhibitors; VEGF: Vascular epithelial growth factor; VEGFR: Vascular epithelial growth factor receptor; HER-2: Human epidermal growth factor receptor-2 |
一项基于韩国接受多柔比星治疗的癌症患者的回顾性队列研究(n = 58 541)发现, 多达4%的患者在7年的随访中确诊了多柔比星诱导的心衰[39]。蒽环类药物用于恶性肿瘤治疗的机制主要是插入肿瘤细胞核DNA, 抑制肿瘤细胞表达的拓扑异构酶Ⅱ-α, 从而阻碍DNA修复[40]。而在心肌细胞中主要表达的拓扑异构酶Ⅱ-β也被蒽环类药物抑制, 干扰心肌细胞的DNA修复, 导致双链破坏。此外, 蒽环类药物还导致心肌细胞中活性氧的积累, 线粒体钙超载, 使其功能失常[41, 42], 最终心肌细胞纤维崩解, 空泡形成, 心脏功能逐渐失去代偿。与其他具有心脏毒性的药物合用, 如曲妥珠单抗等, 可显著增强心脏毒性, 最终引发心力衰竭。尽管没有充分的证据表明蒽环类药物可以诱发高血压, 但患有高血压的癌症患者使用蒽环类药物发生心衰的风险显著升高, 需要有效的血压管理[43]。随着对蒽环类药物心脏毒性的认识了解, 这类药物的处方量已经逐年下降, 大大减少了心衰等心血管不良事件的发生。
3.2 抗人表皮生长因子受体2 (HER-2)药物以赫赛汀(曲妥珠单抗)为代表的抗HER-2药物是乳腺癌等恶性肿瘤治疗的经典药物, 通过功能性封闭HER-2, 阻断人表皮生长因子(EGF)的结合实现抑制肿瘤细胞增殖、转移的作用, 同时通过抗体依赖的细胞介导的细胞毒效应杀伤肿瘤细胞。根据一项大规模队列研究, 接受赫赛汀治疗的患者3年内新发心衰的风险为4.8%[44]。合用蒽环类药物后, 3年内心衰发生率则高达41.9%[45]。赫赛汀产生心脏毒性的原因存在众多假说[46, 47]。HER-2的正常生理功能是与HER-4形成异二聚体, 与gp130结合后活化, 抑制心肌细胞凋亡, 加速葡萄糖摄取, 增强心脏化学刺激或血流动力学改变的抵抗力。心脏表达的HER-2受体被赫赛汀非特异性地抑制后, 心脏的抗逆性降低, 合用蒽环类药物后, 增强蒽环类药物的心脏毒性, 进而增加心衰的风险, 这推动了进一步开发其他低心脏毒性的抗HER-2药物的研究。
3.3 免疫检查点阻断疗法2018年诺贝尔生理学或医学奖表彰了阐释CTLA-4与PD-1/PD-L1在肿瘤免疫调节机制的两位科学家。抗CTLA-4和抗PD-1/PD-L1的单克隆抗体是免疫检查点阻断的两类代表性药物, 在治疗黑色素瘤等难治恶性肿瘤中显著地延长了患者的无进展生存期, 降低了复发和转移率[48, 49]。针对使用伊匹单抗和纳武单抗后出现心肌炎及心衰患者的研究认为, 以CTLA-4和PD-1/PD-L1为靶点的免疫治疗, 其心脏毒性是单克隆抗体作用于心脏-T细胞轴产生的[50]。CTLA-4和PD-1/PD-L1在正常情况下, 对T细胞的增殖、活化和成熟起到负性调节作用, 而被单抗阻断后, CD8+ T细胞大量增殖, 杀伤肿瘤细胞的同时, 浸润心肌, 平均34天后引起自身免疫性心肌炎[51], 最终可能导致心衰。随着免疫治疗的逐步推广, 心脏毒性成为临床应用中不可忽视的问题。
3.4 酪氨酸激酶抑制剂酪氨酸激酶抑制剂(TKI)抑制VEGF、EGF等细胞因子受体的下游通路的酪氨酸激酶, 从而抑制肿瘤细胞的分裂增殖及血管生成。相对于其他抗肿瘤疗法, TKI是一种小分子抑制剂, 具有更高的靶向性, 但在临床应用中出现了显著的心脏毒性。根据回顾性研究的结果, 接受TKI治疗的患者大约有1%~4.1%发生了心衰[42]。TKI直接诱导心肌凋亡, 降低心脏收缩力[52, 53]; 导致心肌细胞线粒体超载; 损伤毛细血管的周细胞, 影响心脏的微循环[53]。TKI可以造成血管内皮功能障碍:一方面抑制内皮细胞一氧化氮合酶活性, 进而抑制微小血管的舒张能力, 导致高血压[43]; 另一方面, 癌症患者血液处于高凝状态, TKI诱导的内皮细胞功能紊乱导致凝血的级联反应启动, 血小板激活, 诱发血栓的形成, 可能导致静脉或动脉血管栓塞[54]。TKI诱导的多数心脏毒性反应是可逆的, 如心衰、高血压等, 可以通过降压治疗减轻患者的心脏负荷。
4 心血管系统药物与癌症 4.1 高血压治疗药物血管紧张素转化酶抑制剂(ACEI)与血管紧张素受体阻滞剂(ARB)通常被认为短期内没有致癌风险, 但长期效应尚不明确。一项大规模的荟萃分析研究(n = 324 168)并没有发现使用ACEI、ARB、β-受体阻断剂、钙通道阻断剂(CCB)和利尿剂等高血压治疗药物导致的癌症风险变化[55]。另有研究表明[30], 这些药物大多可以通过抑制血管生成、上调免疫、抑制肿瘤细胞迁移、抑制细胞增殖、促进细胞凋亡和降低交感张力等发挥一定的抗癌作用。动物实验和近年来的临床数据验证了这些假说, 肯定了心血管疾病治疗药物作为辅助疗法, 与标准化疗结合改善癌症患者预后的作用。以常用的非选择性的β-受体阻断药为例, 可以使上皮型卵巢癌的中位生存期从42个月延长到47.8个月[56]; 与PD-1抑制剂合用可以增强抗黑色素瘤活性, 再与高剂量IL-2组合的治疗效果最显著[56]。但近期一项队列研究指出[57], 使用ACEI导致肺癌总体患病率增加了14%, 这对过去研究方法和结论的可靠性提出了质疑, 也引发了对于这些常用抗高血压药物的长期用药安全性的思考。尽管如此, 这些药物仍然是可靠、常用的一线药物, 可以有效改变液体潴留和充血状态, 降低心脏前负荷、后负荷, 明显改善心血管疾病患者的预后。
4.2 阿司匹林阿司匹林是经典的非甾体消炎药, 不可逆地结合环加氧酶(COX)。阿司匹林通过抑制COX-1阻断血栓素A2的合成, 从而抑制血小板聚集; 阿司匹林抑制肿瘤细胞增殖、转移的机制尚不明确, 可能与抑制慢性炎症状态、抑制肿瘤细胞过量表达的COX-2有关, 不依赖COX的机制如信号抑制、COX外蛋白乙酰化等可能也发挥了作用[4, 58]。低剂量的阿司匹林被认为可用于心血管疾病和恶性肿瘤的二级预防, 但其一级预防的效果尚不明确, 缺乏有力的数据支持。大规模的回顾性研究表明, 阿司匹林用于心血管疾病一级预防的影响是微弱的, 反而增加了出血等不良反应, 但在恶性肿瘤的一级预防中可产生明确的效果[59]。
4.3 他汀类药物他汀类药物通过竞争性抑制羟基甲基戊二酸单酰CoA合酶(HMG-CoA)还原酶的活性来减少甲羟戊酸的合成, 从而抑制胆固醇的生物合成, 同时增强低密度脂蛋白的摄取、分解, 是临床上广泛应用的降血脂药物, 可以有效预防包括动脉粥样硬化、心衰在内的多种心血管疾病。过多的胆固醇摄入可能增加脂筏的形成, 改变表皮生长因子受体(EGFR)、肿瘤坏死因子受体(TNFR)等受体在细胞膜表面的定位、分布, 加快肿瘤细胞的增殖、转移[28]。另有研究表明甲羟戊酸通路的激活与肿瘤的发生密切相关, 而p53基因位于甲羟戊酸途径的上游, 通过抑制甲羟戊酸通路发挥抑癌作用[60], HMG-CoA还原酶正是甲羟戊酸途径的限速酶。使用阿伐他汀的动物模型中, 肿瘤生长被明显抑制, 印证了他汀类药物降低多种癌症死亡风险的临床观察结果, 证明在p53突变的患者中, 抑制甲羟戊酸途径可以实现抗癌效果[12], 为新型药物研发提供了广阔前景。
5 结论随着恶性肿瘤患者预期寿命的不断延长, 新型药物不断研发和上市, 但不可忽视肿瘤治疗诱导的心脏毒性, 这方面的研究也成为肿瘤心脏病学最热门的研究方向, 激发了低心脏毒性药物的开发和对一线药物心脏毒性的监测和预防。随着心血管疾病与恶性肿瘤之间的联系不断被发现、认识, 心血管疾病和恶性肿瘤的发生机制被重新认真思考, 常见药物预防肿瘤发生、辅助肿瘤治疗的作用也得到了重视。越来越多的可以同时导致心血管疾病和恶性肿瘤的危险因素被证实, 对预防、临床治疗和护理提出更高的要求。肿瘤心脏病学将两类看似关联性很小的疾病联系起来, 为新疗法提供了更多的靶点, 这需要心血管领域与肿瘤领域、临床与基础研究方面开展全方位、多层次的深入合作, 以深入阐释发病机制, 积累更多的循证医学证据, 提供从预防到诊断到治疗的精准防治策略。
| [1] |
Hu SS, Gao RL, Liu LS, et al. Summary of the 2018 report on cardiovascular diseases in China[J]. Chin Circ J (中国循环杂志), 2019, 34: 209-220. |
| [2] |
Sun KX, Zheng RS, Zhang SW, et al. Report of cancer incidence and mortality in different areas of China, 2015[J]. China Cancer (中国肿瘤), 2019, 28: 1-11. |
| [3] |
Tuzovic M, Yang EH, Sevag Packard RR, et al. National outcomes in hospitalized patients with cancer and comorbid heart failure[J]. J Card Fail, 2019, 25: 516-521. DOI:10.1016/j.cardfail.2019.02.007 |
| [4] |
Meijers WC, de Boer RA. Common risk factors for heart failure and cancer[J]. Cardiovasc Res, 2019, 115: 844-853. DOI:10.1093/cvr/cvz035 |
| [5] |
Blaes A, Prizment A, Koene RJ, et al. Cardio-oncology related to heart failure: common risk factors between cancer and cardiovascular disease[J]. Heart Fail Clin, 2017, 13: 367-380. DOI:10.1016/j.hfc.2016.12.006 |
| [6] |
Ho JE, Enserro D, Brouwers FP, et al. Predicting heart failure with preserved and reduced ejection fraction: the international collaboration on heart failure subtypes[J]. Circ Heart Fail, 2016, 9: e003116. |
| [7] |
Ameri P, Canepa M, Anker MS, et al. Cancer diagnosis in patients with heart failure: epidemiology, clinical implications and gaps in knowledge[J]. Eur J Heart Fail, 2018, 20: 879-887. DOI:10.1002/ejhf.1165 |
| [8] |
Bertero E, Ameri P, Maack C. Bidirectional relationship between cancer and heart failure: old and new issues in cardio-oncology[J]. Card Fail Rev, 2019, 5: 106-111. DOI:10.15420/cfr.2019.1.2 |
| [9] |
Stocks T, Van Hemelrijck M, Manjer J, et al. Blood pressure and risk of cancer incidence and mortality in the metabolic syndrome and cancer project[J]. Hypertension, 2012, 59: 802-810. DOI:10.1161/HYPERTENSIONAHA.111.189258 |
| [10] |
Becker MA, Ibrahim YH, Oh AS, et al. Insulin receptor substrate adaptor proteins mediate prognostic gene expression profiles in breast cancer[J]. PLoS One, 2016, 11: e0150564. DOI:10.1371/journal.pone.0150564 |
| [11] |
Werner H, Bruchim I. IGF-1 and BRCA1 signalling pathways in familial cancer[J]. Lancet Oncol, 2012, 13: e537-e544. DOI:10.1016/S1470-2045(12)70362-5 |
| [12] |
Moon SH, Huang CH, Houlihan SL, et al. p53 represses the mevalonate pathway to mediate tumor suppression[J]. Cell, 2019, 176: 564-580. DOI:10.1016/j.cell.2018.11.011 |
| [13] |
Zamanian-Daryoush M, DiDonato JA. Apolipoprotein A-I and cancer[J]. Front Pharmacol, 2015, 6: 265. |
| [14] |
Georgila K, Vyrla D, Drakos E. Apolipoprotein A-I (Apo A-I), immunity, inflammation and cancer[J]. Cancers (Basel), 2019, 11: 1097. DOI:10.3390/cancers11081097 |
| [15] |
Hu CA, Klopfer EI, Ray PE. Human apolipoprotein L1 (Apo L1) in cancer and chronic kidney disease[J]. FEBS Lett, 2012, 586: 947-955. DOI:10.1016/j.febslet.2012.03.002 |
| [16] |
Su WP, Sun LN, Yang SL, et al. Apolipoprotein C1 promotes prostate cancer cell proliferation in vitro[J]. J Biochem Mol Toxicol, 2018, e22158. |
| [17] |
Ren H, Chen Z, Yang L, et al. Apolipoprotein C1 (APO C1) promotes tumor progression via MAPK signaling pathways in colorectal cancer[J]. Cancer Manag Res, 2019, 11: 4917-4930. DOI:10.2147/CMAR.S192529 |
| [18] |
Lai H, Zhao X, Qin Y, et al. FAK-ERK activation in cell/matrix adhesion induced by the loss of apolipoprotein E stimulates the malignant progression of ovarian cancer[J]. J Exp Clin Cancer Res, 2018, 37: 32. DOI:10.1186/s13046-018-0696-4 |
| [19] |
Zheng P, Luo Q, Wang W, et al. Tumor-associated macrophages-derived exosomes promote the migration of gastric cancer cells by transfer of functional apolipoprotein E[J]. Cell Death Dis, 2018, 9: 434. DOI:10.1038/s41419-018-0465-5 |
| [20] |
Kaya H, Kurt R, Beton O, et al. Cancer antigen 125 is associated with length of stay in patients with acute heart failure[J]. Tex Heart Inst J, 2017, 44: 22-28. DOI:10.14503/THIJ-15-5626 |
| [21] |
Li KHC, Gong M, Li G, et al. Cancer antigen-125 and outcomes in acute heart failure: a systematic review and meta-analysis[J]. Heart Asia, 2018, 10: e011044. DOI:10.1136/heartasia-2018-011044 |
| [22] |
Bianco CM, Al-Kindi SG, Oliveira GH. Advanced heart failure therapies for cancer therapeutics-related cardiac dysfunction[J]. Heart Fail Clin, 2017, 13: 327-336. DOI:10.1016/j.hfc.2016.12.005 |
| [23] |
Banke A, Schou M, Videbaek L, et al. Incidence of cancer in patients with chronic heart failure: a long-term follow-up study[J]. Eur J Heart Fail, 2016, 18: 260-266. DOI:10.1002/ejhf.472 |
| [24] |
Fernandez-Ruiz I. Heart failure: heart failure after MI might increase risk of cancer[J]. Nat Rev Cardiol, 2016, 13: 506-507. |
| [25] |
Mamas MA, Sperrin M, Watson MC, et al. Do patients have worse outcomes in heart failure than in cancer? A primary care-based cohort study with 10-year follow-up in scotland[J]. Eur J Heart Fail, 2017, 19: 1095-1104. DOI:10.1002/ejhf.822 |
| [26] |
Sakamoto M, Hasegawa T, Asakura M, et al. Does the pathophysiology of heart failure prime the incidence of cancer?[J]. Hypertens Res, 2017, 40: 831-836. DOI:10.1038/hr.2017.45 |
| [27] |
Bertero E, Canepa M, Maack C, et al. Linking heart failure to cancer[J]. Circulation, 2018, 138: 735-742. DOI:10.1161/CIRCULATIONAHA.118.033603 |
| [28] |
Tapia-Vieyra JV, Delgado-Coello B, Mas-Oliva J. Atherosclerosis and cancer; a resemblance with far-reaching implications[J]. Arch Med Res, 2017, 48: 12-26. DOI:10.1016/j.arcmed.2017.03.005 |
| [29] |
Moro-Garcia MA, Echeverria A, Galan-Artimez MC, et al. Immunosenescence and inflammation characterize chronic heart failure patients with more advanced disease[J]. Int J Cardiol, 2014, 174: 590-599. DOI:10.1016/j.ijcard.2014.04.128 |
| [30] |
Regulska K, Regulski M, Karolak B, et al. Beyond the boundaries of cardiology: still untapped anticancer properties of the cardiovascular system-related drugs[J]. Pharmacol Res, 2019, 147: 104326. DOI:10.1016/j.phrs.2019.104326 |
| [31] |
Le CP, Nowell CJ, Kim-Fuchs C, et al. Chronic stress in mice remodels lymph vasculature to promote tumour cell dissemination[J]. Nat Commun, 2016, 7: 10634. DOI:10.1038/ncomms10634 |
| [32] |
Karlstaedt A, Schiffer W, Taegtmeyer H. Actionable metabolic pathways in heart failure and cancer-lessons from cancer cell metabolism[J]. Front Cardiovasc Med, 2018, 5: 71. DOI:10.3389/fcvm.2018.00071 |
| [33] |
Li L, Zhao Q, Kong W. Extracellular matrix remodeling and cardiac fibrosis[J]. Matrix Biol, 2018, 68-69: 490-506. DOI:10.1016/j.matbio.2018.01.013 |
| [34] |
Rupaimoole R, Calin GA, Lopez-Berestein G, et al. miRNA deregulation in cancer cells and the tumor microenvironment[J]. Cancer Discov, 2016, 6: 235-246. DOI:10.1158/2159-8290.CD-15-0893 |
| [35] |
Zhou Z, Lu ZR. Molecular imaging of the tumor microenvironment[J]. Adv Drug Deliv Rev, 2017, 113: 24-48. DOI:10.1016/j.addr.2016.07.012 |
| [36] |
Patel A, Sant S. Hypoxic tumor microenvironment: opportunities to develop targeted therapies[J]. Biotechnol Adv, 2016, 34: 803-812. DOI:10.1016/j.biotechadv.2016.04.005 |
| [37] |
Olson OC, Quail DF, Joyce JA. Obesity and the tumor microenvironment[J]. Science, 2017, 358: 1130-1131. DOI:10.1126/science.aao5801 |
| [38] |
Taha Isra N, Naba A. Exploring the extracellular matrix in health and disease using proteomics[J]. Essays Biochem, 2019, 63: 417-432. DOI:10.1042/EBC20190001 |
| [39] |
Kim YA, Cho H, Lee N, et al. Doxorubicin-induced heart failure in cancer patients: a cohort study based on the korean national health insurance database[J]. Cancer Med, 2018, 7: 6084-6092. DOI:10.1002/cam4.1886 |
| [40] |
Bloom MW, Hamo CE, Cardinale D, et al. Cancer therapy-related cardiac dysfunction and heart failure: part 1: definitions, pathophysiology, risk factors, and imaging[J]. Circ Heart Fail, 2016, 9: e002661. |
| [41] |
Cappetta D, De Angelis A, Sapio L, et al. Oxidative stress and cellular response to doxorubicin: a common factor in the complex milieu of anthracycline cardiotoxicity[J]. Oxid Med Cell Longev, 2017, 2017: 1521020. |
| [42] |
Cuomo A, Rodolico A, Galdieri A, et al. Heart failure and cancer: mechanisms of old and new cardiotoxic drugs in cancer patients[J]. Card Fail Rev, 2019, 5: 112-118. DOI:10.15420/cfr.2018.32.2 |
| [43] |
Hassen LJ, Lenihan DJ, Baliga RR. Hypertension in the cardio-oncology clinic[J]. Heart Fail Clin, 2019, 15: 487-495. DOI:10.1016/j.hfc.2019.06.010 |
| [44] |
Goldhar HA, Yan AT, Ko DT, et al. The temporal risk of heart failure associated with adjuvant trastuzumab in breast cancer patients: a population study[J]. J Natl Cancer Inst, 2016, 108. |
| [45] |
Chen J, Long JB, Hurria A, et al. Incidence of heart failure or cardiomyopathy after adjuvant trastuzumab therapy for breast cancer[J]. J Am Coll Cardiol, 2012, 60: 2504-2512. DOI:10.1016/j.jacc.2012.07.068 |
| [46] |
Menna P, Minotti G, Salvatorelli E. Cardiotoxicity of targeted cancer drugs: concerns, "the cart before the horse, " and lessons from trastuzumab[J]. Curr Cardiol Rep, 2019. DOI:10.1007/s11886-019-1121-0 |
| [47] |
Watanabe H, Ichihara E, Kano H, et al. Congestive heart failure during osimertinib treatment for epidermal growth factor receptor (EGFR)-mutant non-small cell lung cancer (NSCLC)[J]. Intern Med, 2017, 56: 2195-2197. DOI:10.2169/internalmedicine.8344-16 |
| [48] |
Rowshanravan B, Halliday N, Sansom DM. CTLA-4: a moving target in immunotherapy[J]. Blood, 2018, 131: 58-67. DOI:10.1182/blood-2017-06-741033 |
| [49] |
Xu-Monette ZY, Zhou J, Young KH. PD-1 expression and clinical PD-1 blockade in B-cell lymphomas[J]. Blood, 2018, 131: 68-83. DOI:10.1182/blood-2017-07-740993 |
| [50] |
Delgobo M, Frantz S. Heart failure in cancer: role of checkpoint inhibitors[J]. J Thorac Dis, 2018, 10: S4323-S4334. DOI:10.21037/jtd.2018.10.07 |
| [51] |
Mahmood SS, Fradley MG, Cohen JV, et al. Myocarditis in patients treated with immune checkpoint inhibitors[J]. J Am Coll Cardiol, 2018, 71: 1755-1764. DOI:10.1016/j.jacc.2018.02.037 |
| [52] |
Schneider C, Wallner M, Kolesnik E, et al. The anti-cancer multikinase inhibitor sorafenib impairs cardiac contractility by reducing phospholamban phosphorylation and sarcoplasmic calcium transients[J]. Sci Rep, 2018, 8: 5295. DOI:10.1038/s41598-018-23630-w |
| [53] |
Truitt R, Mu A, Corbin EA, et al. Increased afterload augments sunitinib-induced cardiotoxicity in an engineered cardiac microtissue model[J]. JACC Basic Transl Sci, 2018, 3: 265-276. DOI:10.1016/j.jacbts.2017.12.007 |
| [54] |
Mukai M, Oka T. Mechanism and management of cancer-associated thrombosis[J]. J Cardiol, 2018, 72: 89-93. DOI:10.1016/j.jjcc.2018.02.011 |
| [55] |
Elliott WJ. Antihypertensive drugs and risk of cancer: network meta-analyses and trial sequential analyses of 324 168 participants from randomised trials[J]. Yearbook Cardiol, 2012, 2012: 22-24. DOI:10.1016/j.ycar.2012.01.089 |
| [56] |
Kokolus KM, Zhang Y, Sivik JM, et al. Beta blocker use correlates with better overall survival in metastatic melanoma patients and improves the efficacy of immunotherapies in mice[J]. Oncoimmunology, 2018, 7: e1405205. DOI:10.1080/2162402X.2017.1405205 |
| [57] |
Hicks BM, Filion KB, Yin H, et al. Angiotensin converting enzyme inhibitors and risk of lung cancer: population based cohort study[J]. BMJ, 2018, 363: k4209. |
| [58] |
Thorat MACJ. A role for aspirin in cancer prevention?[J]. Cancer Discov, 2013, 3: 1324. DOI:10.1158/2159-8290.CD-ND2013-027 |
| [59] |
Sutcliffe P, Connock M, Gurung T, et al. Aspirin for prophylactic use in the primary prevention of cardiovascular disease and cancer: a systematic review and overview of reviews[J]. Health Technol Assess, 2013, 17: 1-253. |
| [60] |
Mullen PJ, Yu R, Longo J, et al. The interplay between cell signalling and the mevalonate pathway in cancer[J]. Nat Rev Cancer, 2016, 16: 718-731. DOI:10.1038/nrc.2016.76 |
 2020, Vol. 55
2020, Vol. 55


