安丝菌素(ansamitocin)是由束丝放线菌(Actinosynnema)等产生的一种安莎类抗生素[1, 2], 具有极强的抗肿瘤细胞活性。安丝菌素作为毒性弹头分子[3], 已应用于抗肿瘤药物——抗体药物偶联物(ADC, antibody drug conjugate)的生产与研发。例如, 治疗HER2阳性乳腺癌的Kadcyla采用了安丝菌素作为弹头分子[4], 还有多种ADC药物候选物采用安丝菌素作为弹头分子[5]。因此, 在ADC研发与生产领域中对安丝菌素具有商业需求。
束丝放线菌发酵产生安丝菌素的水平较低。近年来, 国内外研究人员正在采用传统和/或现代生物技术方法, 不断地提高安丝菌素发酵效价, 已经从初始的5~30 mg·L-1提高至200~500 mg·L-1 [6-8]。通过对束丝放线菌产生安丝菌素的生物合成与调节机制进行系统深入研究, 有望继续提高安丝菌素发酵水平, 满足其在生物医药领域中的需求。
本文作者在提高安丝菌素发酵水平的研究中[9], 认识到建立一种安全高效的安丝菌素生物检定方法并应用于批量的发酵培养物安丝菌素效价测定, 对于筛选安丝菌素高产菌株具有重要作用。目前, 文献报道的安丝菌素效价测定方法主要为高效液相色谱(HPLC)和生物检定(抑菌圈)法, 硅胶板薄层色谱(TLC)也用于安丝菌素测定[6, 8, 10-16]。其中, HPLC和TLC方法可完成定量或半定量测定, 但是操作相对复杂, 不适用于高通量筛选; 生物检定(抑菌圈)法可完成定量或半定量(与所使用的检定菌等有关)测定, 操作相对简单和高效, 因而适用于高通量筛选。然而, 文献报道的安丝菌素生物检定方法中所使用的检定菌——指甲绒黑粉类酵母(Filobasidium uniguttulatum)为生物安全Ⅱ类微生物, 属于条件致病菌[17]; 榛色青霉(Penicillium avellaneum)作为美登木素(maytansine, 植物来源的安丝菌素类似物)生物检定菌[18], 推测可作为安丝菌素的生物检定菌, 但在公开出版的微生物菌种保藏目录中没有查阅到对其保藏, 因而无法公开获得该检定菌。因此, 有必要建立一种安全而高效的安丝菌素生物检定方法, 即采用生物安全Ⅰ类的微生物(非致病的普通微生物)作为安丝菌素生物检定菌。
基于安丝菌素具有一定的抗真菌活性, 本文作者从中国药学微生物菌种保藏中心筛选到一株对安丝菌素敏感的真菌——CPCC 400749, 初步的分类学结果表明它属于木霉属。木霉是一种常见的真菌, 属于生物安全Ⅰ类微生物。本文主要报道以该木霉作为检定菌所建立的安丝菌素效价测定方法。
材料和方法菌株 木霉CPCC 400749, 中国药学微生物菌种保藏中心提供; 该菌株已在中国微生物菌种保藏管理委员会普通微生物中心保藏(保藏号CGMCC 16849)。珍贵束丝放线菌(Actinosynnema pretiosum) ATCC 31565, 安丝菌素产生菌, 本实验室保藏。
培养基 PDA培养基(即马铃薯葡萄糖琼脂培养基):马铃薯粉6.0 g·L-1, 葡萄糖20.0 g·L-1, 琼脂20.0 g·L-1。
仪器与试剂 PDA培养基为北京奥博星生物技术有限责任公司产品; 微生物培养所需的其他原料均为国产试剂。甲醇为国产分析纯试剂; 乙腈为Fisher产品; 液相用水为屈臣氏蒸馏水; HPLC分析色谱柱Dikma Diamonsil C18 (4.6 mm×150 mm, 5 μm)购自北京迪科马科技有限公司。安丝菌素对照品(P-3组分, HPLC纯度95%), 本实验室采用Actinosynnema pretiosum ATCC 31565发酵和分离纯化自制。
样品浓缩使用Christ RVC 2-33IR离心浓缩仪; HPLC分析使用安捷伦1260高效液相色谱仪; 涡旋振荡器使用美国Scientific Industries公司的Vortex-Genie 2;抑菌圈测量使用杭州迅数科技有限公司的抑菌圈测量仪Supcre G9。
木霉CPCC 400749培养 PDA培养基经高压蒸汽灭菌, 适当冷却后倒入培养皿(直径为9.0 cm), 每个培养皿内装15.0 mL培养基。培养皿水平静置至完全凝固。将于30%甘油中冷冻保藏的木霉CPCC 400749孢子悬液均匀涂布于上述PDA平板, 28 ℃培养5~7天, 显微镜观察菌丝形态。
木霉CPCC 400749初步的分类学鉴定 以真菌CPCC 400749的基因组DNA为模板, 采用引物ITS1F (5' CTTGGTCA TTTAGACGAAGTAA 3')和ITS4 (5' TCCTCCGCTTATTGATATGC 3')扩增其内部转录间隔区(internal transcribed spacer, ITS) DNA, 完成测序后提交至GenBank数据库获得登录号。使用MEGA7软件将其与同源性较高菌株的ITS序列进行比对并构建系统进化树。
木霉CPCC 400749检定平板
孢子悬液 采用PDA培养基在28 ℃培养7天, 木霉CPCC 400749在平板上长满一层绿色孢子; 用无菌水洗下孢子层, 转入无菌的50 mL离心管中, 加入几粒玻璃珠, 放在涡旋振荡器上快速振荡, 经脱脂棉过滤得到孢子悬液, 最后用无菌水稀释孢子悬液至约每毫升108 CFU。
检定平板 PDA培养基高压蒸汽灭菌并冷却至45~50 ℃, 将上述稀释后的孢子悬液以0.5%比例加入PDA培养基, 混匀后倒入平板(直径9.0 cm, 每平板12.0 mL)中, 待培养基完全凝固后得到检定平板。
安丝菌素浓度-HPLC峰面积标准曲线 取2.0 mg安丝菌素对照品, 溶于2.0 mL甲醇, 制成1 000 mg·L-1安丝菌素溶液; 再用甲醇依次稀释, 得到7个不同浓度的安丝菌素甲醇溶液, 浓度分别为300、250、200、150、100、50和10 mg·L-1。经直径0.22 μm滤膜过滤, 用于HPLC分析, 进样量为10 μL。流动相为乙腈和水, 分析条件为0~5 min, 55%~80%乙腈梯度, 5~10 min, 100%乙腈等度, 10~15 min, 55%乙腈等度。将测得的安丝菌素(P-3组分)洗脱峰面积与相应的安丝菌素溶液浓度作拟合, 得到安丝菌素浓度-HPLC峰面积标准曲线与标准曲线方程式。
安丝菌素浓度-木霉检定平板抑菌圈直径标准曲线 称取2.0 mg安丝菌素对照品, 溶于2.0 mL甲醇, 配制1 000 mg·L-1安丝菌素溶液, 然后用甲醇稀释, 得到浓度分别为750、500、250、100和50 mg·L-1的安丝菌素溶液。用打孔器将滤纸片打成直径为6.0 mm的圆形滤纸片, 分别取5.0 μL上述安丝菌素甲醇溶液, 点样至圆形滤纸片上, 于通风橱中挥干, 依次贴到制备的木霉检定平板上, 28 ℃培养24 h, 测定抑菌圈直径。每个浓度做3个平行, 取抑菌圈直径平均值, 与安丝菌素浓度log10值拟合得到标准曲线。
木霉检定平板测定固体(琼脂)发酵培养物甲醇提取液安丝菌素浓度 将珍贵束丝放线菌的固体(琼脂)发酵培养物切成小块, 称重后以每克2.0 mL的比例加入甲醇提取48 h, 离心得上清液。取5.0 μL上清液, 点样至6.0 mm圆形滤纸片, 于通风橱中挥干后置于木霉检定平板, 28 ℃培养24 h, 测量抑菌圈直径; 每个样品做3个平行, 取抑菌圈直径平均值, 计算安丝菌素浓度。
固体(琼脂)发酵培养物安丝菌素效价-木霉检定平板抑菌圈直径标准曲线 安丝菌素固体(琼脂)发酵培养物, 用打孔器获得直径6.0 mm的圆柱形琼脂块。每个发酵培养物平板取3个琼脂块(即3个平行), 将其完全贴合于木霉检定平板上, 28 ℃培养24 h, 测定抑菌圈并取其平均值。对同一个安丝菌素发酵培养物, 另取3个琼脂块(即3个平行), 称重后以每克2.0 mL的比例加入甲醇提取48 h, 离心取上清, 上清液经0.22 μm滤膜过滤后, HPLC测定安丝菌素浓度并换算成安丝菌素效价(单位mg·L-1)。将抑菌圈直径与安丝菌素效价的log10值拟合做标准曲线。
木霉检定平板测定固体(琼脂)发酵培养物安丝菌素效价 用打孔器获得安丝菌素发酵培养物的圆柱形琼脂块(直径6.0 mm)。每个安丝菌素发酵培养物取3个琼脂块样品, 置于木霉检定平板28 ℃培养24 h, 按照上述方法测定抑菌圈, 计算安丝菌素效价。
结果 1 真菌CPCC 400749初步的分类学鉴定采用方法“木霉CPCC 400749培养”培养真菌CPCC 400749, 5~7天时可见平板上长满厚厚的黄绿色气生菌丝(图 1); 显微镜下可观察其菌丝为有隔分枝, 分生孢子梗从菌丝的侧枝长出, 孢子梗顶端呈簇分布着分生孢子。

|
Figure 1 Trichoderma CPCC 400749 cultured on PDA plate for 5 days. Left: Mycelium on PDA plate. Right: Mycelium under microscope |
对菌株CPCC 400749测定了其ITS序列, 长度544 bp, 并将该序列提交至GenBank数据库(登录号MN 203628)。BLAST分析结果显示, 该菌株与哈茨木霉Trichoderma harzianum strain CBS 130673的ITS序列同源性为99.82%。将其ITS序列与多个同源性较高的菌株进行聚类并构建系统进化树(图 2), 表明菌株CPCC 400749属于木霉属。

|
Figure 2 The phylogenetic tree based on neighbor-joining analysis of ITS |
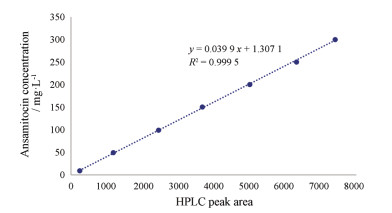
对7个配制的不同浓度安丝菌素甲醇溶液进行HPLC分析。将安丝菌素浓度与HPLC峰面积拟合得到标准曲线(图 3), 以及计算公式:安丝菌素浓度(mg·L-1) = HPLC峰面积× 0.039 9 + 1.307 1。
|
Figure 3 The standard curve for ansamitocin concentration - HPLC peak area |
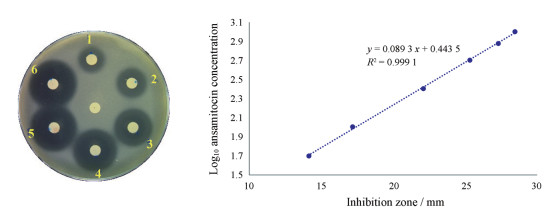
将6个配制的不同浓度安丝菌素甲醇溶液点样至圆形滤纸片上, 挥干后贴至木霉检定平板上28 ℃培养24 h, 所产生的抑菌圈见图 4; 每个浓度做3个平行, 取抑菌圈的平均值。将安丝菌素浓度的log10值与抑菌圈直径拟合得到标准曲线(图 4), 以及计算公式: log10安丝菌素浓度(mg·L-1) =抑菌圈直径(mm)× 0.089 3 + 0.443 5。
|
Figure 4 Inhibition zones generated by various concentrations of ansamitocin and the standard curve of ansamitocin concentration - inhibition zone. Left: Inhibition zone. Right: Standard curve |
采用木霉检定平板法对3个固体(琼脂)发酵培养物的甲醇提取液进行了安丝菌素浓度测定, 并采用HPLC法对测定结果进行了验证。木霉检定平板法测定的3个数据分别为60.47、186.23和363.61 mg·L-1, 与HPLC法测定数据(分别为66.58、175.17和348.45 mg·L-1)的误差均在10%以内, 表明木霉检定平板法测定安丝菌素浓度是可行的。
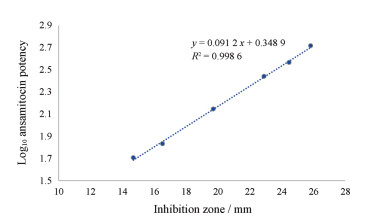
5 固体(琼脂)发酵培养物安丝菌素效价-木霉检定板抑菌圈直径标准曲线对6个固体(琼脂)发酵培养物(其安丝菌素效价处于不同水平), 首先采用HPLC法测定效价, 然后采用木霉检定板法测定抑菌圈直径。将抑菌圈直径与HPLC方法测定的安丝菌素效价的log10值拟合得到标准曲线(图 5), 以及计算公式: log10安丝菌素效价(mg·L-1) =抑菌圈直径(mm)× 0.091 2 + 0.348 9。
|
Figure 5 The standard curve of ansamitocin potency - inhibition zone |
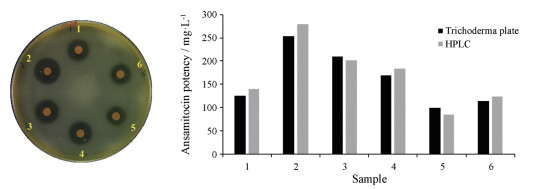
采用木霉检定平板法对6个安丝菌素固体(琼脂)发酵培养物进行了效价测定(图 6)。同时, 用HPLC法对木霉平板法测定的结果进行了验证, 除了效价较低的5号样品, 误差均在10%以内(推测5号样品抑菌圈较小, 致测量误差较大), 表明两种方法得到的安丝菌素效价基本一致(图 6)。因此, 采用木霉检定平板法对安丝菌素效价进行测定是可行的。
|
Figure 6 Determination of ansamitocin potency by Trichoderma plate. Left: Inhibition zone generated by Trichoderma plate. Right: Ansamitocin potency determined by Trichoderma plate (with HPLC data as comparison) |
对于具有抗菌(细菌或真菌)活性的微生物次级代谢产物, 选择对操作人员安全的敏感菌株作为检定菌并建立生物检定方法, 是经典和现代微生物育种实践中实现高效筛选目标次级代谢产物高产菌株的一个重要前提。
本文报道的安丝菌素生物检定方法, 采用木霉CPCC 400749作为检定菌, 具有如下优点或特点: ①检定菌属于生物安全Ⅰ类微生物, 对操作人员安全; ②检定菌生长速度快, 经24 h培养即可测定抑菌圈大小; ③检定菌产孢能力强, 易于培养和保藏。
本文报道的安丝菌素生物检定方法可应用于束丝放线菌固态发酵培养物效价测定, 操作简便且测定通量大, 因而有望用于安丝菌素高产菌株的高通量筛选。
| [1] |
Higashide E, Asai M, Ootsu K, et al. Ansamitocin, a group of novel maytansinoid antibiotics with antitumour properties from Nocardia[J]. Nature, 1977, 270: 721-722. DOI:10.1038/270721a0 |
| [2] |
Tanida S, Hasegawa T, Hatano K, et al. Ansamitocins, maytansinoid antitumor antibiotics. Producing organism, fermentation, and antimicrobial activities[J]. J Antibiot (Tokyo), 1980, 33: 192-198. DOI:10.7164/antibiotics.33.192 |
| [3] |
Liu C, Tadayoni BM, Bourret LA, et al. Eradication of large colon tumor xenografts by targeted delivery of maytansinoids[J]. Proc Natl Acad Sci U S A, 1996, 93: 8618-8623. DOI:10.1073/pnas.93.16.8618 |
| [4] |
LoRusso PM, Weiss D, Guardino E, et al. Trastuzumab emtansine: a unique antibody-drug conjugate in development for human epidermal growth factor receptor 2-positive cancer[J]. Clin Cancer Res, 2011, 17: 6437-6447. DOI:10.1158/1078-0432.CCR-11-0762 |
| [5] |
Klute K, Nackos E, Tasaki S, et al. Microtubule inhibitor-based antibody-drug conjugates for cancer therapy[J]. OncoTargets Ther, 2014, 7: 2227-2236. |
| [6] |
Ng D, Chin HK, Wong VVT. Constitutive overexpression of asm2 and asm39 increases AP-3 production in the actinomycete Actinosynnema pretiosum[J]. J Ind Microbiol Biotechnol, 2009, 36: 1345-1351. DOI:10.1007/s10295-009-0619-7 |
| [7] |
Chung J, Byng GS. Mutant Actinosynnema pretiosum strain with increased maytansinoid production. EP1468077[P]. 2003-01-05.
|
| [8] |
Yi D, Wang Y, Chen SX. Fermentation process for the production of ansamitocin P-3[J]. Chin J Pharm (中国医药工业杂志), 2012, 43: 260-262. |
| [9] |
Nan YN, Bai XG, Sun GZ, et al. Solid-state fermentation of Actinosynnema pretiosum ATCC 31565 for ansamitocins and preparation of ansamitocin P-0[J]. Chin J Antibiot (中国抗生素杂志), 2015, 40: 241-244. |
| [10] |
Hatano K, Higashide E, Yoneda M. Bioassay of ansamitocin P-3, an antitumor antibiotic[J]. Agric Biol Chem, 1984, 48: 1899-1890. |
| [11] |
Hanka LJ, Barnett MS. Microbiological assays and bioautography of maytansine and its homologues[J]. Antimicrob Agents Chemother, 1974, 6: 651-652. DOI:10.1128/AAC.6.5.651 |
| [12] |
Gao Y, Fan YX, Nambou K, et al. Enhancement of ansamitocin P‑3 production in Actinosynnema pretiosum by a synergistic effect of glycerol and glucose[J]. J Ind Microbiol Biotechnol, 2014, 41: 143-152. DOI:10.1007/s10295-013-1374-3 |
| [13] |
Hatano K, Higashide E, Akiyama SI, et al. Selective accumulation of ansamitocins P-2, P-3 and P-4, and biosynthetic origins of their acyl moieties[J]. Agric Biol Chem, 1984, 48: 1721-1729. |
| [14] |
Asai M, Mizuta E, Izawa M, et al. Isolation, chemical characterization and structure of ansamitocin, a new antitumor ansamycin antibiotic[J]. Tetrahedron, 1979, 35: 1079-1085. DOI:10.1016/S0040-4020(01)93726-3 |
| [15] |
Gu JF. The Chemistry and Analysis of Microbial Drugs (微生物药品化学与分析)[M]. Beijing: Military Medical Science Press, 1996: 202-213.
|
| [16] |
Liang MX. Screening of High Ansamitocin P-3 Producing Strain and Fermentation Process Optimization (安丝菌素AP-3高产菌株选育及发酵条件优化)[D]. Fuzhou: Fujian Normal University, 2016.
|
| [17] |
Pan W, Liao W, Hagen F, et al. Meningitis caused by Filobasidium uniguttulatum: case report and overview of the literature[J]. Mycoses, 2012, 55: 105-109. |
| [18] |
Hanka LJ, Barnett MS. Microbiological assays and bioautography of maytansine and its homologues[J]. Antimicrob Agents Chemother, 1974, 6: 651-652. DOI:10.1128/AAC.6.5.651 |
 2019, Vol. 54
2019, Vol. 54


