CQ止痛复方(Chuanxiong Qingfengteng Mixture, CQM), 是本课题组根据中医药理论及临床实践组分配伍的药物, 由川芎有效组分川芎嗪和青风藤有效组分青藤碱等配伍而成, 具有活血行气、祛风除湿、通络止痛的功效[1]。前期研究表明CQM对坐骨神经损伤[2]、三叉神经损伤[3]及脊髓损伤[4]引起的多种神经病理性疼痛, 以及切口痛[5]、骨癌痛[6]、癌侵袭痛[7]等动物模型的疼痛行为具有改善作用, 其镇痛效果近似或优于一线治疗药物加巴喷丁或氯诺昔康。后期研究发现CQM能调节中枢神经系统内多种与疼痛相关的化学物质、递质/调质的动态变化, 如能调节脑组织细胞外液兴奋性氨基酸/抑制性氨基酸递质的平衡[2, 3, 7], 能降低脑脊液中致痛因子P物质的含量[5], 能提高脑脊液中镇痛因子β-内啡肽的含量[6]等等, 提示CQM具有一定的中枢性药理作用, 但目前CQM的脑通透性特征尚不清楚。药物发挥中枢性作用一般需要先通过血脑屏障(blood-brain barrier, BBB), 并且在脑组织达到足够暴露量, 即脑通透性良好。由于外排性药物转运体如P-糖蛋白(P-gp)在BBB上大量表达, 且特异性低、底物广泛, 能介导绝大部分药物的外排, 是限制药物通过BBB和脑通透性的主要原因之一[8]。并且血液中只有游离型的药物会通过BBB, 所以药物的血浆蛋白结合率也是限制药物脑通透性重要因素。因此, 为了解CQM各组分能否通过BBB及影响因素, 本研究利用UHPLC-UV建立同时分析血浆、脑组织、细胞液等生物样品川芎嗪和青藤碱浓度的检测方法, 通过分析CQM在大鼠和小鼠的血浆、脑组织以及Caco-2细胞中各组分浓度的经时变化过程, 分析各组分的血浆蛋白结合率, 从整体动物和细胞层面评估其脑通透性, 以期为CQM发挥的中枢性作用机制提供依据。
材料与方法仪器 ACQUITY超高效液相色谱系统(美国Waters公司), 配有二元高压梯度泵、自动进样器、柱温箱、PDA检测系统和Empower2数据处理工作站; Targin VX-Ⅲ多管涡旋振荡器(北京踏锦科技有限公司); Precellys Evolution生物样品均质器和Precellys氧化锆磁珠试剂盒(法国Bertin公司); Rotanta 460R高速冷冻离心机(德国Hetich公司); N-EVAP水浴氮吹仪(美国Organomation公司); Millicell ERS-2细胞电阻仪(美国Millipore公司); Easyflow独立通气笼具(意大利Tecniplast公司); Synergy2多功能酶标仪(美国BioTek公司); 多聚碳酸脂膜24孔插入式培养皿(美国Corning公司); Microcon@型超滤离心装置(截留相对分子质量: 30 000, 美国Millipore公司)。
药品与试剂 青藤碱(盐酸青藤碱, 批号: DT201803-19, 纯度 > 98%)、川芎嗪(盐酸川芎嗪, 批号: DT201806-22, 纯度 > 98%), 均购自陕西大田生物科技有限公司。异氟烷(批号: 217180801), 深圳瑞沃德生命科技有限公司。甲醇、乙腈和甲酸等均为色谱纯, 迪马科技公司。Caco-2细胞株由国家实验细胞资源共享平台提供。最小量伊格尔氏培养基-伊格尔氏平衡盐、青霉素-链霉素、胎牛血清和汉克斯缓冲溶液(Hank's Balanced Salt Solution, HBSS), 美国Gibco公司。异硫氰酸荧光素标记葡聚糖(相对分子质量40 000, FD4, 批号: S24J9I66383)和维拉帕米(维拉帕米盐酸盐, 批号: Y05J6C2)购自上海源叶生物科技有限公司。
实验动物 所有动物实验过程和动物关怀均遵守中华人民共和国《实验动物管理条例》 (1988; http://www.gov.cn/gongbao/content/2017/content_5219148.htm), 并得到中国中医科学院医学实验中心伦理委员会的批准。雄性SD大鼠, SPF级, 6~7周龄, 实验动物质量合格证号11400700354418;雄性Bal/bc小鼠, SPF级, 6~7周龄, 实验动物质量合格证号11400700337318, 均购自北京维通利华实验动物技术有限公司(许可证号: SCXK (京) 2016-0006)。所有动物饲养于独立通气笼具(长×宽×高: 461 mm×274 mm×229 mm), 保持实验室环境温度为22 ℃, 湿度为50%左右, 并提前喂养1~2周适应饲养环境, 自由饮水和食用商业饲料。给药前, 动物禁食12~16 h, 自由饮水。实验结束后, 所有动物施行安乐死。
药物制备 用生理盐水配制浓度为12.5 mg·mL-1 (含青藤碱和川芎嗪均为12.5 mg·mL-1)和2.5 mg·mL-1 (含青藤碱和川芎嗪均为2.5 mg·mL-1)的CQM用于动物实验, 配制10 μg·mL-1 (含青藤碱和川芎嗪均为10 μg·mL-1)的CQM用于细胞实验。各药物过0.22 μm滤膜即得。
UHPLC-UV检测方法 色谱柱为ACQUITY UPLC HSS T3色谱柱(2.1 mm×50 mm, 1.8 μm, Waters, USA); 流动相为A (水, 含0.05%甲酸):B (甲醇, 含0.05%甲酸), 梯度洗脱程序: 0~2.5 min, 85% A; 2.5~5 min, 85%~65% A; 5~6 min, 65%~20% A; 6~6.01 min, 20%~85% A; 6.01~7.5 min, 85% A; 流速为0.2 mL·min-1; 柱温为30 ℃; 样品室温度为4 ℃; 进样量为5 μL; 用最大吸收波长定量, 青藤碱263 nm和川芎嗪296 nm。
混合对照品溶液和质量控制(QC)样品的配制 分别称取各对照品约20 mg, 精密称定, 加适量甲醇溶解后定容, 配制成含青藤碱和川芎嗪的混合对照品溶液, -80 ℃冰箱中保存备用。取混合对照品溶液, 用空白血浆、脑组织匀浆液和细胞液稀释得到低浓度质控(LQC, 青藤碱0.29 μg·mL-1和川芎嗪0.11 μg·mL-1)、中浓度质控(MQC, 青藤碱2.92 μg·mL-1和川芎嗪4.22 μg·mL-1)和高浓度质控(HQC, 青藤碱14.62 μg·mL-1和川芎嗪21.12 μg·mL-1)样品, -80 ℃冰箱中保存备用。
生物样品的处理
生物样品制备 动物在给药前和给药后不同时间处死, 腹主动脉取血于肝素化管中, 4 ℃、2 000 ×g下离心15 min, 上清为血浆; 枕骨大孔取脑脊液, 4 ℃、2 000 ×g下离心15 min, 上清为脑脊液; 取全脑, 用4 ℃生理盐水快速清洗, 吸干水分后称重, 置氧化锆磁珠试剂盒中, 然后加入4倍质量体积生理盐水混匀, 放入生物样品均质器中, 按以下程序匀浆: 4 ℃、8 000 r·min-1振荡30 s, 停30 s, 再次8 000 r·min-1振荡30 s, 制备成脑组织匀浆液。细胞实验的细胞液样品在给药后不同时间吸取。全部样品-80 ℃冻存。
生物样品前处理 血浆及血浆滤过液、脑脊液、脑组织匀浆液和细胞液等样品在室温下融化后, 涡旋混匀, 精密吸取100 µL, 置于0.6 mL管中, 等比例加入甲醇(含0.1%甲酸) 100 µL, 8 000 r·min-1涡旋振荡5 min, 4 ℃、20 000 ×g下离心10 min, 上清用纯水(含0.1%甲酸)稀释2倍后进样。
方法学考察
选择性 取空白生物样品100 µL, 按“生物样品前处理”项下方法操作, 获得空白生物样品的色谱图; 将一定浓度的混合对照品溶液加入空白生物样品中, 依同法操作, 得色谱图; 取受试动物和细胞给药CQM的血浆、脑组织匀浆液及细胞液样品, 同法操作, 得色谱图, 考察分析方法的选择性。
线性范围及定量限 取动物空白样品100 µL, 加入混合对照品系列溶液适量, 配制成含青藤碱质量浓度约为10、5、2、1、0.5、0.2、0.1和0.05 μg·mL-1及川芎嗪质量浓度约为20、10、5、2、1、0.5、0.2和0.1 μg·mL-1的模拟生物样品; 取细胞液100 µL, 加入混合对照品系列溶液适量, 配制成含青藤碱质量浓度约为5、2、1、0.5、0.2、0.1和0.05 μg·mL-1及川芎嗪质量浓度约为5、2、1、0.5、0.2、0.1、0.05和0.02 μg·mL-1的模拟生物样品, 然后按“生物样品前处理”项下方法操作, 以生物样品中待测药物的浓度X与峰面积Y作直线回归, 求得的回归方程即为标准曲线, 根据S/N=10及准确度、精密度数据判定各成分的定量限(limit of quantification, LOQ)。
提取回收率、准确度与精密度 取LOQ、LQC、MQC及HQC样品, 每一浓度配制6份, 按“生物样品前处理”项下方法操作, 进样分析得到各成分色谱峰面积A; 另取空白生物样品, 按“生物样品前处理”项下方法操作, 蛋白沉淀后的上清液加入与上述相应等浓度的混合对照品溶液, 然后同法操作, 得到色谱峰面积B, A与B的比值即为提取回收率。LOQ样品和QC样品1日之内测定6次, 以及连续3天测定, 计算日内、日间精密度和准确度。
稳定性 取LQC、MQC及HQC样品, 每一浓度配制3份, 并按“生物样品前处理”项下方法操作, 经历3次冻融(-80 ℃冻存24 h, 室温融化), 考察冻融稳定性; 室温下放置4 h, 考察室温稳定性; -80 ℃条件下冷冻6 m, 考察长期稳定性; 处理后的样品在进样室中放置24 h, 考察后期稳定性。
脑通透性实验 所有动物随机分为0.083 h给药组、0.5 h给药组、1 h给药组和2 h给药组, 每组均有3只大鼠和3只小鼠。大鼠按2 mL·kg-1体重静脉注射给予CQM (12.5 mg·mL-1), 小鼠按10 mL·kg-1体重尾静脉注射给予CQM (2.5 mg·mL-1), 给药剂量青藤碱和川芎嗪均为25 mg·kg-1体重。给药0.083、0.5、1和2 h后, 经麻醉机麻醉(异氟烷: 5%诱导和1.5%~2.5%维持), 采集全血、脑脊液和全脑等组织, 按“生物样品制备”方法制备血浆、脑脊液以及脑组织匀浆液。另取6只空白动物, 按上述方法制备空白生物基质样品。
取给药后的血浆、脑脊液和脑组织匀浆液样品, 按“生物样品前处理”项下进行操作, 分别检测血浆中药物浓度(Cplasma)、脑脊液中药物浓度(Ccsf)和脑组织中药物浓度(Cbrain), 其中Cbrain用脑组织匀浆液药物浓度和脑组织质量换算而来。根据以下公式计算药物脑脊液/血浆浓度比(CSF/plasma ratio, C/P ratio): C/P ratio = Ccsf/Cplasma×100%、药物脑组织/血浆浓度比(brain/plasma ratio, B/P ratio): B/P ratio = Cbrain/Cplasma×100%和组织/血浆分配系数(partition coefficient between tissues and plasma, Kp): Kp = AUC组织(0.083-4 h)/AUC血浆(0.083-4 h)×100%, 即脑脊液/血浆分配系数Kp, C/P和脑组织/血浆分配系数Kp, B/P, 其中AUC采用梯形法计算。
血浆蛋白结合实验 按文献的超滤法进行药物血浆蛋白结合率测定[9]。测定前考察药物与超滤装置的非特异性吸附(non-specific binding, NSB), 即用缓冲液配制LQC、MQC及HQC样品, 取0.5 mL加入超滤离心管内, 于37 ℃在14 000 ×g转速下离心10 min, 每一浓度3份。超滤后, 按“生物样品前处理”项下方法操作, 分别检测滤过液中药物浓度(Cf)和未过滤前药物浓度(Cd)。根据以下公式考察NSB:NSB = (Cd-Cf)/Cd×100%。
取“脑通透性实验”大鼠给药后0.083、0.5、1和2 h的血浆样品0.5 mL, 按上述方法操作, 分别检测滤过液中药物浓度(Cu)和未处理前血浆中药物浓度(Ct)。根据以下公式计算血浆游离药物分数(unbound fraction in plasma, fu): fu = Cu/Ct×100%。
膜通透和转运实验[10, 11] 在孔径0.4 μm多聚碳酸脂膜的24孔插入式培养皿上以1.0×105 cm-2的密度接种Caco-2细胞, 每2天更换培养液1次, 观察细胞生长情况。培养21~24 d后用细胞电阻仪测量并计算其跨膜电阻值(transepithelial electrical resistance, TEER)。选取TEER值大于400 Ω·cm-2的细胞模型用于膜通透性和转运实验。①分别于细胞单层顶端(AP侧)加入CQM (10 μg·mL-1) 0.2 mL, 底端(BL侧)加入HBSS溶液0.9 mL, 进行AP侧到BL侧的转运实验。②用上述方法进行BL侧到AP侧的转运实验。③研究维拉帕米对各CQM各组分通透性的影响, 先用100 μmol·L-1维拉帕米溶液作用细胞2 h后, 吸弃, 将含100 μmol·L-1维拉帕米和CQM (10 μg·mL-1)用上述方法进行AP侧到BL侧的转运实验。在37 ℃下孵育, 在第0.083、0.5、1和2 h, 迅速从AP侧或BL侧取样100 μL (每个时间点取样后, 均将插入式培养皿转移至新的含等体积HBSS的孔板中, n=4), 分析各组分表观通透系数(Papp)和外排分数(efflux ratio, ER)。2 h时间点取给药侧样品, 计算各侧组分质量总和与加入组分的总量间的比值, 分析各组分的回收率。实验结束后用FD4考察细胞膜完整性, 首先配制0.2、1、2、20和200 μg·mL-1 (分别对应0.1%、0.5%、1%、10%和100%的FD4)浓度的FD4建立标准曲线, 即在AP侧加各浓度的FD4溶液, BL侧加入HBSS, 置于培养箱培养, 1 h后取BL侧液体于酶标仪上检测(激发波长488 nm, 发射波长535 nm), 通过建立的标准曲线计算其通透率。若200 μg·mL-1的FD4通透率小于0.1%, 则可说明膜是相对完整的。
Papp计算公式为Papp=(dQ/dt)/(A·C0)[10], 其中Q是积累转运量, 代表化合物在接收端出现的总量, 单位为μg; dQ/dt是接收端组分的线性浓度变化速率, 单位是μg·s-1; A是插入式培养皿膜表面积, 单位是cm2 (24孔板为0.33 cm2); C0是开始实验时给予的初始浓度, 单位是μg·L-1。ER计算公式为Papp, BL→AP /Papp, AP→BL。
统计学分析 数据处理和绘图软件为Origin Pro 2016 (Ver.b9.3.226, OriginLab Corporation, Northampton, MA 01060, USA), 数据用x± s表示, 两组均数间比较采用独立样本双尾student's t检验, 以P < 0.05有统计学意义, P < 0.01有显著统计学意义。
结果 1 方法学确证 1.1 方法的选择性经不同个体生物基质考察, 本方法待测成分峰形较好, 血浆、脑组织匀浆液及细胞液中的内源性物质、代谢产物不干扰待测成分的检出, 选择性良好。各组分不同生物样品典型的UHPLC色谱图如图 1所示, 青藤碱出峰时间约为3.00 min, 川芎嗪出峰时间约为5.00 min。
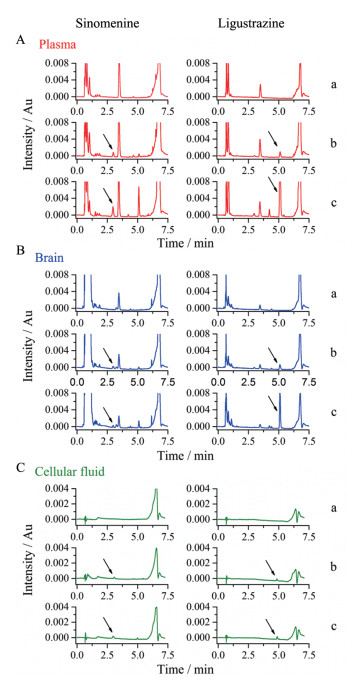
|
Figure 1 Representative UHPLC chromatograms of sinomenine and ligustrazine in plasma (A), brain (B) and cellular fluid (C) samples. a: Blank samples; b: Blank samples spiked with sinomenine (0.10 μg·mL-1 for plasma and brain, 0.05 μg·mL-1 for cellular fluid) and ligustrazine (0.05 μg·mL-1 for plasma and brain, 0.02 μg·mL-1 for cellular fluid); c: Samples obtained 5 min after administration of Chuanxiong Qingfengteng mixture in rats (25 mg·kg-1) and incubation with cells (10 μg·mL-1). The retention time of sinomenine and ligustrazine was 3.00 min and 5.00 min, respectively |
各组分在血浆、脑组织匀浆液及细胞液中典型的标准曲线回归方程、相关系数的平方(r2)和线性范围如表 1所示, 知青藤碱和川芎嗪在相应浓度范围内r2均大于0.99, 线性关系良好。经S/N=10及准确度、精密度结果判定各成分LOQ, 血浆和脑组织中LOQ青藤碱为0.10 μg·mL-1、川芎嗪为0.05 μg·mL-1, 细胞液中LOQ青藤碱为0.05 μg·mL-1、川芎嗪为0.02 μg·mL-1。
| Table 1 Calibration curve parameters of sinomenine and ligustrazine in rat plasma, brain and cellular fluid samples |
提取回收率LQC、MQC和HQC样品在69.88%~99.87%内; 准确度结果LOQ样品和LQC样品在-12.34%~23.05%内, MQC和HQC在-11.94%~9.26%内; 日内和日间精密度结果均在10%以内, 表明方法准确、精密, 符合有关生物样品分析方法验证的要求[12]。
1.4 稳定性LQC、MQC和HQC样品中青藤碱和川芎嗪在室温放置4 h准确度为-12.8%~12.3%, 经过3次冻融准确度为-14.3%~0.2%, 在-80 ℃条件下储存6个月准确度为-12.8%~15.6%, 处理后的样品在进样室内放置24 h准确度为-13.9%~5.3%, 说明在这些条件下样品稳定, 符合测定要求。
由于大鼠脑脊液和小鼠血浆、脑组织匀浆液与上述考察的样品基质有所不同, 因此对该方法进行了部分方法学验证, 结果本方法也满足大鼠脑脊液和小鼠血浆、脑组织匀浆液等生物用样品中CQM青藤碱和川芎嗪定量分析。
2 脑通透性单次给予CQM后, 青藤碱和川芎嗪能快速分布到脑中。具体表现为大鼠静脉注射CQM后5 min (0.083 h)即可在脑脊液、脑组织匀浆液中检测出青藤碱和川芎嗪(图 2)。CQM不同组分的体内分布程度不同, 如给药剂量同为25 mg·kg-1, 但血浆中达峰浓度川芎嗪(16.27 μg·mL-1)为青藤碱(3.83 μg·mL-1)的4倍多, 脑脊液和脑组织中达峰浓度川芎嗪为青藤碱的10倍以上, C/P ratio、B/P ratio各点的均值及AUC、Kp结果川芎嗪也均高于青藤碱(图 3和表 2)。CQM同一组分向脑脊液和脑组织分布的动力学过程不同, 见图 2和3, 青藤碱浓度在脑脊液中0.083 h即是峰值, C/P ratio在0.5 h点最高(36.59%), 在脑组织中1 h达峰, B/P ratio则持续性增加, 从6.61% (0.083 h)增至17.30% (2 h); 川芎嗪浓度在脑脊液和脑组织中均是0.083 h最高, C/P ratio在0.5 h最高(57.42%), B/P ratio持续性增加, 从19.14% (1 h)增至37.53% (2 h)。CQM各组分脑组织与脑脊液的浓度具有强烈的相关性(Pearson's R > 0.86), 脑脊液是脑组织浓度的2~3倍(P < 0.001), 结果见图 4。以上表明了青藤碱和川芎嗪均能快速通过血-脑脊液屏障和血-脑组织屏障, BBB通透性良好, 但向脑脊液分布的能力更强; 另外, 川芎嗪的脑通透性高于青藤碱。
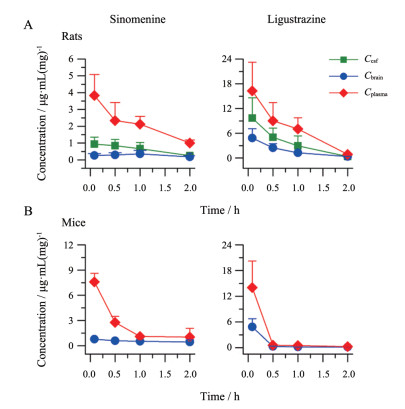
|
Figure 2 Mean concentration-time profiles of cerebrospinal fluid (Ccsf, μg·mL-1), brain (Cbrain, μg·mg-1) and plasma (Cplasma, μg·mL-1) of sinomenine and ligustrazine after single intravenous administration of Chuanxiong Qingfengteng mixture at the dosage of 25 mg·kg-1 in rats (A) and mice (B). n = 3, x± s |

|
Figure 3 Mean C/P and B/P ratio profiles of sinomenine and ligustrazine after single intravenous administration of Chuanxiong Qingfengteng mixture at the dosage of 25 mg·kg-1 in rats. The maximum B/P ratio of sinomenine and ligustrazine was 17.30% and 37.53%, respectively. n = 3, x± s |
| Table 2 AUC, Kp and fu results of sinomenine and ligustrazine after single intravenous administration of Chuanxiong Qingfengteng mixture at the dosage of 25 mg·kg-1 in rats. n = 3, x± s |
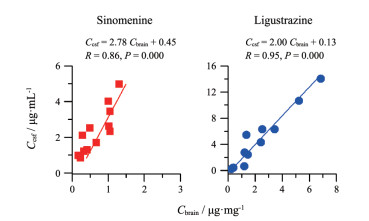
|
Figure 4 Correlation of the concentrations between cerebrospinal fluid (Ccsf) and brain (Cbrain) for sinomenine and ligustrazine after single intravenous administration of Chuanxiong Qingfengteng mixture at the dosage of 25 mg·kg-1 in rats. Ccsf and Cbrain results were strongly correlated (Pearson's R > 0.86, P < 0.001). n = 12 |
NSB青藤碱约为3.03%, 川芎嗪约为8.24%, 均小于10%, 因此本实验选用的超滤装置可以用于青藤碱和川芎嗪血浆蛋白结合率的研究。结果见表 2, 青藤碱的血浆fu为78.92% (浓度范围: 0.61~4.98 μg·mL-1), 川芎嗪的血浆fu为34.07% (浓度范围: 0.08~22.41 μg·mL-1), 并且蛋白结合率在各自浓度范围内无明显依赖性。
4 膜通透和转运CQM中青藤碱和川芎嗪在Caco-2细胞单层膜上Papp分别为1.30×10-6和3.64×10-6 cm·s-1 (表 3), 若以Papp < 0.2×10-6、0.2×10-6~2.8×10-6和 > 2.8×10-6 cm·s-1作为膜通透性低、中和高的评价标准[11], 则青藤碱属于中通透性化合物, 而川芎嗪属于高通透性化合物, 川芎嗪膜通透性高于青藤碱, 这和动物实验脑通透结果是一致的。
| Table 3 Apparent permeability for sinomenine and ligustrazine of Chuanxiong Qingfengteng mixture (CQM) in Caco-2 cell monolayers. **P < 0.01 vs CQM group. n = 4, x± s |
在Caco-2细胞单层膜上双向转运时, 青藤碱和川芎嗪的ER在1以内; 和P-gp抑制剂维拉帕米共同进行转运实验, 青藤碱和川芎嗪的Papp没有增加, 以上结果可以说明CQM各组分的跨膜转运可能不受P-gp等外排转运体的影响。合用P-gp抑制剂, 川芎嗪的Papp反而降低约15.9% (P < 0.01), 其具体机制有待进一步验证。
在培养皿上各组分的回收率为(95.03~101.1)%, 说明青藤碱和川芎嗪与培养皿半透膜不发生NSB, 并且在Caco-2细胞中未被代谢。实验前选用的细胞模型TEER值均大于400 Ω·cm-2, 实验结束后FD4通透率均小于0.1%, 说明实验前和整个实验过程单层膜是相对完整的。
讨论与结论生物样品中青藤碱和川芎嗪检测方法多有文献说明, 涉及HPLC-UV、HPLC-MS/MS等[13-15], 但青藤碱和川芎嗪两者同时进行定量的方法尚未见报道。本研究发现青藤碱的色谱行为具有明显的溶剂效应, 溶剂中含有机相越多其峰形越差, 响应也越低。川芎嗪极易升华, 样品用甲醇沉淀, 然后上清液用氮气吹干, 川芎嗪的回收率低且变异大(提取回收率: 7.31%~14.08%, RSD > 56.84%)。因此, 本研究旨在建立一种简单、快速和稳定的生物样品前处理方法和CQM中青藤碱、川芎嗪同时定量的检测方法。考察不同的蛋白沉淀方式: 1倍甲醇、1倍甲醇(含0.1%甲酸, 样品pH约2.1)及1倍6%高氯酸(样品pH约0.5), 血浆和脑组织样品青藤碱和川芎嗪的提取回收率均在73%以上(RSD < 5.37%), 因此均可作为青藤碱和川芎嗪的蛋白沉淀方法。但考虑到本实验的色谱柱pH耐受范围(pH 1~12)和流动相组成, 最终选择1倍甲醇(0.1%甲酸)作为前处理溶剂进行后期方法学验证。结果表明, 本实验分析方法符合生物样品定量指导原则的要求[12], 可用于实际生物样品中青藤碱(0.11~4.98 μg·mL-1)和川芎嗪(0.02~22.41 μg·mL-1)的同时定量分析, 这为CQM脑通透性研究及后期药代动力学研究提供了方法学依据。
青藤碱或川芎嗪给药后检测脑组织中分布的研究已有报道, 如Liu等[13]研究大鼠口服青藤碱90 mg·kg-1, 0.75 h点B/P ratio高达83.76%; Long等[14]研究大鼠腹腔注射青藤碱30 mg·kg-1, 脑组织中0.25 h达峰, 浓度约为1.23 μg·mL-1, 但Kp仅为1.79%; Liang等[16]研究大鼠静脉注射川芎嗪10 mg·kg-1, 0.25 h后大脑皮层约1.45 μg·g-1, B/P ratio约为20.76%; Xu等[17]研究大鼠腹腔注射川芎嗪40 mg·kg-1, 脑组织Kp约为68.30%, 以上研究表明了青藤碱和川芎嗪可以通过血-脑组织屏障。本研究大鼠和小鼠静脉注射CQM (含青藤碱和川芎嗪均为25 mg·kg-1), 证实青藤碱和川芎嗪能通过血-脑组织屏障和血-脑脊液屏障, 且浓度之间具有强烈的相关性(Pearson's R > 0.86, P < 0.001), 虽然血-脑组织屏障和血-脑脊液屏障存在结构和功能上的差异[18], 但因脑脊液在实验和临床实践中的易获得性, 用脑脊液浓度预测脑组织浓度数据仍具有实际借鉴意义。本研究青藤碱和川芎嗪的B/P ratio、Kp数值等和上述文献的报道不尽相同, 有研究表明青藤碱和川芎嗪能降低Claudin-1、Occludin和ZO-1等紧密连接蛋白的表达[19, 20], 能降低P-gp等多药耐药转运体的表达和活性[21, 22], 另外川芎嗪能提高P-gp和药物代谢酶CYP3A的底物-环孢素A的口服生物利用度[23], 因此CQM中青藤碱和川芎嗪很有可能发生药物-药物相互作用, 进而影响各组分B/P ratio、Kp及体内过程。但CQM药物-药物相互作用是具体在什么部位发生以及具体是影响紧密连接蛋白、药物转运体还是药物代谢酶等的表达或功能, 这都需要后期进一步探讨和验证。
为进一步解释CQM脑通透数据结果, 进行了体内血浆蛋白结合率和体外膜通透性的测定, 显示青藤碱和川芎嗪血浆fu大于30%, 这部分解释了两组分能向脑组织分布的能力; 其中川芎嗪的血浆蛋白结合率比青藤碱高3倍多, 因此可在体内停留更长时间, 解释了川芎嗪AUC较高等结果。体外细胞实验时, 为保证体内外实验的相关性, 参考了CQM体外细胞毒剂量(在1.25~40 μg·mL-1存活率高于90%)及体内暴露水平, 选择10 μg·mL-1的CQM进行膜通透性和跨膜转运实验。结果青藤碱和川芎嗪的膜通透性良好, 并且跨膜转运可能不受P-gp等外排转运体的影响, 因此在脑内可以达到足够的暴露量, 这是CQM能在中枢神经系统发挥止痛疗效的重要依据。另外, 体内川芎嗪的脑通透性参数B/P ratio、Kp比青藤碱大, 虽然fu青藤碱大于川芎嗪, 但Papp川芎嗪高于青藤碱, 所以膜通透性数据是评估脑通透的更关键参数。有文献表明细胞模型类型、药物浓度选择等均会影响对药物跨膜转运方式的评价[24, 25], CQM各组分的跨膜过程是否受摄取转运体的介导还需要进一步证实。
总之, 本研究建立的同时分析血浆、脑组织和细胞液等生物样品中青藤碱和川芎嗪的检测方法, 为CQM脑通透性及后期体内过程研究提供了方法学依据; 在体内证实的CQM各组分能快速通过BBB, 是CQM发挥止痛疗效中枢性机制的重要依据; 另外, 青藤碱和川芎嗪的BBB通透性良好, 体内血浆蛋白结合率适中, 跨膜转运可能不受P-gp等外排转运体的影响, 这是CQM、青藤碱和川芎嗪各自作为中枢神经系统药物研究和开发的重要前提。
| [1] |
Wang DQ, Li LD, Zhao XL, et al. CQM, a compound drug composition composed of Ligusticum chuanxiong and Sinomenium acutum extracts: CN, 103083401A[P]. 2013-05-08.
|
| [2] |
Li P, Zhang MY, Wang DQ, et al. Effects of sinomenine on analgesia and exciting amino acid neurotransmitters in brain of SSNI rat model[J]. Chin Pharmacol Bull (中国药理学通报), 2012, 28: 1365-1369. |
| [3] |
Wang Y, Wang DQ, Cui Y, et al. Analgesic effect of CQM on prosopalgia model rats and its impact on exciting amino acid neurotransmitters[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 3554-3559. |
| [4] |
Gao TL, Shi TS, Wiesenfeld-Hallin Z, et al. Sinomenine facilitates the efficacy of gabapentin or ligustrazine hydrochloride in animal models of neuropathic pain[J]. Eur J Pharmacol, 2019, 854: 101-108. DOI:10.1016/j.ejphar.2019.03.061 |
| [5] |
Zhao XL, Liu Y, Wang Y, et al. Effects of sinomenine on analgesia and contents of substance P in central nervous system of incisional pain rat model[J]. Label Immunoass Clin Med (标记免疫分析与临床), 2013, 20: 422-426. |
| [6] |
Zhang Y, Wang ZG, Ouyang JF, et al. Analgesic effect and mechanism of CQ compound on rats model with tibia metastatic cancer pain[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2017, 23: 119-124. |
| [7] |
Jiang YM, Sun DD, Wang ZG, et al. Analgesic effect and central mechanisms of CQ prescription on cancer invasion induced mirror image pain in model mice[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 739-745. |
| [8] |
Sanchez-Covarrubias L, Slosky LM, Thompson BJ, et al. Transporters at CNS barrier sites: obstacles or opportunities for drug delivery?[J]. Curr Pharm Des, 2014, 20: 1422-1449. DOI:10.2174/13816128113199990463 |
| [9] |
Guo B, Li C, Wang GJ, et al. Rapid and direct measurement of free concentrations of highly protein-bound fluoxetine and its metabolite norfluoxetine in plasma[J]. Rapid Commun Mass Spectrom, 2006, 20: 39-47. DOI:10.1002/rcm.2265 |
| [10] |
Yang XW, Yang XD, Wang Y, et al. Establishment of Caco-2 cell monolayer model and standard operation procedure for assessing intestinal absorption of chemical components of traditional Chinese medicine[J]. J Chin Integr Med (中西医结合学报), 2007, 5: 634-641. DOI:10.3736/jcim20070607 |
| [11] |
Li L, Zhao Y, Du F, et al. Intestinal absorption and presystemic elimination of various chemical constituents present in GBE50 extract, a standardized extract of Ginkgo biloba leaves[J]. Curr Drug Metab, 2012, 13: 494-509. DOI:10.2174/1389200211209050494 |
| [12] |
Chinese Pharmacopoeia Commission. Guiding Principles for Quantitative Analysis of Biological Samples[S]// Chinese Pharmacopoeia (中国药典), 2015ed. Beijing: China Medicine Science and Technology Press, 2015.
|
| [13] |
Liu ZQ, Chan K, Zhou H, et al. The pharmacokinetics and tissue distribution of sinomenine in rats and its protein binding ability in vitro[J]. Life Sci, 2005, 77: 3197-3209. DOI:10.1016/j.lfs.2005.05.054 |
| [14] |
Long LH, Wu PF, Chen XL, et al. HPLC and LC-MS analysis of sinomenine and its application in pharmacokinetic studies in rats[J]. Acta Pharmacol Sin, 2010, 31: 1508-1514. DOI:10.1038/aps.2010.122 |
| [15] |
Zhao XL, Li T, Liu Y, et al. Pharmacokinetic analysis of sinomenine based on automatic blood sampling system and HPLC-QQQ-MS[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2015, 21: 66-70. |
| [16] |
Liang CC, Hong CY, Chen CF, et al. Measurement and pharmacokinetic study of tetramethylpyrazine in rat blood and its regional brain tissue by high-performance liquid chromatography[J]. J Chromatogr B: Biomed Sci Appl, 1999, 724: 303-309. DOI:10.1016/S0378-4347(99)00010-9 |
| [17] |
Xu HY, Tang Z, Wang Q. Brain and blood pharmacokinetics of tetramethylpyrazine hydrochloride after intraperitoneal administration in rats by microdialysis[J]. Chin J Clin Pharm (中国临床药学杂志), 2013, 22: 206-211. |
| [18] |
Pardridge WM. CSF, blood-brain barrier, and brain drug delivery[J]. Expert Opin Drug Deliv, 2016, 13: 963-975. DOI:10.1517/17425247.2016.1171315 |
| [19] |
Li Y, Duan Z, Tian Y, et al. A novel perspective and approach to intestinal octreotide absorption: sinomenine-mediated reversible tight junction opening and its molecular mechanism[J]. Int J Mol Sci, 2013, 14: 12873-12892. DOI:10.3390/ijms140612873 |
| [20] |
Wang Y. Effect of Ligustrazine on the Blood-brain Barrier Model Permeability in vitro and Part of the Mechanism (川芎嗪对体外血脑屏障模型通透性的影响及部分作用机制)[D]. Heifei: Anhui University of Chinese Medicine, 2013.
|
| [21] |
Chen Y, Zhang L, Lu X, et al. Sinomenine reverses multidrug resistance in bladder cancer cells via P-glycoprotein-dependent and independent manners[J]. Pharmazie, 2014, 69: 48-54. |
| [22] |
Wang XB, Wang SS, Zhang QF, et al. Inhibition of tetramethylpyrazine on P-gp, MRP2, MRP3 and MRP5 in multidrug resistant human hepatocellular carcinoma cells[J]. Oncol Rep, 2010, 23: 211-215. |
| [23] |
Liu XL, Tang J, Song J, et al. The effect of tetramethylpyrazine on the pharmacokinetics of intragastrically administered cyclosporine A in rats[J]. Acta Pharm Sin (药学学报), 2006, 41: 882-887. |
| [24] |
Ge JD, Chen M, Song BW. Absorption mechanism of tetramethylpyrazine hydrochloride across PAMPA and MDCK monolayers[J]. J Zhejiang Univ Technol (浙江工业大学学报), 2010, 38: 616-619. |
| [25] |
Li XY. Study on Absorption Mechanism and Pharmacokinetics of Sinomenine (青藤碱的肠吸收特性及药动学研究)[D]. Shenyang: China Medical University, 2010.
|
 2019, Vol. 54
2019, Vol. 54


