2. 山西大学化学化工学院, 山西 太原 030006;
3. 中国医学科学院、北京协和医学院药物研究所, 北京 100050
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
中药配伍方剂是中医临床用药的重要形式, 方剂的最小元素为单味中药, 其次为药对。药对又称对药, 是医家在基于药性和长期的遣方用药中, 逐渐积累经验所得来的应用形式。药对之间可以相互促进增强药效, 或者相互制约以减弱毒性, 相反相成, 有着组成结构简单、配伍特点取效明确等特点, 具有很大的研究价值。其中, 柴胡-白芍药对是临床常用药对, 柴胡疏肝气, 白芍养肝血, 二者以白芍之酸敛, 制柴胡之辛散; 用柴胡之辛散, 又佐白芍之酸敛, 相互依赖、相互促进, 互制其短而展其长, 是疏肝养肝, 体用兼顾之最佳配伍。早在清初, 著名医家陈士铎便将柴胡-白芍药对灵活运用于各类疾病, 如用于治疗心痛之极的“救痛安心汤”, 以柴胡白芍解肝气之郁, 炒栀子、贯仲泄肝火之暴, 一剂而痛定, 再剂则痊愈。再如用于治疗瘕的“平肝消瘕汤”, 以柴胡白芍舒肝中之邪, 助脾胃之气, 则土气自安, 有形化为无形[1]。
目前国内外对柴胡、白芍的研究较多, 但大多集中在体外化学成分、药理作用等方面。研究表明, 白芍中主要化学成分为单萜及单萜苷类化合物, 其中芍药总苷为目前公认的活性物质, 具有抗炎、镇痛、抗菌、抗抑郁等活性[2]; 柴胡中以皂苷类化合物居多, 具有解热镇痛、镇定催眠、抗病毒等多种药理活性[3], 但对于二者的体内吸收及代谢情况目前研究较少, 对于白芍, 虽已有一定的研究, 但多集中于白芍中以芍药苷为代表的单萜苷类物质, 关于白芍中其他多酚及酚酸类物质的体内情况则研究较少; 对于柴胡, 则更多的是关注其药理活性以及体内某些成分的药代动力学。缺乏对柴胡-白芍药对入血成分及代谢产物的整体分析, 而药对配伍是通过协同作用发挥药效, 因此有必要对入血成分进行全面研究, 以明确药效成分, 阐明药效物质基础[4]。
由于中药成分多且复杂, 研究其药效物质基础必须以系统论和中药整体观为基础[5], 而中药血清药物化学则是以药物服用后的血中移行成分为分析目标, 阐明药物在体内的吸收成分种类, 代谢情况等信息。有助于快速、准确地对中药药效物质进行分析鉴定, 已成为研究中药药效物质基础的新方法之一[6]。本课题组前期建立了柴胡-白芍超高效液相色谱-串联质谱(UPLC-MS/MS)的化学成分分析方法, 鉴定了柴胡-白芍药对提取液的体外化学成分[7], 在此基础上, 本实验利用UPLC-QE-Orbitrap-MS技术进一步分析柴胡-白芍药对的血中移行成分及相关代谢产物, 通过比较柴胡-白芍药对提取液、给药后的含药血清以及空白血清, 初步鉴定19个入血原形成分以及39个相关代谢产物, 为进一步阐明柴胡-白芍药对的体内药效物质基础及后续配伍规律研究提供依据。
材料与方法仪器及试剂 超高效液相色谱与质谱联用仪(Thermo Scientific Q Exactive LC-MS), 美国Thermo公司; 色谱柱: Acquity UPLC HSS T3 (100 mm×2.1 mm, 1.8 μm), 十八烷基键合硅胶为填充剂, 美国Waters公司; KQ5200E超声波清洗器, 昆山市超声仪器有限公司; ZX-LGJ-18冷冻干燥机, 上海知信仪器技术有限公司; RV 10旋转蒸发仪, 德国IKA公司; 色谱乙腈、色谱甲酸(Fisher Scientific); 纯净水(杭州娃哈哈集团有限公司)。数据分析采用Xcalibur3.2软件处理系统(美国Thermo公司); Compound Discover 2.0 (美国Thermo Fisher公司)。
药物 柴胡(批号: 180801, 产地内蒙古)、白芍(批号: 181102, 产地安徽)均由山西和仁堂中药饮片有限公司提供, 经山西大学秦雪梅教授鉴定为正品。
动物 健康雄性SPF级SD大鼠(180 ± 20) g购于北京维通利华实验动物技术有限公司, 许可证号: SCXK (京) 2016-0006。实验期间饲养环境温度为(25 ± 1) ℃, 湿度为(55 ± 5) %, 12 h明暗交替光照, 动物保持自由饮水和进食。实验前适应性饲养1周。动物实验获得山西大学伦理委员会的批准。
药物制备 取柴胡-白芍药对(1:1)用10倍量70%乙醇浸泡1 h后回流提取1次, 倒出提取液, 再加10倍量70%乙醇提取, 每次2 h。合并提取液, 静置后过滤, 将滤液经旋转蒸发仪浓缩, 冷冻干燥, 干燥后称量所得粉末质量, 计算产率(柴胡-白芍药对提取物浸膏得率为11.2%), 4 ℃冰箱保存备用。药物使用之前用蒸馏水配制成1.008 g·mL-1 (相当于生药量90 g·kg-1)的大鼠给药药液, 超声溶解即得。
血清样本的制备 取SD大鼠16只, 随机分成空白组与给药组, 每组8只。实验前禁食一整夜但不禁水, 实验时给实验组灌胃柴胡-白芍提取液, 早晚各一次, 连续给药3天。同时, 空白组以同样的方式给同等体积的蒸馏水。最后一次给药后, 分别在15、30、45、60 min和3 h进行眼眶取血收集血清样本, 每个时间点采集1 mL, 静置30 min, 然后将采集到的血样在4 ℃、3 500 r·min-1条件下离心15 min, 收集上清, 分装, 并立即冻存在-80 ℃冰箱备用。空白血浆收集方式相同。
取大鼠空白血清及给药血清样品于冰水混合物中解冻, 各个时间点各取200 μL血清样品并混合, 得到1 000 μL混合血清样本, 加入3倍量甲醇, 涡旋60 s混匀, 在4 ℃、13 000 r·min-1条件下离心15 min, 移取上清液至另一EP管中, 室温下氮气吹干, 残渣用甲醇100 μL复溶, 涡旋60 s后, 在4 ℃、13 000 r·min-1条件下离心15 min, 取上清液待测。
色谱条件 ACQUITY UPLC HSS T3 (100 mm×2.1 mm, 1.8 μm)色谱柱; 柱温40 ℃; 流动相为0.1%的甲酸水溶液(A)-乙腈(B); 梯度洗脱程序: 0~8 min, 5%~10% B; 8~18 min, 10%~17% B; 18~26 min, 17%~20% B; 26~36 min, 20%~60% B; 36~40 min, 60%~100% B; 40~43 min, 100% B; 43~46 min, 100%~5% B; 46~50 min, 5% B。流速为0.3 mL·min-1; 进样量为2 μL。
质谱条件 采用电喷雾离子源正负离子检测的电离模式, 雾化气体为高纯度氮气(N2), 碰撞气体为高纯度氦气(He)。采用全扫描和二级质谱扫描, 质量扫描范围: 100~1 500 Da, 毛细管电压正负离子模式下分别为3.5、2.5 kV, 碰撞能量(CE) 50~80 V, 脱溶剂气体温度正负离子模式下300 ℃, 毛细管温度320 ℃, 鞘气流: 241 kPa, 辅助气流: 69 kPa。
数据处理方法 将柴胡-白芍药对提取液、含药血清、空白血清的UPLC-MS/MS图谱及数据导入Compound Discover 2.0 (美国Thermo Fisher公司)软件进行前处理, 包括峰提取、峰匹配, 将空白血清作为对照, 找出给药组存在而空白血清不存在的成分, 利用LC-MS/MS技术中的离子峰信息, 包括保留时间、质荷比、二级碎片等, 并结合相关文献数据对血中移行成分进行指认。将鉴定得到的血中移行成分化合物结构式(mol格式)导入Compound Discover 2.0中, 在体内代谢模式下分别计算每个化合物的所有Ⅰ相和Ⅱ相代谢产物, 得到化合物的保留时间、质荷比、反应类型、匹配度等一系列信息, 结合软件分析结果以及参考文献, 用给药血清的质谱数据进行验证, 推测原形成分可能的代谢产物。
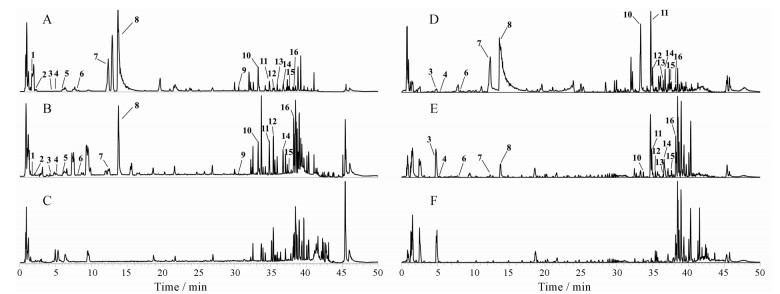
结果 1 入血成分分析根据数据处理方法项下的分析方法, 结合对照品以及参考文献, 对大鼠灌胃柴胡-白芍药对后多个采血时间点的血清样本进行分析, 共鉴定了55个血中移行成分, 其中16个为原形成分, 39个为原形成分的代谢产物, 鉴定结果分别见表 1与表 2; 其基峰离子流色谱图见图 1。
| Table 1 Analysis results for migrating constituents of drug-couple absorbed into blood. RB: Radix Bupleuri; RPA: Radix Paeoniae Alba |
| Table 2 Analysis results of metabolites in vivo. SSa: Saikosaponin A; SSb2: Saikosaponin B2; SSd: Saikosaponin D; SSc: Saikosaponin C |
|
Figure 1 Base peak current chromatogram in positive (A-C) and negative (D-F) ion mode. A, C: Drug-couple; B, E: Serum after administration; C, F: Blank serum; Peak 1-16 is the prototype of the drug into the blood, corresponding to the serial number in Table 1 |
化合物2 保留时间为1.94 min, 在负离子模式下, 一级全扫描质谱分析显示存在加和离子峰m/z 405.140 6 [M+HCOO]-以及准分子离子峰m/z 359.134 8 [M-H]-。二级质谱扫描分析显示, 其存在碎片离子m/z 197.081 7和m/z 179.070 9, 相比于分子离子峰分别丢失了162 Da和180 Da, 可知m/z 197.081 7是由于分子离子丢失了一分子C6H10O5形成的碎片; m/z 179.070 9是由于分子离子丢失一分子C6H10O5以及一分子H2O而形成的碎片。进一步结合文献推测化合物2为glucopyranosyl-paeonisuffrone[8]。
化合物5 负离子模式下给出准分子离子峰m/z 183.030 6 [M-H]-, 保留时间为10.01 min, 失去一分子甲基裂解成碎片m/z 168.005 0 [M-CH3-H]-, 碎片m/z 168.005 0继续裂解, 丢失一个CO后形成m/z 140.015 5[M-CH3-CO-H]-, 结合文献将化合物5鉴定为没食子酸甲酯[9]。
化合物6 保留时间为8.11 min, 与氧化芍药苷对照品的保留时间(tR = 8.18 min)相近, 同时特征碎片离子m/z 333.098 3、165.055 1、137.023 7与氧化芍药苷对照品的碎片离子m/z 333.098 0、165.055 3、137.023 7基本一致, 因此, 将化合物6鉴定为氧化芍药苷。
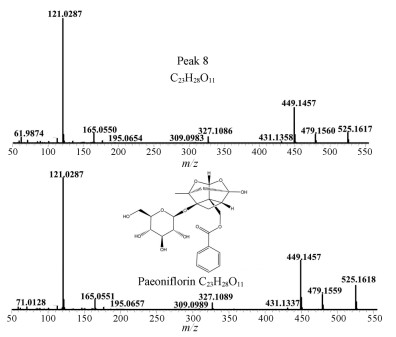
化合物7和8 负离子模式下显示化合物7、化合物8均产生加和离子峰m/z 525.161 7 [M+HCOO]-以及准分子离子峰m/z 479.156 0 [M-H]-, 可知其分子式为C23H28O11, 保留时间分别为12.26与13.81 min, 通过对其二级质谱碎片离子峰进行分析, 存在分子离子脱去一分子甲醛形成的碎片离子m/z 449.145 6 [M-CH2O-H]-以及其继续脱去一分子水形成的m/z 431.137 3 [M-CH2O-H2O-H]-; 存在苯甲酰特征离子峰m/z 121.028 7、蒎烷骨架m/z 165.055 0, 与芍药苷及芍药内酯苷对照品二级碎片基本一致。故通过保留时间与对照品比对, 将化合物7和8分别鉴定为芍药内酯苷与芍药苷, 结果见图 2。
|
Figure 2 MS spectra of peak 8 and paeoniflorin standard |
化合物9 负离子模式下在tR为30.51 min时, 显示准分子离子峰m/z 329.030 6 [M-H]-, 可知其分子式为C16H10O8。二级质谱图显示, 准分子离子峰分别失去一分子甲基与两分子甲基形成碎片离子m/z 314.007 0 [M-CH3-H]-、m/z 298.983 6 [M-2CH3-H]-。通过与参考文献对比, 确定化合物9为二甲基鞣花酸[10]。
化合物10 保留时间为33.27 min, 负离子模式下给出加和离子峰m/z 971.521 8 [M+HCOO]-及准分子离子峰m/z 925.516 4 [M-H]-, 二级质谱图可见中性丢失一分子脱氧六碳糖(146 Da)产生的碎片离子m/z 779.457 2 [M-146-H]-, 该脱氧六碳糖可能为岩藻糖, 以及其进一步丢失一分子六碳糖(162 Da)产生的碎片离子m/z 617.406 5 [M-146-162-H]-, 该六碳糖可能为葡萄糖, 结合文献推测化合物10为柴胡皂苷c[11]。
化合物11、12与14 负离子模式下显示, 在保留时间为34.83、36.73和35.42 min时, 存在3个准分子离子峰均为m/z 779.464 5 [M-H]-的离子峰, 推测三者为同分异构体, 且分子式为C42H68O13, 进一步分析二级碎片信息发现, 该分子离子存在碎片离子m/z 617.405 9、439.323 8, 相对于分子离子分别丢失了162 Da与340 Da, 是由于分子离子先丢失一分子六碳糖形成m/z 617.405 9, 再丢失一分子脱氧六碳糖(146 Da)和一分子CH3OH (32 Da)形成m/z 439.323 8。与柴胡皂苷a、柴胡皂苷d以及柴胡皂苷b2对照品二级碎片基本吻合, 进一步通过保留时间与对照品比对, 将化合物11确定为柴胡皂苷a, 化合物14确定为柴胡皂苷d, 化合物12确定为柴胡皂苷b2。
化合物13、15与16 化合物13保留时间为36.30 min, 负离子模式下一级质谱图显示m/z 867.473 0和m/z 821.470 2, 二者之间丢失了46 Da, 故m/z 821.470 2 [M-H]-为准分子离子峰, m/z 867.473 0[M+HCOO]-为加和离子峰。二级质谱数据显示存在碎片离子m/z 779.459 6、617.406 1、439.321 8, 这与柴胡皂苷类物质的碎片离子信息基本吻合, 而化合物13的准分子离子峰m/z 821.470 2与m/z 779.459 6之间丢失了42 Da, 即丢失一分子C2H2O, 推测化合物13为柴胡皂苷的乙酰化产物。化合物15与化合物16在保留时间37.62和38.23 min时, 与化合物13有着同样的裂解规律。故根据保留时间与文献信息[12], 将化合物13、化合物15与化合物16鉴定为乙酰化柴胡皂苷a、乙酰化柴胡皂苷b2以及乙酰化柴胡皂苷d。但具体结合位点无法确定。
其余化合物1、3与4, 结合碎片离子信息以及文献[13]报道分别鉴定为去苯甲酰芍药苷、glucopyranosyl-lactinolide以及牡丹皮苷F。
1.2 代谢产物分析通过对比柴胡-白芍药对提取液与含药血清以及空白血清的总离子流图, 发现有39个化合物峰仅出现在含药血清的离子流图中, 推测这几种化合物可能为柴胡-白芍药对中原形成分在体内的代谢产物, 并对其进行了指认分析, 现以其中部分代谢物为例说明指认过程。
代谢物M9 保留时间为5.39 min, 在负离子模式下, 产生离子峰m/z 183.029 3、m/z 168.005 9以及m/z 124.018 8, 其中准分子离子峰m/z 183.029 3 [M-H]-相比于碎片m/z 168.005 9 [M-CH3-H]-丢失了15 Da, 提示丢失了一个CH3, 推测该化合物是某个原形成分甲基化的产物, 继续分析二级碎片发现存在特征离子峰m/z 124.018 8, 该离子峰是没食子酸脱羧的特征产物, 这与文献报道的没食子酸甲基化产物质谱数据基本吻合[14], 故根据二级碎片与文献信息将代谢物M9鉴定为甲基没食子酸, 但无法确定甲基化准确的代谢位点。
代谢物M10 保留时间为9.06 min, 负离子模式下显示准分子离子峰m/z 359.135 3 [M-H]-, 其碎片离子有m/z 183.029 0、m/z 168.006 8以及m/z 124.015 8, 这与化合物甲基没食子酸一致, 而准分子离子m/z 359.135 3相比碎片离子m/z 183.029 0增加了176 Da, 提示增加了一个C6H8O6, 发生了葡萄糖醛酸化反应, 故将代谢物M10确定为甲基没食子酸葡萄糖醛酸化产物。
代谢物M11 保留时间为4.07 min, 负离子模式下显示准分子离子峰m/z 262.986 8 [M-H]-, 代谢物M11也存在m/z 183.028 0、m/z 168.005 8以及m/z 124.015 6的特征离子, 准分子离子m/z 262.986 8相比碎片m/z 183.028 0增加了80 Da, 提示发生了硫酸酯化反应, 故将代谢物M11确定为甲基没食子酸硫酸酯化产物。
代谢物M17 保留时间为18.19 min, 负离子模式给出其准分子离子峰m/z 197.081 5 [M-H]-, 二级质谱扫描显示, 其主要碎片离子m/z 153.091 4、m/z 138.071 0是准分子离子分别失去一分子CO2、CO2+CH3后形成的碎片, 通过以上信息及与文献比对[15], 初步确定代谢物M17为芍药苷代谢素Ⅰ。
代谢物M19 保留时间为10.41 min, 负离子模式下显示准分子离子峰为373.077 6 [M-H]-, 失去一分子葡萄糖醛酸裂解成碎片m/z 197.075 1 [M-C6H8O6-H]-, 碎片离子继续裂解形成碎片m/z 153.093 3、m/z 138.074 0, 这与芍药苷代谢素Ⅰ的碎片离子吻合, 故将代谢物M19确定为芍药苷代谢素Ⅰ葡萄糖醛酸化产物。
代谢物M22、M23与M24 代谢物M22保留时间为34.29 min, 一级质谱数据显示负离子模式下存在m/z 663.412 5和m/z 617.406 4, 二者之间丢失了46 Da, 故m/z 617.406 4 [M-H]-为准分子离子峰, m/z 663.412 5 [M+HCOO]-为加和离子峰。m/z 617.406 4 [M-H]-在柴胡皂苷a、柴胡皂苷d、柴胡皂苷b2的碎片离子中均有出现, 是柴胡皂苷丢失一分子六碳糖产生的碎片。进一步分析准分子离子峰的二级碎片信息, m/z 439.323 3是准分子离子丢失一分子脱氧六碳糖(146 Da)与一分子CH3OH (32 Da)形成的。代谢物M23与M24, 在保留时间35.84及38.16 min时也表现相同的裂解规律, 故推测其为柴胡皂苷丢失一分子糖的次级苷元。有文献[16]表明, 当柴胡皂苷的同分异构体(例如SSa、SSd、SSb2)发生相同的代谢反应时, 代谢产物的极性顺序一般不发生变化, 所以根据母体化合物的出峰顺序将代谢物M22、M23与M24分别鉴定为柴胡次皂苷F、柴胡次皂苷D与柴胡次皂苷G。
代谢物M26、M27与M28 代谢物M26保留时间为30.03 min, 一级质谱图数据显示, 正离子模式下存在m/z 455.315 2 [M-H2O+H]+离子, 负离子模式下检测到m/z 517.323 0 [M-HCOO]-离子, 故分子式确定为C30H48O4。进一步分析二级质谱发现, 正离子模式存在碎片离子为m/z 437.305 3、419.294 2、425.201 5, 这些碎片离子被鉴定为[M-2H2O+H]+、[M-3H2O+H]+、[M-H2O-CH2O+H]+; 同时负离子二级质谱发现, 存在m/z 439.323 3的离子峰, 这与上述柴胡次皂苷的碎片离子相吻合, 结合正负离子质谱数据, 初步推测代谢物M26为某一柴胡苷元。代谢物M27与M28在保留时间33.16和36.52 min时也表现出相同的裂解规律, 故根据保留时间将代谢物M26、M27与M28鉴定为柴胡苷元F、柴胡苷元D和柴胡苷元G。
讨论本实验通过建立UPLC-MS/MS分析方法, 对大鼠灌胃柴胡-白芍药对提取物后血中移行成分进行分析。在大鼠给药血清中, 共指认出55个入血成分, 其中16个原形成分, 39个代谢成分。代谢反应包括Ⅰ相代谢(氧化、还原、开环)和Ⅱ相代谢(甲基化、脱羟基、脱羧、葡萄糖醛酸化、硫酸酯化), 其中主要发生Ⅱ相代谢。
本实验考察了15、30、45、60 min和3 h五个采血时间点, 对不同时间点的血清样本质谱数据进行分析发现, 不同的入血成分会出现在不同采血时间点样本中, 例如柴胡中的SSa与SSd只在15与30 min的取血点可以检测到, 有文献也报道了SSa与SSd在体内30 min即可转化完全[17]; 白芍中glucopyranosyl-paeonisuffrone只在30 min以及之后的取血点可以检测到; 芍药苷虽然在各个取血时间点均可检测到, 但在15 min取血点时含量最多。所以为了更多的表征药对入血后的血中移行成分, 同时也为了保证检测的全面性与完整性, 选择将不同时间点的血清样本混合进行分析。本实验还比较了甲醇沉淀法、乙腈沉淀法两种血清处理方法, 通过比较不同处理方法的图谱数据, 包括峰强度、峰数目以及峰面积等信息, 发现甲醇沉淀法处理得到的血中移行成分数目较多, 内源性杂志干扰较少, 故选择甲醇沉淀处理血清样本。
本实验初步探究了柴胡-白芍药对的入血成分, 在所找到的39个代谢产物中, 8个是以白芍中儿茶素为母体代谢而来; 8个是以白芍中没食子酸为母体代谢而来; 5个是以白芍中芍药苷类物质为母体代谢而来, 18个是以柴胡中皂苷类物质为母体代谢而来。结果表明白芍中单萜苷类、酚酸类以及多酚类; 柴胡中柴胡皂苷类及其代谢产物是药对入血的主要成分。现代药理研究表明, 柴胡-白芍药对具有抗抑郁、抗惊厥、镇痛、抗炎等多种药理活性[18], 没食子酸有抗炎、抗氧化、保护心血管等作用[19]; 芍药苷等单萜类化合物具有镇痛、抗炎、免疫调节等作用[20]; 儿茶素作为多酚类物质, 已有明确报道在抗菌、抗氧化、预防心血管疾病方面具有显著生物活性[21]; 以柴胡皂苷a、柴胡皂苷d为代表的柴胡皂苷类化合物具有抗病毒、抗肿瘤、抗炎等作用[22]。柴胡-白芍作为疏肝解郁、调畅情志的经典药对, 在治疗抑郁症方面具有广阔的前景。但其配伍规律的科学内涵目前尚不明确, 本实验从血清药物化学的角度出发, 在化学层面上对柴胡-白芍药对的药效物质基础进行了研究, 为进一步的药对配伍规律研究提供了一定的借鉴与依据。
| [1] |
Sun L. The Literature Research on Differentiation Memoir (《辨证录》文献研究)[D]. Beijing: China Academy of Chinese Medical Sciences, 2018.
|
| [2] |
Jin YS, Chen MY, Tao J. Advances in studies on chemical constituents and pharmacological effects of Paeonia lactiflora Pall[J]. Chin Pharmacol Toxicol (中国药理学与毒理学), 2013, 27: 745-750. |
| [3] |
Xin G, Zhao XT, Huang XW. Research progress on chemical constituents and pharmacological effects of Bupleurum[J]. Jilin J Tradit Chin Med (吉林中医药), 2018, 38: 1196-1198. |
| [4] |
Wang J, Han YQ, Wei LB, et al. UPLC-Q-TOF/MS analysis on transitional constituents of before and after combination Psoralea corylifolia-Myristica fragrans absorbed into plasma[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 5264-5270. |
| [5] |
Chen M. Study on Constituents Absorbed into Blood after Oral Administration of Shao-yao Gan-cao Tang (芍药甘草汤入血成分的研究)[D]. Nanjing: Nanjing University of Chinese Medicine, 2010.
|
| [6] |
Wei S. TCM Serum Pharmacochemistry-based Analysis of the Effective Components of Fangjihuangqi Tang (基于中药血清药物化学方法的防己黄芪汤药效物质基础研究)[D]. Shanxi: Shanxi University of Traditional Chinese Medicine, 2017.
|
| [7] |
He J, Gao XX, Tian JS, et al. Changes of chemical composition of Bupleuri Radix-Paeoniae Radix Alba herb pair before and after compatibility by UPLC-MS background subtraction and metabonomics[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 1779-1788. |
| [8] |
Chen ZW, Tong L, Li SM, et al. Identification of metabolites of Radix Paeoniae Alba extract in rat bile, plasma and urine by ultra-performance liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. Pharm Anal, 2014, 4: 14-25. DOI:10.1016/j.jpha.2013.06.004 |
| [9] |
Zhao TX, Cao D, Mao WL, et al. Analysis of chemical constituents of different polarity fractions from Liuwei Dihuang Pills by HPLC-QTOF-MS[J]. Tradit Chin Drugs Res Clin Pharmacol (中药新药与临床药理), 2018, 29: 489-496. |
| [10] |
Yang LM, Yang LJ, Jia P, et al. HPLC-Q-TOF-MS/MS-based analysis of chemical constituents in Choerospondiatis fructus[J]. Acad J Second Mil Med Univ (第二军医大学学报), 2016, 37: 159-166. |
| [11] |
Xu L, Tian JX, Song R, et al. LC-MS/MS determination and comparison of saikosaponin a, b2, c, d in crude and processed Radix Bupleuri by vinegar[J]. J China Pharm Univ (中国药科大学学报), 2012, 43: 334-340. |
| [12] |
Qiao YR, Zhang F, Fang Y, et al. LC-MS analysis of saikosaponins in rat lung tissues after oral administration of Bupleurum saikosaponin extract[J]. J Shanxi Med Univ (山西医科大学学报), 2016, 47: 264-269. |
| [13] |
Xu W, Huang M, Li H, et al. Chemical profiling and quantification of Gua-Lou-Gui-Zhi decoction by high performance liquid chromatography/quadrupole-time-of-flight mass spectrometry and ultra-performance liquid chromatography/triple quadrupole mass spectrometry[J]. Chromatography B, 2015, 986-987: 69-84. DOI:10.1016/j.jchromb.2015.02.002 |
| [14] |
Yong P, Liu Y, Lv LY, et al. Rapid identification on chemical compounds in roots of Rheum nobile based on UPLC-ESI-HRMSn[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 1066-1074. |
| [15] |
Xiang H, Zhang L, Song J, et al. The profiling and identification of the absorbed constituents and metabolites of Guizhi decoction in rat plasma and urine by rapid resolution liquid chromatography combined with quadrupole-time-of-flight mass spectrometry[J]. Int J Mol Sci, 2016, 17: 1409. DOI:10.3390/ijms17091409 |
| [16] |
Lu LL, Shu Y, Qian DW, et al. Identification of the metabolites of Sinisan extract in rat plasma, urine, feces and bile after intragastric administration[J]. Acta Pharm Sin (药学学报), 2011, 46: 1374-1379. |
| [17] |
Shimizu K, Amagaya S, Ogihara Y. Structural transformation of saikosaponins by gastric juice and intestinal flora[J]. Pharmacobio-dynamics, 1985, 8: 718-725. DOI:10.1248/bpb1978.8.718 |
| [18] |
Mu XY, Guo YH, Sun WJ, et al. Effect of Radix Bupleuri combined with Radix Paeoniae Alba in treatment of PMDD liver Qi stagnation[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 192-199. |
| [19] |
Gao Y, Li H, Wang SW, et al. Research progress of pharmacological action and pharmacokinetics of gallic acid[J]. Northwest Pharm J (西北药学杂志), 2014, 29: 435-438. |
| [20] |
Jiang WJ, Wang Q, Li XN, et al. Advances in pharmacological effects and quality control methods of total glucosides of paeony[J]. J Hebei Med Univ (河北医科大学学报), 2006, 27: 500-502. |
| [21] |
Zhou LL, Gao Y, Niu ZH, et al. Pharmacological effects of catechins in tea and its research progress[J]. Liaoning Chen Ind (辽宁化工), 2018, 47: 316-318+363. |
| [22] |
Ye XP, Song CQ. Advance in pharmacological research of saikosaponin[J]. Chin Tradit Herb Drugs (中草药), 2004, 35: 117-119. |
 2019, Vol. 54
2019, Vol. 54


