慢性肾病(chronic kidney disease, CKD)已成为严重影响公众健康生活的重要卫生问题, 在我国, 每10人中就有1人患有CKD[1]。健康的肾脏能够排出机体内大量有机物质, 然而对于肾功能不断衰退的CKD患者, 某些物质会在体循环内不断聚积, 这些物质也称为尿毒素[2]。随着对CKD认知的不断深入, 尿毒素的潴留已经被认为是伴随CKD进展过程中全身器官功能障碍的一个越来越重要的因素[3]。作为一种强促炎因子, 尿毒素能够加剧功能性肾损伤、肾纤维化及氧化应激等[4], 导致CKD病情的加速发展。尿毒素中如硫酸吲哚酚(indoxyl sulfate, IS)、硫酸对甲酚(p-cresyl sulphate, pCS)等蛋白结合型尿毒素, 极难经血液透析清除, 已有证据表明, 透析患者的体内IS水平高达正常水平的20倍[5], 并且目前无经济有效的降低蛋白结合型尿毒素在体内蓄积的治疗方法。在CKD患者体内, 血中IS水平与其肾功能呈负相关[6], 并且与主动脉硬化、第一次心力衰竭事件及心血管死亡有着直接的关系[7]。
近年来, 有大量研究证实, 肠道微生态失调与CKD发病机制及病情进展密切相关[8, 9]。CKD患者肠道内约190多种细菌丰度发生改变, 这一现象已在CKD模型动物上得到验证[8]。经由肠道进入体内的尿毒素完全依赖于肾脏清除[10], 随着CKD患者肾功能的丧失, 尿毒素不断积累, 会扰乱肠道菌群、破坏肠道屏障的完整性使屏障通透性增加, 从而导致肠道细菌进入血液, 肠道内有毒物质吸收增加, 引发全身性炎症及多种并发症, 进而导致患者死亡[8, 11]。因此, 靶向肠道细菌、减少尿毒素蓄积这一新的CKD治疗靶点应被广泛重视。
黄葵单方制剂黄葵胶囊作为中医临床治疗CKD的一线药物, 其增强肾脏功能、改善CKD临床症状及减少蛋白尿等疗效确切, 但其作用机制并未完全明确。黄葵胶囊是黄葵的乙醇提取物, 其有效活性成分主要为以槲皮素为母核的黄酮苷类化合物。研究证实, 黄酮苷类成分的生物利用度低, 其原型成分血药浓度低于1 μg·mL-1[12-14], 但其作用于离体细胞的有效浓度高达50 μg·mL-1[15]。在大多数情况下, 药物有效成分需经各类途径吸收入血, 到达作用靶器官与靶点相结合, 并且能够在一定时间内维持血药浓度, 方能发挥药效[16]。黄葵口服给药后, 有效成分难以经肠道吸收, 在肠道内大量分布, 并且停留时间较长。故针对肠道细菌介导的黄葵治疗CKD的作用机制研究有着科学且重要的意义。本研究主要以黄葵对CKD大鼠体内尿毒素蓄积的影响作为切入点, 研究黄葵靶向肠道细菌、延缓CKD进展的作用机制。
材料与方法 实验动物与细菌菌株SPF级的雄性SD大鼠, 体重180~250 g, SPF级雄性C57BL/6小鼠, 体重18~25 g, 均购自北京维通利华实验动物技术有限公司, 许可证号: SCXK (苏) 2016-0003, 动物合格号: NO. 201807103。实验用动物均饲养于南京中医药大学药物安全评价中心, 所有动物研究均遵循南京中医药大学动物伦理委员会的指导方针, 伦理审核号: 201805A002。
大肠杆菌(Escherichia coli, E. coli)由健康人粪便中分离鉴定而得。经生工生物工程(上海) 16S rDNA序列分析结果可知, 该菌与大肠杆菌菌株NCTC8623相似度为100%。
药物、试剂黄葵胶囊(江苏苏中药业集团股份有限公司, 批号: 17020604);异槲皮苷、金丝桃苷、槲皮素、杨梅素标准品(上海士锋生物科技有限公司, 纯度 > 98%); 氯霉素(中国材料研究中心); 生理盐水(山东齐都药业有限公司); 腺嘌呤、硫酸吲哚酚、硫酸对甲酚、二甲基亚砜(美国Sigma-Aldrich公司); 质谱级乙腈(德国Merck公司); 质谱级甲酸(天津科密欧有限公司)。
动物实验分组、造模及给药将21只SD大鼠随机分配为3组, 即正常组(normal) 5只、模型组(model)及黄葵组(HK), 每组8只。腺嘌呤诱导慢性肾病大鼠造模方法参考以往文献[17]。给药:正常组及模型组大鼠每日灌胃生理盐水1次, 黄葵组大鼠每日灌胃黄葵胶囊粉末水溶液(0.675 g·kg-1) 1次, 连续灌胃4周。每周取各组大鼠粪便及血浆, 实验结束后取肝脏及肾脏。
将15只SD大鼠随机分配为3组, 即正常组(normal)、对照组(indole)和黄葵+吲哚组(indole+HK), 每组5只。给药:正常组大鼠每日上午灌胃生理盐水1次, 对照组及黄葵组大鼠每日上午灌胃吲哚水溶液(0.1 g·kg-1) 1次, 此外, 黄葵组大鼠每日下午灌胃黄葵胶囊水溶液(0.675 g·kg-1) 1次, 连续灌胃11天。实验结束后取各组大鼠血浆、肝脏及肾脏。
将12只C57BL/6小鼠随机分配为2组, 每组各6只。正常组(normal)小鼠每日上午灌胃生理盐水1次, 黄葵组(HK)小鼠每日上午灌胃黄葵胶囊水溶液(0.8 g·kg-1) 1次, 连续灌胃1个月。最后一天, 收集小鼠眼底血液样品, 作为正常组及黄葵组的血浆样品来源。随后, 各组小鼠灌胃吲哚水溶液(0.1 g·kg-1), 2 h后, 取小鼠血浆、肝脏及肾脏样品, 作为对照组(indole)及黄葵+吲哚组(HK+indole)小鼠样品来源。
将30只SD大鼠随机分配为3组, 即假手术组(sham)、模型组(model)和黄葵组(HK), 每组10只。5/6肾切除诱导慢性肾病大鼠造模方法参考以往文献[8]。给药:假手术组及模型组大鼠每日灌胃生理盐水1次, 黄葵组大鼠每日灌胃黄胶囊粉末水溶液(0.675 g·kg-1) 1次, 连续灌胃8周。实验结束后取各组大鼠粪便。
血浆、肝脏及肾脏样品采集与处理大鼠麻醉后, 眼眶采血法收集大小鼠全血至含有抗凝剂的样品管中, 室温静置2 h, 4 000 r·min-1离心10 min, 离心后取上清即得血浆。PBS灌流大鼠全身后, 剪取固定部位的肝脏及肾脏于样品管中, 每1 g样品加入1 mL PBS溶液, 匀浆后13 000 r·min-1离心10 min, 取上清。所有样品以10:1 (v/v)加入200 μg·mL-1的氯霉素作为内标物, 再以1:3 (v/v)加入乙腈, 充分混匀, 13 000 r·min-1离心10 min, 取上清至进样小瓶中, 置于冰上待测。
血浆、肝脏及肾脏样品分析色谱条件:采用Acquity UHPLCTM系统(美国Waters公司)、Acquity UHPLC BEH C18色谱柱(2.1 mm I.D.×100 mm, 1.7 μm)进行色谱分析。分析期间, 柱温35 ℃, 自动进样器温度4 ℃。流动相由(A)甲酸-水溶液(1:1 000, v/v)以及(B)乙腈构成。梯度洗脱条件: (0~1.0 min) 14%~21% B, (1.0~4.0 min) 21%~40% B, (4.0~4.2 min) 40%~95% B, (4.2~5.0 min) 95% B, (5.0~5.2 min) 95%~14% B, (5.2~5.5 min) 14% B。流速: 0.4 mL·min-1。进样体积2 μL。
质谱条件:采用Xevo Triple Quadrupole Mass Spectrometer (TQ/MS) (美国Waters公司)、选择性反应监测法进行质谱分析。检测参数参考以往文献[18]。IS、pCS及氯霉素的最佳检测条件如表 1。
| Table 1 Optimal detection conditions for compounds by UHPLC-TQ/MS. IS: Indoxyl sulfate; pCS: p-Cresyl sulphate |
5/6肾切大鼠灌胃黄葵8周后, 取各组大鼠新鲜粪便, 粪便微生物16S rDNA测序委托派森诺生物科技有限公司(上海)进行。微生物多样性测序平台为Illumina Miseq, 测序原理为合成测序法。对样品进行可操作分类单元(OUT)划分, 采取门、纲、目、科、属分类, 进行菌群的分类学组成分析。
粪便样品采集与处理实验期间, 在固定时间点, 以压迫法收集大鼠肛门处新鲜粪便于样品管中。每1 g样品加入4 mL PBS溶液, 匀浆后10 000 r·min-1离心5 min, 取上清以10:1 (v/v)加入200 μg·mL-1的4-乙基苯胺作为内标物, 再以1:3 (v/v)加入乙腈, 充分混匀, 13 000 r·min-1离心10 min, 取上清至进样小瓶中, 置于冰上待测。
HPLC-FLD分析吲哚及对甲酚浓度采用高效液相色谱-荧光检测器(HPLC-FLD) (美国Waters公司)、Alltima C18色谱柱(250 mm×4.6 mm)进行分析。分析期间, 柱温35 ℃, 自动进样器温度4 ℃。色谱条件:流动相由(A)乙酸铵缓冲液(200 mol·L-1, 冰醋酸调pH至4.5)以及(B)乙腈构成。70% B相等度洗脱。进样体积10 μL。吲哚检测条件:波长270~360 nm, 保留时间4.4 min; 对甲酚检测条件:波长260~300 nm, 保留时间3.7 min; 4-乙基苯酚检测条件:波长260~300 nm, 保留时间5.9 min。
药物配制精密称取黄葵胶囊内粉末, 用无菌LB培养液稀释至100、10、1、0.1 mg·mL-1, 涡旋, 作为黄葵给药液, 临用现配。
精密称取异槲皮苷、金丝桃苷、槲皮素及杨梅素标准品粉末, 用二甲基亚砜(DMSO)稀释至浓度为500 mol·L-1作为储备液置于-20 ℃冰箱中备用。临用前, 用无菌LB培养液稀释100倍至5 mol·L-1作为给药液。以无菌LB培养液稀释的1% DMSO作为实验溶剂对照溶液。
细菌培养及给药将冻存于-80℃冰箱的大肠杆菌接种于LB平板上, 在37 ℃条件下, 于充满惰性混合气(10%氢气, 10%二氧化碳, 80%氮气)的厌氧工作站(AW200SG, Electrotek, UK)中过夜复苏。待平板上长出细菌菌落后, 挑取1个菌落接种于5 mL LB培养液中, 厌氧工作站内过夜扩增, 扩增菌液经LB稀释100倍后用于实验。于1.5 mL的无菌EP管中接种入480 μL菌液, 将EP管置于厌氧工作站中, 待到细菌A600 nm至0.2左右时, 向菌液中加入20 μL黄葵给药液至终浓度为4 000、400、40、4、0 μg·mL-1, 每浓度平行3次, 于37 ℃厌氧孵育6、8、12、24 h; 或加入20 μL化合物给药液至终浓度为200 μmol·L-1, 加入DMSO至终浓度为0.04%, 各组平行3次, 于37 ℃厌氧孵育0.5、1、2、4、6、8、24 h。
收集正常大鼠的新鲜粪便, 置于10 mL无菌离心管中, 每1 g样品加入4 mL无菌生理盐水, 匀浆后200 ×g离心10 min, 取上清即得大鼠肠道混合细菌母液。用无菌LB培养液稀释混合细菌母液至A600 nm为0.1左右后用于实验。于1.5 mL的无菌EP管中接种入480 μL混合菌液, 每组平行3次, 向菌液中加入20 μL黄葵给药液至终浓度为400 μg·mL-1, 于37 ℃厌氧孵育12 h。
细菌样品分析前处理及生长情况检测取培养后菌液, 10 000 r·min-1离心3 min, 分离上清及底菌。底菌加入500 μL PBS, 充分涡旋, 吸取200 μL至透明96孔板中, 利用酶标仪(美国PerkinElmer公司)于600 nm波长(A600 nm)下测定细菌生长情况。细菌上清以1:3 (v/v)加入乙腈, 混匀后13 000 r·min-1离心10 min, 取上清至进样小瓶中, 置于冰上待测。
UPLC-TQ/MS分析细菌内色氨酸转运将LB溶解的2 mg·mL-1黄葵与E. coli厌氧共孵2、4、8、24 h, 10 000 r·min-1离心3 min, 分离上清及底菌。细菌上清以1:3 (v/v)加入乙腈, 混匀后13 000 r·min-1离心10 min, 取上清至进样小瓶中, 置于冰上待测。
色谱条件:采用Acquity UHPLC TM系统(美国Waters公司)、Acquity UHPLC BEH Amide氨基色谱柱(2.1 mm I.D.×100 mm, 1.7 μm)进行色谱分析。分析期间, 柱温35 ℃, 自动进样器温度4 ℃。流动相由(A)含5 mmol·L-1甲酸铵、乙酸铵的甲酸-水溶液(2:1 000, v/v)以及(B)含1 mmol·L-1甲酸铵、乙酸铵的甲酸-乙腈溶液(2:1 000, v/v)构成。洗脱条件: 10% (A)以及90% (B)等度洗脱。流速: 0.4 mL·min-1, 进样体积2 μL。
质谱条件:采用Xevo Triple Quadrupole Mass Spectrometer (TQ/MS) (美国Waters公司)、选择性反应监测法进行质谱分析。检测参数参考以往文献[18]。最佳检测条件如表 1。
统计学方法数据统计分析均采用GraphPad Prism version 7.0软件。吲哚及A600 nm抑制率以(1-给药组/对照组)×100%确定, 色氨酸转运量以(初始色氨酸浓度-某时间点细菌上清残留色氨酸浓度)确定。所有结果均以x±s表示, n ≥ 3。采用Nonparametric Mann-Whitney Test进行组间差异性分析, P < 0.05表示有显著性差异。
结果 1 黄葵抑制CKD模型大鼠体内尿毒素蓄积建立CKD模型后, 大鼠连续灌胃黄葵28天, 于不同时期检测各组大鼠血浆中尿毒素含量(图 1A)。经UPLC-TQ/MS检测大鼠血浆中尿毒素(IS)及pCS含量可知, CKD模型大鼠血浆内IS及pCS含量显著增加(图 1B和G)。与模型组相比, 黄葵提取物灌胃14天后, 黄葵组大鼠血浆内IS含量有一定的下降趋势(图 1C); 灌胃28天后, 黄葵组大鼠血浆中IS含量显著降低(图 1D, P < 0.001)。但黄葵无法抑制尿毒素pCS在模型大鼠血浆内的蓄积(图 1G, P > 0.05)。此外, 取黄葵灌胃28天后大鼠肝脏及肾脏检测组织中IS含量, 结果发现, 与模型组相比, 黄葵组大鼠肝脏及肾脏中IS含量均显著下降(图 1E和F)。以上结果均提示, 黄葵可以抑制CKD模型大鼠体内IS蓄积。
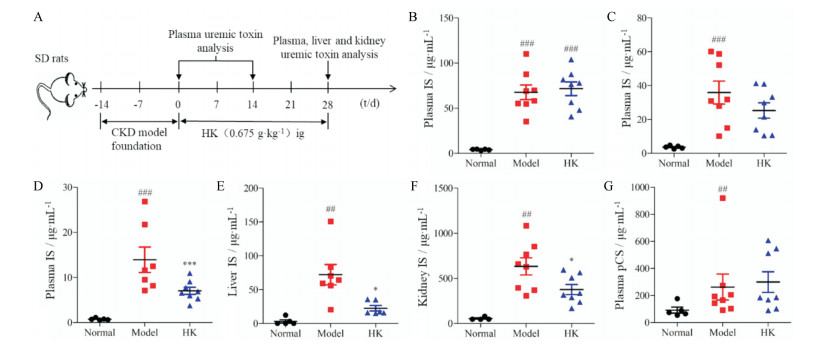
|
Figure 1 Effect of HK on the IS accumulation in CKD rats. A: Scheme of experimental design; Plasma IS concentration in CKD rats after ig with HK (B: 0 day; C: 14 day; D: 28 day); IS concentration in CKD rats after ig with HK for 28 day (E: liver; F: kidney); G: Plasma pCS concentration in CKD rats after ig with HK for 28 day. Normal: n = 5; model and HK: n = 8, x±s. ##P < 0.01, ###P < 0.001 vs normal group; *P < 0.05, ***P < 0.001 vs model group. HK: Huangkui capsule; CKD: Chronic kidney disease |
IS是由肠道细菌与宿主细胞共同代谢生成的。肠道中富含色氨酸酶的细菌将色氨酸转化为吲哚, 吲哚经门静脉吸收入肝脏中, 被细胞色素酶p450-2E1羟基化为吲哚酚并在磺基转移酶作用下硫酸化为IS[19], 随后经肾小管清除出体外。由图 1可知黄葵显著降低模型大鼠血浆及肝脏中IS含量, 提示黄葵可能直接抑制IS合成途径的某一环节, 最终降低体内IS蓄积。
为探明黄葵是否影响宿主肝脏细胞内IS代谢通路, 向大鼠灌胃吲哚, 吲哚可直接经由肠道吸收入血, 在肝脏合成IS, 最终增加大鼠血浆及肾脏IS水平[20]。给大鼠灌胃吲哚及黄葵后, 利用UPLC-TQ/MS检测血浆及肾脏内IS含量(图 2A)。结果发现, 与正常组相比, 吲哚灌胃可显著增加大鼠血浆及肾脏内IS浓度, 但黄葵并不能有效降低大鼠血浆或肾脏中的IS含量(图 2B和C, P > 0.05)。为进一步验证以上结果, 将小鼠进行黄葵预给药28天后, 给各组小鼠灌胃吲哚, 2 h后, 利用UPLC-TQ/MS检测血浆、肝脏及肾脏内IS含量(图 2D)。结果发现, 黄葵不影响小鼠血浆内IS含量(图 2E, P > 0.05), 在吲哚灌胃2 h后各组小鼠血浆内IS含量显著增高, 但正常组和黄葵预保护组小鼠血浆内IS含量并无显著差异(图 2E)。此外, 吲哚灌胃后各组小鼠肝脏及肾脏内IS含量亦无显著差异(图 2F和G)。以上结果提示, 黄葵不影响IS在宿主体内的合成途径, 不影响IS的前体分子吲哚转化为IS的过程。
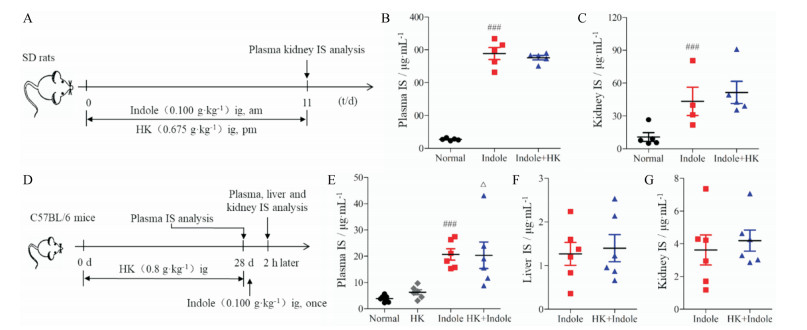
|
Figure 2 Effect of HK on the indole conversion to IS in rats or mice. A: Scheme of SD rats experimental design; IS concentration in rats after ig with HK and indole for 11 day (B: Plasma; C: Kidney); D: Scheme of C57BL/6 mice experimental design; IS concentration in mice after ig with HK for 28 day and indole for once (E: Plasma; F: Liver; G: Kidney). A, B: n = 5, C-E: n = 6, x±s. ###P < 0.001 vs normal group; △P < 0.05 vs HK group |
为研究黄葵是否影响肠道内IS的代谢通路, 收集黄葵灌胃后各组大鼠粪便, 利用HPLC-FLD检测粪便内尿毒素IS前体分子吲哚含量(图 3A)。结果发现, 与正常组相比, CKD大鼠粪便内吲哚含量显著增高(图 3B), 黄葵灌胃28天后, 黄葵组大鼠粪便吲哚含量相比于模型组显著降低(图 3C)。此外, 检测粪便中尿毒素pCS前体分子对甲酚的含量发现, 黄葵不影响CKD大鼠粪便内对甲酚含量(图 3D和E)。以上结果提示, 黄葵可以显著减少肠道菌群中IS前体分子吲哚的合成, 提示黄葵干预IS生物合成的作用靶点可能集中在肠道菌群。

|
Figure 3 Effect of HK on the indole and p-cresol concentration in rat's fecal. A: Scheme of experimental design; Indole concentration in rat's fecal after ig with HK (B: 7 day; C: 28 day); p-Cresol concentration in rat's fecal after ig with HK (D: 7 day; E: 28 day). n = 8, x±s. #P < 0.05 vs normal group; **P < 0.01 vs model group |
肠道中, 富含色氨酸酶的肠道细菌代谢色氨酸为吲哚[21], 该途径是体内吲哚的唯一合成途径[22]。既然黄葵能够有效降低肠道内的吲哚含量, 是否与抑制肠道内富含色氨酸酶的细菌丰度有关?收集黄葵灌胃后各组大鼠粪便样品, 16S rDNA测序分析肠道菌群丰度变化(图 4A), 结果发现, 与对照组大鼠相比, CKD大鼠肠道细菌门水平构成发生改变(图 4B), 其中变形菌门(Proteobacteria)丰度显著扩增(图 4C), 提示CKD导致大鼠的肠道菌群紊乱, 但黄葵灌胃后CKD大鼠肠道内变形菌门细菌丰度并无显著改变(P > 0.05)。细菌科水平分析检测出肠杆菌科(Enterobacteriaceae)及拟杆菌科(Bacteroidaceae)两种富含色氨酸酶的细菌[23]。与对照组相比, CKD大鼠肠道内肠杆菌科细菌丰度显著扩增, 拟杆菌科细菌丰度无显著变化, 但黄葵并未显著抑制以上两科细菌的丰度(图 4D)。此外, 与对照组相比, CKD大鼠还有4个细菌科丰度存在显著差异, 其中, 双歧杆菌科(Bifidobacteriaceae)、肠球菌科(Enterococcaceae)及棒状杆菌科(Corynebacteriaceae)丰度上调, 艰难杆菌科(Mogibacteriaceae)丰度下调(图 4D)。黄葵长期灌胃后, 仅抑制CKD大鼠肠道内棒状杆菌科的扩增, 但对其他科细菌无显著影响, 说明黄葵无法纠正CKD导致的大鼠肠道菌群紊乱。以上结果提示, 黄葵降低肠道内吲哚含量, 并非通过抑制肠道内代谢合成吲哚相关细菌的丰度实现的。
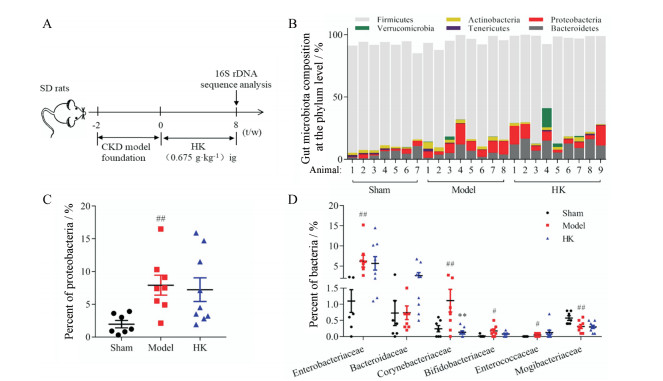
|
Figure 4 Effect of HK on the gut microbiota composition in rats. A: Scheme of experimental design; B: Gut microbiota composition at the phylum level in rats; C: The percent of proteobacteria in rats' gut microbiota; D: Gut microbiota composition at the family level in rats. n = 7-9, x±s. #P < 0.05, ##P < 0.01 vs sham group; **P < 0.01 vs model group |
黄葵对CKD模型大鼠肠道内异常升高的肠杆菌科细菌(也是吲哚合成的主要菌群)的丰度无显著影响, 提示黄葵不是通过直接影响吲哚合成相关细菌的丰度来干预吲哚生物合成的。吲哚来源于肠道细菌的代谢, 是IS代谢通路上的重要中间体。16S rDNA测序证明CKD大鼠肠道内能够合成吲哚的肠杆菌科细菌丰度显著扩增, 且已有研究证实大肠杆菌(E. coli)可以产生吲哚并将其排至细菌的上清液中[24], 因此, 采用E. coli为实验对象, 在体外厌氧环境观察黄葵对肠道细菌合成吲哚的调控作用。将0、4、40、400、4 000 μg·mL-1的黄葵与大肠杆菌厌氧共孵6~24 h, HPLC-FLD检测其细菌上清中吲哚分泌量, 结果发现, 黄葵呈剂量依赖性抑制肠道细菌合成吲哚, 并且抑制能力随共孵时间延长而降低(图 5A~D); 经A600 nm检测可知, 除4 000 μg·mL-1的高浓度黄葵作用下细菌生长受到了显著抑制, 其他浓度下黄葵未明显抑制细菌生长(图 5E)。选择400 μg·mL-1黄葵与正常大鼠的粪便混合细菌厌氧共孵12 h, 检测黄葵对肠道混合细菌合成吲哚及生长情况影响, 结果发现, 400 μg·mL-1黄葵提取物可以非致死性抑制肠道混合细菌合成吲哚(图 5F和G)。
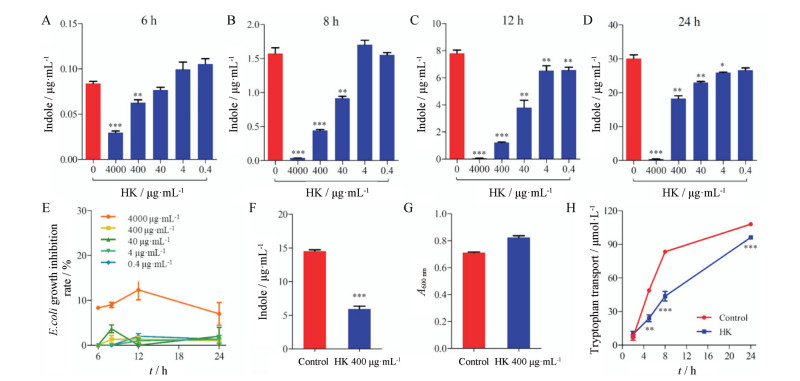
|
Figure 5 Effect of HK on the indole production of gut bacteria. Indole concentration in E. coli culture supernatant after co-incubated with HK (0, 0.4, 4, 40, 400, 4 000 μg·mL-1) (A: 6 h; B: 8 h; C: 12 h; D:24 h); E: E. coli growth inhibition rate; indole concentration in mixed intestinal bacteria culture supernatant (F) and its A600 nm (G) after co-incubated with 400 μg·mL-1 HK for 12 h; H: The tryptophan transport in E. coli after co-incubation with HK for 2-24 h. n = 3, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group |
在肠道细菌中, 吲哚的产生一般取决于外源性色氨酸的存在[24], 色氨酸经由转运体被转运入细菌内部, 随后激活色氨酸酶的表达后将色氨酸代谢为吲哚, 因此色氨酸向肠道细菌内的转运是吲哚合成的一个关键途径。LB培养液中含有色氨酸, 将E. coli与400 μg·mL-1黄葵共孵后, 利用UPLC-TQ/MS检测细菌培养液上清中色氨酸残余含量。结果发现, 与对照组相比, 黄葵组细菌培养液上清中色氨酸浓度显著高于对照组, 即对照组细菌的色氨酸转运量显著高于黄葵组(图 5H)。该结果说明, 黄葵可直接干扰外源色氨酸向细菌内部的转运, 从而抑制细菌合成吲哚。
黄葵胶囊是黄葵乙醇提取物的单方制剂, 其主要成分为黄酮类化合物[25], 将200 μmol·L-1异槲皮苷、杨梅素、槲皮素、金丝桃苷分别与E. coli厌氧共孵0~24 h, HPLC-FLD检测细菌上清中吲哚含量, A600 nm检测细菌生长情况。结果发现, 4种黄酮类化合物均可不同程度地抑制E. coli合成吲哚, 其抑制能力由高到低为:异槲皮苷、杨梅素、槲皮素、金丝桃苷(图 6A~D, 左), 其中金丝桃苷抑制能力极弱; 对E. coli生长情况影响由低到高为:异槲皮苷、金丝桃苷、槲皮素、杨梅素(图 6A~D, 右)。各成分抑制细菌合成吲哚的能力均表现出时间依赖性, 即随共孵时间延长, 其抑制能力逐渐降低。值得注意的是, 异槲皮苷有强效的非致死性抑制E. coli合成吲哚的能力。
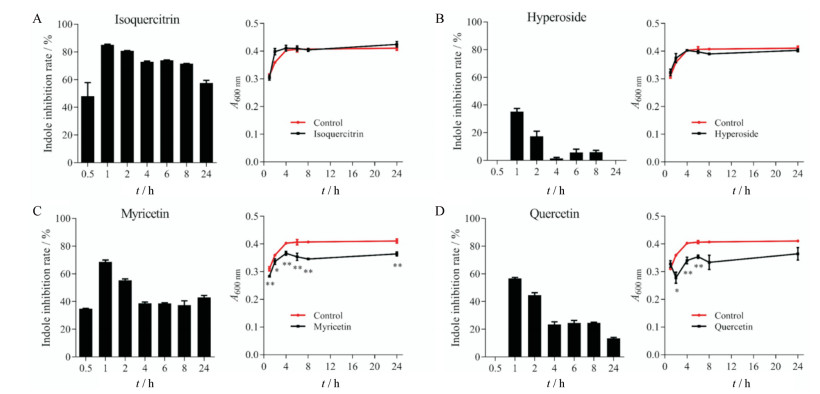
|
Figure 6 Effect of HK active components on the indole production of E. coli. Indole concentration in E. coli culture supernatant and its A600 nm after co-incubated with 200 μmol·L-1 HK active components for 0-24 h (A: Isoquercetrin; B: Hyperoside; C: Myricetin; D: Quercetin). n = 3, x±s. *P < 0.05, **P < 0.01 vs control group |
IS是一种蛋白结合型尿毒素, 在CKD患者肾功能衰退时, 不能经由肾脏清除, 不断在体内蓄积危及患者生命健康[26]。末期CKD的临床治疗方法主要有血液透析及肾脏移植, 但是血液透析需要患者终身透析, 费用高昂, 并且IS在体内与白蛋白高度结合导致其透析率极低, 而肾脏移植同样面临着肾源紧缺的困境。其他的辅助干预手段, 如低蛋白饮食、益生菌调节、吸附剂治疗法[8]及中医的方剂灌肠治疗均有各类隐患存在, 如吸附剂治疗法选择性较低且会导致患者便秘, 方剂灌肠会导致患者肠道菌群失调、电解质紊乱等。故而开发抑制尿毒素蓄积的延缓CKD病情发展的新方法有着重要的意义。
本研究发现, 黄葵能够有效抑制CKD大鼠体内尿毒素IS的蓄积, 降低其血浆、肝脏及肾脏中的IS浓度。尿毒素IS始于食物蛋白质的降解, 肠道微生物将色氨酸代谢转化为IS前体吲哚, 吲哚在肝脏进一步合成为IS, 最终通过肾脏排出体外[19]。针对IS代谢通路的各个环节, 本研究设计了不同的动物实验, 分析黄葵抑制IS在CKD大鼠体内蓄积的作用靶点。采用吲哚作为IS底物直接刺激大小鼠体内IS生成, 同时进行黄葵长期给药或预给药的方法, 研究黄葵对宿主肝脏细胞内的IS合成环节的影响。结果显示, 黄葵不能降低吲哚刺激导致的IS含量在血浆、肝脏及肾脏中增加, 说明黄葵不作用于吲哚向IS转化的环节, 即不作用于宿主细胞内的IS合成环节(图 7)。
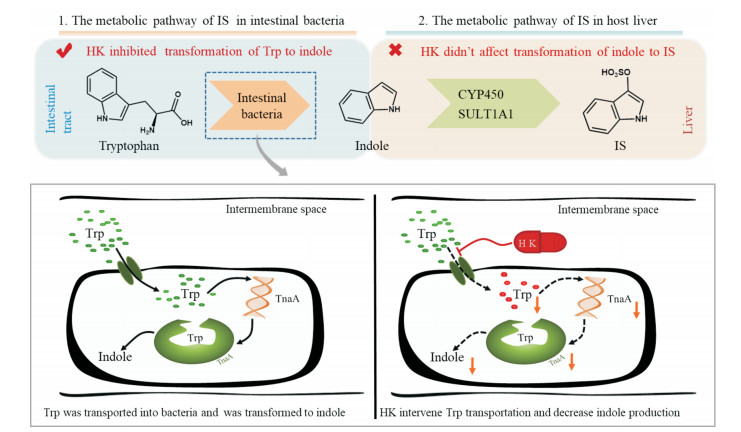
|
Figure 7 The metabolic pathway of IS in intestinal bacteria and host liver. Trp: Tryptophan; TanA: Tryptophanase A |
IS作为一种经肠道细菌代谢后合成的尿毒素, 其肠道内吲哚合成环节在IS代谢通路上占据关键且重要的地位。据报道, 吸附剂AST-120可以通过吸附肠道内尿毒素前体物质, 减少其吸收率来降低尿毒素的体内浓度, 帮助延缓CKD的进展[27]。此外, Devlin等[23]研究发现, 将肠道细菌内吲哚相关基因敲除, 会使肠道吲哚水平降低, 进而使血液循环中IS含量降低。因此, 通过降低肠道内的吲哚含量来遏制CKD患者体内过量蓄积的IS是一个可行途径。通过分析CKD大鼠粪便发现, 黄葵可以显著降低CKD大鼠粪便内吲哚含量, 该结果提示黄葵能够干扰肠道细菌内的IS代谢途径(图 7)。
食物来源的色氨酸被富含色氨酸酶的肠道细菌代谢为吲哚、丙酮酸和氨, 该途径是吲哚在体内的唯一合成通路[22]。研究表明, CKD患者肠道内微生物数量及质量均不如健康人群, 肠道菌群构成发生显著改变, 导致肠道细菌衍生的尿毒素在体内含量增加。基因测序结果显示, CKD大鼠肠道内肠杆菌科细菌显著扩增, 肠杆菌科细菌携带色氨酸酶, 并且是肠道炎症发生的指标性细菌。但是, 长期灌胃黄葵对CKD导致的肠道菌群紊乱及肠杆菌科丰度扩增并无显著调控作用。
肠道细菌体外厌氧培养研究表明, 黄葵及其有效成分黄酮类化合物能够显著抑制肠道细菌合成吲哚, 部分浓度及单体成分在有效抑制肠道细菌合成吲哚的同时, 不影响细菌的生长, 这与黄葵降低肠道内吲哚、但不影响相关合成细菌丰度的结果相一致。在肠道细菌中, 吲哚的产生一般取决于外源性色氨酸的存在, 色氨酸经由转运体被转运入细菌内部, 随后激活色氨酸酶表达, 使之代谢为吲哚[22, 28]。经检测发现黄葵能够显著抑制色氨酸向细菌内转运, 切断吲哚合成途径的源头, 最终降低细菌的吲哚生成(图 7)。
综合以上结果得出结论, 黄葵主要通过干扰色氨酸向肠道细菌内转运, 从而抑制吲哚的生物合成, 降低肠道内IS代谢通路上重要分子吲哚的含量, 最终减少IS蓄积。近年来, 通过调控肠道菌群来延缓疾病进展这一具有发展前景的治疗策略越来越引发研究者的热切关注[29-32], 本研究表明, 黄葵能够直接靶向肠道细菌, 调控尿毒素前体在肠道内的合成, 最终抑制CKD导致的尿毒素体内蓄积、助于延缓CKD病情进展, 为CKD治疗提供了新思路。
| [1] |
Zhang L, Wang F, Wang L, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey[J]. Lancet, 2012, 379: 815-822. DOI:10.1016/S0140-6736(12)60033-6 |
| [2] |
Vanholder R, De Smet R, Glorieux G, et al. Review on uremic toxins: classification, concentration, and interindividual variability[J]. Kidney Int, 2003, 63: 1934-1943. DOI:10.1046/j.1523-1755.2003.00924.x |
| [3] |
Meyer TW, Hostetter TH. Uremia[J]. N Engl J Med, 2007, 357: 1316-1325. DOI:10.1056/NEJMra071313 |
| [4] |
Lekawanvijit S, Kompa AR, Wang BH, et al. Cardiorenal syndrome: the emerging role of protein-bound uremic toxins[J]. Circ Res, 2012, 111: 1470-1483. DOI:10.1161/CIRCRESAHA.112.278457 |
| [5] |
Duranton F, Cohen G, De Smet R, et al. Normal and pathologic concentrations of uremic toxins[J]. J Am Soc Nephrol, 2012, 23: 1258-1270. DOI:10.1681/ASN.2011121175 |
| [6] |
Barreto FC, Barreto DV, Liabeuf S, et al. Serum indoxyl sulfate is associated with vascular disease and mortality in chronic kidney disease patients[J]. Clin J Am Soc Nephrol, 2009, 4: 1551-1558. DOI:10.2215/CJN.03980609 |
| [7] |
Lin CJ, Liu HL, Pan CF, et al. Indoxyl sulfate predicts cardiovascular disease and renal function deterioration in advanced chronic kidney disease[J]. Arch Med Res, 2012, 43: 451-456. DOI:10.1016/j.arcmed.2012.08.002 |
| [8] |
Vaziri ND, Wong J, Pahl M, et al. Chronic kidney disease alters intestinal microbial flora[J]. Kidney Int, 2013, 83: 308-315. DOI:10.1038/ki.2012.345 |
| [9] |
Anders HJ, Andersen K, Stecher B. The intestinal microbiota, a leaky gut, and abnormal immunity in kidney disease[J]. Kidney Int, 2013, 83: 1010-1016. DOI:10.1038/ki.2012.440 |
| [10] |
Vanholder R, Glorieux G. The intestine and the kidneys: a bad marriage can be hazardous[J]. Clin Kidney J, 2015, 8: 168-179. DOI:10.1093/ckj/sfv004 |
| [11] |
Wong J, Piceno YM, DeSantis TZ, et al. Expansion of urease- and uricase-containing, indole- and p-cresol-forming and contraction of short-chain fatty acid-producing intestinal microbiota in ESRD[J]. Am J Nephrol, 2014, 39: 230-237. DOI:10.1159/000360010 |
| [12] |
Lu L, Qian DW, Guo JM, et al. Abelmoschi Corolla non-flavonoid components altered the pharmacokinetic profile of its flavonoids in rat[J]. J Ethnopharmacol, 2013, 148: 804-811. DOI:10.1016/j.jep.2013.05.009 |
| [13] |
Guo JM, Lin P, Duan JA, et al. Application of microdialysis for elucidating the existing form of hyperoside in rat brain: comparison between intragastric and intraperitoneal administration[J]. J Ethnopharmacol, 2012, 144: 664-670. DOI:10.1016/j.jep.2012.10.008 |
| [14] |
Xue CF, Guo JM, Qian DW, et al. Absorption of flavonoids from Abelmoschus manihot extract by in situ intestinal perfusion[J]. Acta Pharm Sin (药学学报), 2011, 46: 454-459. |
| [15] |
Zhou L, An XF, Teng SC, et al. Pretreatment with the total flavone glycosides of Flos Abelmoschus manihot and hyperoside prevents glomerular podocyte apoptosis in streptozotocin-induced diabetic nephropathy[J]. J Med Food, 2012, 15: 461-468. DOI:10.1089/jmf.2011.1921 |
| [16] |
Yan W. Binding time--not just affinity--gains stature in drug design[J]. Nat Med, 2015, 21: 545. DOI:10.1038/nm0615-545 |
| [17] |
Claramunt D, Gil-Pena H, Fuente R, et al. Chronic kidney disease induced by adenine: a suitable model of growth retardation in uremia[J]. Am J Physiol Renal Physiol, 2015, 309: F57-F62. DOI:10.1152/ajprenal.00051.2015 |
| [18] |
Li JP, Guo JM, Shang EX, et al. Quantitative determination of five metabolites of aspirin by UHPLC-MS/MS coupled with enzymatic reaction and its application to evaluate the effects of aspirin dosage on the metabolic profile[J]. J Pharm Biomed Anal, 2017, 138: 109-117. DOI:10.1016/j.jpba.2016.12.038 |
| [19] |
Ellis RJ, Small DM, Vesey DA, et al. Indoxyl sulphate and kidney disease: causes, consequences and interventions[J]. Nephrology, 2016, 21: 170-177. DOI:10.1111/nep.12580 |
| [20] |
Niwa T, Ise M, Miyazaki T. Progression of glomerular sclerosis in experimental uremic rats by administration of indole, a precursor of indoxyl sulfate[J]. Am J Nephrol, 1994, 14: 207-212. DOI:10.1159/000168716 |
| [21] |
Cigarran Guldris S, Gonzalez Parra E, Cases Amenos A. Gut microbiota in chronic kidney disease[J]. Nefrologia, 2017, 37: 9-19. DOI:10.1016/j.nefro.2016.05.008 |
| [22] |
Lee J, Jayaraman A, Wood TK. Indole is an inter-species biofilm signal mediated by SdiA[J]. BMC Microbiol, 2007, 7: 42. DOI:10.1186/1471-2180-7-42 |
| [23] |
Devlin AS, Marcobal A, Dodd D, et al. Modulation of a circulating uremic solute via rational genetic manipulation of the gut microbiota[J]. Cell Host Microbe, 2016, 20: 709-715. DOI:10.1016/j.chom.2016.10.021 |
| [24] |
Li G, Young KD. Isolation and identification of new inner membrane-associated proteins that localize to cell poles in Escherichia coli[J]. Mol Microbiol, 2012, 84: 276-295. DOI:10.1111/j.1365-2958.2012.08021.x |
| [25] |
Guo JM, Xue CF, Duan JA, et al. Fast characterization of constituents in HuangKui capsules using UPLC–QTOF-MS with collision energy and massfragment software[J]. Chromatographia, 2011, 73: 447-456. DOI:10.1007/s10337-011-1915-8 |
| [26] |
Meyer TW, Hostetter TH. Uremic solutes from colon microbes[J]. Kidney Int, 2012, 81: 949-954. DOI:10.1038/ki.2011.504 |
| [27] |
Akizawa T, Asano Y, Morita S, et al. Effect of a carbonaceous oral adsorbent on the progression of CKD: a multicenter, randomized, controlled trial[J]. Am J Kidney Dis, 2009, 54: 459-467. DOI:10.1053/j.ajkd.2009.05.011 |
| [28] |
Newton WA, Morino Y, Snell EE. Properties of crystalline tryptophanase[J]. J Biol Chem, 1965, 240: 1211-1218. |
| [29] |
Lin Z, Zu XP, Xie HS, et al. Research progress in mechanism of intestinal microorganisms in human diseases[J]. Acta Pharm Sin (药学学报), 2016, 51: 843-852. |
| [30] |
Wang Y, Jiang JD. A new research mode of drug PK-PD mediated by the gut microbiota: insights into the pharmacokinetics of berberine[J]. Acta Pharm Sin (药学学报), 2018, 53: 659-666. |
| [31] |
Zhang JH, Zhang JM, Wang R, et al. Interaction of amoxicillin and nifedipine mediated by intestinal flora[J]. Acta Pharm Sin (药学学报), 2018, 53: 1721-1725. |
| [32] |
Gao XJ, Li T, Wei B, et al. Regulatory mechanisms of gut microbiota on intestinal CYP3A and P-glycoprotein in rats with dextran sulfate sodium-induced colitis[J]. Acta Pharm Sin (药学学报), 2017, 52: 34-43. |
 2019, Vol. 54
2019, Vol. 54


