中药注射剂是指药材(饮片)经提取、纯化后制成的供注入体内的溶液、乳状液及供临用前配制成溶液的粉末或浓溶液的无菌制剂。中药注射剂突破了中药传统的给药方式, 具有疗效确切、生物利用度高、作用迅速等特点, 尤在急救及抢救重症病人等方面有着独特作用[1]。中药注射剂是中药现代化的一个重要成果, 我国最接近“重磅炸弹”式药物的中成药大品种前十个品种里中药注射剂占据了7席, 前两名都是中药注射剂[2]。与此同时, 中药注射剂存在成分复杂、批间变异度大、风险可控性差等特点, 数据显示90%左右的中药严重不良反应和预警信号与注射剂型相关。尽管目前国家药品监督管理局(National Medical Products Administration, NMPA)对中药注射剂制定了近乎严苛的质量控制检测项目, 但仍然难以高效发现与预测中药注射剂的不良反应, 导致即使符合中药注射剂现行的质量控制方法检测要求的中药注射剂在临床应用时仍会出现较多问题。
鉴于中药注射剂复杂体系和现有测试方法尚难高效测试其质量的现状, 赵军宁研究团队基于Microtox (微毒)技术开发了一种能够反映中药注射剂特点的早期、灵敏、快速、可靠的新技术平台和方法体系[3-8], 并依托国家药品不良反应监测系统数据平台, 在中药注射剂重点关注品种及其主要毒性风险信号、不良反应发生率研究基础上, 探讨建立和完善中药注射剂等高风险品种的体外质量控制快速评价关键技术, 探讨解决现有高风险中药注射剂生物评价及检测方法难以控制其风险的难题, 实现高风险中药注射剂毒性参数的定量化表征, 提高中药注射剂质量控制和安全性评价的可靠性。
1 Microtox测试的技术原理Microtox技术是以一种非致病的发光细菌(luminescent bacteria)作指示生物, 以其发光强度的变化为指标, 测定环境中有害有毒物质的一种简单、快速的生物毒性检测手段。发光细菌是一类在生理条件下能够发射波长450~490 nm可见荧光的革兰阴性菌[7], 其发光强度在一定条件下是恒定的。当发光细菌接触到无机、有机毒物、抑菌、杀菌物等物质时, 其细胞膜、酶及细胞质的结构会发生改变, 导致其发光强度发生改变。发光强度变化与接触物质毒性呈相关关系, 毒性越强, 发光抑制率越高。通常认为外来受试物通过下面两个途径抑制细菌发光: ①直接抑制参与发光反应的酶类活性; ②抑制细胞内与发光反应有关的代谢过程(如细胞呼吸等)。发光细菌毒性测试是在20世纪70年代后兴起的一种微生物监测环境污染及检测污染物毒性的新方法。1978年美国Beckman公司即推出功能完备的生物发光光度计“Microtox”。自此这一急性毒性测试技术在世界范围内迅速推广。因此人们也将发光菌毒性测试称为Microtox测试。
赵军宁研究团队依托国家药品不良反应监测系统数据平台, 和相关企业合作, 对10余家中药注射剂生产企业的多种高风险中药注射剂Microtox (微毒)技术质量控制的技术方法、技术路线、关键问题以及应用范围等进行了全面研究, 系统研究中药注射剂对发光细菌发光强度影响的药效-毒性效应谱、剂量-反应曲线和剂量-时间-反应关系, 采用半数抑制浓度(50% inhibitory concentration, IC50)、参比毒性等综合指标客观比较微毒技术评价结果与传统毒性评价方法及临床研究结果的差异, 分析各方法的优势及不足; 探讨该方法作为中药注射剂质量控制的适用性, 为高风险中药新药创制质量控制、风险预警和临床安全用药提供了支撑。
2 中药注射剂微毒(Microtox)生物检定原则和内容 2.1 基本原则 2.1.1 符合药理学研究基本原则目前建立的方法符合药理学研究随机、对照、重复的基本原则, 具备简单、准确、快速等特点, 有明确的判断标准。
2.1.2 品种选择合理选择开展生物评价的中药注射剂应有明确的功能主治和适应症。
2.1.3 方法科学可靠优先选用生物效价测定法, 不能建立生物效价测定的品种可考虑采用生物活性限值测定法。
2.2 实验条件 2.2.1 实验系的选择选择费氏弧菌作为生物活性测定的试验系。所选费氏弧菌符合国际标准ISO11348:2007的非致病性发光细菌, 具有背景资料清楚、影响因素少、检测指标灵敏和成本低廉等特点, 且检测速度较快。
2.2.2 供试品的选择选择工艺稳定、质量合格的中药注射剂, 至少3批。
2.2.3 标准品或对照品选择空白对照品选择复苏稀释液(主要成分为3%氯化钠), 毒性对照品参照国家标准GB/T 15441, 可选择氯化汞作为毒性对照品。由于氯化汞毒性较大, 亦可参照Wang等[9]的实验研究, 选择硫酸锌作为毒性对照品。
2.3 实验设计 2.3.1 设计原理基于费氏弧菌相对发光强度与中药注射剂组分总浓度呈显著负相关, 因此可通过生物毒性测试仪测定样品相对发光强度, 以此表示供试品的急性毒性水平。
2.3.2 设计类型实验设计空白对照组(复苏稀释液)、中药注射剂供试品组和毒性对照组(硫酸锌溶液)。
2.3.3 剂量设计中药注射剂供试品及硫酸锌浓度的设计应先做探测试验, 确定1%~100%相对发光度对应的供试品浓度范围, 再在该浓度范围内增配7~10个浓度。
2.3.4 测定方式供试品溶液与费氏弧菌反应10~15 min后测定发光强度, 每个样品设3个平行管。
2.3.5 指标选择选择相对发光强度、IC50、标准毒物参比值、浓度-效应曲线等指标。
2.4 方法学验证 2.4.1 测定方法影响因素考察考察时间、温度、pH值等测定方法影响因素, 确定最佳试验条件, 以保证试验方法的专属性和准确性。根据考察结果, 规定方法的误差控制限值或对统计有效性进行说明。前期对费氏弧菌、明亮发光杆菌和青海弧菌均进行了方法学考察[10, 11], 结果表明, 费氏弧菌体系更适合中药注射剂研究, 该试验体系最佳试验条件为:检测时间为10~15 min, 温度15~25 ℃, pH值范围为4.0~8.0, 菌液体积50~100 μL。
2.4.2 精密度考察 2.4.2.1 重复性按确定的测定方法, 至少用3批供试品、每批重复3次或同批供试品进行6次重复测定试验后对结果进行评价。前期研究表明, 重复性试验的相对标准偏差小于15%。
2.4.2.2 中间精密度考察实验室内部条件改变, 如:不同人员、不同仪器、不同工作日和实验时间等, 对测定结果的影响, 至少对同实验室改变人员进行考察。前期研究表明, 中间精密度相对标准偏差小于15%。
2.4.2.3 重现性应在3家以上实验室能够重现。
2.4.3 方法适用性考察按已建立的生物活性测定方法和剂量对10批以上产品进行测定, 以积累数据, 考察质量标准中该测定项目的适用性。已经完成10批以上样品检测的中药注射剂有鱼腥草注射液、红花注射液、丹参注射液、参附注射液、参麦注射液、生脉注射液。
3 中药注射剂微毒(Microtox)生物检定应用范围 3.1 中药注射剂微小毒性定量参数表征 3.1.1 相对发光强度相对发光强度按以下公式进行计算:
| $ 相对发光强度\left( {\rm{\% }} \right) = \frac{{硫酸锌管或供试品管的发光量\left( {{\rm{mV}}} \right)}}{{CK管的发光量\left( {{\rm{mV}}} \right)}} \times 100{\rm{\% }} $ | (1) |
| $ 相对发光度 \left( {\rm{\% }} \right)平均值 = \frac{{\left( {重复1} \right){\rm{\% }} + \left( {重复2} \right){\rm{\% }} + \left( {重复3} \right){\rm{\% }}}}{3} \times 100{\rm{\% }} $ | (2) |
IC50指费氏弧菌发光强度降低一半时对应的中药注射剂供试品浓度。GB/T 15441-1995以相对发光强度的平均值(%), 见公式(1), (2)及样品质量浓度(mg·L-1)拟合二元一次线性方程来计算IC50。由于费氏弧菌的发光强度随时间的延长呈下降趋势, 因此, 这既不能消除发光菌自身发光强度的变化所产生的误差, 也不能反映发光反应的核心—荧光素酶动力学的变化规律, 故ISO标准中通过引入fkt, 见公式(3), 这一相对恒定的发光系数来校正该误差, 就显得更为合理[12]。
| $ {f_{{\rm{kt}}}} = {I_{{\rm{kt}}}}/{I_0} $ | (3) |
| $ D = \left( {{f_{{\rm{kt}}}} \pm {f_{\rm{k}}}} \right)/{f_{{\rm{kt}}}} \times 100\% $ | (4) |
| $ {I_{{\rm{ct}}}} = {I_{\rm{c}}} \times {f_{{\rm{kt}}}} $ | (5) |
| $ {H_{\rm{t}}} = \left( {{I_{{\rm{ct}}}} - {I_{\rm{t}}}} \right)/{I_{{\rm{ct}}}} \times 100\% $ | (6) |
I0为对照管发光菌初始发光强度, Ikt为对照管发光菌与复苏稀释液接触一定时间后的发光强度, fkt为发光系数。D为发光系数的均值偏差, fkt为2个平行管fkt的平均值。Ict为样品管发光菌初始发光强度的校正值, Ic为样品管发光菌初始发光强度。It为样品管发光菌与样品接触一定时间后的发光强度, Ht为样品对发光强度的抑制率。
3.1.3 标准毒物参比值Xiong等[10]在最优检测体系条件测得ZnSO4对费氏弧菌CS234的IC50值为19. 90 mg·L-1。在每批样品测定时, 因同时测定了ZnSO4的IC50值, 故可计算供试品与硫酸锌比值, 判定供试品的相对毒性大小。
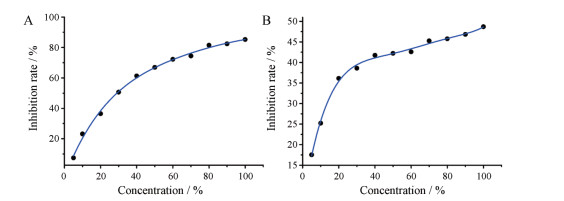
3.1.4 浓度-效应曲线同一样品具有相对固定的浓度-效应曲线图形, 除中药注射剂以外, 其他中药提取物亦是如此[13, 14]。当曲线图形发生变化时, 如左/右移, 上/下移, 曲线形态变化等, 均提示供试品质量发生了变化。两种中药注射剂的浓度-效应曲线图见图 1。

|
Figure 1 Concentration-effect curve of two kinds of traditional Chinese medicine injection |
Zheng等[15]以费氏弧菌作为测试菌种对同一生产厂家的3个批次鱼腥草注射液进行质量控制检测。结果发现, 3个批次鱼腥草注射液的IC50值分别为51.62%、48.26%和41.69%, 批间差异无显著意义(P > 0.05)。Luo等[16]对同一厂家9个批次参附注射液进行质量控制检测发现, 9个批次参附注射液的IC50值无显著性差异(P > 0.05), 平均值为41.07%, 标准偏差1.74%, 相对标准偏差4.25%。研究表明, 这两个厂家的两种中药注射剂不同批次之间质量波动性较小, 生产工艺控制力较强。
Luo等[17]在对不同生产厂家所生产的各3个批次红花注射液以费氏弧菌为测试菌种, 进行质量控制检测发现, 在最优检测体系条件下不同生产厂家A、B、C成品的IC50平均值分别为3.36%、5.58%、4.33%, 具有显著性差异(P < 0.05)。提示红花注射液成品生物学检测标准存在进一步提升的空间, 应用Microtox技术检测红花注射液综合毒性并用于控制不同厂家成品质量波动具有很好的应用前景。类似的结论在生脉注射液、参麦注射液和银杏内酯注射液质量控制检测时均得到验证[18-21]。
在对两个厂家各10个批次的中药注射剂A进行质量控制对比研究时发现, 厂家甲的IC50值为(34.58 ± 12.24) % (20.63%~51.62%), 厂家乙的IC50值为(56.00 ± 50.82) % (17.84%~177.40%), 结果表明, 厂家甲中药注射剂A批间差异波动较小, 质量较稳定, 厂家乙中药注射剂A批间差异波动较大, 质量不稳定。
两个厂家的中药注射剂A的浓度-效应曲线图见图 2。由图 2可见, 厂家乙中药注射剂A该批次原溶液(100%浓度)对费氏弧菌的抑制率不达50%, 与均值偏差较大, 属于有明显质量问题的批次。
|
Figure 2 Concentration-effect curve of traditional Chinese medicine injection A in two factories. A represents the concentration-effect curve of traditional Chinese Medicine injection A from manufacturer A; B represents the concentration-effect curve of traditional Chinese medicine injection A from manufacturer B |
对同一厂家临床出现不良反应和未出现不良反应的各10个批次的中药注射剂B进行对比研究, 结果发现, 临床出现不良反应样品的IC50值为5.12% ± 0.58% (4.22%~6.30%), 临床未出现不良反应样品的IC50值为6.46% ± 1.19% (4.80%~8.85%), 两者比较差异有显著意义(P < 0.05)。
中药注射剂B的浓度-效应曲线图见图 3。由图 3可见, 出现不良反应样品的浓度-效应曲线发生左移。
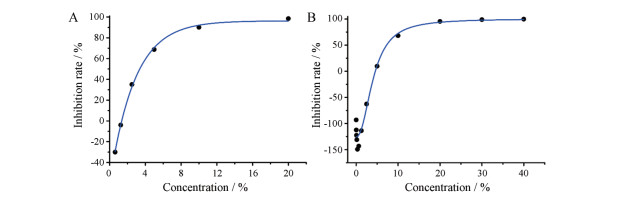
|
Figure 3 Concentration-effect curve with and without adverse reactions of traditional Chinese medicine injection B from the same factory. A represents the concentration-effect curve with adverse reaction sample; B represents the concentration-effect curve without adverse reaction sample |
中药注射剂的质量控制是中药注射剂临床安全性和有效性的保证。目前, 中药注射剂的质量控制方法主要有通则检查、常规安全性检查、含量测定和化学指纹图谱相似度评价等。常规检查的局限性在于缺乏专属性、灵敏性, 且化学指纹图谱对于一些难以用常规色谱或光谱检识的物质无法控制, 化学成分含量变化难以评价中药注射剂疗效或毒副作用, 且存在被勾兑的危险。表观化学信息的重现, 导致对样品质量合格与否的误判, 其潜在风险更大[22]。质量控制的常规检测多以理化指标检测为主, 而对综合质量的考虑较少。生物检定已逐步成为中药质量控制的重要发展方向之一, 是生物医药科学研究中认识事物本质和特征的重要方法之一, 尤其适用于作用机制不完全明晰、成分组成复杂的中药注射剂的检定[23]。
Microtox (微毒)技术引入中药注射剂质量控制检测的特点与优势有以下几方面[24]: ①以发光细菌为试验系, 是对中药注射剂质量进行综合检测的一种生物检定方法; ②参照国际和国家标准, 具有操作简单、结果可靠、检测快速等优点; ③单次检测细菌数量大, 多达数百万个, 个体差异可忽略不计, 结果重复性好; ④可采用IC50、标准毒物参比值、浓度-效应曲线等多个毒性参数表征中药注射剂的特点; ⑤中药注射剂可直接用于试验, 无需专门制备受试样品; ⑥可用于不同批次中药注射剂质量差异测定及不良反应样品的初筛。
中药注射剂存在以下情况时不宜应用Microtox (微毒)技术进行质量控制检测: ①中药注射剂的pH值低于4或高于8时; ②中药注射剂的颜色太深, 超出仪器色度校正范围时。
2014年2月在国家药物不良反应中心组织的专家论证会上已达成共识, Microtox (微毒)技术不仅可同时获得多个定量参数, 如IC50、标准毒物参比值、浓度-效应曲线等, 还可作为药物毒效生物指纹图谱, 又可以测试其毒性效能和效强, 综合表征药物毒性特点, 更可以作为质量控制和风险预警的灵敏指标。尽管如此, 作为中药注射剂质量控制有益补充的Microtox (微毒)技术仍存在一些亟需进一步研究完善的地方, 比如:专用试剂和专用仪器的开发; 扩大样品量, 针对每个中药注射剂品种制定生物活性限值; 与现行质量控制方法、临床不良反应相关性和波动性分析等。
| [1] |
Zhao JN, Yan LC, Luo LM. A quick evaluation of comprehensive toxicity of traditional Chinese medical injections based on Microtox technology[J]. World Sci Technol-Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2016, 18: 1929-1934. |
| [2] |
Zhang BL. Quality control and rational application of traditional Chinese medicine injection[J]. China Food Drug Admin Magaz(中国食品药品监管), 2012, 6: 64-65. |
| [3] |
Zhao JN, Yan LC, Zheng XQ, et al. A rapid detection of comprehensive toxicity of Houttuynia cordata injection test method: CN, ZL 201310369652.8[P]. 2016-02-17.
|
| [4] |
Zhao JN, Yan LC, Zhu YN, et al. A rapid biological test method for comprehensive toxicity of Carthamus tinctorius injection: CN, ZL201410113782. X[P]. 2016-08-17.
|
| [5] |
Zhao JN, Yan LC, Zheng XQ. A biological test method for rapid detection of comprehensive toxicity of traditional Chinese medicine injection: CN, ZL201310210195.8[P]. 2016-12-28.
|
| [6] |
Zhao JN, Yan LC. A biological test method for rapid detection of synthetic toxicity of traditional Chinese medicine: CN, ZL201410115374.8[P]. 2017-04-12.
|
| [7] |
Zhao JN, Xiong JY, Yan LC, et al. A Micrtox assay for determination of certain drugs Quality control method: CN, 201610271016.5[P]. 2016-04-27.
|
| [8] |
Zhao JN, Yan LC, Sun Y. The invention discloses a quality control method for ginkgolide injection: CN, 201810415895.3[P]. 2017-05-05.
|
| [9] |
Wang LS, Wei DB, Hu HY. Optimization of toxicity test conditions for luminescent bacteria and corresponding toxicity reference with[J]. Res Environ Sci (环境科学研究), 2004, 17: 61-62, 66. |
| [10] |
Xiong JY, Li XR, Yan LC, et al. Optimization of reaction conditions and methodological investigation on microtox-based fast testing system for traditional Chinese medicine injection[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 1622-1626. |
| [11] |
Xiong JY, Li XR, Yan LC, et al. Reaction conditions comparison of Photosbacterium phosphoreum 502 and Vibrio qinghaiensis Q67 Microtox-based fast testing system for traditional Chinese medicine injection[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2016, 32: 227-230. |
| [12] |
Ma Y, Huang Y, Jia YL, et al. Improved acute toxicity test method for luminescent bacteria[J]. Environ Pollut Control (环境污染与防治), 2010, 32: 48-52. |
| [13] |
Li XR, Hua H, Yan LC, et al. The relevance research of cocklebur based on microtox technology and acute toxicity test in mice[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2016, 32: 134-138. |
| [14] |
Xia JY, Hua H, Yan LC, et al. Rapid detection of toxicity change of Xanthium sibiricum and its pieces and formulas based on microtox technology[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2016, 32: 151-154. |
| [15] |
Zheng XQ, Yan LC, Zhao JN, et al. Application of microtox technology in detecting the comprehensive toxicity of Houttuynia cordata injection[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2013, 29: 92-95. |
| [16] |
Luo LM, Yan LC, Hou XL, et al. Microtox-based fast testing method of comprehensive toxicity of Shen-Fu injection[J]. World Sci Technol-Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2017, 19: 491-496. |
| [17] |
Luo LM, Yan LC, Wei TX, et al. The microtox-based fast test of comprehensive toxicity of safflower injection[J]. World Sci Technol-Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2016, 18: 1935-1941. |
| [18] |
Luo LM, Yan LC, Hua H, et al. Application of Microtox-based fast test to the evaluation of comprehensive toxicity of Sheng Mai injection[J]. World Sci Technol-Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2016, 18: 1948-1954. |
| [19] |
Zhao BX, Luo LM, Yan LC, et al. Microtox technology for the evaluation of comprehensive toxicity of Shen Mai injection[J]. World Sci Technol-Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2016, 18: 1942-1947. |
| [20] |
Xiong JY, Qin XR, Li H, et al. Biotoxicity based on microtox fast testing system and correlative material basis of Shenmai injection[J]. Remedy Open Access, 2016, 1: 1036-1039. |
| [21] |
Li H, Yan LC, Li HR, et al. Microtox assay for the quality control of Ginkgolide injections[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2017, 33: 45-49. |
| [22] |
Yan Y, Yan D, Zhang P, et al. Evaluation methods for quality volatility about Yiqi Fumai freeze-dried power used for injection based on Bio-thermodynamics exosyndrome[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 41-45. |
| [23] |
Feng X, Yan D, Yan Y, et al. Compatibility evaluation of Chinese medicines injections based on isothermal titration calorimetry[J]. Acta Pharm Sin (药学学报), 2011, 46: 322-328. |
| [24] |
Zhao JN, Yan LC, Zheng XQ. Microtox-based fast testing method of comprehensive toxicity of traditional Chinese medicine[J]. World Chin Med (世界中医药), 2014, 9: 137-140, 144. |
 2019, Vol. 54
2019, Vol. 54


