2. 解放军总医院第五医学中心, 全军中医药研究所, 中西医结合诊疗与研究中心, 北京 100039;
3. 重庆多普泰制药股份有限公司, 重庆 401420
2. China Military Institute of Chinese Medicine, Integrative Medical Center, Fifth Medical Center, General Hospital of Chinese PLA, Beijing 100039, China;
3. Chongqing Duoputai Pharmaceutical Co., Ltd., Chongqing 401420, China
水蛭(hirudo), 又名蚂蟥、马鳖, 为水蛭科动物。2015年版《中国药典》收载水蛭的3个品种, 即蚂蟥(Whitmania pigra Whitman, 宽体金线蛭)、水蛭(Hirudo nipponica Whitman, 日本医蛭)或柳叶蚂蟥(Whitmania acranulate Whitman, 尖细金线蛭)的干燥全体。其中宽体金线蛭为市场主流品种[1], 日本医蛭和尖细金线蛭较为少见。此外, 药典虽未收载菲牛蛭(Poecilobdella manillensis Lesson), 但因其抗凝活性强, 资源丰富, 易于养殖等特点, 在广西, 云南, 海南等地区被广泛应用[2-4]。
《中国药典》 2015年版以测定水蛭的抗凝血酶活性来评价其质量[5], 参照的方法是Markwardt报道[6]的凝血酶滴定法, 其原理是依据水蛭素可与凝血酶以1:1比例结合, 因此一个抗凝血酶活力单位(ATU)等于中和一个单位(NIH)凝血酶的水蛭素量。作为一味成分复杂的动物药, 目前药典中水蛭项下的凝血酶滴定法测定的是与凝血酶结合的一类成分。其中, 水蛭素作为目前最强的凝血酶抑制剂, 主要存在于活体的吸血水蛭的唾液腺[7], 而且水蛭素在强碱性及高温下会发生不可逆失活[8]。目前, 水蛭中药材市场流通的主要品种为非吸血水蛭宽体金线蛭, 临床多以水煎液或配方颗粒应用, 均经过高温煎煮。因此, 有必要基于其活血化瘀的功效, 构建新的生物评价方法。
水蛭是活血化瘀的要药, 临床疗效确切[9-11]。水蛭味咸善入血分, 主要用于血液瘀滞造成的各种心脑血管疾病。研究表明, 血小板聚集异常增高是造成血瘀的一个重要原因[12]。体外血小板聚集功能的测定, 作为一种定量检测, 可以反映血小板在诱导剂的作用下发生聚集变化的动态过程。目前已经被广泛应用于心脑血管疾病的基础研究以及活性药物筛选中[13-15]。因此, 为了探索更能真实反映水蛭临床功效的质量评价方法, 本研究首先测定了高温煎煮水蛭的抗凝血酶活性, 对凝血酶滴定法的适用性进行再评价。以菲牛蛭为吸血水蛭代表, 宽体金线蛭为非吸血水蛭代表, 分别测定水蛭体内和体外的抗血小板聚集活性。最后基于抗血小板聚集活性建立水蛭的生物效价测定方法, 以用于评价水蛭的质量评价。
材料和方法动物和仪器 雄性SD大鼠, SPF级, 体重240~260 g, 动物许可证号: SYXK-(京) 2016-0002, 斯贝福(北京)实验动物科技有限公司。饲养条件:温度(25 ± 2) ℃, 采用标准饲料喂养, 自由进食及饮水。实验过程符合动物实验伦理标准(批准号: IACUC-2017-007)。AggRAM血小板聚集仪(美国Helena公司), L-550台式低速大容量离心机(湖南湘仪离心机仪器有限公司), HW-SY21-K型水浴锅(北京市长凤仪器仪表公司)。
药物与试剂 本研究共采集12批次样品, 产地包括:江西(S1)、江苏1 (S2)、安徽(S3)、江苏2 (S4)、湖北(S5)、山东1 (S6)、江苏3 (S7)、江苏4 (S8)、山东2 (S9)、江西(S10)、大连(S11)、广西(S12)。由解放军总医院第五医学中心全军中药研究所肖小河研究员鉴定, S1~S9分别为水蛭科蚂蟥(Whitmania pigra Whitman, 宽体金线蛭), S10为水蛭科柳叶蚂蟥(Whitmania acranulate Whitman, 尖细金线蛭), S11为水蛭科水蛭(Hirudo nipponica Whitman, 日本医蛭), S12为医蛭科菲牛蛭(Poecilobdella manillensis Lesson)的干燥全体。凝血酶(批号: T4648, Sigma公司); (牛)纤维蛋白原(批号: 601B026, 北京索莱宝科技有限公司); 腺苷二磷酸(ADP, 批号: 6-18-5366, 美国Helena公司); 0.9%氯化钠注射液(批号: 1801073205, 石家庄四药有限公司); 高分子右旋糖酐(50万, 批号: L160S67, 北京百灵威科技有限公司)。
凝血酶滴定法的适用性再评价 分别精密称取适量日本医蛭、菲牛蛭粉末和水蛭素, 加入10倍量水, 分别浸提和煎煮120 min, 3 000 r·min-1离心10 min, 取上清, 冷冻干燥, 备用。按《中国药典》 2015版水蛭项下凝血酶滴定法测定供试品溶液的抗凝血酶活性[5]。
基于急性血瘀动物模型的水蛭抗血小板聚集活性评价 称取适量宽体金线蛭和菲牛蛭, 加10倍量水浸泡30 min, 煮沸后水煎60 min, 纱布过滤, 残渣再次加8倍量水煎煮60 min, 过滤, 合并滤液。浓缩, 冷冻干燥。SD雄性大鼠, 随机分为7组, 每组10只, 分别为空白组, 模型组, 阿司匹林组, 宽体金线蛭高、低剂量组, 菲牛蛭高、低剂量组。除空白组, 模型组给予等体积的蒸馏水, 其余各组均灌胃给药, 水蛭各剂量组分别按2.5 g·kg-1、1.25 g·kg-1给药, 阿司匹林组按100 mg·kg-1给药, 给药体积均为10 mL·kg-1, 每日1次, 连续给药7天。在给药的第7天造模, 除正常对照组外, 大鼠尾静脉注射6%高分子右旋糖酐5 mL·kg-1, 30 min后麻醉, 腹主动脉取血。大鼠腹主动脉取血前禁食不禁水12 h。用血小板聚集仪检测血小板在5 min内的最大聚集程度, 并计算各药物对血小板聚集的抑制率, 计算公式为:抑制率(I, %) = (模型组最大聚集率-给药组最大聚集率) /模型组最大聚集率×100 %。
水蛭体外抗血小板聚集活性评价 测定宽体金线蛭和菲牛蛭供试品溶液的体外抗血小板聚集活性。计算公式为:抑制率(I, %) = (空白溶液的最大聚集率-供试品的最大聚集率) /空白溶液的最大聚集率。
水蛭生物评价提取方法的优化 精密称取水蛭粉末适量, 加入10倍量水, 分别采用超声(200 W超声1 h)、冻融(-80 ℃冷冻1 h, 室温解冻)、回流1 h提取, 过滤, 滤液浓缩, 冷冻干燥, 得干浸膏, 使用时, 用生理盐水溶解, 过滤, 即得样品溶液。以血小板聚集抑制率为评价指标, 对冻融、超声、回流3种提取方式进行比较。
以加水量、煎煮时间和煎煮次数为考察因素(表 1)[16, 17], 按照正交设计表格的条件(表 2), 制备水蛭供试品溶液, 每次试验平行重复3次。以血小板聚集抑制率为评价指标, 优化得到水蛭最佳提取工艺。
| Table 1 Design for factors and levels of L9 (34) orthogonal test |
| Table 2 The design and results of L9 (34) orthogonal test |
方法学考察 根据可靠性检验结果成立的判别要求, 对定量测定水蛭提取物抗血小板聚集活性的结果进行可靠性检验。
取同一编号相同质量浓度的水蛭供试品溶液, 分6次进行测定, 计算平均效价, 考察方法的精密度。实验室3名实验人员分别进行测定, 考察精密度。
用同一编号的水蛭样品粉末6份, 提取制成供试品溶液6份, 计算平均效价, 考察方法的重复性。
水蛭抗血小板聚集效价的测定 雄性SD大鼠, 用戊巴比妥钠(60 mg·kg-1)麻醉, 0.109 mol·L-1枸橼酸钠抗凝真空采血管从腹主动脉取血(1:9), 800 r·min-1离心15 min, 分离上清; 剩余血液重复操作一次, 合并上清, 得到PRP; 剩余血液在转速3000 r·min-1下离心10 min, 吸取上清液, 得到PPP, 备用。PRP和PPP需要保持在18~25 ℃内, 并尽量不要扰动。
用PPP 400 μL进行透光度调零, 测试管中分别加入PRP 175 μL和待测样本50 μL混匀(空白组加入不含药的含0.5% DMSO的生理盐水), 再加入一粒搅拌子, 37 ℃预热3 min, 加入ADP诱导剂25 μL后进行检测, 待检测完毕后, 记录聚集波形和最大聚集率。诱导剂ADP终浓度为10 μmol·L-1。
按正交实验得到的最佳提取工艺提取水蛭, 干燥。以含0.5% DMSO的生理盐水制备水蛭和阿司匹林供试品溶液, 并按1:0.8剂间距稀释。以阿司匹林为工作对照组, 不同批次水蛭供试品为供试品组, 分别测定工作对照组和供试品的血小板聚集抑制率, 平行测定3次。参照《药品生物检定》 “质反应平行线法”进行相对效价计算[18, 19]。对阿司匹林进行原始效价赋值, 定义每毫克阿司匹林的效价为10 000个活性单位(U), 计算水蛭提取物的生物效价, 并检验其可靠性。
统计方法及分析 本研究采用SPSS 20.0软件(SPSS, Chicago)进行统计学分析。计量资料表示为均数±标准差(x±s), 组间均数差异采用Student's t-test进行检验。多组间比较采用单因素方差分析(ANOVA); 采用Probit回归分析计算半数抑制浓度(IC50)及95%置信区间(CI), 并对其差异进行统计学分析。P < 0.05表示差异有统计学意义。
结果 1 凝血酶滴定法的适用性再评价本实验选用活性较强的吸血水蛭、日本医蛭和菲牛蛭来进行煎煮前后的抗凝血酶活性比较。结果表明, 浸提的日本医蛭和菲牛蛭均具有较强的抗凝血酶活性。经高温煎煮后, 水蛭素活性丧失, 日本医蛭由30 U·g-1下降至1 U·g-1, 菲牛蛭由150 U·g-1下降至10 U·g-1, 抗凝血酶活性几近丧失活性。虽然它们的抗凝血酶活性丧失, 但不能代表它们所有的生理活性, 水蛭饮片、配方颗粒等经煎煮后临床应用均有效, 因此, 凝血酶滴定法并不能完全覆盖其临床功效。亟需建立一种新的生物评价方法来评控水蛭的质量。
2 基于急性血瘀动物模型的水蛭体内抗血小板聚集活性测定与空白对照组相比, 经尾静脉注射高分子右旋糖酐造模后, 模型组大鼠的血小板聚集率显著增大(P < 0.001), 说明造模成功; 与模型组比较, 宽体金线蛭和菲牛蛭不同剂量组(2.5和1.25 g·kg-1)均能不同程度的显著抑制ADP诱导的大鼠血小板聚集(P < 0.05或P < 0.001)。结果提示水蛭可显著抑制ADP诱导的血小板聚集(图 1)。
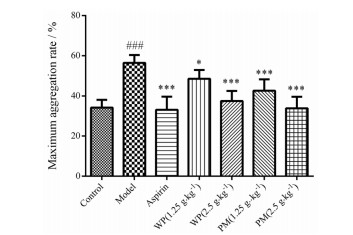
|
Figure 1 Effect of Whitmania pigra and Poecilobdella manillensis on platelet aggregation rate in rats with acute blood stasis (n = 6, x±s). WP indicated Whitmania pigra; PM indicated Poecilobdella manillensis. ###P < 0.001 vs the control group. *P < 0.05, ***P < 0.001 vs the model group |
对不同浓度的宽体金线蛭和菲牛蛭提取物分别进行抗血小板聚集测定, 求得宽体金线蛭的IC50值为120.7 mg·mL-1, 95% CI为103.7~144.2 mg·mL-1。菲牛蛭的IC50值为23.3 mg·mL-1, 95% CI为20.4~26.2 mg·mL-1。说明菲牛蛭的抗血小板聚集活性显著强于宽体金线蛭, 这个结果与体内实验结果一致, 提示体外抗血小板聚集实验对于评价水蛭的抗血小板聚集活性具有可行性。
4 水蛭生物评价方法的提取工艺由图 2可知, 回流提取制得的提取物抗血小板聚集活性最强。因此针对回流提取法进行正交实验优化。
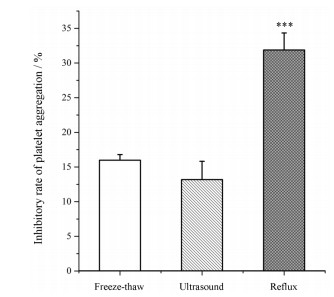
|
Figure 2 Comparison of the antiplatelet aggregation of different hirudo extracts. n = 3, x±s. ***P < 0.001 vs freeze-thaw group |
由正交实验结果可知, 在3个主要因素中, 煎煮次数的影响最大, 煎煮时间次之, 加水量的影响最小。方差分析表明, 煎煮次数对于水蛭的抗血小板聚集活性有显著性意义。最后选择提取方法条件为A1B1C3, 即10倍量水, 煎煮1.5 h, 煎煮3次(表 3)。后续实验按此条件进行样品的提取。
| Table 3 The ANOVA of L9 (34) orthogonal test. A: Amount of water; B: Decoction time; C: Decoction times; D: Error; S: Sum of deviation squares; f: Degrees of freedom. F0.05(2, 2) = 19.0 |
结果表明, 回归项差异显著(P < 0.01), 说明随着质量浓度的增加, 血小板抑制率呈规律性增加。偏离平行不显著(P > 0.05), 表明对照品和供试品的剂量曲线呈平行直线关系。说明本方法可靠性检验的结果成立, 可用于定量测定水蛭提取物的抗血小板聚集活性。
5.2 精密度精密度结果表明, 6次测定的平均效价为108.72 U·mg-1, RSD 3.6%。中间精密度结果表明, 平均效价109.99 U·mg-1, RSD 5.6%, 说明不同实验人员对测定结果影响较小, 该方法稳定性较好。
5.3 重复性6份供试品溶液的平均效价107.80 U·mg-1, RSD 6.3%。表明该方法重复性良好。
6 不同批次水蛭效价测定由效价测定结果(表 4)可知, 本研究建立的方法可以很好地区分不同来源的水蛭药材的抗血小板聚集活性差异。宽体金线蛭的抗血小板聚集效价为76.9~127.95 U·mg-1, 尖细金线蛭的抗血小板聚集效价为126.27 U·mg-1, 日本医蛭的抗血小板聚集效价为132.89 U·mg-1, 菲牛蛭的抗血小板聚集活性为573.53 U·mg-1。以抗血小板聚集效价为指标, 从品种的角度来看, 菲牛蛭的活性强于宽体金线蛭, 提示菲牛蛭的质量优于宽体金线蛭。宽体金线蛭为市场主流品种, 所以产地分布较广, 不同产地的宽体金线蛭的抗血小板聚集效价存在差异。总的来说, 不同品种和不同产地的水蛭的抗血小板聚集效价不同, 提示其质量存在差异。故本方法可用于水蛭的抗血小板聚集活性的定量测定, 以评价其质量。
| Table 4 Biopotency of 12 batches of hirudo based on anti-platelet aggregation. FL: Fiducial limit |
动物药成分复杂, 物质基础不明确, 直接导致目前动物药质量评价与控制方法相对落后, 很大一部分动物药只是通过性状、鉴别和检查等进行质控。只有少部分选择指标性成分进行定性检测或定量测定。生物评价具有关联药效、整体可控等技术优势, 可以很好地关联临床功效, 反映中药的整体作用和质量, 已成为中药质量标准化的重要发展方向之一[20]。尤其应用于成分复杂、理化方法不能测定其含量, 或理化测定不能反映其临床生物活性的动物药, 更凸显其优越性[21, 22]。
本研究采取加热回流提取的方法来制备水蛭供试品, 与其临床应用更为一致, 更能反映水蛭的实际功效, 从而真实反映水蛭的质量。本课题组建立生物评价方法遵循“体外为先, 体内为本, 关联药效”的原则。即优先考虑灵敏、易量化、高通量的体外活性测定方法, 并需经过体内实验验证[23]。研究表明抗血小板聚集作用亦是水蛭起到活血化瘀功效的药理作用之一[24, 25]。体内药效实验结果表明水煎煮提取水蛭具有抗血小板聚集活性, 但通过常规药理实验所建立的生物活性检测方法常常操作繁琐, 准确性和重现性也较差。鉴于体外测定结果与体内活性一致, 说明体外抗血小板聚集模型对于评价水蛭的抗血小板聚集活性具有可行性。因此, 选择体外血小板聚集这一关键环节, 建立了基于抗血小板聚集活性的水蛭生物效价检测方法, 测定了不同来源水蛭药材的抗血小板聚集活性, 来评价水蛭活血化瘀的功效, 为现行水蛭质量控制方法提供补充和参考。
| [1] |
Liu F, Yang DJ. Study on artificial breeding model of medical leech in China[J]. Mod Tradit Chin Med Mater Med-World Sci Tech (世界科学技术-中医药现代化), 2014, 16: 2170-2173. |
| [2] |
Food and Drug Administration of Guangxi Zhuang Autonomous Region: Guangxi Zhuang Pharmacopoeia (广西壮药典)[S]. Nanning: Guangxi Science and Technology Publishing House, 2011183-184.
|
| [3] |
Yang T. Zoology of China (Anthropozoa. Leeches) (中国动物志·蛭纲)[M]. Beijing: Science Publishing House, 1996: 120.
|
| [4] |
Yunnan Food and Drug Administration. Yunnan Traditional Chinese Medicine Standard(云南省中药材标准)[S]. Kunming: Yunnan Science and Technology Press, 2013. YNZYC-0357.
|
| [5] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2015: 84.
|
| [6] |
Markwardt F. Hirudin as an inhibitor of thrombin[J]. Methods Enzymol, 1970, 19: 924-932. DOI:10.1016/0076-6879(70)19082-3 |
| [7] |
Baskova IP, Cherkesova DU, Mosolov VV. Hirudin from leech heads and whole leeches and "pseudo-hirudin" from leech bodies[J]. Thromb Res, 1983, 30: 459-467. DOI:10.1016/0049-3848(83)90180-9 |
| [8] |
Chang JY. Stability of hirudin, a thrombin-specific inhibitor. The structure of alkaline-inactivated hirudin[J]. J Biol Chem, 1991, 266: 10839-10843. |
| [9] |
Wang E, Sun F, Wei W, et al. Meta-analysis of the effect of proprietary Chinese medicine containing Leech on carotid atherosclerosis[J]. Mod J Integr Tradit Chin West Med (现代中西医结合杂志), 2015, 24: 2519-2523. |
| [10] |
Dong H, Ren JX, Wang JJ, et al. Chinese medicinal leech: ethnopharmacology, phytochemistry, and pharmacological activities[J]. Evid Based Complement Alternat Med, 2016, 2016: 1-11. |
| [11] |
Porshinsky BS, Saha S, Grossman MD, et al. Clinical uses of the medicinal leech: a practical review[J]. J Postgrad Med, 2011, 57: 65-71. DOI:10.4103/0022-3859.74297 |
| [12] |
Li Z, Delaney MK, Brien KA O, et al. Signaling during platelet adhesion and activation[J]. Arterioscler Thromb Vasc Biol, 2010, 30: 2341-2349. DOI:10.1161/ATVBAHA.110.207522 |
| [13] |
Yang Y, Zuo J, Li JM, et al. Design, synthesis, and biological evaluation of phenylpropenamides compounds as anti-platelet aggregation[J]. Acta Pharm Sin (药学学报), 2017, 52: 120-125. |
| [14] |
Tan P, Zhang HZ, Li Y, et al. Preliminary study on antiplatelet aggregation of 10 anthraquinones in Rhei Radix et Rhizoma based on bioassay[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 859-865. |
| [15] |
Zhang HZ, Tan P, Liu ZJ, et al. Activating blood biological potency assay and chemical fingerprint chromatogram applied to quality evaluation of rhubarb[J]. Acta Pharm Sin (药学学报), 2017, 52: 436-442. |
| [16] |
Hu RB, Cheng Y, Chen WH, et al. Comprehensive study on the extraction of hirudo by determinating the antithrombase activity[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2011, 29: 2553-2555. |
| [17] |
Yao L, Wang WM, Zhang YY, et al. Studies on extraction and purification technology of Chinese medicine leeches[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2011, 17: 31-33. |
| [18] |
Zhou HJ. Drug Biological Analysis (药品生物检定)[M]. Beijing: People's Medical Publishing House, 2005: 127-134.
|
| [19] |
Wang JB, Jin C, Li HF, et al. Essential issues of bioassay methods for quality control of laxative traditional Chinese medicines[J]. Acta Pharm Sin (药学学报), 2009, 44: 500-505. |
| [20] |
Xiao XH, Wang JB, Yan D. Studies and application of biological evaluation in the quality standardization of Chinese medicines[J]. Mod Tradit Chin Med Mater Med-World Sci Tech (世界科学技术-中医药现代化), 2014, 3: 514-518. |
| [21] |
Wang X, Ou-yang LD, Dai CM, et al. Biological assay in quality control of animal medicines[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 2228-2235. |
| [22] |
Luo Y, Jin C, Zhou J, et al. Quality evaluation of artificial musk based on its inhibitory effect on cyclooxygenase-2[J]. Acta Pharm Sin(药学学报), 2011, 46: 438-442. |
| [23] |
Yan D. Investigation on pattern and methods of quality control for Chinese materia medica based on dao-di herbs and bioassay-bioassay for Coptis chinensis[J]. Acta Pharm Sin (药学学报), 2011, 46: 568-572. |
| [24] |
Liu X, Wang C, Ding X, et al. A novel selective inhibitor to thrombin-induced platelet aggregation purified from the leech Whitmania pigra[J]. Biochem Biophys Res Commun, 2016, 473: 349-354. DOI:10.1016/j.bbrc.2016.03.117 |
| [25] |
Liang JQ, Mi SQ, Wang NS. Anticoagulative effect and antiplatelet aggregation effect of combination of hirudo and tabanus on rat model of blood stasis syndrome[J]. J Chin Med Mater (中药材), 2009, 32: 1347-1350. |
 2019, Vol. 54
2019, Vol. 54


