2. 解放军总医院第五医学中心, 全军中医药研究所, 北京 100039;
3. 中国医学科学院、北京协和医学院肿瘤医院, 北京 100021;
4. 四川省中医药科学院, 国家中医药管理局中药质量生物评价重点研究室, 四川 成都 610041;
5. 江西中医药大学, 江西 南昌 330004;
6. 四川好医生攀西药业有限责任公司, 四川 西昌 615000
2. China Military Institute of Chinese Medicine, the Fifth Medical Centre of Chinese People's Liberation Army General Hospital, Beijing 100039, China;
3. Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021;
4. State Key Laboratory of Quality Evaluation of Traditional Chinese Medicine, Sichuan Academy of Traditional Chinese Medicine, Chengdu 610041, China;
5. Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China;
6. Sichuan Good Doctor Panxi Pharmaceutical Co., Ltd., Xichang 615000, China
附子是确有疗效的有毒中药, 因其具有快速而显著的强心、升压、抗休克等作用, 被誉为“回阳救逆第一品药”, 治病保命“药中四维”。以附子为原料开发的现代中成药参附注射液、四逆汤、芪苈强心胶囊等, 对于各种急、慢性心衰均具有显著疗效, 奠定了附子在中医临床的特殊地位。为控制附子毒性, 从古至今衍生出46种炮制品类型。当今市场流通的附子饮片类型多达17种[1], 包括黑顺片、白附片、淡附片、炒附片等。一定程度上讲, 附子的炮制品类型是所有中药中最为丰富的, 一方面反映了中药炮制技艺的多元化, 另一方面也为中医临床应用带来了困惑。这些饮片的质量如何、毒性与疗效是否存在差异、临床能否等同使用[2]有待研究。
目前, 附子的质量评价主要参照《中国药典》2015年版(一部), 分别以3个双酯型生物碱含量之和控制安全性, 以3个单酯型生物碱含量之和评价有效性。然而, 附子中主要的毒性成分乌头碱、新乌头碱、次乌头碱的毒性相差较大, 乌头碱与新乌头的毒性为次乌头碱毒性的3倍, 三者含量简单相加合理性存疑[3, 4]; 此外, 附子中尚存在众多毒性较低, 但含量较高的物质, 如3种单酯型生物碱、尼奥林、宋果灵等, 微毒成分的毒性综合叠加效应不可忽视[3, 5]。附子的强心成分认识尚未完全统一[6], 各成分的量效关系、综合效应不明确, 单独采用多组分含量测定方法仍很难准确表征其强心活性。
为此, 本文依据附子的毒效作用特点, 通过测定引起大鼠室性早搏(PVC)的最小剂量表征附子的整体毒性[7], 通过测定对急性心衰动物模型血液流变学(左心室内压最大上升速率, +dp/dtmax)的即时改善情况表征附子的强心活性, 并通过与化学成分关联分析, 进一步筛选强心质量标志物。该研究有望为精准评价附子毒效以及不同炮制品的质量控制提供科学依据, 为提高中药临床用药水平提供支撑。
材料与方法仪器 RM6240BD型多道生理信号采集处理系统(成都仪器厂), 压力换能器, 心电图导联; 无阻尼动脉导管、静脉插管; BYZ-810T注射泵(长沙比扬医疗器械有限公司); 美国Agilent1260高效液相色谱仪(配有在线脱气机, 四元泵, 自动进样器)和Agilent6460C三重串联四极杆液质联用仪, 配有ESI离子源(美国Agilent公司); Sartorius-BS110S千分之一分析天平、十万分之一分析天平(德国赛多利斯公司)。
动物 雄性SPF级SD大鼠, 240 ± 10 g, 6~10周龄, 由中国人民解放军军事医学科学院实验动物中心提供, 动物许可证号: SCXK-(A) 2012-0004。动物饲养温度为20 ± 0.5 ℃, 湿度55% ± 5%。本研究严格按照中华人民共和国科技部《实验动物管理条例》的要求进行。动物实验规程经原解放军302医院动物实验伦理委员会批准(批准号: IACUC-2013-054)。
药品与试剂 生附片(Shengfupian, SFP)、黑顺片(Heishunpian, HSP)、白附片(Baifupian, BFP)、蒸附片(Zhengfupian, ZFP)、炒附片(Chaofupian, CFP)、刨附片(Baofupian, BAP)、炮附子(Paofuzi, PFZ)、炮天雄(Paotianxiong, PTX)购于四川江油中坝附子科技有限公司, 经全军中医药研究所肖小河研究员鉴定为毛茛科植物乌头(Aconitum carmichaelii Debx.)子根的各种加工品。新乌头碱(mesaconitine, MA)、乌头碱(aconitine, AC)、次乌头碱(hypaconitine, HA)、苯甲酰新乌头原碱(benzoylmesaconine, BMA)、苯甲酰乌头原碱(benzoylaconine, BAC)、苯甲酰次乌头原碱(benzoylhypaconine, BHA)对照品购于中国食品药品检定研究院, 批号分别为111795-200901、111794-200901、111796-201303、110799-201106、110720-201111、110798-201106;乌头原碱(acontine, AN)对照品购于成都普瑞法科技开发有限公司, 批号为15122008;尼奥林(neoline, NE)、附子灵(fuziline, FU)、宋果灵(songorine, SO)、塔拉乌头胺(talatisamine, TA)购于成都普菲德生物技术有限公司, 批号分别为131214、140315、140420、131112;去甲乌药碱(higenamine, HI)与去甲猪毛菜碱(salsolinol, SA)对照品购于成都克洛玛生物科技有限公司, 批号分别为141201与141202;各对照品纯度均大于98%。盐酸普罗帕酮注射液, 规格10 mL: 35 mg, 国药准字H44020249, 广州白云山明兴制药有限公司; 尼莫酮, 浓度50 mL: 10 mg, Bayer Schering Pharma, 产品批号BXG2EV1;肝素钠注射液, 规格2 mL: 12 500 U, 国药准字H32022088, 常州千红生化制药股份有限公司, 产品批号090916;乌来糖(氨基甲酸乙酯), 化学纯, 纯度≥98%, 国药集团化学试剂有限公司; 去乙酰毛花苷注射液(西地兰注射液), 国药准字H31021178, 上海旭东海普药业有限公司; 生理盐水, 国药准字H13023200, 石家庄四药有限公司。
心毒性测试原理 附子具有明显的心毒性。根据中毒程度的不同, 依次表现为PVC、室性心动过速、心室纤颤、心室扑动、停搏。因此, 可通过心电图导联记录引起大鼠PVC的最小给药剂量, 作为附子心毒性的评价指标。该实验条件下, 大鼠仅轻微中毒, 停药后药物快速代谢, 毒性消失。动物清醒后可循环使用。
心毒性测试方法 大鼠用20%乌来糖溶液(8 mL·kg-1)麻醉, 背位固定, 连接电极, 用多道生理信号采集处理系统, 测定二导联心电图, 描记正常心电图。注射器与头皮针相连, 一端固定于微量注射泵上, 另一端接于大鼠尾静脉中, 以2 mL·h-1恒速推注附子提取液, 观察记录心电图的变化, 当首次出现QRS波倒置及变宽等室性早搏变化时, 停止推注, 记录推注体积。体积越小, 样品毒性越强。若推注体积大于4 mL时仍未发生PVC, 停止推注, 认为该供试品测不出心脏微毒[7]。
心毒性测试供试品溶液的制备 称取细粉约2 g, 加入10倍量70%乙醇, 超声提取30 min (功率300 W, 频率40 kHz), 以5 000 r·min-1离心10 min, 分离上清液, 加入70%乙醇定容至20 mL。将提取液全部转移至蒸发皿中, 待溶剂挥发至约2 mL, 加入生理盐水稀释定容, 即得供试品溶液。生附片提取液定容至10 mL, 其余附片提取液定容至4 mL。
附子炮制品心毒性的测定 推注饮片的质量除以大鼠的体重即可算出8种炮制品引起PVC的MTD, 以此表征心毒性的强弱。
强心活性测试原理 复制大鼠急性心衰模型, 给予附子提取液后, 记录血液流变学的变化, 观察一定时间内心脏收缩功能金指标+dp/dtmax的恢复情况, 评价附子的强心效果。
强心活性测试方法 大鼠用20%乌来糖溶液(8 mL·kg-1)麻醉, 仰卧固定四肢, 于颈部正中线纵向切开皮肤。分离左侧颈外静脉, 眼科剪切口, 向近心端方向插入静脉插管, 结扎固定, 用于泵入造模液与附子提取液。用文氏钳在呼吸肌正中偏右分离右侧颈总动脉约2 cm, 结扎远心端, 动脉夹夹闭近心端, 经颈动脉插入已注满肝素钠生理盐水(250 U·mL-1)的左心室导管。轻轻松开动脉夹, 将导管插入, 当感到导管随心脏搏动明显时, 放慢插管速度, 可观察到动脉血在导管中小幅跳动, 示波器显示明显的动脉压(动脉压波上沿一般高于90 mm Hg, 下沿在50~80 mm Hg), 此时, 导管已插入4 cm左右。当显示器上波形由血压波变为下沿达0 mm Hg附近具有明显舒张期而峰顶平坦的波形时, 表明导管已插入左心室。再送入导管约0.2~0.3 cm, 若波形保持不变, 则将导管固定于颈总动脉上[8, 9]。所有信号均同步记录在四通道生理记录仪上。实验前, 采用血压计对压力换能器定标校正。测定收集左心室内压前, 扭转三通阀, 关闭动脉导管, 使换能器与大气联通, 快速零点校正, 即可记录数据。
正常大鼠+dp/dtmax的平均值在6 000~8 000 mmHg·s-1, 心率在每分钟350~450次。采用恒速泵从静脉推注盐酸普罗帕酮注射液与尼莫酮注射液(1:1)混合溶液, 推注速度10 mL·h-1, 推注时间6~7 min, 推注剂量1.0~1.2 mL; 此时+dp/dtmax下降约50% (或更多)。稳定5 min, 观察+dp/dtmax是否上升, 若无上升趋势, 即造模成功。
强心活性测试供试品制备方法考察 取黑顺片20 g, 加10倍量去离子水回流煎煮, 考察煎煮次数(1、2和3次)与煎煮时间(0.5、1、2、4和8 h)对强心活性的影响。
附子炮制品强心活性的测定 分别制备各种附子炮制品的供试品溶液, 按照4 mL·h-1的流速从颈静脉推注给药, 记录并计算急性心衰+dp/dtmax在15 min内最大上升幅度(maximum restoration ratio, RRmax)与恢复程度(restoration degree, RD)。每组5只动物。所有计量资料采用均值±标准差表示, 采用SPSS22.0软件进行数据分析。组间比较采用单因素方差分析, 经Levene检验判断方差齐性; 方差齐, 采用LSD检验, 方差不齐, 采用Tamhane检验, 检验水准α为0.05。
附子炮制品强心活性的聚类分析 以RRmax与RD为评价指标, 采用SPSS 22.0统计软件对8种饮片的强心效果进行系统聚类。
附子水提液的化学分析及强心标志物筛选原理 采用LC-MS/MS测定水煎液中10种生物碱的含量(乌头碱、新乌头碱、次乌头碱3种剧毒双酯型生物碱因完全水解无法测出)。采用相关分析法研究水提液强心活性与成分含量的相关性, 确定强心标志物[10]。
色谱与质谱条件 色谱柱为Phenomenon Gemini C18色谱柱(4.6 mm×150 mm, 5 μm); 流动相为水(A, 0.05%甲酸)-乙腈(B), 梯度洗脱, 0~2 min, 2%~5% B; 2~5 min, 5%~10% B; 5~10 min, 10%~15% B; 10~15 min, 15%~30% B; 15~20 min, 30%~50% B, 进样前按流动相初始条件平衡5 min; 体积流量0.3 mL·min-1; 柱温30 ℃; 进样量5 μL。离子源为ESI源, 正离子模式; 脱溶剂温度300 ℃; 脱溶剂气流N2 11 L·min-1; 雾化器压力15 psi (1 psi = 6.895 kPa); 毛细管电压4 kV; 扫描方式为多反应检测(MRM)[11]。
对照品溶液的制备 分别取各对照品适量, 精密称定, 用甲醇配制成含0.357 μg·mL-1 HI、0.163 μg·mL-1 SA、0.089 μg·mL-1 AN、1.032 μg·mL-1 NE、1.320 μg·mL-1 FU、2.904 μg·mL-1 SO、0.330 μg·mL-1 TA、0.736 μg·mL-1 BMA、0.714 μg·mL-1 BAC、0.871 μg·mL-1 BHA、0.771 μg·mL-1 MA、0.786 μg·mL-1 AC、0.786 μg·mL-1 HA的对照品储备液。
水提液供试品的制备 取各饮片20 g, 加10倍量去离子水煎煮1 h, 提取3次, 滤过, 合并滤液, 滤液定容至600 mL, 以5 000 r·min-1离心10 min, 取上清液, 即得。由于生附片中乌头碱等剧毒成分含量较高, 在第一煎时煎煮2 h, 其余提取参数不变, 以充分减毒, 保证实验动物的安全。
水提液的含量测定 按上述色谱与质谱条件进样, 进行LC-MS/MS分析, 测定样品中10种生物碱的含量, 每个样品平行测定3份。
关联分析筛选附子炮制品的强心标志物 生附片中生物碱含量显著高于其他炮制品, 数据的轻微波动会引起相关性结果的明显变化; 去甲乌药碱仅在生附片提取液中检出, 因此选择除生附片外的7种炮制品中去甲猪毛菜碱等9种生物碱含量与RRmax、RD进行相关性分析, 探寻成分含量与强心活性的关系。
附子强心标志物的验证 直接给予急性心衰大鼠颈静脉推注13种生物碱单体溶液, 给药浓度分别为5.50 μg·mL-1 AC、5.35 μg·mL-1 MA、5.00 μg·mL-1 HA、1.06 mg·mL-1 BAC、1.05 mg·mL-1 BMA、1.00 mg·mL-1 BHA、136 μg·mL-1 AN、133.00 μg·mL-1 NE、103.00 μg·mL-1 FU、89.50 μg·mL-1 SO、50.00 μg·mL-1 TA、50.00 μg·mL-1 HI、50.00 μg·mL-1 SA, 观察其强心活性。
结果 1 MTD的测定大鼠正常心电图与室性早搏的心电图见图 1A, 8种饮片的计算结果见图 1B。由结果可知, 生附片的醇提液毒性强, 每只大鼠尾静脉推注约0.04 g生附片即发生室性早搏, 毒性远高于其余7种炮制品; 其次分别为黑顺片、白附片、刨附片、炮附子、蒸附片, 这5种炮制品的MTD在2.64~5.75 g·kg-1, 表明黑顺片与白附片在醇提情况下, 仍具有一定的心毒性, 刨附片、炮附子、蒸附片则需在更大给药剂量条件下才能诱发室性早搏, 安全性更高; 炒附片与炮天雄未检测出MTD, 安全性非常高。

|
Figure 1 Normal electrocardiogram (ECG) and premature ventricular contraction (PVC) ECG of rats (A), minimal toxic dose (MTD) results of different Aconiti Lateralis Radix Praeparata (ALRP) products (B). *P < 0.05 vs SFP. SFP, HSP, BFP, ZFP, CFP, BAP, PFZ, and PTX represented Shengfupian, Heishunpian, Baifupian, Zhengfupian, Chaofupian, Baofupian, Paofuzi, and Paotianxiong, respectively |
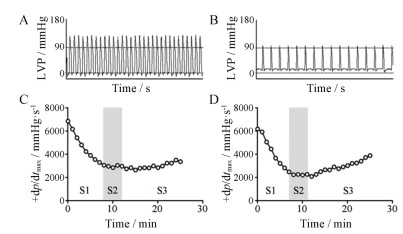
正常大鼠与心衰大鼠的左心室内压示意图见图 2A、B。当生理盐水与西地兰注射液(阳性药)作用于急性心衰大鼠, 其+dp/dtmax曲线会经历造模期(S1)、稳定期(S2)及恢复期(S3) (图 2C、D)。S1期, 给予造模药后, +dp/dtmax快速下降, 当下降幅度超过50%时, 停止造模。进入S2期后, 观察5 min内+dp/dtmax数值是否明显上升; 若不明显上升, 则认为模型复制成功。给予西地兰注射液后, +dp/dtmax数值会立即上升, 进入恢复期。连续给药至少15 min, 观察+dp/dtmax数值随给药时间(剂量)的变化, 计算15 min内最大的恢复率RRmax (%)与恢复程度RD (%)。计算公式如下:
| $ {\rm{R}}{{\rm{R}}_{{\rm{max}}}} = \frac{{{{\left( { + {\rm{d}}p/{\rm{d}}{t_{{\rm{max}}}}} \right)}_{{\rm{max}}}} - {{( + {\rm{d}}p/{\rm{d}}{t_{{\rm{max}}}})}_i}}}{{{{( + {\rm{d}}p/{\rm{d}}{t_{{\rm{max}}}})}_i}}} \times 100{\rm{\% }} $ | (1) |
| $ {\rm{RD}} = \frac{{{{\left( { + {\rm{d}}p/{\rm{d}}{t_{{\rm{max}}}}} \right)}_{15}}}}{{{{( + {\rm{d}}p/{\rm{d}}{t_{{\rm{max}}}})}_0}}} \times 100{\rm{\% }} $ | (2) |
|
Figure 2 The left ventricle pressure (LVP) for normal rats (A), and for heart failure rats (B). The change of +dp/dtmax value after injecting pure water (C) and deslanoside injection (D), and the whole process included the modeling stage (S1), stable stage (S2), and recovery stage (S3) |
公式中(+dp/dtmax)0为造模前的+dp/dtmax, (+dp/dtmax)i为稳定5 min后的初始+dp/dtmax, (+dp/dtmax)15为恢复期第15 min时的+dp/dtmax, (+dp/dtmax)max为恢复期15 min内最大的+dp/dtmax。
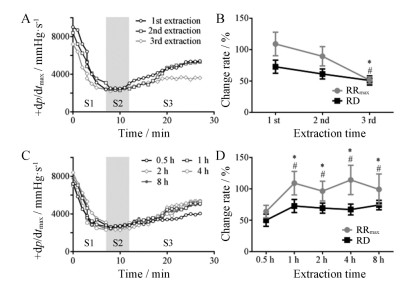
3 强心活性测试供试品制备方法的优化结果见图 3。由结果可知, 黑顺片第1次提取与第2次提取强心效果相当, 第3次提取后仍具有部分强心活性, 但活性降低, 提取次数以3次为佳。提取时间对黑顺片强心效果影响明显, 提取0.5 h后水煎液即有强心活性, 但活性较弱; 当提取时间延长至1 h以上, 强心效果不再随时间的延长而显著增加。因此, 供试品溶液的制备方法为:取附子饮片20 g, 加10倍量去离子水回流提取3次, 每次1 h, 滤过, 合并滤液, 定容至600 mL。
|
Figure 3 The change of +dp/dtmax value effect of decoction times on heart failure rats (A). Screened results of decoction times on maximum restoration ratio (RRmax) and restoration degree (RD) (B). *P < 0.05 vs 3rd RRmax, #P < 0.05 vs 3rd RD. The change of +dp/dtmax value effect of decoction time on heart failure rats (C). Screened results of decoction time on RRmax and RD (D). *P < 0.05 vs 0.5 h RRmax, #P < 0.05 vs 0.5 h RD |
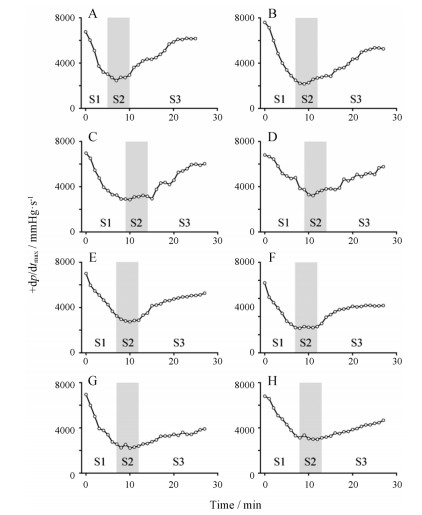
附子炮制品对急性心衰大鼠+dp/dtmax的代表性图谱见图 4, 数据统计分析见表 1。由结果可知, 8种附片均具有明确的强心效果, 能快速升高急性心衰大鼠的+dp/dtmax, 恢复心功能, 但不同炮制品的作用又有差异。其中, 生附片强心活性最强, 连续静脉推注给药15 min, 大鼠心功能几近恢复正常, 强心效果明显强于其他炮制品。炮附子与炮天雄强心活性明显弱于其他附片, 大鼠心功能仅恢复约60%。
|
Figure 4 The effect of SFP (A), HSP (B), BFP (C), ZFP (D), CFP (E), BAP (F), PFZ (G), and PTX (H) on the +dp/dtmax of heart failure rats |
| Table 1 The effect of different fuzi processed products on +dp/dtmax in heart failure rats. n = 5, x ± s. *P < 0.05 vs SFP RRmax, #P < 0.05 vs SFP RD |
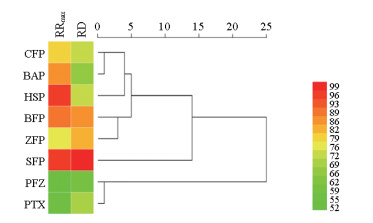
结果见图 5。8种炮制品明显可分为3类, 第Ⅰ类是生附片, 第Ⅱ类黑顺片、白附片、蒸附片、炒附片与刨附片, 第Ⅲ类是炮附子与炮天雄。结合各附片的强心作用强弱, 生附片为强活性饮片, 白附片、黑顺片、蒸附片、炒附片与刨附片为中等强度活性饮片, 而炮附子、炮天雄为弱活性饮片。
|
Figure 5 Cluster analysis results for different processed products of ALRP based on cardiac effect |
10种待测成分的提取离子流见图 6, 用于定量分析的检测离子对见表 2。该方法满足含量测定的要求。

|
Figure 6 EIC of ten identified alkaloids, HI (A), SA (B), AN (C), BMA (D), BAC (E), BHA (F), NE (G), FU (H), SO (I), and TA (J) |
| Table 2 The detected ion pairs of fourteen alkaloids |
结果见表 3。提取液中剧毒的乌头碱、新乌头碱与次乌头碱均无法检出, 提取液安全可靠; 除生附片外, 其余炮制品均无法检出去甲乌药碱。生附片中去甲猪毛菜碱含量约为黑顺片的4.4倍、白附片的7.6倍、蒸附片的8.1倍, 其余生物碱含量也显著高于各种饮片。
| Table 3 Determined results of 10 investigated compounds in the decoction of ALRP processed products (ng·mL-1). "-" means no detection |
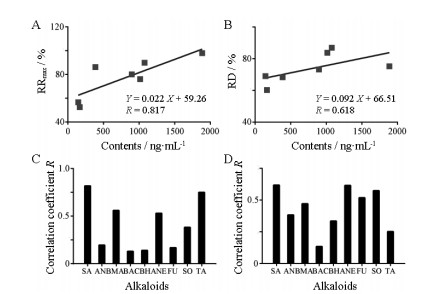
结果见图 7。去甲猪毛菜碱含量与RRmax、RD的相关性系数高达0.817、0.618, 相关性较好, 明显高于其余8种生物碱; 而3种单酯型生物碱与RRmax、RD的相关性系数仅为0.13~0.559 7、0.133 8~0.471 0, 可认为去甲猪毛菜碱与强心作用的相关性较大, 而单酯型生物碱与强心作用相关性不大。
|
Figure 7 Correlation analyses between salsolinol content and RRmax (A), and salsolinol content and RD (B). Correlation coefficient R of nine alkaloids with RRmax (C) and RD (D) |
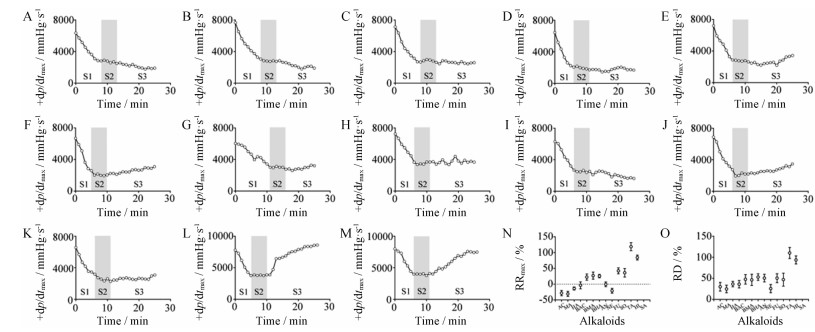
结果见图 8。去甲乌药碱与去甲猪毛菜碱具有显著的强心活性后, 给药后心肌收缩功能立即恢复, 给药15 min后超过或接近正常水平; 其余11种生物碱均不具备强心活性, 乌头碱等3种双酯型生物碱给药后不但无强心活性, 还会导致心肌收缩功能的进一步降低。该研究直接证实了去甲乌药碱与去甲猪毛菜碱为附子的强心活性物质。
|
Figure 8 The change of +dp/dtmax value after AC (A), MA (B), HA (C), BAC (D), BMA (E), BHA (F), AN (G), NE (H), FU (I), SO (J), TA (K), HI(L), or SA (M) was injected into heart failure rats, and their calculated results of RRmax (N) and RD (O) |
强心效果的评价载体主要包括心肌细胞、离体心脏、在体心脏等方法[12]。心肌细胞主要源于乳鼠心室细胞分离培养, 也可直接购买iPS人源干细胞定向诱导分化心肌细胞[13]; 采用倒置显微镜或高内涵细胞成像分析系统通过观察心肌搏动次数与幅度, 以评价细胞的强心效果。但心肌细胞为原代细胞, 分离、纯化、培养存在一定的技术难度, 且细胞收率低, 评价系统稳定性较差。离体心脏主要来源于离体蛙心或蟾蜍, 心肌灌流实验技术难度相对较低, 但实验结果受供试品溶液所含离子浓度的影响较大, 加之缺乏在体神经体液调节能力, 实验结果的证据力明显不足[14]。为此, 本研究选择整体动物的心脏血流动力学为评价指标, 测定结果真实可靠, 最贴近临床评价指标。
大鼠急性心衰模型的复制, 最常用的药物包括戊巴比妥钠、尼莫地平、盐酸普罗帕酮等[8, 15, 16]。其中, 戊巴比妥钠是中枢抑制剂, 可作为催眠与麻醉药; 但该药易引起心率失常, 且易抑制呼吸中枢, 造成动物突然死亡, 通常使用呼吸机辅助, 增加实验难度。尼莫地平注射液是中枢降压药, 为钙离子通道阻断剂, 单用该药能使+dp/dtmax下降一定幅度并维持稳定, 但难以达到大幅降低的技术要求。盐酸普罗帕酮注射液临床常用于阵发性室性心动过速的治疗, 为钠离子通道阻断剂, 能显著降低心率, 单用该药能使+dp/dtmax快速下降, 但心功能易恢复, 造模效果难以维持。通过反复预试, 确定盐酸普罗帕酮与尼莫地平等比例配伍, 能达到快速造模且效果稳定的实验目的。
在急性心力衰竭大鼠模型上观察附子的强心效果, 证据力强, 能准确反映附子的活性, 避免离体细胞或组织观察结果的假阳性。采用恒速泵颈外静脉推注给药, 既能保证给药速率与给药量的一致性, 降低实验操作的影响; 又能确保药物快速起效, 降低胃肠道给药过程中动物个体差异的影响。同时, 该实验载体能观察药物作用的动态变化趋势, 也便于研究药物的量-时-效关系, 具有实时动态的技术特点。
关于附子强心的物质基础一直存有争议, 有学者认为脂溶性生物碱可能是其强心成分, 如王璐[17]等采用离体蛙心灌流发现北乌头碱、新乌头原碱、多根乌头碱、异塔拉定、次乌头原碱及3-去氧乌头原碱等二萜类生物碱具有强心活性。有学者[18]认为乌头碱等双酯型生物碱仅具有毒性, 乌头碱及其水解产物不具强心活性; 强心物质主要是去甲乌药碱、去甲猪毛菜碱、氯化甲基多巴胺等水溶性成分, 该观点亦为《中药药理学》教材认可。此外, 也有学者认为水溶性的尿嘧啶、鸟苷[19]及附子苷[20]也是强心成分。
针对上述争议, 课题组对13种单体成分的活性进行了验证, 结果显示, 乌头碱、新乌头碱、次乌头碱及其水解产物苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱、乌头原碱对于急性心衰动物并不具备强心效果, 且乌头碱、新乌头碱、次乌头碱静脉推注后会进一步损伤降低心肌收缩功能; 脂性生物碱尼奥林、附子灵、宋果灵、塔拉乌头胺也不具备强心作用; 而去甲乌药碱与去甲猪毛菜碱静脉注射后能立即增强心肌收缩力, 产生强心效果, 结果快速可靠。该研究结果与周远鹏等学者在上世纪80年代的研究结果一致[21, 22]。去甲乌药碱具有明显的正性肌力作用, 能增加左心室收缩压的最大上升速率, 缩短收缩期持续时间[23]; 去甲猪毛菜碱也具有正性肌力作用, 但与浓度有关, 低浓度表现为促进, 高浓度则出现一定程度的抑制[24]。
结合课题组前期LC-MS/MS测定发现, 江油泥附子中去甲乌药碱含量约为20 μg·g-1, 去甲猪毛菜碱含量约为650 μg·g-1。但两个成分水溶性强, 在炮制水处理环节大量损失; 尤其是去甲乌药碱在各种附片中几乎无法检出。制附片中普遍存在的是去甲猪毛菜碱, 含量在4~270 μg·g-1。生附片与其余附片在强心物质上存在质与量的双重差异。生附片中同时含有强强心成分去甲乌药碱与弱强心成分去甲猪毛菜碱, 其余附片中几乎不含去甲乌药碱, 去甲猪毛菜碱含量也低于生附片1/4。因此, 去甲乌药碱与去甲猪毛碱可作为生附片的强心质量标志物, 去甲猪毛菜碱可以作为其余附片的强心质量标志物。
该研究采用基于最小PVC测定的心毒性评价方法与基于急性心衰大鼠+dp/dtmax测定的强心活性评价方法准确测定了8种附子炮制品的生物毒效。结果发现, 生附片属于毒强效亦强, 黑顺片、白附片、蒸附片等具有较小的心毒性与较好的强心活性, 炮天雄等安全无毒但强心活性较弱。
生附片为鲜附子切片后直接干燥而成, 解毒并不完全, 还含有相当部分的双酯型生物碱, 毒性较强, 但在煎煮环节可实现完全减毒; 各类成分保留较为完全, 水溶性强心成分含量远高于其他炮制品, 强心活性最强, 这也是《伤寒论》四逆汤原方使用生附子的原因。黑顺片是附子最常见的主流商品, 也是参附注射液的原料; 白附片, 又称天雄片, 为火神派医家钟爱; 蒸附片为新型大宗商品, 无胆无硫, 系在生附片的基础上进一步蒸制加工而成; 上述几种附片均具有明确的强心作用, 且心毒性较低。这是由于这些饮片在繁复的炮制工艺中毒效成分均损失较多。炮天雄与炮附子传统理论认为以温补肾阳为主, 并不作为强心药物使用, 炮制工艺更为复杂, 各类成分保留更少, 安全性最高, 强心作用最弱。
综合炮制工艺、强心成分性质与含量来看, 炮制过程中水处理环节多少与程度直接影响去甲乌药碱与去甲猪毛菜碱的含量, 进而影响炮制品强心活性的强弱。为了更好地保留强心成分, 附子炮制应简化工艺流程, 减少浸、泡、洗、漂、煮等水处理环节, 以烘干等干法工艺为主, 实现减毒与存效的平衡[25]。
致谢: 中国食品药品检定研究院周远鹏研究员对本工作给予支持与指导。
| [1] |
Huang QW, Zhou ZY, Wang J, et al. Investigation and collection development pattern for genuineness of Aconitum carmichali[J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 2599-2601. |
| [2] |
Zhang DK, Han X, Zhou YF, et al. Development of Fuzi precision decoction pieces (PDP) (Ⅰ):specification and quality uniformity[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 3488-3495. |
| [3] |
Qin Y, Wang JB, Zhao YL. Establishment of a bioassay for the toxicity evaluation and quality control of Aconitum herbs[J]. J Hazard Mater, 2012, 15: 350-357. |
| [4] |
Zhang DK, Li RS, Han X, et al. Toxic constituents index:a toxicity-calibrated quantitative evaluation approach for the precise toxicity prediction of the hypertoxic phytomedicine-aconite[J]. Front Pharmacol, 2016, 7: 164-176. |
| [5] |
Li RY, Zhang DK, Han X, et al. Chemical constituent change regulation of processed aconite during decoction and discussion on time limit of decoction based on metabolomics[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 38-45. |
| [6] |
Singhuber J, Zhu M, Prinz S, et al. Aconitum in traditional Chinese medicine-a valuable drug or an unpredictable risk?[J]. J Ethnopharmacol, 2009, 126: 18-30. DOI:10.1016/j.jep.2009.07.031 |
| [7] |
Zhao ZH, Zhang DK, Wu MQ, et al. Establishment of biological assess for quality control of Fuzi based on determination of premature ventricular contractions in rats[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 3814-3820. |
| [8] |
Pan Y, Peng C, Zhou YX, et al. Experimental study of Shenfu Injection in the treatment of acute heart failure rat with deficiency of heart yang[J]. Guangming J Chin Med (光明中医), 2015, 30: 1189-1191. |
| [9] |
He YN, Zhang DK, Lin JZ, et al. Cardiac function evaluation for a novel one-step detoxification product of Aconiti Lateralis Radix Praeparata[J]. Chin Med, 2018, 13: 62. DOI:10.1186/s13020-018-0219-4 |
| [10] |
Zhang TJ, Bai G, Liu CX. The concept, core theory and research methods of Chinese medicine quality markers[J]. Acta Pharm Sin (药学学报), 2019, 54: 187-196. |
| [11] |
Tan JF, Wang SQ, Wang XY, et al. Quality consistency evaluation of Fuzi formula granules using determination of multi-component contents by HPLC-MS/MS method[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 1871-1879. |
| [12] |
Cao JM. Recent progress in experimental study of heart failure[J]. Basic Med Sci Clin (基础医学与临床), 2002, 22: 16-25. |
| [13] |
Lan F, Lee A S, Liang P, et al. Abnormal calcium handling properties underlie familial hypertrophic cardiomyopathy pathology in patient-specific induced pluripotent stem cells[J]. Cell Stem Cell, 2013, 12: 101-113. DOI:10.1016/j.stem.2012.10.010 |
| [14] |
Dai XJ, Song J, Yan LC, et al. The exploratory study of bioassay method on aconite quality[J]. J Sichuan Tradit Chin Med (四川中医), 2013, 31: 43-46. |
| [15] |
Lu ZQ, Zhang YJ, Zhuang PW, et al. Effect of Aconiti Lateralis Radix Preparata on hemodynamics of rats with acute heart failure and its mechanism[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 3223-3227. |
| [16] |
Zhang SF, Wu JY, Jia ZH, et al. Dose-toxicity relationship study for cardiotonic effect of aconitine[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2012, 18: 222-225. |
| [17] |
Wang L, Ding JY, Liu XX, et al. Identification of aminoalcohol-diterpenoid alkaloids in Aconiti Lateralis Radix Praeparata and study of their cardiac effects[J]. Acta Pharm Sin (药学学报), 2014, 49: 1699-1704. |
| [18] |
Zhou YP, Liu WH. Review and reappraisal on the effect of aconite on cardiovascular system (Ⅰ)[J]. Chin Med Pharmacol Clinic (中药药理与临床), 2013, 29: 198-205. |
| [19] |
Li Y, Li Y, Dang J, et al. Simultaneous determination and comparative pharmacokinetics of Fuzi water-soluble alkaloids between normal and acute heart failure rats by ultra performance liquid chromatography method[J]. J Chromatogr Sci, 2017, 55: 719-728. DOI:10.1093/chromsci/bmx026 |
| [20] |
Li XH, He P, Liu XY, et al. Synthesis and cardiac activity evaluation of the proposed structures of fuzinoside[J]. Tetrahedron, 2015, 71: 8661-8668. DOI:10.1016/j.tet.2015.09.009 |
| [21] |
Zhou YP. Review and evaluation of water-soluble active components of aconite on cardiovascular system[J]. Chin Med Pharmacol Clinic (中药药理与临床), 2011, 27: 106-110. |
| [22] |
Liu WH, Zhou YP, Zeng GY. Therapeutic effects of higenamine on experimental heart failure[J]. Acta Pharm Sin (药学学报), 1988, 23: 81-85. |
| [23] |
Park CW, Chang KC, Lim JK. Effects of higenamine on isolated heart adrenoceptor of rabbit[J]. Arch Int Pharmacodyn Ther, 1984, 267: 279-288. |
| [24] |
Praman S, Mulvany MJ, Williams DE, et al. Crude extract and purified components isolated from the stems of Tinospora crispa exhibit positive inotropic effects on the isolated left atrium of rats[J]. J Ethnopharmacol, 2013, 149: 123-132. DOI:10.1016/j.jep.2013.06.010 |
| [25] |
Zhang DK, Han X, Tan P, et al. Establishment of one-step approach to detoxification of hypertoxic aconite based on the evaluation of alkaloids contents and quality[J]. Chin J Nat Med, 2017, 15: 49-61. |
 2019, Vol. 54
2019, Vol. 54


