2. 成都中医药大学药学院, 四川 成都 611137;
3. 中国人民解放军总医院第五医学中心, 全军中医药研究所, 北京 100039;
4. 莱顿大学, LU-欧洲中医药与天然产物研究中心, 荷兰 莱顿 2333 BE
2. College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China;
3. the Fifth Medical Center of PLA General Hospital, China Military Institute of Chinese Medicine, Beijing 100039, China;
4. LU-European Center for Chinese Medicine and Natural Compounds, Institute of Biology, Leiden University, Leiden 2333 BE, Netherlands
客观综合量化评价中药品质一直是中药标准化的要点和难点。目前中药品质评价常规方法主要有感官评价和化学评价。以指标性成分含量测定为代表的化学评价能够表征部分成分的定性定量差异, 但这些检测指标往往与临床安全性和有效性关联不大[1-4], 即使有一定活性, 但其活性强度及成分含量不同, 对中药内在品质的贡献度是不尽一致的。中药生物效价测定是一种关联中药功效/活性的评价方法, 近年来获得越来越多的重视。美国FDA药物评价和研究中心于2015年发布的《植物药开发指南(草案)》中特别指出, 与临床疗效相关的生物检测方法是植物药质量控制手段的发展方向[5]。《中国药典》2015年版已经开始重点关注中药生物评价方法, 收载有《中药生物活性测定指导原则(9105)》[6], 并收载了水蛭的抗凝血酶活性生物测定方法[7]。但由于中药质量生物评价短时间内难以在基层检验机构和研究机构全面普及, 即存在一定的可及性和普适性难题。未来中药的品质评控模式应是化学评价与生物评价相结合。为此, 近年来, 课题组以黄连[8]、丹参[9]、附子[10]等为代表, 探索建立了中药品质综合量化评价方法-效应成分指数(effect-constituents index, ECI)。该方法融合了化学评价的精准性和可及性优势与生物评价关联功效和安全性的技术优势, 实现了通过化学成分检测即可评价中药的药效品质, 增强了中药品质生物评价的可及性和普适性, 同时解决了不同成分对中药品质整体药效贡献度的评价难题, 克服了中药品质评价指标“碎片化”现象[11]。作为一种与中药的临床功效相关的综合量化指数, 效应成分指数能在一定程度上体现中药的效能趋向。
大黄是临床常用中药之一, 是典型的多基原、多炮制品、多功效药材。其化学成分背景比较清晰, 致泻等生物活性相对明确且易于客观表征。课题组前期研究结果表明[12], 不同来源的大黄中化学成分存在一定的差异, 这导致它们在质量和功效方面(例如致泻效果)也有显著差异, 但是大黄现有的质量评控方法并不与其致泻功效相关, 也不能反映出不同化学成分对致泻活性的贡献度[13]。本文拟选取大黄为代表, 开展中药效应成分指数的示范应用研究, 以期为临床中药实现辨质用药、优质优价和科学监管提供新的科学依据和技术支持。
材料与方法仪器与材料 Acquity超高效液相色谱仪(Waters, USA), 自动进样器, 光电二极管阵列检测器, Empower 2色谱工作站; XS-205电子天平(Mettler Toldeo), AL-204电子天平(Mettler Toldeo); 10~100 μL移液枪(Eppendorf); 超声仪(南京新辰生物科技有限公司, 40 kHz); Milli-Q超纯水制备系统(Millipore, USA)。
动物与试剂 SPF级雄性ICR小鼠, 体重15~16 g (适应性饲养至体重20 g), 动物许可证号: SCXK-(军) 2012-0004。动物实验伦理要求已获得原解放军302医院动物实验伦理委员会的批准(批准号: IACUC-2015-012)。芦荟大黄素-8-O-β-D-葡萄糖苷(供含量测定以98.61%计)、大黄酸-8-O-β-D-葡萄糖苷(供含量测定以98.35%计)、大黄酚-8-O-β-D-葡萄糖苷(供含量测定以98.42%计)、大黄素-8-O-β-D-葡萄糖苷(供含量测定以98.45%计)和大黄素甲醚-8-O-β-D-葡萄糖苷(供含量测定以98.41%计)由成都克洛玛生物科技有限公司提供。芦荟大黄素(供含量测定以98.30%计)、大黄酸(供含量测定以99.21%计)、大黄素(供含量测定以98.01%计)、大黄酚(供含量测定以98.58%计)、大黄素甲醚(供含量测定以99.27%计)、番泻苷A (供含量测定以98.76%计)和番泻苷B (供含量测定以99.03%计)由成都普菲德生物科技有限公司提供。色谱级甲醇(Thermo Fisher Scientific, USA), 色谱级磷酸([85% (w/w)], Thermo Fisher Scientific, USA), ACS级Dimethyl sulfoxide (DMSO, AMRESCO)。
大黄供试品 从中国四川、甘肃省收集了10批大黄原药材(编号为为S01~S10)。样品S01-S05被鉴定为唐古特大黄Rheum tanguticum Maxim.ex Balf。样品S06~S10被鉴定为掌叶大黄Rheum palmatum L.。原药材按照2015版《中国药典》大黄项下规定, 制备成大黄饮片(相应的编号为Rh01~Rh10);取同1批次大黄饮片(Rh05)进一步炮制成酒大黄饮片(编号为Rh11、Rh12)、熟大黄饮片(编号为Rh13和Rh14)和大黄炭饮片(编号为Rh15和Rh16)。
色谱条件[14] 色谱柱为Waters BEH C18柱(2.1 mm×100 mm, 1.7 μm), 流动相为甲醇(A)和0.1% (v/v)磷酸水溶液(B)的混合液, 梯度洗脱条件为: 0~5 min: 38%~43% A; 5~7 min: 43%~52% A; 7~12 min: 52%~57% A; 12~15 min: 57%~72% A; 15~17 min: 72%~79% A; 17~25 min: 79%~85% A。流速为0.20 mL·min-1, 检测波长为410 nm, 柱温为30 ℃, 柱平衡时间为5 min。
对照品溶液的制备 以色谱级甲醇溶液作溶剂, 精密称取番泻苷A、芦荟大黄素-8-O-β-D-葡萄糖苷等12个对照品适量, 置于50 mL棕色量瓶中, 先用4.0 mL DMSO溶解, 再用甲醇稀释至刻度, 配制浓度为7.00~60.00 μg·mL-1的对照品溶液。
供试品溶液的制备[14] 准确称取各批次大黄粉末0.2 g (过四号筛), 置于50 mL棕色玻璃烧瓶中, 加入80%甲醇水溶液25 mL, 称定重量, 超声处理提取60 min (500 W, 40 kHz)。超声处理后, 使用80%甲醇水溶液补足重量。用0.22 μm微孔滤膜过滤, 用于化学定量分析实验。另准确称取各批次大黄粉末5.0 g (过三号筛), 分别置于盛有200.0 mL沸腾蒸馏水的烧杯中, 煎煮10 min。放冷, 煎煮液用无灰定性滤纸滤过, 用于泻下生物效价测定实验。
含量测定 准确吸取混合对照品溶液和供试品溶液各2.0 μL注入超高效液相色谱仪进行测定, 记录色谱图, 采用标准曲线法计算各化学成分的含量。
12个化学成分的生物效价权重系数测定 在ICR小鼠便秘模型上(用复方地芬诺酯片造模)进行12个化学成分致泻生物效价测定实验[15]。将总共140只体重约20 g的健康ICR雄性小鼠随机平均分成14组, 在测试前1 h保持自由饮食饮水。第1组作为空白组(不建模不给药); 第2组作为模型组(仅建模不给药); 第3组作为对照组(建模后给药番泻苷A); 第4~14组作为实验组。每只小鼠分别通过灌胃方式给予地芬诺酯混悬液, 剂量为0.05 g·kg-1。1.0 h后, 每只小鼠以0.05 g·kg-1的剂量给予12个化学成分对照物质的水溶液(1.0 mg·mL-1), 灌胃量0.4 mL, 然后收集灌胃后10 h内小鼠排泄的粪便, 并准确称重。在本实验中约定1.0 mg粪便相当于1.0 U泻下生物效价。以番泻苷A的生物效价设定为参比值; 将其他11种化学成分的致泻生物效价与番泻苷A的致泻生物效价进行比较。该比率定义为待测化合物与参照品番泻苷A相比所得到的生物效价权重系数, 其中参照品番泻苷A的生物效价权重系数为1。根据公式(1)计算其余待测化合物的生物效价权重系数:
| ${\rm{ECF}} = \frac{{{P_i} - {P_{{\rm{control}}}}}}{{{P_{{\rm{sennoside}}\;{\rm{A}}}} - {P_{{\rm{control}}}}}}$ | (1) |
生物效价权重系数(efficacy-calibrated factor, ECF)表示每个化学成分的生物效价与参比物的生物效价相比所得到的一种权重系数, 它表示一种与参比物相比的相对值; Pi表示实际测得的每一种化学成分的致泻生物效价, Pcontrol表示模型组的实际测得的致泻生物效价, Psennoside A表示实际测得的番泻苷A的致泻生物效价。泻下功效生物效价权重系数可以初步反映每种生物活性成分对致泻药理作用的贡献程度。
致泻效应成分指数的建立 通过整合ECF和同时定量多组分分析建立泻药ECI, 计算公式(2)如下所示:
| ${\rm{ECI}} = \mathop \sum_i^n {\rm{EC}}{{\rm{F}}_i} \times {C_i}$ | (2) |
式(2)中, ECFi代表成分i的致泻功效生物效价权重系数, 即相对于番泻苷A的致泻生物活性的权重系数; Ci代表大黄中化学成分i的实际含量。致泻效应成分指数公式的构成表明ECI表征大黄中12种具有致泻生物活性成分对本实验中泻下通便作用的贡献总和。
大黄样品的致泻生物效价的测定 基于便秘小鼠模型测定16批大黄样品的实际致泻生物效价。将总共190只健康的雄性ICR小鼠随机平均分成19组, 在测试前1 h保持自由饮食饮水。第1组作为空白组(不建模不给药); 第2组作为模型组(仅建模不给药); 第3组作为对照组(番泻苷A); 第4~19组作为实验组。每只小鼠按照0.05 g·kg-1的剂量给予复方地芬诺酯水溶液灌胃。1 h后, 给每只实验组小鼠0.4 mL不同的大黄煎剂溶液, 收集小鼠灌胃后10 h内排出的粪便并称重。
统计分析 回归分析在软件SPSS-22.0 (IBM, USA)上进行。根据相关系数(r)评估每种化学成分与实际测得的致泻生物效价之间的相关性。在Heml-1.0软件上进行热图分析和聚类分析。
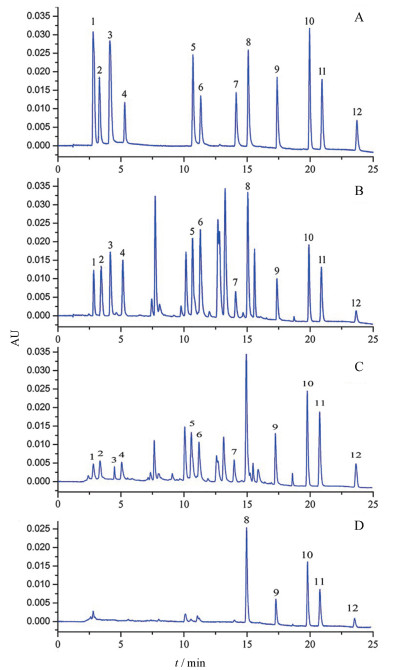
结果 1 大黄指标性成分的含量测定采用课题组建立的UPLC法同时定量测定大黄中12种指标性成分的含量[14], 详细结果如表 1所示, 混合标准溶液和不同样品溶液的典型UPLC色谱图如图 1所示。不同批次间样品中化合物含量的热图(图 2)表明唐古特大黄饮片(Rh01~Rh05), 掌叶大黄饮片(Rh06~Rh10)和不同炮制品饮片(Rh11~Rh16)三类样品之间在化学成分的含量高低存在显著差异。结果显示, 在唐古特饮片样品中, 番泻苷A、番泻苷B、芦荟大黄素-8-O-β-D-葡萄糖苷、大黄酸-8-O-β-D-葡萄糖苷和大黄酚-8-O-β-D-葡萄糖苷的含量显著高于掌叶大黄饮片样品中各相应化学成分的含量。通过黄酒蒸制后, 这些指标性成分的含量显著下降。例如, Rh03中芦荟大黄素-8-O-β-D-葡萄糖苷的含量比Rh07中该成分的含量高近40倍(4.79 vs 0.12 mg·g-1), Rh03中大黄酸-8-O-β-D-葡萄糖苷的含量比Rh07中该成分的含量高近45倍(3.56 vs 0.08 mg·g-1)。实际上, 尽管还有许多其他化学成分可以在不同的检测波长下被检测到, 但是由于这些化学成分目前没有标准物质, 无法对这些化学成分进行准确定量。因此, 选择了12种具有泻下通便功效的指标性化学成分来表征大黄的整体质量。
| Table 1 Results of 12 bioactive chemical constituents in16 rhubarb samples (mg·g-1, mean, n = 6). ND means that it has not been detected |
|
Figure 1 Typical UPLC chromatograms. A: Mixed standard solution; B: Rh05 sample solution (R. tanguticum); C: Rh06 sample solution (R. palmatum); D: Rh16 sample solution (wine steamed sample). 1: Aloe-emodin-8-O-β-D-glucoside; 2: Sennoside B; 3: Rhein-8-O-β-D-glucoside; 4: Sennoside A; 5: Chrysophanol-8-O-β-D-glucoside; 6: Emodin-8-O-β-D-glucoside; 7: Physcion-8-O-β-D-glucoside; 8: Aloe-emodin; 9: Rhein; 10: Emodin; 11: Chrysophanol; 12: Physcion |

|
Figure 2 The heatmap analysis of 12 bioactive chemical constituents in 16 batches of rhubarbs |
基于小鼠便秘模型测定12种指标性成分的致泻生物活性, 如表 2所示。基于泻下生物效价权重系数和多组分同时定量分析建立泻下效应成分指数ECI。计算方法如公式(3)所示。计算了16批大黄样品的泻下效应成分指数ECI, 如表 3所示。结果显示唐古特大黄饮片样品的ECI相对较高, 而掌叶大黄饮片样品的ECI相对较低。值得注意的是, 对于大黄炮制品, 随着炮制次数的增加, 其ECI值显著下降。
| $\begin{array}{*{20}{c}} {{\rm{ECI}} = \mathop \sum_i^{12} {F_i} \times {C_i} = 1.00 \times {C_{{\rm{sen}}\;{\rm{A}}}} + 0.63 \times {C_{{\rm{sen}}\;{\rm{B}}}} + }\\ {0.66 \times {C_{{\rm{alo}} - {\rm{glu}}}} + 0.71 \times {C_{{\rm{rhe}} - {\rm{glu}}}} + 0.45 \times {C_{{\rm{chr}} - {\rm{glu}}}} + }\\ {0.46 \times {C_{{\rm{emo}} - {\rm{glu}}}} + 0.56 \times {C_{{\rm{phy}} - {\rm{glu}}}} + 0.36 \times {C_{{\rm{alo}}}} + }\\ {0.47 \times {C_{{\rm{rhe}}}} + 0.26 \times {C_{{\rm{emo}}}} + 0.25 \times {C_{{\rm{chr}}}} + 0.52 \times {C_{{\rm{phy}}}}} \end{array}$ | (3) |
| Table 2 Efficacy-calibrated factors of 12 bioactive components |
| Table 3 The actual measured laxative biological potencies and effect-constituent index (ECI) of 16 rhubarb samples |
为了验证根据公式计算得到的ECI是否能够真正反映大黄饮片样品的实际致泻作用强度, 在小鼠便秘模型测得了16个大黄饮片样品的致泻生物效价, 结果列于表 3中。结果显示, 16个大黄饮片样品实际致泻效价范围从23.84 U·g-1 (Rh16)到310.94 U·g-1 (Rh05)之间。实际测得生物效价结果表明, 不同批次的大黄饮片样品之间存在较大的致泻生物效价差异。
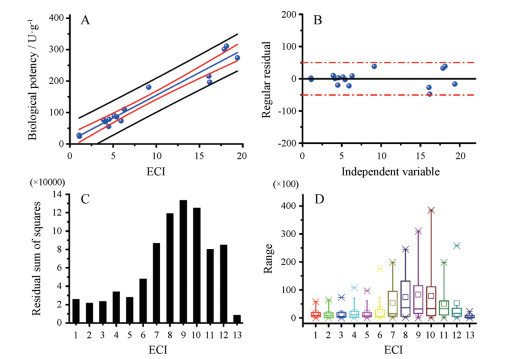
4 ECI和化学成分含量与实际测得致泻效价之间的相关性分析通过比较构建的ECI和12个指标性化学成分的含量与实际测得大黄样品致泻作用强度之间的相关性(以相关系数r表示), 以探讨ECI和指标性化学成分含量来表征大黄药材实际测得致泻效价的准确性。为了确保分析过程的准确性, 使用置信区间和预测区间作为相关性分析结果的一部分, 如图 3所示。结果显示单一指标性成分的含量高低与药材实际测得致泻生物效价之间相关性最好的是番泻苷A (r= 0.919 5);其次是大黄酸-8-O-β-D-葡萄糖苷(r= 0.908 4);提示这两种化学成分的含量高低与大黄发挥致泻作用的关联最大。游离蒽醌含量与大黄样品实际测得的生物效价之间的相关性普遍较差, r范围为0.217 7至0.647 7, 这提示游离蒽醌的含量高低与大黄发挥泻下作用的关联并不密切。统计分析显示, 与12个指标性化学成分含量的相关性相比较, ECI与大黄实测致泻生物效价之间的相关性最优, r= 0.969 5 (图 4A), 这提示ECI可作为不同来源的大黄是否具有强致泻作用的质量评价指标。估计值与大黄生物效能的实际测量值之间的差异, 即统计残差, 可用于评估ECI的准确性。残差分布图显示ECI的离散度非常窄(图 4B), 这提示当评价不同来源的大黄的致泻效果时, ECI是一个更准确评价指标。采用残差平方和作为量化指标反映出ECI作为一张大黄质量控制指标的准确度优于其余评价指标(图 4C)。统计残差的箱式图表明与指标性成分含量测定相比, ECI的异常值很小(图 4D)。统计分析结果表明, ECI作为大黄品质(致泻效果)的一种评价指标的准确性是相对比较可靠的。

|
Figure 3 The correlation analysis among content of each bioactive component and actual measured laxative biological potencies of all rhubarb samples, respectively. Note: Blue lines represent linear fits, red lines represent confidence bands, and black lines represent prediction bands. 1: Aloe-emodin-8-O-β-D-glucoside, r = 0.899 7, **P < 0.01 vs Sennoside A; 2: Sennoside B, r = 0.878 4, **P < 0.01 vs Sennoside A; 3: Rhein-8-O-β-D-glucoside, r = 0.825 1, **P < 0.01 vs Sennoside A; 4: Sennoside A, r = 0.908 4, **P < 0.01 vs Sennoside A; 5: Chrysophanol-8-O-β-D-glucoside, r = 0.895 0, **P < 0.01 vs Sennoside A; 6: Emodin-8-O-β-D-glucoside, r = 0.799 9, **P < 0.01 vs Sennoside A; 7: Physcion-8-O-β-D-glucoside, r = 0.612 1, *P < 0.05 vs Sennoside A; 8: Aloe-emodin, r = 0.370 4, P > 0.05 vs Sennoside A; 9: Rhein, r = 0.217 7, P > 0.05 vs Sennoside A; 10: Emodin, r = 0.647 7, **P < 0.01 vs Sennoside A; 11: Chrysophanol, r = 0.328 2, P > 0.05 vs Sennoside A; 12: Physcion, r = 0.621 1, *P < 0.05 vs Sennoside A |
|
Figure 4 The detailed result of statistical analysis. A represents the correlation analysis between ECI and actual measured biopotencies of all rhubarb samples, r = 0.969 5, **P < 0.01; B represents the standardized residual distribution diagram of ECI; C represents residual sum of squares; D represents boxplot of standardized residuals |
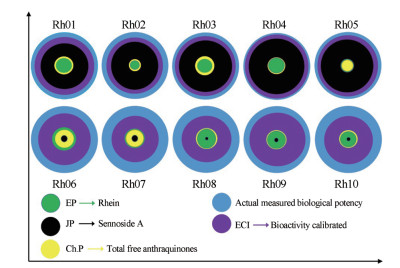
根据《中国药典》 (Ch.P)、《欧洲药典》 (EP)和《日本药典》 (JP)中收载的大黄质量控制方法测定16批大黄样品中的指标性成分的含量。测定结果显示, 16批次大黄样品中总游离蒽醌的含量范围从0.22% (Rh02)至0.48% (Rh06), 表明所有样品均符合《中国药典》对大黄的含量限度要求。番泻苷A的含量范围从0.06% (Rh07)到1.09% (Rh03), 表明所有的唐古特大黄(Rh01~Rh05)均符合《日本药典》的含量限度要求, 而所有掌叶大黄(Rh06~Rh10)不符合《日本药典》的含量限度要求。以大黄酸计, 其含量范围从1.69% (Rh01)到2.31% (Rh06), 表明只有少部分样品符合《欧洲药典》的含量限度要求。分析结果表明, 3种质量控制方法测定的指标性成分各有侧重点, 均在一定程度上反映不同批次大黄的化学差异性, 但都没有从整体上反映大黄的质量差异性。为了比较ECI和指标性化学成分含量测定对大黄的质量可控性, 将ECI、Ch.P、JP和EP中关于大黄的质量控制方法进行了比较, 如图 5所示。每个不同颜色的圆圈代表不同的质量评价指标, 圆圈的面积大小由实际测得的大黄的生物效力决定, 面积越大表示该评价指标更接近于大黄的实际测得致泻效价。结果显示, 当以致泻功效为导向来评价不同来源的大黄质量时, 不同评价指标的质控力强弱为: ECI > JP > Ch.P > EP, 提示致泻效应成分指数评价指标用于评估大黄的实际泻下生物效应具有更好的质控力。
|
Figure 5 The comparison of quality controllability of four different analysis methods. Each of the different color circles represents the quality evaluation index provided by the official pharmacopoeias, and the area of the circle is closer to the actual measured biopotency of the rhubarb |
近几十年来, 随着分析化学的快速发展, 如高效液相色谱(HPLC)和超高效液相色谱/质谱联用(UPLC-MS)的普及应用, 为中药的质量控制提供了良好的技术手段[16, 17], 但也存在质控结果难以反映中药整体活性、难以关联临床疗效、难以客观评价中药品质优劣、难以指导临床科学合理用药等不足。实际上, 现有的化学评价方法不能解释不同指标性成分对中药品质整体药效的贡献度。一些指标性化学成分(例如大黄中的番泻苷A)可以表现出较强的致泻生物活性, 并且比那些具有含量百分比高的指标性成分(例如大黄中的大黄素和大黄酚)对临床致泻功效有更大的贡献。课题组在基于单一化学成分含量测定的基础上, 增加相应的生物效价测定, 进而构建了一种基于生物效价权重系数加权的多组分化学定量分析的中药质量评控方法, 即效应成分指数。该方法融合化学成分检测的准确性与生物评价关联药效和安全性的技术优势, 实现了通过化学成分检测即可评价中药的药效品质, 显著增强了中药品质生物评价的可及性和普适性, 同时解决了不同活性成分对中药品质整体药效贡献度的评价难题。针对主要药效物质基础和生物活性成分明确的中药建立相应的效应成分指数, 此后评价不同来源、不同批次的样品时则避免重复测定生物效价, 仅使用HPLC对测定指标性成分来计算ECI。当然, 效应成分指数的构建也存在一些缺陷和不足。效应成分指数方法的主要限制和挑战是如何确证药材中与临床功效相关联的活性成分以及这些活性成分之间的协同或拮抗作用如何表征。在本文研究中, 尚未考虑其余化学成分的协同或拮抗作用。毫无疑问, 多种化合物的协同或拮抗作用将影响中药品质的整体综合评价。
效应成分指数方法的优势之一是质量评控方法与中药的临床疗效相关, 效应成分指数有望能够指导临床中医师更合理地使用不同来源的大黄。例如, 根据本文建立的大黄致泻效应成分指数, 当大黄用于治疗便秘时, 建议中医师优选ECI数值较高(15~20)的大黄; 当大黄用于治疗其他疾病而不是便秘时, 建议中医师选择ECI数值较低(1~10)的大黄, 从而避免ECI数值较高的大黄带来的剧烈腹泻副作用。本文构建的致泻效应成分指数方法有望成为大黄传统质量评控方法的有益补充。效应成分指数评控方法可为临床中药实现辨质用药、优质优价和科学监管提供新的科学依据和技术支持。
| [1] |
Yang MH, Kong LY. Several thoughts and suggestions on modernization and internationalization of quality standard for traditional Chinese medicine[J]. World Sci Technol/Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2017, 19: 1619-1622. |
| [2] |
Xiao XH, Zhao ZZ, Xiao PG, et al. Probe into innovation and development of pattern of quality control and evaluation for Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2007, 32: 1377-1381. |
| [3] |
Zhang HZ, Xiao XH, Wang JB, et al. Consistency of efficacy-equivalent:key essential point of quality control for Chinese materia medica[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 1571-1575. |
| [4] |
Zhang P, Yang Y, Ren YS, et al. Application of multi-target ingredients determination and fi ngerprint analysis in preparation and quality control of Chinese medicine[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2010, 25: 120-123. |
| [5] |
US Food and Drug Administration. Botanical drug development guidance for industry[EB/OL].[2019-07-18]. https://wenku.baidu.com/view/d4cd21d55f0e7cd18525369b.html.
|
| [6] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Vol 4.2015 ed. Beijing: China Medical Science Press, 2015: 381.
|
| [7] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典一部)[S]. 2015 ed. Beijing: China Medical Science Press, 2015: 83.
|
| [8] |
Xiong Y, Hu Y, Li F, et al. Promotion of quality standard of Chinese herbal medicine by the integrated and efficacy-oriented quality marker of effect-constituent index[J]. Phytomedicine, 2018, 45: 26-35. DOI:10.1016/j.phymed.2018.03.013 |
| [9] |
Liu ZJ, Shi ZL, Tu C, et al. An activity-calibrated chemical standardization approach for quality evaluation of Salvia miltiorrhiza Bge[J]. RSC Adv, 2017, 7: 5331-5339. DOI:10.1039/C6RA26281C |
| [10] |
Zhang DK, Li RS, Han X, et al. Toxic constituents index:a toxicity-calibrated quantitative evaluation approach for the precise toxicity prediction of the hypertoxic phytomedicine-aconite[J]. Front Pharmacol, 2016, 7: 164-177. |
| [11] |
National Natural Science Foundation of China[EB/OL].[2017-05-12]. http://www.nsfc.gov.cn/publish/portal0/tab448/info68546.htm.
|
| [12] |
Tan P, Zhang HZ, Zhang DK, et al. Simultaneous determination of 10 anthraquinone derivatives in Rhei Radix et Rhizoma based on UPLC[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 928-934. |
| [13] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典一部)[S]. 2015 ed. Beijing: China Medical Science Press, 2015: 23-24.
|
| [14] |
Tan P, Zhang L, Zhao YL, et al. A practical method for the simultaneous quantitative determination of twelve anthraquinone derivatives in rhubarb by a single-marker based on ultra-performance liquid chromatography and chemometric analysis[J]. Anal Methods, 2016, 19: 3927-3934. |
| [15] |
Tan P, Zhang HZ, Zhang DK. Quality evaluation of rhubarb dispensing granules based on multicomponent simultaneous quantitative analysis and bioassay[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 2683-2690. |
| [16] |
Song JH, Chen FZ, Liu J, et al. Combinative method using multi-components quantitation and HPLC fingerprint for comprehensive evaluation of gentiana crassicaulis[J]. Pharmacogn Mag, 2017, 13: 180-187. |
| [17] |
Yan Y, Zhang QQ, Feng F. HPLC-TOF-MS and HPLC-MS/MS combined with multivariate analysis for the characterization and discrimination of phenolic profiles in nonfumigated and sulfur-fumigated rhubarb[J]. J Sep Sci, 2016, 39: 2667-2677. DOI:10.1002/jssc.201501382 |
 2019, Vol. 54
2019, Vol. 54


