近年来, 国内生物类似药申报品种不断增多, 已有将近两百个单抗生物类似药候选药进入临床研究阶段。其中阿达木单抗(28家)、贝伐珠单抗(23家)、利妥昔单抗(18家)、曲妥珠单抗(11家)等品种注册受理最多。2019年2月份, 上海复宏汉霖公司开发的利妥昔单抗生物类似药——汉利康®获批上市用于治疗非霍金奇淋巴瘤, 成为在我国上市的首个单抗生物类似药[1]。确保候选药物与原研药的质量相似性(或分析相似性)是生物类似药药学开发与评价的核心[2]。但是, 一方面由于单抗药物产品上市后普遍存在工艺变更, 可能会造成产品质量发生“漂移”[3], 如:目前已经发现利妥昔单抗[4]、曲妥珠单抗[5]、依那西普[4]等原研药在上市后, 其糖型修饰及恒定区效应功能上存在变化; 另一方面, 生物类似药开发厂家所收集的原研药批次数量有限且生产时间跨度较窄, 如:多数国内生物类似药开发厂家申报临床阶段仅采用三批原研药物进行表征分析, 报产阶段收集原研品生产时间往往集中在最近5年。因此, 仅通过测定分析有限批次原研药物质量的表征数据, 无法获得原研药在整个生命周期的质量属性区间, 这就为生物类似药的开发与评价提出了挑战。
为此, 课题组利用已有申报品种药学资料对部分单抗药物(阿达木单抗、贝伐珠单抗、利妥昔单抗、曲妥珠单抗等)的质量表征数据进行采集与分析, 提出了上述品种的关键质量属性及限度要求参考区间, 初步形成单抗生物类似药的“质量相似性评价标准”与“技术审评考虑要点”。本文作为该课题探索性研究成果, 以利妥昔单抗为例对原研药及生物类似药在国内的研发与注册现状进行调研, 通过统计与分析原研厂及18家生物类似药研发企业累计的123批原研药表征分析数据, 为此类生物类似药的药学开发与评价提供参考。
1 利妥昔单抗及其生物类似药研发进展 1.1 利妥昔单抗原研产品注册与工艺变更情况利妥昔单抗(rituximab, 商品名Rituxan®, IDEC-C2B8)系基因泰克公司20世纪90年代开发的抗CD20重组人鼠嵌合单克隆抗体, 由人源IgG1恒定区和鼠源抗CD20抗体的可变区组成。利妥昔单抗与细胞表面的CD20分子结合后, 通过补体依赖性细胞毒作用(complement-dependent cytotoxicity, CDC)、抗体依赖性细胞毒作用(antibody dependent cellular cytotoxicity, ADCC)以及促凋亡(apoptosis)等多种作用机制杀伤CD20阳性B细胞[6]。
利妥昔单抗先后1997年在美国注册上市, 1998年在欧盟注册上市, 2000年在我国注册上市。目前已经成为非霍金奇淋巴瘤(non-Hodgkin's lymphoma, NHL)标准一线治疗和维持治疗药物, 适应证包括NHL、慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL)和类风湿性关节炎(rheumatoid arthritis, RA)等。
根据欧洲药监机构公布的公众评估报告(European Public Assessment Report, EPAR)所披露的信息, 利妥昔单抗自1998年上市后至少经过23次不同风险等级的工艺变更。其中包括7次低风险, 15次中度风险和1次重大风险[7]。从原研罗氏公司在我国药品再注册和补充申请等受理情况分析, 供应中国市场的利妥昔单抗在关键原材料、原液生产场地场地、生产工艺等方面确存多次工艺变更。上述工艺变更可能导致利妥昔单抗在其药品生命周期内发生“质量漂移”。
1.2 国内外利妥昔单抗生物类似药研发进展目前, 国内至少共有18家企业进行了注册申报利妥昔生物类似药候选药。由于在2015年之前, 《药品注册管理办法》中未对生物类似药进行明确的定义及分类, 当时申报者多按照“新药”研发路径进行利妥昔生物类似药的开发。2015年《生物类似药研发与评价技术指导原则(试行) 》明确了生物类似药的定义, 提出了生物类似药研发和评价的基本原则, 此后注册申报的候选药物均按照“生物类似药”进行注册, 并严格遵循“比对原则”、“逐步递进原则”、“一致性原则”, “相似性评价原则”等进行研发与评价[8]。目前, 国内已有复宏汉霖公司利妥昔生物类似药(汉利康®)获批上市, 另有一家已申请注册生产, 同时尚有三家利妥昔生物类似药处于Ⅲ临床研究阶段, 近十家国内研发企业的利妥昔单抗候选药物进入临床研究(表 1)。
| Table 1 List of clinical trial application for rituxiamb biosimilar candidate in China. (https://data.pharmacodia.com) |
国际上, 美国FDA和欧盟EMA已经批准Celltrion公司Truxima®/Blitzima® (CT-P10)[9]、Sandoz公司Rixathon®/Riximyo® (GP-2013)[10]等上市销售; 也有报道印度Dr.Reddy's Laboratories公司Reditux®、IntasPhamaceuticals公司Mabtas®和Hetero公司Maball®、俄罗斯BIOCAD公司Acellbia®、墨西哥Probiomed公司Kikuzbam® (2014年撤回)、伊朗Laboratorio Elea公司Novex®等产品在当地上市; 此外, 尚有辉瑞公司PF-05280586[11]、古巴分子免疫中心IB8、mAbxience公司RTXM83处于不同研发阶段。而BoehringerIngllheim公司BI695500、Samsung公司SAIT101、默沙东公司MK8808、Teva公司TL011等产品因多种原因已经暂停开发[12]。
通过对已受理利妥昔单抗类似药(表 1)药学资料进行回溯分析, 发现国内在研利妥昔生物类似药的生产工艺一般采用单抗惯用平台工艺[13, 14], 即:流加培养工艺、3步层析纯化与两步病毒灭活/去除工序。在研品种的发酵规模一般为200~1 000 L, 单抗表达量在1.0~5.0 g·L-1, 抗体收率在40%~70%左右, 其中反应器规模与纯化得率与原研厂尚有差距。此外, 部分厂家为进一步控制生物类似药的酸碱变异体含量, 在病毒灭活或阴离子交换工序后增加特定处理工序。
质量研究方面, 在早期利妥昔生物类似药开发中, 国内企业一般仅采用1~3批原研品进行简单的结构确证研究; 2015年国内生物类似药指导原则出台后, 国内企业在申报临床阶段已经普遍采用至少3批原研药与3批自制品进行“头对头”比对的研究策略[2], 而在申报生产阶段一般则积累了超过10个批次的原研与自制品进行分析比对研究[15]。
1.3 利妥昔单抗生物类似药质量相似性评价的挑战与创新药的研发策略不同, 生物类似药的开发是以原研药物的关键质量属性为目标。应尽可能收集不同产地、较长时间的代表性原研药物进行表征分析, 依据确定的“目标质量属性” (target quality attribute)利用“反向工程”进行“迭代式”工艺开发[16]。根据国内外生物类似药相关技术指导原则[17-20], 候选药与原研药具有质量相似性, 是前者作为“生物类似药”开发的前提。若候选药物具备与原研药物高度相似的质量相似性, 只需开展必要的非临床与临床试验即可支持产品上市。若药学研究显示, 候选药物与原研药物存在质量差异, 则还需开展额外的非临床与临床研究及进一步证明其相似性。因此, 如何基于原研品表征数据定义“目标质量属性”, 或如何建立“相似性评价标准”显得至关重要[21]。
原研利妥昔单抗上市后发生多次工艺变更, 在可追溯的时间范围内其产品质量已经发生“漂移” (drift)。如: 2008年前后, 罗氏公司所产利妥昔单抗在酸碱变体(N端焦谷氨酸环化、C端赖氨酸剪切等)分布、去岩藻糖修饰糖型(afucosylation)含量以及“抗体依赖细胞毒效应”等方面发生显著变化[4]。在这种情况下, 如果生物类似药企业仅通过购买市售3批原研制剂来进行表征分析, 其所确认的类似药“目标质量属性”很可能出现偏差。据笔者了解, 国内某企业在申报临床阶段仅通过收集3批原研品来确定类似药目标质量属性。虽然在早期研究中证明了候选药与原研具有“质量相似性”。但是, 随着临床试验期间积累的原研批次增多, 逐渐发现原目标质量属性控制范围恰处于原研药质量控制范围的下限, 这就造成了候选类似药在临床期间开发失败的风险。
2 基于原研药物表征数据的利妥昔单抗“质量相似性”评价参考标准 2.1 原研数据来源及分析方法基于审评实践所积累的数据, 课题组对123批利妥昔单抗原研药质量数据进行采集。其中包括: ①生物类似药厂家检测的原研药数据86个批次; ②原研药厂自检数据25个批次; ③中检院对原研药进行标准复核时的检验数据12个批次等。这其中也包括7家类似药企业重复检测1个批次原研药物所得实验结果。上述质量数据时间跨度近15年, 基本覆盖了利妥昔单抗进口中国后产品质量变化趋势; 表征数据采集项目包括, 理化性质(氨基酸序列、分子量、N/C端序列、等电点、二硫键、自由巯基含量、翻译后修饰等)、纯度(SEC-HPLC、CEX-HPLC、CE-SDS)、生物活性等方面。
原研厂或监管部门在进行质量回顾分析时, 一般以均值收±2SD作为警戒线而均值±3SD作为行动限[22]; 但是, 原研药与候选药进行质量相似性评价值, 其分析方法与限度要求应严于上述标准。如:美国FDA在2017年9月发布的《用于评估质量相似性的统计方法》建议, 临床风险最高质量属性应按照Tier 1类别采用等效性检验法(equivalence test)评价; 临床风险相对较低的质量属性归为Tier 2类别采用控制范围法(quality range)评价; 对于临床风险最低或不可量化的其他质量属性归为Tier 3类别, 可采用图谱对比法或描述法进行评价[23]。但是, 由于上述统计方法所得容忍区间可能导致的“相似性评价标准”限度过宽。并且, 统计学方法对原研药与候选药物的批次有着苛刻的要求(一般大于10批次), 会严重限制生物类似药的开发进程, 因此, FDA于2018年6月撤销了该指南草案。2019年更新的最新关于质量可比性的指导原则, 其中明确对“可比性评估方法”及“参照药”提出了进一步的要求, 如: “不再要求质量属性的分层级(Tier), 仅提出两个相似性评价标准:即, 平均值(mean)±X标准差(SD)以及原始图谱/数据相似”, “至少10批参照药, 且应在保质期不同时间段选取, 不允许将不同区域的原研药数据整合确定相似性标准” [24]。
目前, 国内生物类似药在申报临床阶段大多数采用候选药和参照药“头对头”表征分析后直接进行比较; 而欧盟EMA一般要求依据原研药与候选药实测结果区间范围(最大/小值、平均值等)进行比对分析。一般在进行质量综合上述质量可比性判定方法, 同时考虑到数据来源的多样性、分析方法的变异性等因素, 课题组就已采集原研药物数据仅统计其最大值(max)、最小值(min)、平均值(mean)和标准偏差(SD)等作为参考指标。
2.2 利妥昔单抗关键质量属性及统计范围根据原研药物利妥昔单抗的作用机制[6]及业界对于相似性评价中“关键质量属性”[21, 25-27]的阐述, 课题组依据对安全性、有效性、免疫原性的影响, 对利妥昔单抗诸多理化特性、纯度、免疫活性等质量属性进行风险排序(表 2)。如:确保氨基酸序列一致是类似药开发的前提, 生物活性体现临床作用机制, 因此二者作为风险评估等级最高(+++); 而电荷变体由于受细胞系、生产工艺影响较大, 且需结合鉴定结果与生物活性进行评判, 因此风险评估等级次之(++)。
| Table 2 The summarized risk-based ranking, analytical methods and statistical analysis of rituximab's quality attributes[9, 10, 15, 26-28] |
此后, 课题组对所采集的原研药多批次测定结果, 根据具体检测方法的稳健性采用不同的分析策略。如:对于利妥昔单抗的氨基酸序列、二硫键配对应“确证”; 对于糖型(去岩藻糖、半乳糖、高甘露糖, 唾液酸等)、纯度(分子大小、电荷变体)统计其变异区间(Min-Max/Mean±3SD); 对于方法学变异较大的亲和力测定与生物活性测定分别仅统计“数量级”或“未统计” (表 2)。
2.3 已公开原研品表征数据与统计结果的比较目前, 多篇国外文献[9, 10, 15, 29-31]以及质量检验技术机构均已发表利妥昔单抗生物活性[22]、糖型修饰[32]的回溯分析等, 已经公开了原研药物的部分质量表征数据。课题组利用上述公开信息对拟定评价标准中统计范围进行验证, 以判断相关项目限度要求的合理性。
关于一级结构方面, 文献报道[15]经脱糖处理后原研品的重链分子量为49 060 Da (-K/PyroQ HC), 轻链为23 036 Da (PyroQ LC); CT-10的质量相似性研究中, 自由巯基含量在0.30%~0.35% (欧洲来源)或0.28%~0.36% (美国来源)[9]。上述利妥昔单抗一级结构表征数据均在数据池统计范围内。
关于分子大小变异体方面, CT-10的质量相似性研究中原研药SEC-HPLC单体含量为98.75%~99.21% (欧洲来源)和98.60%~99.06% (美国来源)[9]; 在HLX01质量相似性研究中, 原研药SEC-HPLC单体含量为98.9%~99.0% (中国来源)和99.0%~99.1% (欧洲来源), 还原CE-SDS非糖重链含量为0.4% (中国来源)和0.3%~0.4% (欧洲来源)[15]; 其他文献报道原研药SEC-HPLC单体含量为96.2%~96.8% (欧洲来源)[31]; 上述分子大小变异体含量与数据池统计范围基本一致。
关于电荷变异体方面, CT-P10质量相似性研究中原研药的酸性峰含量为18.7%~22.8% (欧洲来源)或19.0%~22.5% (美国来源), 碱性峰含量为7.0%~11.0% (欧洲来源)和8.0%~10.6% (美国来源)[9]; HLX01质量相似性研究中, 酸性峰含量为19.6%~23.9% (中国来源)和21.0%~22.5% (欧洲来源), 碱性峰含量9.4%~12.3% (中国进口)和9.1%~11.1% (欧洲来源)[15]; 此外, 尚有其他文献报道酸性峰平均值22.1% (欧洲来源), 碱性峰平均值为9.4%[31]; 上述酸碱变异体含量均在数据池统计范围。
关于糖型修饰方面, 在CT-P10的质量相似性研究中原研药去岩藻糖苷含量为0.46%~1.34% (欧洲来源)和0.40%~1.24% (美国来源); 半乳糖(galactosylation)含量为44.70%~56.51% (欧洲来源)和46.17%~56.08% (美国来源); 高甘露糖(high mannose)含量为1.46%~2.48% (欧洲来源)和1.54%~2.38% (美国来源)[9]; 在HLX01的质量相似性研究中, 去岩藻糖含量为1.0%~2.5% (中国进口)和1.0%~2.3% (欧洲来源), 半乳糖苷含量为48.3%~58.9% (中国进口)和51.3%~55.8% (欧洲进口), 高甘露糖含量为1.6%~3.7% (中国进口)和1.8%~3.4% (欧洲来源)[15]; 此外也有文献报道利妥昔单抗(欧洲来源)去岩藻糖含量为1.58%~2.00%;半乳糖苷含量为41.92%~47.75%[29]; 上述不同糖型含量与数据池统计范围基本一致。
关于受体亲和力方面, 文献报道[10, 30]采用SPR法所测定的FcRn (1×10-7)、FcγIa (1×10-9)、FcγIIa (1×10-6)、FcγIIb (1×10-6)、FcγIIIa (11×0-6)、FcγIIIb (1×10-6)等亲和力常数数量级与数据池统计范围基本一致。
3 利妥昔单抗“质量相似性”标准在审评实践中的应用课题组利用拟定质量相似性评价标准对国内注册生物类似药进行回溯性分析, 除早期申报的利妥昔类似药部分表征研究数据缺失外, 绝大多数候选药质量数据, 尤其是纯度项目(图 1A, B)均落入拟定标准限定范围内。这与原审评报告中“候选药物与原研参比药物具有药学相似性基础”的结论基本一致。最近一年, 拟定评价标准也开始在应用于生物类似药的申请临床、注册生产以及产品上市的工艺变更等审评实践。
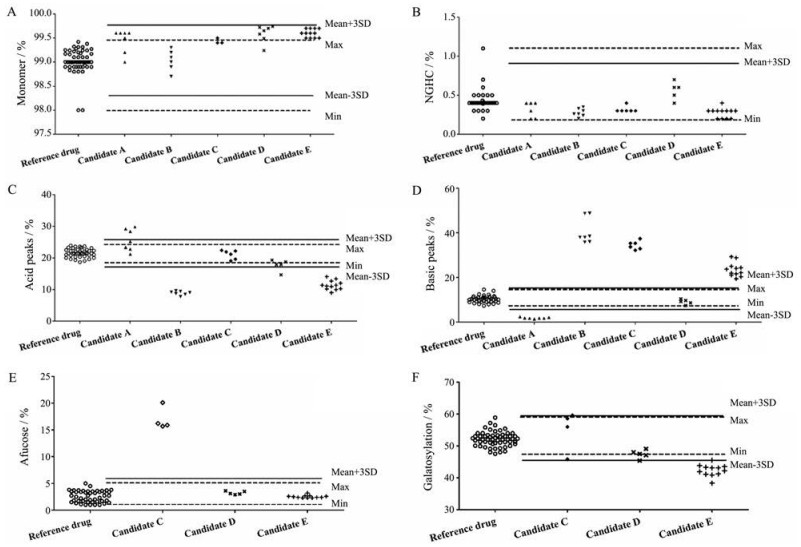
|
Figure 1 Comparison of rituximab and proposed biosimilars characterization data by proposed quality similar criteria. A: Monomer percent by SEC-HPLC; B: NGHC percent by reduced CE-SDS; C: Acid peaks percent CEX-HPLC; D: Basic peaks by CEX-HPLC; E: Afucosylation percent by HILIC UPLC; F: Galactosylation percent by HILIC UPLC |
目前, 国内生物类似药研发企业在申请临床阶段, 一般用3批原研参比药与3批生物类似药进行“头对头”质量比较[9, 10]。考虑到原研药物累计批次较少, 审评实践中除了进行头对头表征数据直观比对外, 也利用质量相似性评价标准进行初步评价。
3.1.1 氨基酸序列不一致在国内外生物类似药研发早期, 由于原研厂氨基酸序列披露信息有限, 质谱表征手段有限, 多次出现过与原研序列氨基酸序列不一致的情况。如:国外某利妥昔类似药LC-MS精确分子量与原研出现显著差异后, 进一步确证类似药Fd区发生氨基酸错误[33]。国内某厂家所开发的抗CD20单抗未与原研品进行“头对头”表征比对, 但其脱糖分子量超出拟定标准限度要求, 后经证实系其恒定区选择不同“allotype”所致。因此, 该品种后续未按照生物类似药路径进行开发与评价。
3.1.2 电荷变异体差别利妥昔原研生产细胞株CHO-DG44, 目前国内生物类似药开发所采用的细胞亚型既包括CHO-DG44 (9家), 也包括CHO-K1 (4家)、CHO-S (3家)等。由于工程细胞系[14]及生产工艺的不同, 候选药在电荷变体分布上普遍与原研药存在差异(图 1C、D)。为此, 一方面, 工业界通过优化培养工艺或增加特定生产工序, 调整候选药的酸碱变异体分布; 另一方面, 技术审评方对于明显出现酸碱变异体差别较大的品种, 要求进行电荷变异体的分离、鉴定, 并进一步说明电荷变异体对生物活性的影响。
3.1.3 糖型修饰差异利妥昔单抗的ADCC、CDC效应功能直接与其去岩藻糖、半乳糖苷含量相关。因此, 糖型含量控制也是利妥昔单抗生物类似药审评关注的重点之一[2]。如图 1E所示, 候选药C去岩藻糖修饰含量超出限定标准, 经进一步确认其“抗体依赖细胞毒作用”活性为参照药3倍以上。因此, 药学专业未判定其与原研药具备药学相似性基础。
3.2 用于申报注册生产或上市后工艺变更的药学评价在生物类似药注册上市阶段, 一般申请人已经积累了十余批原研药物表征分析数据, 考虑到生物类似药开发时间较短(3~5年), 所收集样品仍不能覆盖原研药上市后的质量变化区间, 因此拟定评价标准仍具有较高的应用价值。
3.2.1 上市申请阶段的“相似性”评价国内某利妥昔生物类似药注册上市阶段提供了自制品(批次12)与欧洲产原研药(7批次)、中国进口原研药(15批次)的质量比对数据, 其中原研药货架期为2015~2019年。“头对头”试验数据提示类似药(38.3%~45.5%)在半乳糖苷(48.3%~58.9%)修饰上与原研药存在显著差异[15]。课题组应用上述拟定评价标准发现, 候选药的半乳糖修饰变化区间实际上接近原研数据分布的统计下限(图 1F), 同时CDC体外生物学活性、非临床与临床试验数据未提示生物活性具备明显差异, 最终该品种按照“生物类似药”注册上市。
3.2.2 产品上市后的工艺变更我国目前上市单抗普遍存在发酵规模小(200~500 L)[34], 产能难以满足市场需求等问题。产品上市后不可避免的要发生工艺变更[35]。虽然, 生物类似药上市后具有独立的质量生命周期, 但是相似性评价标准对于生物类似药预设工艺变更“验收标准”, 和后期扩展临床适应症同样具有重要的指导意义。如:某生物类似药企业在发生重大工艺变更时, 仅提供工艺变更前后三批原液的“头对头”表征数据。审评实践中, 课题组结合临床期间所积累原研药和生物类似药表征数据, 同时参考拟定标准限度要求进行综合评价。
目前, 用于评价利妥昔生物类似药工艺变更“可比性”的标准物质正在开发, 考虑到标准物质的制备、标定及溯源性等因素, 短时间内利妥昔单抗标准物质的实际应用还不现实[36], 因此较长一段时间内拟定标准在类似药的工艺变更评价实践中仍具有应用价值。
3.3 拟定“质量相似性”评价标准的应用范围与局限性上述“质量相似性”评价基于原研企业、质量复核检验机构和生物类似药研发企业等对多批次原研品的表征研究结果。虽然具有纳入统计分析样品具备批次多、原研品生产日期跨度大等优点, 但仍存在以下局限性: ①不同实验室对原研药物进行表征分析时, 分析方法、参比品、质量体系等因素会导致结果的变异。这一点尤其生物学活性的测定上体现的尤为突出。如, 国内研发者对于利妥昔单抗“补体依赖细胞毒作用”生物活性的测定方法中靶细胞、补体来源、显色剂等选择尚未统一(表 3); ②早期原研品表征研究中部分项目(如:糖型、受体亲和力等)数据缺乏。如, 由于国内企业一般仅对代表性批次的原研品进行受体亲和力测定, 造成该项目采集数据批次的不足(< 20批次); ③由于无法追溯原研制剂分析测定时的实际寿命, 采集数据推测为来自于不同生产日期原研品在不同货架期的质量数据。上述原因均可造成拟定标准限度较为宽泛或不准确。因此, 在实际审评中拟定标准仅作为生物类似药质量相似性的初步评价参考标准。判定结果应与申请人提供的多批次“头对头”表征分析比对结果互为补充。并且, 在某些分析项目上后者在相似性评价上应更具实际意义。如:采用同一参比品和测定方法下测定生物类似药与原研品的生物活性; 叠加比较生物类似药与原研品的高级结构、强制降解杂质谱等。此外, 生物类似药相似性评价是基于“整体证据” (totality of evidence), 即便是候选药物某些项目质量数据超出拟定标准限度, 也应结合临床作用机制, 参考非临床、临床研究结果进行综合评价。
| Table 3 The summary of CDC bioassay mentioned in clinic trail application for the proposed rituximab biosimilars |
生物类似药在满足药物可及性方面具有不可替代的优势, 近年来, 单抗生物类似药已经成为国内生物制品注册受理数量最多的类别, 国内多个生物类似药(利妥昔单抗、阿达木单抗、曲妥珠单抗等)开始注册申报上市。为此构建“生物类似药评价支撑体系”是技术审评环节现阶段面临重要而紧迫的研究课题, 药学研究的“质量相似性”评价是候选药物按照“生物类似药”进行开发与评价的前提, 因此拟定“质量相似性评价标准”对于指导生物类似药的开发与评价具有更为重要的现实意义。2015年~2019年, 在国家科技重大专项“重大新药创新”课题资助项目(2015ZX09501008)支持下, 国家药品监督管理局药品审评中心生物制品药学部利用审评信息数据库, 对目前申报受理数量较多的利妥昔单抗(123批次)、阿达木单抗(99批次)、曲妥珠单抗(59批次)、贝伐珠单抗(103批次)进行了原研药质量数据采集与分析。本课题组认为, 本品研究中汇集的统计分析数据样本量大, 原研品生产时间跨度大, 基于多批次原研品表征数据所统计与分析所确定的原研药关键质量属性控制范围, 在类似药质量相似性评价中具有较高的参考价值。最近, 上述拟定标准已经开始应用于国内生物类似药注册临床及上市阶段的药品审评实践。如:某阿达木单抗分子筛纯度低于拟定相似性标准暂停临床试验; 某曲妥珠单抗氨基酸序列与拟定标准中收载序列不一致, 因此未按照“生物类似药”路径进行研发。随着后期原研表征数据的不断累积, 常用分析方法的不断进步及国际标准物质的引入[36]等, 基于原研品质量标准数据的相似性评价标准会日益完善。
| [1] | Kan HJ, Liu BN, Bai Y, et al. Analysis of monoclonal antibody drug registration in China[J]. Chin J New Drug (中国新药杂志), 2019, 16: 1–9. |
| [2] | Liu BN, Bai Y, Lou JH. Biosimilarity study regarding productquality of recombinant monoclonal antibodies as biosimilars[J]. Chin Pharm J (中国药学杂志), 2017, 52: 1194–1199. |
| [3] | Ramanan S, Grampp G. Drift, evolution, and divergence in biologics and biosimilars manufacturing[J]. BioDrugs, 2014, 28: 363–372. DOI:10.1007/s40259-014-0088-z |
| [4] | Schiestl M, Stangler T, Torella C, et al. Acceptable changes in quality attributes of glycosylated biopharmaceuticals[J]. Nat Biotechnol, 2011, 29: 310–312. DOI:10.1038/nbt.1839 |
| [5] | Kim S, Song J, Park S, et al. Drifts in ADCC-related quality attributes of herceptin (R): impact on development of a trastuzumab biosimilar[J]. MAbs, 2017, 9: 704–714. DOI:10.1080/19420862.2017.1305530 |
| [6] | Boross P, Leusen JH. Mechanisms of action of CD20 antibodies[J]. Am J Cancer Res, 2012, 2: 676–690. |
| [7] | Vezer B, Buzas Z, Sebeszta M, et al. Authorized manufacturing changes for therapeutic monoclonal antibodies (mAbs) in European Public Assessment Report (EPAR) documents[J]. Curr Med Res Opin, 2016, 32: 829–834. DOI:10.1185/03007995.2016.1145579 |
| [8] | Liu BN. Industrial biosimilar development under guidelines[N]. China Pharm News (中国医药报), 20150317(A 06). |
| [9] | Lee KH, Lee J, Bae JS, et al. Analytical similarity assessment of rituximab biosimilar CT-P10 to reference medicinal product[J]. MAbs, 2018, 10: 380–396. DOI:10.1080/19420862.2018.1433976 |
| [10] | Visser J, Feuerstein I, Stangler T, et al. Physicochemical and functional comparability between the proposed biosimilar rituximab GP2013 and originator rituximab[J]. BioDrugs, 2013, 27: 495–507. DOI:10.1007/s40259-013-0036-3 |
| [11] | Ryan AM, Sokolowski SA, Ng CK, et al. Comparative nonclinical assessments of the proposed biosimilar PF-05280586 and rituximab (MabThera(R))[J]. Toxicol Pathol, 2014, 42: 1069–1081. DOI:10.1177/0192623313520351 |
| [12] | Jacobs I, Ewesuedo R, Lula S, et al. Biosimilars for the treatment of cancer: a systematic review of published evidence[J]. BioDrugs, 2017, 31: 1–36. DOI:10.1007/s40259-016-0207-0 |
| [13] | Liu BN. The progress of therapeutic antibody drug and theindustrial key-technology of antibody product[J]. China Biotechnol (中国生物工程杂志), 2013, 33: 132–138. |
| [14] | Liu BN. The technology progress of antibody-producing cellline develoment[J]. China Biotechnol (中国生物工程杂志), 2013, 33: 111–116. |
| [15] | Xu Y, Xie L, Zhang E, et al. Physicochemical and functional assessments demonstrating analytical similarity between rituximab biosimilar HLX01 and the MabThera(R)[J]. MAbs, 2019, 11: 606–620. DOI:10.1080/19420862.2019.1578147 |
| [16] | da Silva A, Kronthaler U, Koppenburg V, et al. Target-directed development and preclinical characterization of the proposed biosimilar rituximab GP2013[J]. Leuk Lymphoma, 2014, 55: 1609–1617. DOI:10.3109/10428194.2013.843090 |
| [17] | EMEA. Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: quality issues[EB/OL]. 2014[2019-8-3]. Https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-similar-biological-medicinal-products-containing-biotechnology-derived-proteins-active_en-2.pdf. |
| [18] | FDA. Guidance for industry: quality considerations indemonstrating biosimilarity of a therapeutic protein product to a reference product[EB/OL]. 2015[2019-8-3]. Https://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM291134.pdf. |
| [19] | CFDA. Guidelines on biosimilars: research. Development and evaluation (draft)[EB/OL]. 2015[2019-8-3]. http://samr.cfda.gov.cn/WS01/CL1616/115104.html. |
| [20] | WHO. Guidelines on evaluation of similar biotherapeutic products (SBPs)[EB/OL]. 2009[2019-8-3]. Https://www.who.int/biologicals/publications/trs/areas/biological_therapeutics/TRS_977_Annex_2.pdf?ua=1. |
| [21] | Vandekerckhove K, Seidl A, Gutka H, et al. Rational selection, criticality assessment, and tiering of quality attributes and test methods for analytical similarity evaluation of biosimilars[J]. AAPS J, 2018, 20: 68. DOI:10.1208/s12248-018-0230-9 |
| [22] | Liu CHY, Wang L, Guo W, et al. Trand analysis of biological activity in quality control of anti-CD20 monoclonal antibody[J]. Chin J Biol (中国生物制品学杂志), 2015, 28: 58–62. |
| [23] | FDA. Statistical approaches to evaluate analytical similarity[EB/OL]. 2017[2019-8-3]. Https://www.pbwt.com/content/uploads/2018/06/UCM576786.pdf. |
| [24] | FDA. Draft guidance for industry: development of therapeutic protein biosimilar: comparative analytical assessment and other quility considerations[EB/OL]. 2019[2019-8-3]. Https://www.fda.gov/regulatory-information/search-fda-guidance-documents/development-therapeutic-protein-biosimilars-comparative-analytical-assessment-and-other-quality. |
| [25] | Schiestl M, Li J, Abas A, et al. The role of the quality assessment in the determination of overall biosimilarity: a simulated case study exercise[J]. Biologicals, 2014, 42: 128–132. DOI:10.1016/j.biologicals.2013.11.009 |
| [26] | Alt N, Zhang TY, Motchnik P, et al. Determination of critical quality attributes for monoclonal antibodies using quality by design principles[J]. Biologicals, 2016, 44: 291–305. DOI:10.1016/j.biologicals.2016.06.005 |
| [27] | Kwon O, Joung J, Park Y, et al. Considerations of critical quality attributes in the analytical comparability assessment of biosimilar products[J]. Biologicals, 2017, 48: 101–108. DOI:10.1016/j.biologicals.2017.04.005 |
| [28] | FDA. CT-P10, a proposed biosimilar to Rituximab FDA Advisory Comminttee Briefing Document[EB/OL]. 2018[2019-8-3]. Https://www.fda.gov/media/121161/download. |
| [29] | Miranda-Hernandez MP, Lopez-Morales CA, Ramirez-Ibanez ND, et al. Assessment of physicochemical properties of rituximab related to its immunomodulatory activity[J]. J Immunol Res, 2015: 1–10. |
| [30] | Montacir O, Montacir H, Eravci M, et al. Comparability study of Rituximab originator and follow-on biopharmaceutical[J]. J Pharm Biomed Anal, 2017, 140: 239–251. DOI:10.1016/j.jpba.2017.03.029 |
| [31] | Luis F, Victor R, Francisco C, et al. Physicochemical properties of rituximab[J]. J Liquid Chromatogr Related Technol, 37: 1438–1452. DOI:10.1080/10826076.2013.794738 |
| [32] | Wang WB, Wang L, Wang X, et al. Analysis of N-linked glycan profile of human/murine anti-CD20 antibodies by capillary electrophoresis[J]. Chin J New Drug (中国新药杂志), 2015, 24: 2312–2316. |
| [33] | Berkowitz SA, Engen JR, Mazzeo JR, et al. Analytical tools for characterizing biopharmaceuticals and the implications for biosimilars[J]. Nat Rev Drug Discov, 2012, 11: 527–540. DOI:10.1038/nrd3746 |
| [34] | Liu BN. The lasted development of large scale cell culturetechnology for commercial antibody manufacture[J]. China Biotechnol (中国生物工程杂志), 2013, 33: 103–111. |
| [35] | Liu BN, Xu GL, Lou JH. CMC regulatory considerations for marketing authorization application of therapeutic antibody in China[J]. Acta Pharm Sin (药学学报), 2019. DOI:10.16438/j.0513-4870.2019-0534 |
| [36] | Prior S, Hufton SE, Fox B, et al. International standards for monoclonal antibodies to support pre- and post-marketing product consistency: evaluation of a candidate international standard for the bioactivities of rituximab[J]. MAbs, 2018, 10: 129–142. DOI:10.1080/19420862.2017.1386824 |
 2019, Vol. 54
2019, Vol. 54


