2. 北京中医药大学东方医院药学部, 北京 100078
2. Department of Pharmacy, Dongfang Hospital Affiliated to Beijing University of Chinese Medicine, Beijing 100078, China
柏子仁是侧柏Platycladus orientalis (L.) Franco的干燥成熟种仁, 有着养心安神、止汗、润肠的功效, 在临床上主要用于治疗虚烦失眠、心悸怔忡、阴虚盗汗、肠燥便秘等[1]。其主要成分为脂肪油、柏子仁苷、柏木醇、双萜类成分以及少量的挥发油、皂苷、维生素A、蛋白质等[2]。现代药理学表明柏子仁苷能治疗阿尔茨海默病[3], 柏子仁脂肪油、挥发油等能改善睡眠[4]等。
柏子仁被环境中复杂的微生物侵染着, 这些微生物群落对药材品质起着不同的作用[5, 6]。一些真菌可能引发药材质量问题进而威胁人类健康, 如黄曲霉菌。柏子仁在种植、采收、加工、运输及储藏过程中, 极易滋生黄曲霉菌[7]。黄曲霉菌的大量繁殖产生的代谢物为黄曲霉毒素, 黄曲霉毒素能诱发致癌、致畸和免疫抑制等结果, 严重时可致死。然而至今没有较好的办法解决柏子仁黄曲霉菌污染的问题, 因此研究柏子仁药材表面微生物群落结构组成具有很重要的意义, 有助于发现新的微生物, 进而抑制潜在病原体的生长。
一直以来大多数微生物在营养基中可培养性低(占总数的5%微生物)[8]或不能被培养, 严重制约了微生物多样性的研究, 新一代的测序技术有利于微生物的群落更深入、全面地分析[9]。高通量测序凭借其速度快、耗时少、成本低、准确度高等优势, 已经成功地应用于分析各类样本, 如土壤[10]、白头翁[11]、黄芩汤[12]等, 但尚未有高通量测序研究柏子仁相关的报道。
目前关于柏子仁的研究多集中在药材鉴别[13]、化学成分的药效[3]等方面, 没有关于柏子仁表面微生物群落结构组成的报道。因此, 本研究采用高通量测序技术对3个地区的柏子仁药材表面真菌进行分析, 为明确市售柏子仁表面真菌群落结构组成奠定基础, 此项研究丰富了对柏子仁表面真菌多样性的认识, 有助于开发新的生物防治剂, 制定新的生物防治策略以克服毒素污染, 同时为柏子仁的质量安全提供参考。
材料与方法材料 柏子仁药材由河北省药品检验研究院段吉平老师提供, 收集于河南、山东以及香港, 每份样品收集到两批, 混匀记为一份样品, 收集到的样品表面微生物群落肉眼均不可见。样品编号、分组及采集信息见表 1, 经北京中医药大学刘春生教授鉴定为柏子仁正品, 于-20 ℃保存备用。
| Table 1 Platycladi semen sample grouping and information table |
DNA提取及检测 取样品1 g, 用无菌水5 mL均质30 min, 对无菌水中的微生物进行DNA提取。参照E.Z.N.A.®soil试剂盒(Omega Bio-tek, Norcross, GA, US)说明书进行提取总DNA, 并利用NanoDrop2000进行纯度与浓度检测, 再采用1%琼脂糖凝胶电泳进行DNA完整性检测。电泳条件: 5 V·cm-1, 时间: 20 min。
PCR扩增及荧光定量 经检验合格的DNA进行PCR扩增。PCR反应体系20 μL:正反引物各0.8 μL, 10×Buffer 2 μL, 2.5 mmol·L-1 dNTPs 2 mL, rTaq Polymerase 0.2 μL, BSA 0.2 μL, Template DNA 10 ng, 补ddH2O至20 μL。其中引物ITS1F: 5'-CTTGGTCATTT AGAGGAAGTAA-3', ITS2R:5'-GCTGCGTTCTTCAT CGATGC-3'。PCR反应条件: 95 ℃ 3 min; 95 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 45 s, 35个循环; 72 ℃ 10 min, 10 ℃停止。每个样本重复3次, 将同一样品的PCR产物混合取3 μL, 经2%琼脂糖凝胶电泳检测。参照电泳初步定量结果, PCR产物用QuantiFluorTM-ST蓝色荧光定量系统定量检测, 之后按照样本测序要求进行相应比例的混合。
Miseq文库的构建及测序 使用2%琼脂糖凝胶回收PCR产物, 利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, USA)进行纯化, Tris-HCI缓冲液洗脱, 2%琼脂糖电泳检测; 氢氧化钠变性, 产生单链DNA片段, 再进行Miseq测序。
生物信息学分析 将Miseq测序得到的PE reads首先根据overlap关系进行拼接, 同时对序列质量进行质控和过滤。根据≥97%的相似性, 将获得的高质量序列合并、过滤成不同的操作单元(OTU)。采用RDP classifier贝叶斯算法对97%的相似水平下的OTU进行生物信息学统计分析, 并分别在各个分类学水平:域(domain), 界(kingdom), 门(phylum), 纲(class), 目(order), 科(family), 属(genus), 种(species)进行每个样本群落组成的统计。利用mothur计算不同随机抽样下的多样性指数, 采用Alpha多样性来反映微生物群落的丰度和多样性, 其中Sobs、Chao、Ace指数反映群落的丰富度; Shannon、Simpson、Coverage指数反映群落的多样性。采用R语言工具统计3组样本中所共有和独有的物种以及进行群落组成分析, 根据beta多样性距离矩阵进行层级聚类分析, 使用UPMGA算法构建树状结构。
结果与分析 1 DNA质检及PCR扩增来自3个地区的7份柏子仁样品扩增条带浓度正确, 大小合适, 可适合后续的建库测序。
2 生物信息学分析 2.1 样本信息7份样品共有序列399 480条, 其中有效序列345 947条, 序列长度在207~553 bp, 平均长度在248~281 bp, 其中1号样本的序列数为最多, 达到59 966条, 6号样本的序列数最少为49 995条。
2.2 物种注释与评估 2.2.1 OTU分析7份样品经测序, 结果划分为267个OUT, 3门, 18纲, 40目, 82科, 120属, 191种。统计每个样本中每个OTU所含的序列数, 将所含有的序列条数由大到小等级排序, 以OTU的排序等级为横坐标, OTU中序列数的相对百分含量为纵坐标作排列分布-丰度曲线图, 排列分布-丰度曲线是用来解释物种丰度和物种均匀度。由图 1可知, HN组与SD组的曲线较宽, 曲线较平缓即说明这两组物种丰度越高, 物种分布越均匀。相比这两组, XG组曲线开始急剧下降, 说明其存在着优势菌群占有一定优势, 而后曲线平缓, 说明物种分布比较均匀。
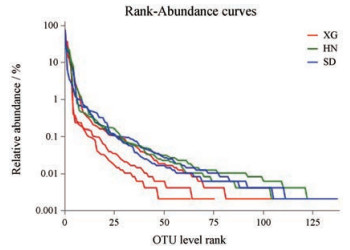
|
Figure 1 Seven distribution of the sample - abundance curve |
采用Shannon、Simpson、Chao、Ace等指数揭示柏子仁样品表面真菌的α多样性。其中Chao指数以及Ace指数代表物种的数量, 数值越大, 表示菌群物种的数量越多; Shannon以及Simpson指数用于衡量物种多样性, Shannon指数越大, 群落多样性越高, 而Simpson指数越大, 群落多样性越低。由表 2可知, 1号样品的Ace以及Chao指数最低, 说明其表面真菌物种数量较其他组少。6号样品Shannon指数最高, 5号样品Simpson指数最高, 说明这两组样品表面真菌的物种多样性程度较高。7份样品OTU覆盖率Coverage均接近1, 说明7份样品表面真菌群落被检出的概率高。
| Table 2 Seven samples Alpha diversity table |
7份柏子仁样品得到3门、18纲、40目、82科、120属共191种真菌。在属水平上, 如图 2, 被鉴定出来的有曲霉属(Aspergillus)、葡萄座腔菌属(Neofusicoccum)、青霉属(Penicillium)、发菌属(Trichothecium)、裸节菌属(Talaromyces)、交链格孢属(Altemaria)、短梗霉属(Aureobasidium)等, 其中曲霉属丰度占比最高, 为(93.36 ± 6.01)%。由图 3可知, 在种水平上被鉴定出的种有黑曲霉(Aspergillus niger)、烟曲霉(Aspergillus fumigatus)、黄曲霉(Aspergillus flavus)、Aspergillus piperis、筛曲霉(Aspergillus cibarius)、帚状曲霉(Aspergillus penicillioides)、浅蓝灰曲霉(Aspergillus caesiellus)、孔曲霉(Aspergillus ostianus)、粉红单端孢(Trichothecium roseum)以及未鉴定出的某些曲霉属的真菌(unclassified_g_Neofusicoccum)、未鉴定出的曲霉(unclassified_g_Aspergillus)、未鉴定出的青霉(unclassified_g_Penicillium)、未鉴定出的裸节菌(unclassified_g_Talaromyces)、某种交链格孢(unclassified_g_Alternaria)、某种短梗霉(unclassified_g_ Aureobasidium)、未鉴定出的小戴卫霉(unclassified_ f_Davidiellaceae)等。
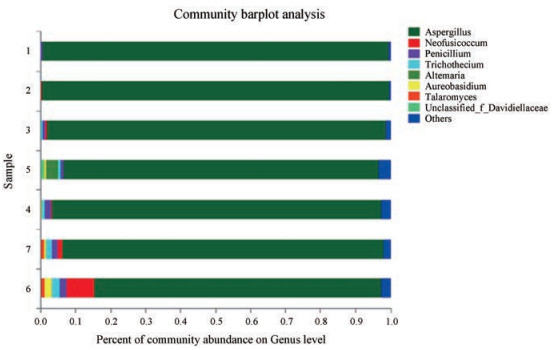
|
Figure 2 Species composition at genus level in 7 samples (Different colors represent different species, and the length of the patch indicates the relative abundance ratio of the species; the species with low abundance merge into others, and the unclassified indicates the species that are not taxonomically annotated) |

|
Figure 3 Species composition at species level of seven samples |
7份样品除5号样品中筛曲霉(Aspergillus cibarius)占比73.76%, 帚状曲霉(Aspergillus penicillioides)占比9.92%, 而黄曲霉(Aspergillus flavus)仅仅占比0.97%。其余6份样品丰度占比前三的真菌分别为黑曲霉、烟曲霉以及黄曲霉菌, 丰度占比情况见表 3。由表 3可知, 6份样品中黄曲霉菌占着一定的比例, 分别为14.58%、15.98%、17.64%、16.44%、23.39%、18.86%, 预示着柏子仁表面存在着严重的黄曲霉菌污染进而会产生黄曲霉毒素超标的问题。
| Table 3 6 samples abundance accounted for a relatively high proportion of colonies |
为呈现不同环境样本中微生物进化的差异程度, 根据beta多样性距离矩阵进行层级聚类分析, 使用UPGMA算法构建树状结构, 如图 4。由图可知, XG组的三份样品聚为一小支, 说明在科水平上具有很高的相似度, SD组样品也有着较高的相似度。

|
Figure 4 Hierarchical clustering tree on family level of 7 samples (The length of the branches represents the distance between the samples) |
近两年微生物群落的研究备受关注, 目前研究者主要集中于研究植物内生真菌, 其目的之一是生产寄主本身的有效成分, 或能产生或转化新的化学成分, 例如有报道从贯叶连翘中分离出来的内生真菌可以产生大黄素, 有一株还可以合成金丝桃素[14]。柏子仁作为常用中药, 未有关于其表面微生物群落多样性的报道。近年来, 高通量测序技术得以快速发展并得到广泛应用[15]。本研究采用的高通量测序技术对柏子仁表面的真菌群落多样性进行分析, 7份柏子仁样品得到3门、18纲、40目、82科、120属共191种真菌, 说明高通量测序技术能较真实、准确的反映柏子仁表面微生物群落种类及丰度情况。
药材是许多微生物的寄主, 是微生物生命周期中的主要栖息地和能源[16], 微生物群落能直接影响药材的健康状态。一些真菌如曲霉、青霉等对药材有着潜在的危害[17, 18], 相反一些真菌却对宿主产生有益的影响, 如酵母菌等。研究表明, 病原菌的生物防治剂很大一部分是从微生物群落中分离出来的, 也就是说药材表面微生物种群与生物防治之间存在着一定的关系[5, 6]。因此, 更好地了解药材表面的微生物组成将为探索新的对抗病原体的生物防治剂增加机会。本研究收集到的7份柏子仁样品表面微生物群落肉眼均观察不到, 采用高通量测序对柏子仁药材表面真菌群落组成的分析发现, 3个地区的柏子仁表面真菌有着明显差异。在属水平上, 曲霉属真菌为核心菌群, 丰度占比达到(93.36 ± 6.01)%, 这与曲霉属真菌易在低水分的基质、高温和潮湿的环境条件下生长繁殖的报道一致[19]。5号样品中筛曲霉(Aspergillus cibarius)为优势菌群, 其余6份样品均以黑曲霉(Aspergillus niger)、烟曲霉(Aspergillus fumigatus)以及黄曲霉菌(Aspergillus flavus)为优势菌群, 推测可能与柏子仁产地的环境如温湿度、柏子仁加工方式如烘干温度等有关。
对种水平上的真菌进行分析发现, 3个地区的柏子仁样品表面黄曲霉菌仍然有一定地占比, 表明黄曲霉菌污染问题仍很严重。但5号样品中筛曲霉(Aspergillus cibarius)占有极大的比例, 黄曲霉菌占比例较小, 是否筛曲霉在某种程度上抑制了黄曲霉菌的生长, 后期还需加大样品数量进行研究。其余样品黑曲霉以及烟曲霉占有着很大的比例, 是否能将黑曲霉以及烟曲霉用于抑制黄曲霉菌后期将是一项极有意义的研究, 将能为解决黄曲霉污染及其黄曲霉毒素超标问题做出极大贡献。此外, 通过对柏子仁药材表面真菌群落组成结构的分析, 极大程度上推动了药材表面真菌的快速检测与动态监控的发展, 能对药材进行早期霉菌污染的预警, 进而制定霉菌污染策略以防治毒素污染。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典一部)[S]. Part 1. Beijing: China Medical Science Press, 2015, 247. |
| [2] | Lu J, Lu S. Research progress of Platycladi seed[J]. J Liaoning Univ Tradit Chin Med (辽宁中医药大学学报), 2013, 15: 247–250. |
| [3] | Suo JH, Mou HJ, Liu XJ, et al. Improving effect and mechanism of Chinese arborvitae glycosides on the behavior of rat model of Alzheimer's disease[J]. Chin J Comp Med (中国比较医学杂志), 2018, 28: 84–88, 95. |
| [4] | Xiao W, Liu ZL, Li ZX, et al. Study on slumber improvement by Platycladi seed extract[J]. Food Sci (食品科学), 2007(07): 475–479. |
| [5] | Angeli D, Sare AR, Jijakli MH, et al. Insights gained from metagenomic shotgun sequencing of apple fruit epiphytic microbiota[J]. Postharvest Biol Technol, 2019, 153: 96–106. DOI:10.1016/j.postharvbio.2019.03.020 |
| [6] | Sebastien M, Margarita MM, Haissam JM, et al. Biological control in the microbiome era: challenges and opportunities[J]. Biological Control, 2015, 89: 98–108. DOI:10.1016/j.biocontrol.2015.06.003 |
| [7] | Li T, Hu XS, Gong Y, et al. Research progress on prevention and control measures of aflatoxin in Chinese medicinal materials[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2019, 25: 228–234. |
| [8] | Kang J, Zhang SY, Han T, et al. Microbial diversity and community structure characteristics of Yam rhizosphere soil at different development periods[J]. Biotech Bull (生物技术通报), 2019: 1–8. DOI:10.13560/j.cnki.biotech.bull.1985.2018-1041 |
| [9] | Shen YM, Nie J, Dong YF, et al. Compositional shifts in the surface fungal communities of apple fruits during cold storage[J]. Postharvest Biol Technol, 2018, 144: 55–62. DOI:10.1016/j.postharvbio.2018.05.005 |
| [10] | Song XH, Tan J, Li LY, et al. Illumina high-throughput sequencing reveals fungal community composition and diversity in root rot of Coptis chinensis in rhizosphere soil[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 5396–5403. |
| [11] | Zhang TT, Liang YM, Xu L, et al. Study on DNA molecular identification of mix samples of five species of Baitouweng medicinal materials based on high-throughput sequencing technology[J]. Acta Pharm Sin (药学学报), 2018, 53: 1918–1923. |
| [12] | Xu YH, Wang YL, Wang DF, et al. Effect of Huangqin Tang on the gut microbiota in rats with ulcerative colitis model determined by high-throughput sequencing[J]. Acta Pharm Sin (药学学报), 2017, 52: 1673–1682. |
| [13] | Xue M, Duan JP, Kang S. The identification for Seman Platycladi and its adulterants[J]. Chin J Med Guide (中国医药导刊), 2018, 20: 225–227. |
| [14] | Vigneshwari A, Rakk D, Nemeth A, et al. Host metabolite producing endophytic fungi isolated from Hypericum perforatum[J]. PLoS One, 2019, 14: e0217060. DOI:10.1371/journal.pone.0217060 |
| [15] | Aregbe AY, Mu TH, Sun HN. Effect of different pretreatment on the microbial diversity of fermented potato revealed by high-throughput sequencing[J]. Food Chem, 2019, 290: 125–134. DOI:10.1016/j.foodchem.2019.03.100 |
| [16] | Abdelfattah A, Wisniewski M, Droby S, et al. Spatial and compositional variation in the fungal communities of organic and conventionally grown apple fruit at the consumer point-of-purchase[J]. Hort Res, 2016, 3: 16047. DOI:10.1038/hortres.2016.47 |
| [17] | Guo MY, Pang XH. Research progress on identification of Aspergillus fungi in traditional Chinese medicinal materials[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 3933–3941. |
| [18] | Makhlouf J, Carvajal-Campos A, Querin A, et al. Morphologic, molecular and metabolic characterization of Aspergillus section Flavi in spices marketed in Lebanon[J]. Sci Rep, 2019, 5: 5263. |
| [19] | Liu J, Deng JC, Yang CQ, et al. Fungal diversity in field mold-damaged soybean fruits and pathogenicity identification based on high-throughput rDNA sequencing[J]. Front Microbiol, 2017, 8: 779. DOI:10.3389/fmicb.2017.00779 |
 2019, Vol. 54
2019, Vol. 54


