2. 四川大学华西药学院, 靶向药物与释药系统教育部重点实验室, 四川 成都 610041
2. Key Laboratory of Drug Targeting and Drug Delivery Systems, Ministry of Education, West China School of Pharmacy, Sichuan University, Chengdu 610041, China
冰点是指在一定温度和压力条件下, 水溶液组分中固相和液相物质处于平衡状态时的温度[1, 2]。在药学领域, 冰点可用来确定药物液体制剂的运输温度、储存温度, 尤其在北方城市的冬天, 室外温度通常在摄氏零度以下, 合理的制定运输温度显得尤为重要[3]。另外, 一定浓度的药物溶液有相对固定的冰点值, 当浓度、成分发生改变时冰点会随之变化, 因此冰点可以区别药物溶液的纯杂程度[4]。
常用的测定冰点方法有步冷曲线冰点测定法[1], 由于测定冰点的过程中体系中出现相变[5], 体系的降温速率或升温速率、溶液因素(用量、纯度、稳定性、晶型)、热传导状态及记录的图像分析等因素均会影响测定结果, 不适合高浓度溶液。詹先成等[6, 7]提出了一种空气湿度冰点测定法, 该法用湿度计测定与溶液呈平衡的空气相对湿度, 再由相对湿度与冰点之间的关系计算出溶液的冰点, 该法在低浓度、高湿度时, 由于湿度传感器固有的缺陷, 相对湿度测定值精密度较差, 得到的低浓度冰点值误差较大, 所以不适宜于低浓度溶液。
冰点是溶液的一个热力学性质, 根据物理化学原理, 溶液冰点与溶液中水的活度有关[8, 9]。作者用一种电解质溶液体系半经验水化模型(semi-empirical hydration model, SEHM)计算NaH2PO4和K2HPO4组成的混合电解质溶液中水的活度, 从而得到冰点, 并与步冷曲线冰点法和空气湿度冰点法得到的冰点值进行了比较。
材料与方法仪器与试剂 Rotronic湿度计(HydroPalm Hp22), 探头型号: HygroClip HC2-S (测定精度:相对湿度±0.8% Hr, 温度±0.1 ℃); SDH401型恒温恒湿箱(重庆试验设备厂, 准确度≤2 ℃, 温度波动≤0.5 ℃); FPD-4A冰点仪(南京南大万和科技有限公司, 温差分辨率: ±0.001 ℃); pH复合电极(雷磁E-201-C型)。计算工具: Microsoft Office Excel 2003;绘图工具: OriginPro8。无水NaH2PO4 (成都市科龙化工试剂厂, 分析纯, 含量≥99.0%), 无水K2HPO4 (成都市科龙化工试剂厂, 分析纯, 含量≥98.0%)。
应用SEHM计算溶液的冰点 根据物理化学的基本原理, 溶液的冰点(Tf)与水的活度(aH2O)的关系[1]为
| ${\rm{ln}}{a_{{{\rm{H}}_2}{\rm{O}}}} = \frac{{{{\rm{\Delta }}_{fus}}H}}{R}\left( {\frac{1}{{{T_f}^{\rm{*}}}} - \frac{1}{{{T_f}}}} \right) = \frac{{6025}}{{8.314}} \times \left( {\frac{1}{{273.15}} - \frac{1}{{{T_f}}}} \right)$ | (1) |
Balomenos等[10, 11]提出了一种半经验水化模型(semi-empirical hydration model, SEHM)用来描述电解质溶液体系, 该模型引入了电解质、离子和混合电解质的特性参数, 考虑了溶液中水的水化平衡和水化离子形式。作者应用此模型计算不同浓度NaH2PO4-K2HPO4混合电解质溶液中aH2O[12], 由此计算溶液冰点。由SEHM针对NaH2PO4-K2HPO4混合电解质溶液体系, 渗透系数ϕ[12]可表达为
| $\begin{array}{*{20}{l}} {\phi = - \frac{{{\rm{ln}}{x_w}}}{{0.018c}} - \frac{{{\kappa ^3}}}{{4.536 \times {{10}^{28}}c + 2.268 \times {{10}^{20}}c\kappa }} + }\\ {2.617 \times {{10}^{ - 28}}c + \frac{{9.157 \times {{10}^{ - 66}}{\kappa ^4}}}{{c{{\left( {1 + 5 \times {{10}^{ - 10}}\kappa } \right)}^2}}}} \end{array}$ | (2) |
式(2)中
| ${x_w} = \frac{{\left( {{m_1}^2 + 6{m_2}^2} \right)Y + 5{m_1}{m_2}X}}{{\left( {{m_1}^2 + 6{m_2}^2} \right)Y\left( {1 + X} \right) + 5{m_1}{m_2}X\left( {1 + Y} \right)}}$ | (3) |
X = 0.032 52 m1 + 0.076 35 m2;
pH = 6时, Y = 0.048 05 m1 - 0.020 58 m2;
pH = 7时, Y = 0.081 49 m1 - 0.002 482 m2;
pH = 8时, Y = 0.161 7m1 - 0.001 159 m2
| $c = \frac{{{m_1}}}{{1.0030 + 0.002301{m_1}}} + \frac{{{m_1}}}{{1.0030 + 0.03399{m_1}}} + \frac{{2{m_2}}}{{1.0030 + 0.01602{m_2}}} + \frac{{{m_2}}}{{1.0030 + 0.02204{m_2}}}$ | (4) |
| $k = 0.329 \times {10^{10}}\sqrt {0.5\left( {\frac{{{m_1}}}{{1.0030 + 0.002301{m_1}}} + \frac{{{m_1}}}{{1.0030 + 0.03399{m_1}}} + \frac{{2{m_2}}}{{1.0030 + 0.01602{m_2}}} + \frac{{4{m_2}}}{{1.0030 + 0.02204{m_2}}}} \right)} $ | (5) |
| ${a_{{{\rm{H}}_2}{\rm{O}}}} = {\rm{exp}}\left[ { - 0.018\phi \left( {2{m_1} + 3{m_2}} \right)\left( {{m_1} + {m_2}} \right)} \right]$ | (6) |
其中, m1、m2分别为NaH2PO4和K2HPO4的质量摩尔浓度。以上模型方程虽然看似繁杂, 但却仅包含溶质的质量摩尔浓度。作者使用Excel进行计算, 由式(2)~(5)计算得到渗透系数ϕ, 再由式(6)计算得到aH2O, 代入式(1), 便可计算出溶液的冰点。
空气湿度冰点测定法测定溶液的冰点 称取一定量的NaH2PO4和K2HPO4于烧杯中, 加入蒸馏水50 g, 搅拌至完全溶解, 配成浓度分别为0.05、0.1、0.2、0.5、1和2 mol·kg-1的pH值为6、7、8溶液。取溶液8 mL于150 mL磨口锥形瓶中, 插入湿度计探头于锥形瓶上方空间(图 1)[13]。25 ℃恒温2 h后, 从湿度计上读取与溶液呈平衡的空气相对湿度值。

|
Figure 1 Assembly used in the determination of the relative air humidity in equilibrium with the solution |
由于溶液中aH2O是与之平衡的空气相对湿度[1], 则
| ${a_{{{\rm{H}}_2}{\rm{O}}}} = {H_r}$ | (7) |
则式(1)可写为
| ${\rm{ln}}{H_r} = \frac{{{{\rm{\Delta }}_{fus}}H}}{R}\left( {\frac{1}{{T_f^{\rm{*}}}} - \frac{1}{{{T_f}}}} \right)$ | (8) |
将读取的相对湿度测定值代入式(8), 可计算出冰点值。
步冷曲线冰点测定法测定溶液的冰点 分别取空气湿度冰点测定法中配制的各浓度溶液25 mL, 置于FPD-4A型冰点仪中[14], 控制降温环境的温度低于待测溶液冰点约3 ℃, 由仪器记录到步冷曲线分析得到溶液的冰点。
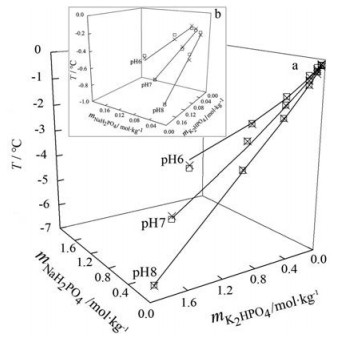
结果 1 应用SEHM计算的溶液冰点将配制好的溶液的浓度数据按步骤代入该方法所述的公式中, 计算出各浓度溶液的冰点值见表 1和图 2。随着溶液浓度增加, 溶液的冰点降低, 符合溶液依数性原理; 浓度相同的NaH2PO4-K2HPO4混合电解质溶液, 随着溶液pH值升高, 溶液冰点降低, 这是因为K2HPO4水溶液呈碱性、NaH2PO4水溶液呈酸性, 两者混合溶液的pH值升高则K2HPO4的比例增加、NaH2PO4的比例减少, 假设电解质在水中仅电离, 则K2HPO4电离出3个离子、NaH2PO4电离出2个离子, 即溶质数量越多, 溶液冰点越低, 这也符合溶液依数性原理。
| Table 1 Freezing point of NaH2PO4-K2HPO4 mixed electrolyte solution calculated by semi-empirical hydration model (SEHM), determined by air humidity cryoscopy and cooling curve cryoscopy. n = 3, x ± s |
|
Figure 2 Comparison of freezing point data of NaH2PO4-K2HPO4 mixed electrolyte solution obtained by SEHM (—), air humidity cryoscopy (□) and cooling curve cryoscopy (×). a: Global graph, b: Local magnification |
应用空气湿度冰点测定法得到的各浓度溶液的冰点值见表 1和图 2, 与用SEHM计算得到的溶液冰点值比较, 两种方法得到的冰点值基本一致。同时也可以看到, 空气湿度冰点测定法得到的pH值分别为6、7和8的0.05mol·kg-1溶液冰点值是相同的, 这是由于溶液浓度较低时, 湿度计探头的精度在测定与溶液呈平衡的空气相对湿度时对相对湿度测定影响较大, 从而影响得到的冰点值。
3 步冷曲线冰点测定法测定溶液冰点应用步冷曲线冰点测定法测定的各浓度溶液的冰点值见表 1和图 2, 与用SEHM计算得到的溶液冰点值比较, 两种方法得到的冰点值基本一致。同时也可以看到, 步冷曲线冰点测定法得到的高浓度溶液冰点值, 与低浓度溶液结果比较, 同一浓度3次测定结果间的标准差较大, 这是由于随着溶液浓度增加, 溶液黏度增大, 结晶速率及结晶时的放热速率减小, 溶液体系中散热损失的影响变大, 导致测定值的重现性差。
4 三种方法结果比较由表 1和图 2可见, 用SEHM计算得到的溶液冰点值与空气湿度冰点测定法、步冷曲线冰点测定法得到的溶液冰点值基本一致。由此, 可以用SEHM计算NaH2PO4-K2HPO4混合电解质溶液冰点。
讨论SEHM可以很好地描述电解质溶液中分子、离子间的相互作用, 应用SEHM公式计算溶液中水的活度, 从而计算出溶液的冰点。作者通过对不同pH值和不同浓度的NaH2PO4-K2HPO4混合电解质溶液应用SEHM计算溶液冰点, 并与空气湿度冰点测定法、步冷曲线冰点测定法的结果进行比较, 结果表明, 应用SEHM计算电解质溶液冰点的方法是可行的。
在应用空气湿度冰点测定法、步冷曲线冰点测定法的操作过程中, 测定结果通常会受到仪器、环境、操作者等因素的影响。如空气湿度冰点测定法中湿度计探头的精度、步冷曲线冰点测定法中溶液相变过程以及对步冷曲线的分析, 表明这些因素均会影响测定的结果, 使得测定结果重现性差, 需要多次进行实验。而使用模型计算的方法避免了上述因素的影响, 并且能提高工作效率、节约成本。
SEHM适合用于含有一种或两种电解质的溶液, 不同溶质的特性参数可通过文献[10, 11]获得。但是, SEHM不适合用于非电解质溶液。作者尝试应用其他模型计算出聚山梨酯20溶液这种非电解质溶液的冰点[15]。所以, 应用模型计算溶液冰点的方法原理只适合溶质已知的溶液。
根据物理化学基本原理[1], 溶液冰点降低、蒸汽压降低、沸点升高和渗透压均是溶液的依数性, 这些性质之间存在相互关系, 已知其中一个物理量, 便可计算出其他的物理量。由此, 在理论上, 应用模型计算蒸汽压、沸点和渗透压也是可行的, 但需要进一步验证。
| [1] | Hou XP. Physical Chemistry (物理化学)[M]. Beijing: People's Medical Publishing House, 2007: 98-128. |
| [2] | Wang XZ, Chen FF. Principle and measurement method of freezing point and triple point of water[J]. Gansu Sci Technol (甘肃科技), 2008, 24: 87–89. |
| [3] | Liu FY, Huang XL, Huang WT, et al. Determination, graphics expression and calculation of freezing point and eutectic point in ternary salt-water system[J]. Ciesc J, 2017, 68: 3336–3342. |
| [4] | National Health and Family Planning Commission of the People's Republic of China. Determination of Ice Point of Raw Milk in National Food Safety Standard[S]. 2016. |
| [5] | Ding H, Wu F. Application of differential scanning calorimetry in pharmaceutical research[J]. World Notes Antibiot, 2002, 23: 193–196. |
| [6] | Zhan XC, Xu A, Fu Q, et al. Air humidity cryoscopy[J]. Acta Pharm Sin (药学学报), 2016, 51: 668–671. |
| [7] | Xu A, Zhan XC, Fu Q, et al. Determination of the freezing point of drug solutions by humidity meter[J]. West China J Pharm Sci (华西药学), 2016, 31: 57–58. |
| [8] | Fu Q, Zhan XC, Xu A. Theoretical calculation of the freezing point of drug soltions[J]. West China J Pharm Sci (华西药学), 2016, 31: 59–60. |
| [9] | Wei XX, Zhan XC, Gao J, et al. Calculating freezing point of NaCl-NH4Cl-H2O system by Pitzer model[J]. West China J Pharm Sci (华西药学), 2017, 32: 193–195. |
| [10] | Balomenos E, Panias D, Paspaliaris I. A semi-empirical hydration model (SEHM) for describing aqueous electrolyte solutions I. Single strong electrolytes at 25℃[J]. Fluid Phase Equilib, 2006, 243: 29–37. DOI:10.1016/j.fluid.2006.02.008 |
| [11] | Balomenos E, Panias D, Paspaliaris I. A semi-empirical hydration model (SEHM) for describing aqueous electrolyte solutions II. Mixing rules for multiple electrolyte systems at 25℃[J]. Fluid Phase Equilib, 2006, 247: 1–7. DOI:10.1016/j.fluid.2006.06.001 |
| [12] | Chen XZ, Cai ZY, Hu WM. Chemical Thermodynamics[M]. Beijing: Chemical Industry Press, 2005: 194-195. |
| [13] | Wang YL, Zhan XC, Luo L, et al. Relationship between critical relative humidity and solubility of drugs[J]. Drug Devel Ind Pharm, 2011, 37: 547–551. DOI:10.3109/03639045.2010.528428 |
| [14] | Ye F, Zhao YQ, Xu T, et al. Establishment and application example of measuring method of FPD-4A freezing point depression instrument[J]. Exp Technol Management, 2016, 33: 102–106. |
| [15] | Gao J, Zhan XC, Wei XX. Calculating the freezing point of polysorbate 20 solution by Uniquac model[J]. West China J Pharm Sci (华西药学), 2017, 32: 401–402. |
 2019, Vol. 54
2019, Vol. 54


