2. 南昌大学第一附属医院药学部, 江西 南昌 330006;
3. 江西中医药大学药学院, 江西 南昌 330004
2. Department of Pharmacy, the First Affiliated Hospital of Nanchang University, Nanchang 330006, China;
3. School of pharmacy, Jiangxi University of Traditional Chinese Medicines, Nanchang 330004, China
截叶铁扫帚[Lespedeza cuneata (Dum.Cour.) G. Don]为豆科(Leguminosae)胡枝子属一年生草本植物, 又名夜关门, 全草入药, 在我国分布于东北、山东、江苏、浙江、江西、湖北、湖南、四川、云南、福建、广东、广西等地, 资源丰富。截叶铁扫帚味微苦, 性平, 具有补肝肾, 益肺阴, 散瘀消肿的功效[1]。目前, 从截叶铁扫帚中分离得到的化合物主要为黄酮类、酚酸类、木脂素类等化合物。现代药理研究表明, 截叶铁扫帚具有抗炎、抗氧化、抗菌、保肝、兴奋离体子宫等药理活性[2-6]。前期本课题组从截叶铁扫帚70%乙醇提取物的乙酸乙酯萃取部位分离到了一系列的木脂素、苯丙素类化合物, 并对其进行了药理活性筛选, 结果显示部分化合物具有良好的抗溃疡性结肠炎、保肝等活性[7-9]。为了拓展截叶铁扫帚化学物质基础范围, 补充和完善其生物活性研究内容, 进一步为截叶铁扫帚的开发利用提供科学依据。本实验采用硅胶柱色谱、中压液相色谱及制备高效液相色谱等多种方法从截叶铁扫帚70%乙醇提取物中分离得到5个黄酮类化合物, 利用MS、IR、UV、1D和2D NMR等波谱技术对其结构进行鉴定, 分别为7-O-glucosyllaburnetin (1)、山柰酚-3-O-β-D-半乳糖苷(2)、山柰酚-3-O-α-L-鼠李糖苷(3)、牡荆素(4)和异牡荆素(5)。其中化合物1为新化合物, 化合物2和3为首次从截叶铁扫帚中分离得到, 结构见图 1。采用特异的体外靶向xbp1高通量双荧光素酶报告基因药物筛选模型对化合物1~5进行了xbp1转录激活作用评价, 发现化合物1具有一定的xbp1转录激活作用, 其作用强度为空载体对照组的1.80倍。
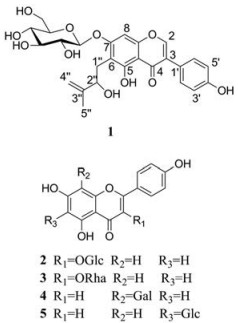
|
Figure 1 Structures of compounds 1-5 |
化合物1黄色粉末, [α]D20-172.5 (c 0.10, CH3OH), IR光谱显示有羟基(3 310 cm-1)、苯环(1 614和1 516 cm-1)的特征吸收峰, UV显示该化合物在MeOH溶液中的最大吸收为204、267 nm。HR-ESI-MS给出准分子离子峰m/z 539.153 1 [M+Na]+ (calcd. for C26H28NaO11, 539.152 4), 同时结合1H NMR和13C NMR图谱数据推测化合物1的分子式为C26H28O11, 不饱和度为13。化合物1的1D NMR (表 1)中δH 7.40 (2H, d, J = 9.0 Hz, H-2', 6')、6.83 (2H, d, J = 9.0 Hz, H-3', 5')为AA'BB'偶合系统的特征信号; δH 6.82 (1H, s, H-8)为芳环质子信号; 上述信息表明1结构中含有两个苯环:一个为1, 4-对位取代, 另一个为1, 2, 3, 4, 5-五取代。结合UV信息, δH 8.43 (1H, s, H-2)表明1可能为异黄酮类化合物。δH 4.76 (1H, brs, H-4''a)、4.67 (1H, brs, H-4''b)、4.22 (1H, m, H-2'')、2.88 (1H, dd, J = 5.0, 13.5 Hz, H-1''a)、2.76 (1H, dd, J = 4.0, 13.0 Hz, H-1''b)、1.77 (3H, s, H-5'')为2-羟基-3-甲基-3-丁烯基的信号。13C NMR中δC 101.0、73.5、76.4、69.7、77.4、60.7为葡萄糖片段的碳信号; δH 4.96 (1H, d, J = 7.0 Hz)表明该糖的端基氢为β型。参照文献[10], 利用酸水解的方法获得单体葡萄糖, 结合GC分析, 确定分子中的葡萄糖为D-葡萄糖构型。基于上述信息和相关文献推断, 化合物1与已知化合物laburnetin (5, 7, 4'-trihydroxy-6-(2''-hydroxy-3''-methyl-3''-butenyl) isoflavone)结构相似[11], 区别在于化合物1的C-7位连接有一个葡萄糖片段。
| Table 1 1H NMR (500 MHz, DMSO-d6) and 13C NMR (125 MHz, DMSO-d6) spectral data of compound 1 (J in Hz) |
化合物1结构中取代基位置通过2D NMR谱图来确定的。在HMBC谱(图 2)中, H-2 (δH 8.43, 1H, s)与C4 (δC 180.6)、C5 (δC 158.8)远程相关, 进一步证明1为异黄酮类化合物; 葡萄糖的H-1 (δH 4.96)与C-7 (δC 161.7)远程相关, 证明β-D-葡萄糖连接在异黄酮母核的C-7位; 2-羟基-3-甲基-3-丁烯基团的H-1'' (δH 2.88, 2.76)与C-5 (δC 158.8)、C-7, H-2'' (δH 4.22)与C-6 (δC 111.0)远程相关, 证明2-羟基-3-甲基-3-丁烯连接在C-6位; 因此, 该化合物的结构确定为7-O-glucosyllaburnetin。

|
Figure 2 Key HMBC correlations of compound 1 |
采用特异的体外靶向xbp1高通量药物筛选模型对已分离鉴定的化合物进行了体外xbp1激活作用评价。研究结果表明, 化合物1对xbp1基因启动子具有一定的转录激活效应, 其作用强度为空载体对照组的1.80倍。然而, 本实验所分离的其他化合物对xbp1的转录未显示激活效应。
实验部分JASCO V650型紫外分光光度计, JASCO P2000型旋光仪(日本JASCO公司); Nicolet impact 5700型傅里叶变换红外光谱仪(美国Thermo Electron Corporation公司); Mercury-400核磁共振仪(美国Varian公司); BRUKER AV500-Ⅲ核磁共振仪(德国Bruker公司); Agilent 1100系列LC/MSD Trap-SL型质谱仪, Agilent 1260型高效液相色谱仪(美国安捷伦科技有限公司); Shimadzu LC-6AD型半制备液相色谱仪(日本岛津公司); YMC ODS-A C18制备柱(250 mm×20 mm, 5 μm, 日本YMC公司); Büchi中压液相制备色谱仪(瑞士布琪有限公司); 354型酶标仪(美国Thermo公司)。柱色谱硅胶(200~300目)和薄层色谱硅胶(GF254)均为青岛海洋化工厂产品。常规试剂均为分析纯。
截叶铁扫帚于2012年9月采自江西省九江市(经度115°89'87.13" ,纬度29°58'51.73'', 海拔65.6米), 经江西省九江森林植物标本馆谭策铭研究员鉴定为豆科胡枝子属植物截叶铁扫帚[Lespedeza cuneata (Dum.Cour.) G. Don]的地上部分。标本现存于江西省九江森林植物标本馆, 标本号为12675。
1 提取分离截叶铁扫帚地上部分20 kg, 粉碎后用70%乙醇回流提取3次, 每次2 h, 过滤, 合并提取液, 减压浓缩回收溶剂后, 得70%乙醇提取物3.7 kg。将70%乙醇提取物用硅藻土拌样, 依次用石油醚、氯仿、乙酸乙酯、丙酮、95%乙醇和70%乙醇依次洗脱, 得到各个部位。其中乙酸乙酯洗脱部位(120 g)经正相硅胶柱色谱分离, CHCl3-MeOH-H2O (4:1:0.1)系统洗脱, 经薄层色谱检识, 合并相近的组分, 得7个组分(Fr.1~Fr.7)。Fr.4 (6.8 g)通过中压柱色谱柱色谱, 梯度洗脱[甲醇-水(25:75→70:30, v/v)], 得到Fr.4-1~Fr.4-20; Fr.4-10 (0.65 g)经制备液相[乙腈-水(15:85, v/v)]分离纯化得到化合物1 (17 mg)、3 (18 mg)和5 (23 mg)。Fr.6 (14.5 g)通过中压柱色谱柱色谱, 梯度洗脱[甲醇-水(20:80→75:25, v/v)], 得到Fr.6-1~Fr.6-22。Fr.6-12 (0.70 g)经半制备液相[乙腈-水(17:83, v/v)]分离纯化得到化合物2 (26 mg)和4 (12 mg)。
2 结果鉴定化合物1 黄色粉末; [α]D20-172.5 (c 0.10, CH3OH); UV (MeOH) λmax (log ε): 204 (4.56)、267 (4.58) nm; IR (microscope) νmax: 3 310、2 917、1 649、1 614、1 516、1 450、1 372、1 262、1 019、953、841 cm-1; HR-ESI-MS m/z 539.153 1 [M+Na]+ (calcd. for C26H28NaO11, 539.152 4)。1H NMR (DMSO-d6, 500 MHz)和13C NMR (DMSO-d6, 125 MHz)数据见表 1。
化合物2 黄色粉末; ESI-MS m/z 471 [M+Na]+, 919 [2M+Na]+; 1H NMR (DMSO-d6, 400 MHz) δH: 8.05 (2H, d, J = 8.8 Hz, H-2', 6'), 6.85 (2H, d, J = 8.8 Hz, H-3', 5'), 6.35 (1H, brs, H-8), 6.13 (1H, brs, H-6), 5.37 (1H, d, J = 7.6 Hz, H-1'')。13C NMR (DMSO-d6, 125 MHz) δC: 156.5 (C-2), 133.1 (C-3), 177.2 (C-4), 160.0 (C-5), 99.2 (C-6), 161.1 (C-7), 93.9 (C-8), 156.0 (C-9), 103.2 (C-10), 120.9 (C-1'), 130.9 (C-2'), 115.0 (C-3'), 160.0 (C-4'), 115.0 (C-5'), 130.9 (C-6'), 101.9 (C-1''), 71.2 (C-2''), 73.1 (C-3''), 67.9 (C-4''), 75.7 (C-5''), 60.1 (C-6'')。以上数据与文献报道的山柰酚-3-O-β-D-半乳糖苷[12]的数据一致。
化合物3 黄色粉末; ESI-MS m/z 455 [M+Na]+, 471 [M+K]+; 1H NMR (DMSO-d6, 400 MHz) δH: 7.78 (2H, d, J = 8.8 Hz, H-2', 6'), 6.91 (2H, d, J = 8.8 Hz, H-3', 5'), 6.38 (1H, brs, H-8), 6.18 (1H, brs, H-6), 5.29 (1H, brs, H-1'')。13C NMR (DMSO-d6, 125 MHz) δC: 157.0 (C-2), 134.1 (C-3), 177.6 (C-4), 161.2 (C-5), 98.9 (C-6), 165.1 (C-7), 93.8 (C-8), 156.6 (C-9), 103.8 (C-10), 120.5 (C-1'), 130.6 (C-2'), 115.4 (C-3'), 160.0 (C-4'), 115.4 (C-5'), 130.6 (C-6'), 101.8 (C-1''), 70.3 (C-2''), 70.6 (C-3''), 71.1 (C-4''), 70.1 (C-5''), 17.5 (C-6'')。以上数据与文献报道的山柰酚-3-O-α-L-鼠李糖苷[13, 14]的数据一致。
化合物4 黄色粉末; ESI-MS m/z 433 [M+H]+, 455 [M+Na]+; 1H NMR (DMSO-d6, 400 MHz) δH: 8.03 (2H, d, J = 8.5 Hz, H-2', 6'), 6.89 (2H, d, J = 8.5 Hz, H-3', 5'), 6.77 (1H, s, H-3), 6.27 (1H, s, H-6), 4.69 (1H, d, J = 9.5 Hz, H-1'')。13C NMR (DMSO-d6, 125 MHz) δC: 163.9 (C-2), 102.4 (C-3), 182.1 (C-4), 161.2 (C-5), 98.2 (C-6), 162.8 (C-7), 104.6 (C-8), 156.0 (C-9), 104.0 (C-10), 121.6 (C-1'), 129.0 (C-2'), 115.8 (C-3'), 160.4 (C-4'), 115.8 (C-5'), 129.0 (C-6'), 73.4 (C-1''), 70.9 (C-2''), 78.7 (C-3''), 70.6 (C-4''), 81.8 (C-5''), 61.3 (C-6'')。以上数据与文献报道的牡荆素[15]的数据一致。
化合物5 黄色粉末; ESI-MS m/z 455 [M+Na]+, 431 [M-H]-; 1H NMR (DMSO-d6, 400 MHz) δH: 7.90 (2H, d, J = 8.5 Hz, H-2', 6'), 6.91 (2H, d, J = 8.5 Hz, H-3', 5'), 6.73 (1H, s, H-3), 6.45 (1H, s, H-8), 4.60 (1H, d, J = 9.5 Hz, H-1'')。13C NMR (DMSO-d6, 125 MHz) δC: 163.2 (C-2), 102.8 (C-3), 181.7 (C-4), 161.3 (C-5), 109.0 (C-6), 163.2 (C-7), 93.8 (C-8), 156.5 (C-9), 103.4 (C-10), 121.0 (C-1'), 128.4 (C-2'), 116.0 (C-3'), 160.7 (C-4'), 116.0 (C-5'), 128.4 (C-6'), 73.2 (C-1''), 70.6 (C-2''), 79.0 (C-3''), 70.2 (C-4''), 81.5 (C-5''), 61.5 (C-6'')。以上数据与文献报道的异牡荆素[15]的数据一致。
3 活性筛选将处于对数生长期的IEC-6细胞接种于48孔板中, 每孔细胞数为5×104, 使细胞在孔内均匀分散, 放置于37 ℃、5% CO2细胞培养箱培养。待细胞生长汇和至70%~80%, 对细胞进行相应质粒的转染(每孔0.6 μg), 4 h后加入1×10-5 mol·L-1各化合物与转染细胞共孵育(n = 3)。于共培养48 h后收样, 利用双荧光素酶报告基因检测试剂盒(Promega, USA)对实验样品进行报告基因荧光素酶活性检测。
| [1] | Jiangsu New Medical College. Dictionary of Chinese Herbal Medicines (中药大辞典)[M]. Shanghai: Shanghai Science and Technology Publisher, 1986: 1444. |
| [2] | Zhou J, Zhang CF, Lyu YN, et al. Research progress on chemical constituents and pharmacological effects of Lespedeza cuneata[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2017, 23: 228–234. |
| [3] | Yoo G, Park SJ, Lee TH. Flavonoids isolated from Lespedeza cuneata G. Don and their inhibitory effects on nitric oxide production in lipopolysaccharide-stimulated BV-2 microglia cells[J]. Pharmacogn Mag, 2015, 11: 651–656. DOI:10.4103/0973-1296.160466 |
| [4] | Deng F, Chang J, Zhang JS. New flavonoids and other constituents from Lespedeza cuneata[J]. J Asian Nat Prod Res, 2007, 9: 655–658. DOI:10.1080/10286020600979894 |
| [5] | Kim SM, Kang K, Jho EH, et al. Hepatoprotective effect of flavonoid glycosides from Lespedeza cuneata against oxidative stress induced by tert-butyl hyperoxide[J]. Phytother Res, 2011, 25: 1011–1017. DOI:10.1002/ptr.3387 |
| [6] | Lee HJ, Lim GN, Park MA, et al. Antibacterial and antioxidative activity of Lespedeza cuneata G. Don extracts[J]. Korean J Microbiol Biotechnol, 2011, 39: 63–69. |
| [7] | Zhou J, Li CJ, Yang JZ, et al. Phenylpropanoid and lignan glycosides from the aerial parts of Lespedeza cuneata[J]. Phytochemistry, 2016, 121: 58–64. DOI:10.1016/j.phytochem.2015.10.002 |
| [8] | Zhang CF, Zhou J, Yang JZ, et al. Two new phenylpropanoid glycosides from the aerial parts of Lespedeza cuneata[J]. Acta Pharm Sin B, 2016, 6: 564–567. DOI:10.1016/j.apsb.2016.05.009 |
| [9] | Zhang CF, Zhou J, Yang JZ, et al. Three new lignanosides from the aerial parts of Lespedeza cuneata[J]. J Asian Nat Prod Res, 2016, 18: 913–920. DOI:10.1080/10286020.2016.1187603 |
| [10] | Sato H, Tahara S, Ingham JL, et al. Isoflavones from pods of Laburnum anagyroides[J]. Phytochemistry, 1995, 39: 673–676. DOI:10.1016/0031-9422(95)00029-7 |
| [11] | Agrawal PK. NMR spectroscopy in the structural elucidation of oligosaccharides and glycosides[J]. Phytochemistry, 1992, 31: 3307–3330. DOI:10.1016/0031-9422(92)83678-R |
| [12] | Tomczyk M, Gudej J. Polyphenolic compounds from Rubus saxatilis[J]. Chem Nat Compd, 2005, 41: 349–351. DOI:10.1007/s10600-005-0148-1 |
| [13] | Fukunaga T, Nishiya K, Kajikawa I, et al. Chemical studies on the constituents of Hyphear Tanakae Hosokawa from different host trees[J]. Chem Pharm Bull, 1988, 36: 1180–1184. DOI:10.1248/cpb.36.1180 |
| [14] | Jia L, Bi YF, Jing LL, et al. Study on chemical constituents of Urena procumbens L.[J]. Chin Pharm J (中国药学杂志), 2010, 45: 1054–1056. |
| [15] | Lin YL, Kuo YH, Shiao MS, et al. Flavonoid glycosides from Terminalia catappa L.[J]. J Chin Chem Soc, 2000, 47: 253–256. DOI:10.1002/jccs.200000030 |
 2019, Vol. 54
2019, Vol. 54


