2. 江苏天士力帝益药业有限公司, 江苏 淮安 223003
2. Jiangsu Tasly Diyi Pharmaceutical Co., Ltd., Huaian 223003, China
吲哚胺2, 3-双加氧酶1 (indoleamine 2, 3-dioxygenase1, IDO1)含有403个氨基酸, 其编码基因位于人类第8号染色体上[1]。IDO1是一种含亚铁血红素的双加氧酶, 结构主要由α-螺旋构成, 并形成一个包含血红素的底物结合口袋[2, 3]。
IDO1是体内L-色氨酸沿犬尿氨酸途径代谢通路中的第一个限速酶, 有两个同工酶IDO2[4]和色氨酸-2, 3双加氧酶(tryptophan 2, 3-dioxygenase, TDO)[5]。IDO2在体内表达量极低, TDO主要在肝脏表达, 而IDO1在人体各组织和器官广泛表达, 因此IDO1在色氨酸代谢通路中备受关注。
IDO1通过降低体内L-色氨酸浓度从而发挥抑制T细胞增殖和活化的作用, 从而抑制正常的免疫应答[6, 7]。研究表明, IDO1对L-色氨酸的持续降解, 导致最终代谢产物犬尿氨酸浓度的增加, 以及犬尿氨酸一系列的代谢产物的累积, 均可直接抑制免疫应答和T细胞的增殖活化[8]。此外, 犬尿氨酸也能诱导IDO1的表达, 进一步抑制T细胞的免疫应答。因此, IDO1抑制剂具有扭转T细胞免疫抑制的作用, 是潜在的肿瘤免疫治疗药物[9]。
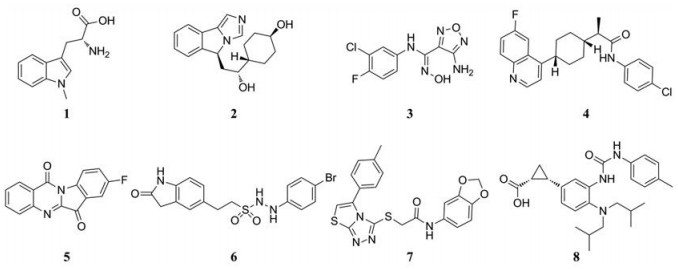
目前已有多个小分子IDO1抑制剂进入临床研究, 包括D-1-MT (1, IC50 > 100 μmol·L-1, HeLa IC50 = 1.5 mmol·L-1)[10]、GDC-0919 (2, IC50 = 13 nmol·L-1, T-REX-293 IC50 = 75 nmol·L-1)[11]、INCB24360 (3, IC50 = 72 nmol·L-1, HeLa IC50 = 7.1 nmol·L-1)[12]和BMS-986205 (4, HeLa IC50=0.5 nmol·L-1)[13], 另有一些化合物处于临床前研究阶段(5, IC50 = 534 nmol·L-1, HEK293 IC50= 23 nmol·L-1; 6, IC50 = 35.8 nmol·L-1, HeLa EC50= 67.6 nmol·L-1; 7, Amg-1, IC50 = 3 μmol·L-1) (图 1)[14-16], 某些天然产物也具有IDO1抑制活性[17]。
IDO1复合物的晶体结构于2006年首次被报道[18], 揭示了IDO1蛋白的整体三维结构。2018年, Nelp等[19]最新报道了一个IDO1抑制剂BMS-978587 (8, 图 1)与IDO1的共结晶结构(PDBID: 6AZV), 揭示了抑制剂分子与底物配体分子之间具有一种新的结合模式。复合物结构显示, 抑制剂分子可以占据结合口袋空间中原本属于亚铁血红素卟啉环的空间, 导致IDO1的重要辅基血红素不能结合, 从而阻止了酶对L-色氨酸底物的氧化作用。该抑制剂与IDO1残基之间形成的两个氢键, 对抑制剂的结合起到重要作用:抑制剂中的脲结构与SER-167残基之间形成稳定氢键, 抑制剂分子中的羧酸与残基HIS-346、SER-264和ALA-263形成稳定的氢键, 是这类分子与蛋白之间结合的基础。实验结果显示, 该化合物对IDO1的抑制活性达到IC50 = 4.2 nmol·L-1 (HeLa细胞) (图 2)。参考BMS-978587结构以及与IDO1蛋白的结合模式, 本研究进行了基于配体结构的药物设计。
|
Figure 1 Structures of IDO1 inhibitors in clinical and preclinical studies |

|
Figure 2 Interaction between IDO1 and BMS-978587 (BMS-978587 colored in yellow, residues involved in interaction colored in gray, hydrogen bond showed with dotted lines) |
基于对抑制剂与IDO1之间的相互作用的认识, 为了探索与残基HIS-346、SER-264和ALA-263形成氢键的抑制剂, 设计A、B和C三个系列化合物; 同时考察调节分子理化性质对抑制剂活性的影响, 设计D系列化合物(图 3)。A系列化合物在邻苯二胺母核4-位上采用芳氨基取代, 所选的3种氨基苯甲酸异构体片段可以探索羧酸基团在口袋中的不同排布位置; B系列化合物含有联苯(吡啶联苯)四唑结构母核, 探索四唑结构作为羧酸结构的生物电子等排体在口袋中的结合方式; C系列是邻苯二胺母核4-位上采用含有氮杂环烷羧酸的取代, 进一步探索羧酸基团在口袋中的空间位置变化; D系列化合物是B系列化合物的电子等排体, 在分子中引入磺酰胺基团, 调节分子的亲水性, 探索理化性质的改变对制剂活性的影响。

|
Figure 3 Design of the target compounds |
各系列化合物的合成如路线1所示。化合物9与N-异丁基-N-(3-正戊基)氨经氨化反应得到N-异丁基-N-(3-正戊基)-2-硝基-4-溴-苯胺(10), 随后与氨基苯甲酸酯生成二苯胺类化合物(14), 再依次经过氨的甲基化、硝基还原和酰胺化反应得到3个A系列化合物(A1~A3)。化合物11经过酰胺化得到化合物12a和12b, 再经过偶联反应和四氮唑化反应得到2个B系列化合物(B1、B2)。化合物12a与相应的氮杂环丙烷甲酸酯、氮杂环丁烷甲酸酯以及氮杂环戊烷甲酸酯通过氨的芳基化反应得到3个C系列化合物(C1~C3)。化合物11经过磺酰化、偶联反应和氰基的水解反应得到3个D系列化合物(D1~D3)。
结果与讨论 1 化合物的结构确证采用上述路线, 合成了11个化合物, 纯度经HPLC测定, 结构全部经1H NMR和ESI-MS确证, 且未见文献报道, 化合物的图谱数据见表 1。
| Table 1 Physico-chemical data of A1-A3, B1-B2, C1-C3 and D1-D3.aPurity was calculated by area normalization method of HPLC |
以进入临床研究中的IDO1抑制剂INCB24360作为阳性对照, 测定了目标化合物对人源IDO1酶抑制活性[20], 结果显示, 化合物A1、A3、C1、C2和C3对酶的抑制活性一般, IC50 > 3 μmol·L-1, 这些化合物在相应的细胞学实验中也显示了较弱的抑制活性; 其余化合物的IC50 < 1 μmol·L-1, 与阳性对照的活性相当, 其中化合物B1、D2和D3在HeLa细胞中对IDO1的抑制活性优于阳性对照(表 2)。
| Table 2 IDO1 inhibition of target compounds (IC50) |
考虑到TDO作为IDO1的同工酶和潜在的肿瘤免疫药物靶点[5], 本研究也考察了部分化合物对TDO酶的初步抑制活性。采用U-87-MG细胞, 测定了1 μmol·L-1浓度下化合物对细胞中的TDO酶抑制活性[19], 结果发现化合物D2有一定的抑制活性, 抑制率达到65% (阳性对照680C91为92%, 表 3)。
| Table 3 TDO inhibition rate of selected target compounds in U-87-MG cells (%) |
根据上述结果, 总结了初步构效关系: ①邻苯二胺母核上4-位的取代基对活性有较大影响, A系列活性强弱: A1 > A2 > A3, 可能是由于氨基苯甲酸片段中羧酸基团在空间不同的朝向影响到与HIS-346侧链形成氢键的能力; ② B系列化合物活性较优, 可能与结构中联苯/吡啶联苯四唑结构有关, 该结构使得分子整体刚性有所增加, 从而可能影响到四唑结构与口袋的结合; ③ C系列化合物中, 羧酸活性优于酰胺, 但整体活性相对较差, 可能由于氮杂环系体积较小, 羧酸与邻苯二胺母核之间的距离较近, 从而影响了与HIS-346等残基的相互作用; ④ D系列化合物作为B系列化合物的电子等排体, 保留了B系列的活性, 同时磺酰胺基团增加分子的亲水性也可能对活性增强是有利的。
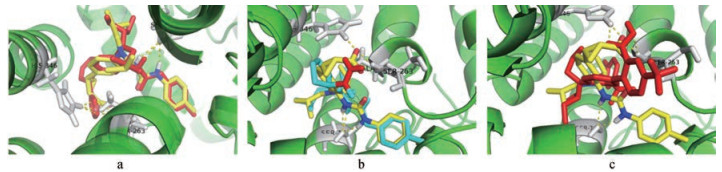
3 分子对接结果分析采用分子对接的方法比较了IDO1酶(PDB ID: 6AZV)分别与化合物B1、C1和D3之间的作用模式(图 4)。结果显示, B1与BMS-978587的作用模式非常相似, 分子中酰胺键与SER-167残基之间形成稳定氢键, 四唑结构与残基HIS-346和ALA-263形成氢键, 与文献报道的关键相互作用一致[19], 体现出较好的活性(图 4a)。C1虽然与BMS-978587有相似的空间构象, 但是四氢吡咯环上的酰胺基团由于空间距离较远, 并没有与HIS-346和ALA-263残基相互作用, 因而抑酶活性较弱(图 4b)。化合物D3虽然与BMS-978587分子整体结构的差异较大, 但分子中的羧酸基团与HIS-346残基之间形成氢键, ALA-263与磺酰胺基团也形成氢键, 进一步稳定了与酶之间的结合, 因此也显现出较好的抑酶活性(图 4c)。分子对接结果提示, 设计分子中含有能与残基HIS-346、SER-264和ALA-263形成相互作用的基团, 是产生抑酶作用的一个关键因素。
|
Figure 4 Comparation of binding to IDO1 between BMS-978587 and B1 (a), C1 (b) and D3 (c), respectively. BMS-978587 colored in yellow, residues involved in interaction colored in gray, B1 and D3 in red, C1 in cyan, and hydrogen bond showed with dotted lines |
根据抑制剂BMS-978587与IDO1的作用模式, 设计合成了11个结构新颖的化合物, 并分别测定了它们对IDO1酶和对HeLa细胞中IDO1的抑制活性。其中4个化合物显示出一定的酶抑制活性; 初步总结了此类化合物的构效关系, 并采用分子对接的方法分析了所设计化合物产生抑酶活性的可能原因, 期望为该类IDO1抑制剂的进一步结构优化, 以及发现IDO1和TDO双重抑制剂提供有益参考。
实验部分核磁共振图谱采用布鲁克AVANCE Ⅲ 400M型核磁共振波谱仪记录, 氘代氯仿或TMS为内标; 质谱采用赛默飞世尔LCQ型质谱仪; HPLC采用Agilent 1100高效液相色谱仪, DAD检测器。实验所用试剂均为市售分析纯。中间体及目标化合物制备反应收率未做进一步优化。
1 化学合成 1.1 N-异丁基-N-(3-正戊基)-2-硝基-4-溴-苯胺的制备(10)将3-硝基-4-氟-溴苯(9) (49 g, 223 mmol)加入到N-异丁基-N-(3-正戊基)氨(32 g, 223 mmol)的三乙胺(33.7 g, 334 mmol)溶液中。将以上反应液加热到140 ℃反应30 h。反应在结束后加入500 mL石油醚(PE)和100 mL甲基叔丁基醚搅拌0.5 h, 静置后分取有机层, 依次用水、饱和食盐水洗涤, 无水硫酸钠干燥, 然后浓缩; 浓缩物用硅胶柱色谱分离(PE, 300~400目硅胶), 得到化合物10 (53 g, 69%)。1H NMR (400 MHz, CDCl3) δ 7.75 (d, J = 2.8 Hz, 1H), 7.42 (q, J = 2.4 Hz, 1H), 6.96 (d, J = 9.6 Hz, 1H), 2.84 (d, J = 7.2 Hz, 2H), 2.79~2.72 (m, 1H), 1.74~1.61 (m, 1H), 1.59~1.54 (m, 2H), 1.51~1.46 (m, 3H), 0.88~0.79 (m, 12H); ESI-MS(m/z): 344.4 [M+H]+。

|
Scheme 1 Synthetic route of target compounds |
室温下将锌粉(15.2 g, 234 mmol)分批加入到化合物10 (8 g, 23.4 mmol)、NH4Cl (12.5 g, 234 mmol)、160 mL乙醇和20 mL水中, 混合物搅拌反应14 h, 加入二氯甲烷继续搅拌30 min; 以硅藻土过滤, 分取有机层, 减压浓缩, 加入乙酸乙酯(EA), 溶液分别用水、饱和食盐水洗涤, 以无水硫酸钠干燥, 硅胶柱色谱分离(VPE:VEA=100:1)得到灰色油状物11 (5.0 g, 68%)。1H NMR (400 MHz, CDCl3) δ 6.85 (q, J = 6.0 Hz, 2H), 6.78 (t, J = 6.0 Hz, 1H), 4.12 (q, J = 7.6 Hz, 2H), 2.60~2.53 (m, 1H), 1.58~1.51 (m, 5H), 0.96~0.81 (m, 12H); ESI-MS (m/z): 313.3 [M+H]+。
1.3 N-[2-(N-异丁基-N-3-正戊基)氨基-5-溴-苯基]-4-甲基苯乙酰胺的制备(12a)取化合物11 (2.00 g, 6.38 mmol)和4-氟苯乙酸(1.48 g, 9.57 mmol)溶于50 mL DMF中, 室温下加入三乙胺(1.29 g, 12.7 mmol)和苯并三氮唑-1-基氧基三(二甲基氨基)磷鎓六氟磷酸盐(BOP) (4.22 g, 9.57 mmol), 室温搅拌12 h, 待TLC检测化合物11消耗完毕后终止反应, 于50 ℃减压除去溶剂, 柱色谱分离(VPE:VEA=10:1)得到白色固体12a (2.35 g, 82%)。1H NMR (400 MHz, CDCl3) δ 7.56 (d, J = 7.6 Hz, 1H), 7.43 (s, 1H), 7.22 (d, J = 8.0 Hz, 1H), 7.21~7.12 (m, 4H), 3.84 (s, 2H), 3.27 (d, 2H), 2.46 (m, 1H), 2.20 (s, 3H), 1.65 (s, 1H), 1.52 (m, 4H), 0.85 (t, J = 7.6 Hz, 6H), 0.78 (d, J = 6.8 Hz, 6H); ESI-MS (m/z): 445.3 [M+H]+。
以4-甲基苯乙酸与化合物11缩合, 得到化合物12b, 收率87%。1H NMR (400 MHz, CDCl3) δ 7.56 (d, J = 7.8 Hz, 1H), 7.40 (s, 1H), 7.25 (d, J = 8.0 Hz, 1H), 7.23~7.08 (m, 4H), 3.85 (s, 2H), 3.27 (d, 2H), 2.43 (m, 1H), 1.68 (s, 1H), 1.50 (m, 4H), 0.87 (t, J = 7.6 Hz, 6H), 0.75 (d, J = 6.8 Hz, 6H); ESI-MS (m/z): 449.2 [M+H]+。
1.4 4'-(N-异丁基-N-3-正戊基)氨基-3'-(4-甲基苯乙酰胺基)-2-氰基-5-甲基-联苯的制备(13a)将化合物12a (0.72 g, 1.61 mmol)室温下溶于20 mL叔丁醇中, 加入4, 4, 5, 5-四甲基-2-(2-氰基-5-甲基苯基)-1, 3, 2-二氧杂硼烷(2.42 mmol, 0.59 g), 室温下加入Pd2(dba)3 (150 mg, 0.16 mmol)、X-Phos (308 mg, 0.64 mmol)和碳酸铯(1.32 g, 4.03 mmol), 减压除去空气, 通氮气5 min, 氮气保护下加热到120 ℃保持2 h, TLC检测(VPE:VEA=1:1)反应完全, 降温到室温, 减压除去溶剂, 硅胶柱色谱分离得到化合物13a粗品, 直接用于下一步反应。
以类似的方法制备得到化合物13b粗品。
1.5 2-[4-(N-异丁基-N-3-正戊基)氨基-3-硝基]苯胺基苯甲酸甲酯的制备(14a)取4, 5-双(二苯基膦基)-9, 9-二甲基氧杂蒽(17 mg, 0.029 mmol)、碳酸铯(141 mg, 0.43 mmol)、Pd(AcO)2 (3.3 mg, 0.015 mmol)、化合物10 (100 mg, 0.29 mmol)和相应的氨基苯甲酸酯(44 mg, 0.29 mmol), 将混合物在110 ℃搅拌4 h, 减压除去溶剂, 柱色谱得到棕色固体14a (60 mg, 50%)。1H NMR (400 MHz, CDCl3) δ 7.88 (d, 1H, J = 7.6 Hz), 7.59 (t, 1H, J = 7.6 Hz), 7.34 (s, 1H), 7.14 (t, 2H, J = 8.8 Hz), 7.03 (t, 1H, J = 8.8 Hz), 6.66 (dd, 1H, J = 2.0, 6.4 Hz), 6.54 (s, 1H), 3.93 (s, 3H), 2.89 (s, 2H), 2.26 (t, 1H, J = 6.4 Hz), 1.46~1.39 (m, 4H), 1.23 (t, 1H, J = 6.4 Hz), 0.85 (s, 6H), 0.71 (d, 6H, J = 6.4 Hz); ESI-MS (m/z): 414.2 [M+H]+。
14b和14c的合成方法与14a相似, 收率分别为59%和42%。14b:1H NMR (400 MHz, CDCl3) δ 8.01 (d, 1H, J = 1.6 Hz), 7.39~7.30 (m, 3H), 7.20 (d, 1H, J = 8.8 Hz), 7.17 (m, 1H), 6.72 (dd, 1H, J = 2.0, 6.4 Hz), 3.95 (s, 3H), 2.69 (s, 2H), 2.43 (t, 1H, J = 6.5 Hz), 1.49~1.43 (m, 4H), 1.31 (t, 1H, J = 6.4 Hz), 0.86 (t, 6H, J = 6.9 Hz), 0.71 (d, 6H, J = 6.5 Hz); ESI-MS(m/z): 414.2 [M+H]+。14c:1H NMR (400 MHz, CDCl3) δ 7.71 (d, 2H, J = 8.8 Hz), 6.73 (d, 2H, J = 8.8 Hz), 6.69 (s, 1H), 6.51 (dd, 1H, J = 2.0, 6.4 Hz), 6.24 (s, 1H), 3.95 (s, 3H), 3.78 (d, 2H, J = 4.8 Hz), 1.75 (t, 1H, J = 5.6 Hz), 1.50~1.44 (m, 4H), 1.36 (t, 1H, J = 6.8 Hz), 0.87 (t, 6H, J = 7.2 Hz), 0.74 (d, 6H, J = 6.4 Hz); ESI-MS (m/z): 414.2 [M+H]+。
1.6 N-{[4-(N-异丁基-N-3-正戊基)氨基-3-氨基]苯基}-N-甲基-胺基苯甲酸甲酯的制备(15a)将化合物14a (350 mg, 0.84 mmol)溶于20 mL DMF中, 0 ℃加入NaH (70 mg, 1.68 mmol, 60%), 然后缓慢加入碘甲烷(350 mg, 2.52 mmol), 室温搅拌1 h, 将反应混合物倒入20 mL水中, 乙酸乙酯萃取两次(2×20 mL), 合并有机层, 干燥浓缩粗品, 将所得粗品溶于甲醇中, 加入Pd/C (30 mg), 氢气存在下室温搅拌6 h, 过滤, 浓缩滤液, 得到黄色固体15a (250 mg, 69%)。1H NMR (400 MHz, CDCl3) δ 7.78 (d, 1H, J = 7.6 Hz), 7.56 (t, 1H, J = 7.6 Hz), 7.15 (t, 2H, J = 8.8 Hz), 7.03 (t, 1H, J = 8.8 Hz), 6.54 (s, 1H), 6.46 (dd, 1H, J = 2.0, 6.4 Hz), 6.34 (s, 1H), 3.92 (s, 3H), 3.12 (s, 3H), 2.64 (s, 2H), 2.27 (t, 1H, J = 6.4 Hz), 1.46~1.36 (m, 4H), 1.24 (t, 1H, J = 6.4 Hz), 0.85 (s, 6H), 0.71 (d, 6H, J = 6.4 Hz); ESI-MS (m/z): 398.2 [M+H]+。
15b和15c的合成方法与15a相似, 收率分别为93%和86%。15b:1H NMR (400 MHz, CDCl3) δ 8.01 (d, 1H, J = 1.6 Hz), 7.35~7.26 (m, 3H), 7.20 (d, 1H, J = 8.8 Hz), 7.07 (m, 1H), 6.55 (dd, 1H, J = 2.0, 6.4 Hz), 3.95 (s, 3H), 3.21 (s, 3H), 2.66 (s, 2H), 2.43 (t, 1H, J = 6.4 Hz), 1.49~1.40 (m, 4H), 1.29 (t, 1H, J = 6.4 Hz), 0.85 (t, 6H, J = 6.8 Hz), 0.71 (d, 6H, J = 6.4 Hz); ESI-MS (m/z): 398.2 [M+H]+。15c:1H NMR (400 MHz, CDCl3) δ 7.71 (d, 2H, J = 8.8 Hz), 6.73 (d, 2H, J = 8.8 Hz), 6.54 (s, 1H), 6.46 (dd, 1H, J = 2.0, 6.4 Hz), 6.34 (s, 1H), 3.93 (s, 3H), 3.68 (d, 2H, J = 4.8 Hz), 3.22 (s, 3H), 1.71 (t, 1H, J = 5.6 Hz), 1.50~1.42 (m, 4H), 1.32 (t, 1H, J = 6.8 Hz), 0.86 (t, 6H, J = 7.2 Hz), 0.73 (d, 6H, J = 6.4 Hz); ESI-MS (m/z): 398.2 [M+H]+。
1.7 N-{[4-(N-异丁基-N-3-正戊基)氨基-3-(4-氟苯乙酰胺基)]苯基}-N-甲基-胺基苯甲酸甲酯的制备(16a)将化合物16a (300 mg, 0.756 mmol)和4-氟苯乙酸(174 mg, 1.13 mmol)溶解于20 mL二氯甲烷中, 加入三乙胺(152 mg, 1.512 mmol)和HATU (430 mg, 1.13 mmol), 室温搅拌过夜, 减压除去溶剂后柱色谱分离, 得到黄色固体16a (310 mg, 77%)。ESI-MS (m/z): 534.3 [M+H]+。
16b和16c的合成方法与16a相似, 收率分别为72%和75%。16b: ESI-MS (m/z): 534.3 [M+H]+。16c: ESI-MS (m/z): 534.3 [M+H]+。
1.8 N-[2-(N-异丁基-N-3-正戊基)氨基-5-溴苯基]-4-氟苯磺酰胺的制备(17)将N-甲基吗啉(3.0 g, 30 mmol)、化合物11 (2.3 g, 7.3 mmol)、4-氟苯磺酰氯(1.4 g, 7 mmol)加入到40 mL二氯甲烷中, 在氩气保护下室温搅拌20 h, 加入石油醚和水, 搅拌30 min, 以饱和食盐水洗涤有机层, 减压浓缩, 浓缩物以硅胶柱色谱分离(300~400目, VPE:VEA=50:1), 得到浅灰色固体17 (2.0 g, 59%)。1H NMR (400 MHz, CDCl3) δ 10.44 (b, 1H), 7.55~7.51 (m, 1H), 7.49~7.42 (m, 1H), 7.39 (d, 2H, J = 8.8 Hz), 7.17~7.10 (m, 2H), 7.09~7.02 (m, 1H), 2.78 (d, 2H, J = 6.4 Hz), 2.68 (b, 2H), 2.13 (t, 1H, J = 6.4 Hz), 1.50~1.46 (m, 2H), 1.39~1.34 (m, 3H), 0.72~0.68 (m, 12H); ESI-MS (m/z): 471.1 [M+H]+。
1.9 N-{[4-(N-异丁基-N-3-正戊基)氨基-2'-氰基]-[1, 1'-联苯]-2-基}-4-氟苯磺酰胺的制备(18a)将化合物17 (0.15 g, 1 mmol)、2-氰基苯硼酸频那醇酯(0.14 g, 2 mmol)、Cs2CO3 (0.40 g, 4 mmol)和Pd[P(Ph3)4] (0.10 g, 0.1 mmol)溶于4 mL二氧六环和2 mL水中, 氩气保护下将混合物在130 ℃反应30 min, 将混合物真空中减压浓缩, 浓缩物以硅胶柱色谱分离得到白色固体18a (0.14 g, 86%)。1H NMR (400 MHz, DMSO-d6) δ 12.89 (b, 1H), 7.80 (t, 1H, J = 6.4 Hz), 7.75 (s, 1H), 7.63 (d, 1H, J = 8.8 Hz), 7.56 (t, 1H, J = 6.4 Hz), 7.48 (d, 2H, J = 8.8 Hz), 7.27~7.21 (m, 3H), 7.19 (t, 2H, J = 2.4 Hz), 2.72 (d, 2H, J = 6.4 Hz), 2.24 (t, 1H, J = 6.4 Hz), 1.52~1.48 (m, 2H), 1.38~1.34 (m, 3H), 0.75~0.80 (m, 12H); ESI-MS (m/z): 494.0 [M+H]+。
18b和18c的制备方法与18a类似, 收率均为86%。18b:1H NMR (400 MHz, DMSO-d6) δ 12.90 (b, 1H), 9.85 (s, 1H), 7.70 (d, 2H, J = 6.8 Hz), 7.45~7.40 (m, 2H), 7.40 (d, 2H, J = 6.9 Hz), 7.19 (t, 3H, J = 6.4 Hz), 2.72 (d, 2H, J = 6.4 Hz), 2.07 (t, 1H, J = 6.4 Hz), 1.43~1.40 (m, 2H), 1.33~1.30 (m, 3H), 0.74~0.79 (m, 12H); ESI-MS (m/z): 512.2 [M+H]+。18c:1H NMR (400 MHz, DMSO-d6) δ 12.5 (b, 1H), 9.65~9.62 (m, 1H), 7.88 (d, 1H, J = 6.4 Hz), 7.77 (s, 1H), 7.48~7.45 (m, 2H), 7.41~7.36 (m, 2H), 7.33~7.30 (m, 1H), 7.17 (t, 2H, J = 8.9 Hz), 2.75 (d, 2H, J = 6.9 Hz), 2.50 (t, 1H, J = 7.0 Hz), 1.56~1.52 (m, 2H), 1.37~1.32 (m, 4H), 0.78~0.73 (m, 12H); ESI-MS (m/z): 562.0 [M+H]+。
1.10 1-[4-(N-异丁基-N-3-正戊基)氨基-3-(4-氟苯乙酰胺基)-苯基]-2-吡咯烷甲酸甲酯的制备(19)将12a (1.5 g, 3.34 mmol)、吡咯烷-2-羧酸甲酯(0.65 g, 5.02 mmol)、Cs2CO3 (2.17 g, 6.68 mmol)、S-phos (137 mg, 0.33 mmol)和Pd2(dba)3 (153 mg 0.17 mmol)混合于20 mL 1, 4-二氧六环中, 吹氮气3 min, 在氮气保护下于100 ℃搅拌8 h, 以乙酸乙酯稀释(150 mL), 水洗涤(30 mL×2), 无水硫酸钠干燥, 减压除去溶剂, 硅胶柱色谱分离(VPE:VEA=1:1)得到黄色固体19 (0.8 g, 48%)。1H NMR (400 MHz, CDCl3) δ 8.99 (s, 1H), 7.69 (d, J = 2.4 Hz, 1H), 7.29~7.26 (m, 3H), 7.04~6.99 (m, 3H), 6.12 (dd, J = 2.8, 8.8 Hz, 1H), 4.15~4.05 (m, 4H), 3.73 (s, 3H), 3.66 (d, J = 2.4 Hz, 2H), 3.54~3.50 (m, 1H), 2.85~2.82 (m, 1H), 2.44~2.29 (m, 2H), 1.49~1.31 (m, 5H), 1.06~0.72 (m, 12H); ESI-MS (m/z): 498.3 [M+H]+。
1.11 1-[4-(N-异丁基-N-3-正戊基)氨基-3-(4-氟苯乙酰胺基)-苯基]-2-吡咯烷甲酸的制备(20)将LiOH (77 mg, 3.22 mmol)加入到化合物19 (0.81 g, 1.61 mmol)的THF/MeOH/H2O (20 mL)混合溶剂组成的溶液中, 室温搅拌3 h。减压去除有机溶剂, 以1 mol·L-1 HCl调节水相至pH=~6.0, 用乙酸乙酯(50 mL×2)萃取, 无水硫酸镁干燥, 采用制备HPLC (CH3CN/H2O, 0.05% HF)分离得到白色固体20 (120 mg, 15%)。1H NMR (400 MHz, CDCl3) δ 8.77 (s, 1H), 7.48 (s, 1H), 7.32~7.09 (m, 5H), 6.13 (d, J = 7.6 Hz, 1H), 3.97~3.94 (m, 2H), 3.81~3.79 (m, 2H), 3.70 (s, 2H), 3.49~3.36 (m, 2H), 2.62~2.60 (m, 1H), 2.27~2.26 (m, 1H), 1.41~1.23 (m, 5H), 0.86~0.69 (m, 12H); ESI-MS (m/z): 484.3 [M+H]+。
化合物21和22的制备分别与化合物19和20的制备方法类似, 相对分子质量经质谱确认, 分别为ESI-MS (m/z): 470.3 [M+H]+和ESI-MS (m/z): 456.3 [M+H]+。
1.12 1-[4-(N-异丁基-N-3-正戊基)氨基-3-(4-氟苯乙酰胺基)-苯基]-氮杂环丁烷-3-甲酸乙酯的制备(23)化合物23的制备方法与化合物19类似, 收率48%。1H NMR (400 MHz, CDCl3) δ 8.99 (s, 1H), 7.69 (d, J = 2.4 Hz, 1H), 7.29~7.26 (m, 3H), 7.04~6.99 (m, 3H), 6.12 (dd, J = 2.8, 8.8 Hz, 1H), 4.15~4.05 (m, 4H), 3.73 (s, 3H), 3.66 (d, J = 2.4 Hz, 2H), 3.54~3.50 (m, 1H), 2.85~2.82 (m, 1H), 2.44~2.29 (m, 2H), 1.49~1.31 (m, 5H), 1.06~0.72 (m, 12H); ESI-MS (m/z): 498.3 [M+H]+。
1.13 N-{[4-(N-异丁基-N-3-正戊基)氨基-3-(4-氟苯乙酰胺基)]苯基}-N-甲基-胺基苯甲酸的制备(A1)将16a (200 mg, 0.38 mmol)溶于甲醇-水(3:1, 20 mL)中, 加入氢氧化钠(45 mg, 1.12 mmol), 回流过夜反应, 减压除去溶剂, 加入10 mL水, 以5%盐酸调节pH=2~3, 过滤, 滤饼以15 mL石油醚洗涤, 干燥得白色固体A1 (120 mg, 61%)。
A2和A3的合成方法与A1相似, 收率分别为72%和56%。
1.14 5-{[4'-(N-异丁基-N-3-正戊基)氨基]-[3'-(4-甲基苯乙酰胺基)]-5-甲基-[1, 1'-联苯]-2-基}四氮唑的制备(B1)将化合物13a (0.89g, 1.85 mmol)室温下加入单口瓶中, 加入20 mL甲苯, 室温下加入NaN3 (12.9 mmol, 0.85 g)和n-Bu3SnCl (5.18 g, 12.9 mmol), 加热到120 ℃搅拌保持40 h, TLC检测(V二氯甲烷:V甲醇=10:1) 13a反应完全, 降温到室温, 减压除去溶剂, 用KF溶液(100 mL, 10%)洗涤, 然后倒入100 mL水中, 用二氯甲烷萃取(100 mL×3), 合并二氯甲烷, 干燥, 硅胶柱色谱分离得到白色固体B1 (0.43 g, 42%)。
以化合物13b采用类似方法制备得到化合物B2, 收率35%。
1.15 1-[4-(N-异丁基-N-3-正戊基)氨基-3-(4-氟苯乙酰胺基)-苯基]-2-吡咯烷甲酰胺的制备(C1)将NH4Cl (74 mg, 1.40 mmol)、HATU (532 mg, 1.96 mmol)和Et3N (212 mg, 2.10 mmol)加入到20 mL化合物20 (367 mg, 0.70 mmol)的DMF溶液, 混合物室温搅拌3 h, 加入100 mL水然后以乙酸乙酯萃取(200 mL×3), 合并有机层并干燥, 以pre-HPLC分离(CH3CN/H2O, 0.05% NH4HCO3)得到白色固体C1 (105 mg, 31%)。
化合物C2的制备方法与C1类似, 收率43%。
1.16 1-[4-(N-异丁基-N-3-正戊基)氨基-3-(4-氟苯乙酰胺基)-苯基]-氮杂环丁烷-3-甲酸的制备(C3)化合物C3的制备方法与化合物20类似, 收率35%。
1.17 3'-(4-氟苯磺酰胺基)-4'-[(N-异丁基-N-3-正戊基)-氨基]-[1, 1'-联苯]-2-甲酸的制备(D1)将0.12 g化合物1加入到2 mL水、2 mL硫酸和2 mL乙酸中, 氩气保护下将反应物于120 ℃搅拌14 h。冷却后, 加入乙酸乙酯和水。加入固体碳酸钠, 用5%稀盐酸将pH调节到5~6。将有机层减压浓缩, 浓缩物通过硅胶柱色谱得到白色固体D1 (43 mg, 34%)。
D2和D3的制备方法与D1类似, 收率分别为42%和33%。
2 分子模拟实验分子对接采用UCSF的DOCK 6.9程序, 采用的蛋白质晶体结构的PDB编号为6AZV。采用Chimera处理蛋白和配体文件, 保存DMS文件, 加氢, 加电荷, 采用Flexible Ligand Docking模式进行对接, 其他参数采用默认值。程序运行在CentOS 7系统上, 采用Pymol 1.5.0.3软件作图。
3 抑制活性实验IDO1酶学实验参考文献方法[19], 在标准反应混合液[50 mmol·L-1磷酸钾缓冲溶液(pH=6.5), 20 mmol·L-1抗坏血酸钠, 10 µmol·L-1亚甲基蓝, 200 µg·mL-1过氧化氢酶, 50 nmol·L-1 IDO1酶, 100 µmol·L-1 L-色氨酸]中加入不同量待测化合物(阳性对照、加DMSO的空白对照), 在37 ℃下反应60 min, 加入适量三氯乙酸终止反应, 在65 ℃下孵育15 min, 离心取上清液转移到96孔板中, 与125 μL 2%的对二甲氨基苯甲醛醋酸溶液混合, 室温孵育10 min。依据480 nm波长处吸光度值(OD)计算抑制率, 从而计算IC50。
IDO1细胞学实验参考文献[21], 将待测化合物及对照化合物用DMSO配成贮备液, 用DMEM稀释至不同浓度; 取对数生长期的HeLa细胞以每孔2×105个细胞接种于96孔板, 加入100 μL IFN-γ, 使用手动移液管将特定浓度的化合物添加孔中, 将细胞置于37 ℃培养20 h。适量三氯乙酸终止反应。在50 ℃下孵育30 min。离心取上清夜, 加入2% (w/v) Ehrlich试剂于透明96孔底板中, 然后在室温下孵育10 min。依据490 nm处OD值计算抑制率, 从而计算化合物IC50值。
TDO细胞学实验参考文献[22], 对合成的化合物及对照化合物用DMSO配成100 μmol·L-1浓度的储备液, 用DMEM继续稀释至1 μmol·L-1; 取对数生长期的U-87-MG细胞以每孔2×104个细胞接种于96孔板, 培养12 h后, 加入上述待测化合物溶液和L-色氨酸, 继续培养8 h后将DMEM培养基上清液转移至新的试管中, 并加入三氯乙酸终止反应。65 ℃水浴中孵育15 min后, 离心取上清液转移至96孔板中, 与等体积4-二甲氨基苯甲醛混合。依据492 nm OD值计算抑制率。
| [1] | Murray MF. The human indoleamine 2, 3-dioxygenase gene and related human genes[J]. Curr Drug Metab, 2007, 8: 197–200. DOI:10.2174/138920007780362509 |
| [2] | Lewis-Ballester A, Karkashon S, Batabyal D, et al. Inhibition mechanisms of human indoleamine 2, 3 dioxygenase 1[J]. J Am Chem Soc, 2018, 140: 8518–8525. DOI:10.1021/jacs.8b03691 |
| [3] | Rohrig UF, Somi Reddy M, Pierre V, et al. Challenges in the discovery of indoleamine 2, 3-dioxygenase 1(IDO1) inhibitors[J]. J Med Chem, 2015, 58: 9421–9437. DOI:10.1021/acs.jmedchem.5b00326 |
| [4] | Fatokun AA, Hunt NH, Ball HJ. Indoleamine 2, 3-dioxygenase 2(IDO2) and the kynurenine pathway: characteristics and potential roles in health and disease[J]. Amino Acids, 2013, 45: 1319–1329. DOI:10.1007/s00726-013-1602-1 |
| [5] | Michael P, Nikolaus VKD, Iris O, et al. Cancer immunotherapy by targeting IDO1/TDO and their downstream effectors[J]. Front Immunol, 2014, 5: 673. |
| [6] | Munn DH, Shafizadeh E, Attwood JT, et al. Inhibition of T cell proliferation by macrophage tryptophan catabolism[J]. J Exp Med, 1999, 189: 1363–1372. DOI:10.1084/jem.189.9.1363 |
| [7] | Klockow JL, Glass TE. Development of a fluorescent chemosensor for the detection of kynurenine[J]. Org Lett, 2013, 15: 235–237. DOI:10.1021/ol303025m |
| [8] | Jochems C, Fantini M, Fernando RI, et al. The IDO1 selective inhibitor epacadostat enhances dendritic cell immunogenicity and lytic ability of tumor antigen-specific T cells[J]. Oncotarget, 2016, 7: 37762–37772. |
| [9] | Zhang XY, Cui GN, Xu BL. The research progress of indoleamine 2, 3-dioxygenase 1(IDO1) inhibitors[J]. Acta Pharm Sin (药学学报), 2018, 53: 1784–1796. |
| [10] | Hong R, Zhou Y, Tian X, et al. Selective inhibition of IDO1, D-1-methyl-tryptophan (D-1MT), effectively increased EpCAM/CD3-bispecific BiTE antibody MT110 efficacy against IDO1hi breast cancer via enhancing immune cells activity[J]. Int Immunopharmacol, 2017, 54: 118–124. |
| [11] | Spahn J, Peng J, Lorenzana E, et al. Improved anti-tumor immunity and efficacy upon combination of the IDO1 inhibitor GDC-0919 with anti-PD-l1 blockade versus anti-PD-l1 alone in preclinical tumor models[J]. J Immunother Cancer, 2015, 3(S2): 1. DOI:10.1186/2051-1426-3-S2-O1 |
| [12] | Beatty GL, O'Dwyer PJ, Clark J, et al. First-in-human phase I study of the oral inhibitor of indoleamine 2, 3-dioxygenase-1 Epacadostat (INCB024360) in patients with advanced solid malignancies[J]. Clin Cancer Res, 2017, 23: 3269–3276. DOI:10.1158/1078-0432.CCR-16-2272 |
| [13] | Siu LL, Gelmon K, Chu Q, et al. Abstract CT116: BMS-986205, an optimized indoleamine 2, 3-dioxygenase 1(IDO1) inhibitor, is well tolerated with potent pharmacodynamic (PD) activity, alone and in combination with nivolumab (nivo) in advanced cancers in a phase 1/2a trial[J]. Cancer Res, 2017, 77(13 Suppl): CT116. |
| [14] | Meininger D, Zalameda L, Liu Y, et al. Purification and kinetic characterization of human indoleamine 2, 3-dioxygenases 1 and 2(IDO1 and IDO2) and discovery of selective IDO1 inhibitors[J]. BBA Proteins Proteom, 2011, 1814: 1947–1954. DOI:10.1016/j.bbapap.2011.07.023 |
| [15] | Cheng MF, Hung MS, Song JS, et al. Discovery and structure-activity relationships of phenyl benzenesulfonylhydrazides as novel indoleamine 2, 3-dioxygenase inhibitors[J]. Bioorg Med Chem Lett, 2014, 24: 3403–3406. DOI:10.1016/j.bmcl.2014.05.084 |
| [16] | Catarina C, David S, Martyn I, et al. Benzofuranquinones as inhibitors of indoleamine 2, 3-dioxygenase (IDO). Synthesis and biological evaluation[J]. Org Biomol Chem, 2014, 12: 2663–2674. DOI:10.1039/c3ob42258e |
| [17] | Pang WQ, Gao L, Dou YY, et al. Screening of natural small molecule IDO-1 inhibitors with anti-tumor role[J]. Acta Pharm Sin (药学学报), 2017, 52: 1416–1423. |
| [18] | Zhang Y, Kang S, Mukherjee T, et al. Crystal structure and mechanism of tryptophan 2, 3-dioxygenase, a heme enzyme involved in tryptophan catabolism and in quinolinate biosynthesis?[J]. Biochemistry, 2007, 46: 145–155. DOI:10.1021/bi0620095 |
| [19] | Nelp MT, Kates PA, Hunt JT, et al. Immune-modulating enzyme indoleamine 2, 3-dioxygenase is effectively inhibited by targeting its apo-form[J]. Proc Natl Acad Sci U S A, 2018, 115: 3249–3254. DOI:10.1073/pnas.1719190115 |
| [20] | Liu X, Shin N, Koblish HK, et al. Selective inhibition of IDO1 effectively regulates mediators of antitumor immunity[J]. Blood, 2010, 115: 3520–3530. DOI:10.1182/blood-2009-09-246124 |
| [21] | Qiang L, Liang Y, Pan X, et al. Discovery of a polysaccharide from the fruiting bodies of Lepista sordida as potent inhibitors of indoleamine 2, 3-dioxygenase (IDO) in HepG2 cells via blocking of STAT1-mediated JAK-PKC-δ signaling pathways[J]. Carbohydr Polym, 2018, 197: 540–547. DOI:10.1016/j.carbpol.2018.05.052 |
| [22] | Zhang S, Qi F, Fang X, et al. Tryptophan 2, 3-dioxygenase inhibitory activities of tryptanthrin derivatives[J]. Eur J Med Chem, 2018, 160: 133–145. DOI:10.1016/j.ejmech.2018.10.017 |
 2019, Vol. 54
2019, Vol. 54


