2. 北京科兴生物制品有限公司, 北京 100085
2. Sinovac Biotech CO., Ltd., Beijing 100085, China
在糖尿病(T2DM)人群中非酒精性脂肪肝(NAFLD)的发病率约为70%[1]。目前治疗T2DM-NAFLD的药物如胰岛素增敏剂和噻唑烷二酮类对减轻肝脏脂肪变性、坏死性炎症或肝纤维化的效果并不显著[2]; 降脂药(如他汀类)和抗氧化剂(如维生素E)对其有一定疗效, 但长期用药对肝脏的保护作用仍不明确[3]。此外, 目前NAFLD仍没有FDA批准的治疗药物[4, 5]。在化学药治疗效果有限的情况下研究者是否可以另辟蹊径从植物药中寻找治疗T2DM-NAFLD的药物[6-8]?
毛菊苣是菊科菊苣属植物毛菊苣干燥的地上茎部分, 富含黄酮、生物碱和萜类成分[9], 具清肝利胆、健胃消食, 利尿消肿的功效[10]。毛菊苣的相关文献报道主要集中在脂肪肝和糖尿病的治疗上[11, 12]。在治疗肝病方面, 体内外脂质过载条件下, 毛菊苣可有效减少脂质积累保护肝细胞免受损伤和炎症[13], 并通过下调TNF-α、TGF-β、IL-6和NF-κB等因子减轻肝脏炎症[14]; 糖尿病方面, 毛菊苣具有体内外抗氧化及抑制α-葡萄糖苷酶和淀粉酶的作用[15], 并通过多种通路降低血浆胰岛素及肝脏游离脂肪酸水平(FFA)[16]。本课题组前期研究结果表明, 毛菊苣乙酸乙酯部位可通过NF-κB信号通路发挥降糖作用[17]。T2DM和NAFLD同为代谢性疾病, T2DM和NAFLD之间关联有多少?毛菊苣可能的靶点和T2DM-NAFLD之间有何关系?毛菊苣有没有可能在治疗糖尿病的同时保护肝脏?这些是本工作探讨的问题。
系统药理学整合了网络药理学和系统生物学, 可揭示化合物-靶点-疾病-通路之间的内在复杂关系, 为揭示疾病的发病机制提供了系统的方法[18-21]。Liu等[22]通过系统药理学剖析中药复方藏红花配方以揭示心血管疾病的多尺度治疗策略。Wang等[23]通过系统药理学对枳术丸抗功能性消化不良进行机制探索, 并进一步对枳实白术的协同作用原因进行阐释。系统药理学不光强调中药活性物质组的早期筛选, 同时也强调药物不同组合对机体系统的综合效应[24], 适合探究中药对复杂的疾病及其并发症作用的活性成分和作用机制。
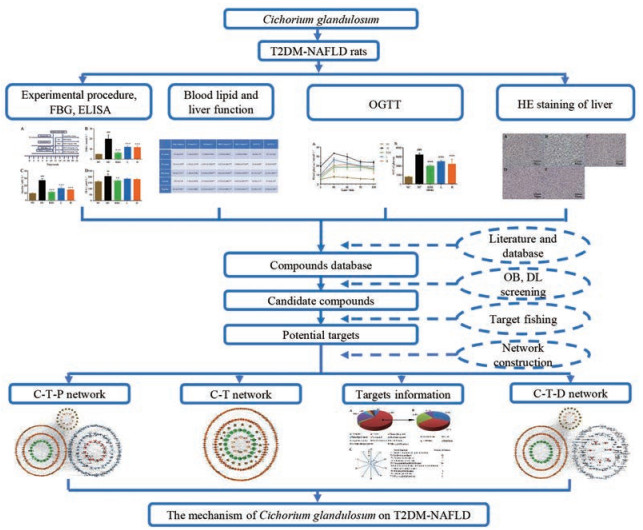
本工作首先通过动物实验对毛菊苣治疗T2DM-NAFLD的药效进行探究, 并尝试利用系统药理学分析其活性成分, 预测了毛菊苣对T2DM-NAFLD的作用靶点、通路和疾病构成。本工作的思路见图 1。
|
Figure 1 Strategy of this systems pharmacology approach to investigate the active compounds and action mechanisms of Cichorium glandulosum on T2DM-NAFLD. T2DM-NAFLD: Type 2 diabetes mellitus accompanied with non-alcoholic fatty liver disease; FBG: Fasting blood glucose; ELISA: Enzyme-linked immunosorbent assay; OGTT: Oral glucose tolerance test; HE staining: Hematoxylin-eosin staining; OB: Oral bioavailability; DL: Drug likeness; C-T-P network: Compounds-targets-pathways network; C-T network: Compounds-targets network; C-T-D network: Compounds- targets-diseases network |
仪器、试剂与动物 毛菊苣茎购于新疆麦迪森有限公司饮片厂, 经石河子大学药学院韩博教授鉴定为菊科菊苣属毛菊苣茎(Cichorium glandulosum Boiss.et Huet), 存放于新疆植物药资源利用教育部重点实验室标本室。
链脲佐菌素(STZ, 编号: S0130-1G)购买于Sigma-Aldrich公司, ELISA试剂盒胰岛素、FFA购买于上海酶联生物科技有限公司, 葡萄糖粉剂购于康美保宁(四川)制药有限公司(批号: 140104), 罗格列酮原料药购于济南一通中科化工有限公司(批号: 20140304), 无水乙醇购于天津富宇精细化工有限公司。
日立HITACHI 7080全自动生化分析仪购于日本日立公司, 活力型血糖试纸及血糖仪购于罗氏血糖健康医护公司, Sunrise A-5082酶标仪购于帝肯(上海)贸易有限公司。
雄性SD大鼠60只, 体量180~220 g, 清洁级, 购自新疆医科大学实验动物中心, 动物合格证号: SCXK (新) 2011-0001。12 h明暗周期、湿度(50%~60%)下, 自由获取食物和水。实验前适应性喂养7天。所有操作流程经石河子大学医学院第一附属医院医学伦理委员会批准并依照《实验动物饲养管理和使用指南》开展实验。
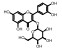
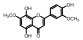
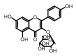
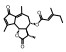
毛菊苣提取物制备 毛菊苣茎2 kg以75%乙醇加热(m/v, 1/10)回流3次, 过滤, 合并滤液得到毛菊苣提取物, 45 ℃减压浓缩除去溶剂得到毛菊苣提取物。毛菊苣提取物100 mg相当于生药433 mg。其中含有预测成分18个, 占总预测成分数量的62.1%。分别为: baicalin、calycosin、isorhamnetin、kaempferol、quercetin、quercetin-3-O-galactoside、5, 8, 3', 4'-tetrahydroxy-7-methoxyflavone、isorhamnetin-3-O-β-D-glucoside、8-O-methylsenecioylaustricin、lactucin、lactupicrin、11β, 13-dihydrolactucin、taraxerone、β-sitosterol、8-O-senecioylaustricin、1, 3-dicaffeoylquinic acid、3, 4-dicaffeoylquinic acid和3, 5-dicaffeoylquinic acid。
造模与给药 将实验大鼠随机分为对照组(NC组) 10只, 实验组40只。对照组给予普通饲料喂养, 实验组高脂饲料喂养。10周后, 实验组大鼠一次性腹腔注射STZ 30 mg·kg-1, 对照组大鼠一次性腹腔注射柠檬酸钠缓冲液。72 h后尾静脉空腹血糖≥11.1 mmol·L-1者造模成功。将造模成功的大鼠随机分成:模型组(DC组)、阳性药组(RSG组, 罗格列酮4 mg·kg-1·d-1)、低剂量组(L组, 毛菊苣提取物100 mg·kg-1·d-1)、高剂量组(H组, 毛菊苣提取物200 mg·kg-1·d-1)。所有大鼠连续灌胃10周, 每周测定大鼠体重和血糖。
灌胃给药第67天, 所有大鼠过夜禁食10 h后, 灌胃2 g·kg-1葡萄糖, 尾静脉取血分别测0、30、60、90和120 min时血糖值。
第10周末禁食12 h, 戊巴比妥麻醉, 腹主动脉取血, 4 ℃离心得血清, 采血后立即取出大鼠肝脏组织, 样本于-80 ℃冰箱保存。
血清生化指标检测 采用罗氏活力型血糖仪和血糖试纸测定空腹血糖, 采用上海酶联生物科技有限公司生产的FFA和胰岛素试剂盒检测血清中的FFA和胰岛素水平; 采用日立HITACHI 7080全自动生化分析仪检测血清中的血脂(TC、TG、HDL-C、LDL-C)水平和肝功能(AST、ALT)水平。
肝脏HE染色 将福尔马林固定好的肝脏右叶组织, 常规脱水, 石蜡包埋, 组织切片机连续切成2 µm厚的切片, HE染色, 光学显微镜下观察组织学变化。
构建毛菊苣化合物库 通过文献挖掘毛菊苣所含化合物, 然后通过PubChem、CHEMBL和Chemspider等数据库下载相应化合物的结构[25]。本研究中, 含有糖基的40个化合物基于糖苷酶水解反应去糖基化, 所以加入它们相应的糖苷配基化学物质到毛菊苣的化合物库进一步研究, 所有去糖基化合物以-qt标记。
ADME筛选 利用口服生物利用度(OB)和类药性(DL)两种ADME模型寻找毛菊苣的候选化合物。OB通过OBioavail 1.1计算得到, DL通过以下公式计算得到:
| $ F\left( {a, b} \right) = \frac{{ab}}{{{{\left| a \right|}^2} + {{\left| b \right|}^2} - ab}} $ | (1) |
a代表毛菊苣化合物的分子描述符, b代表FDA中所有批准药物的平均相似性指数[26]。将这些筛选模型的阈值设为OB≥30%、DL≥0.18, 若化合物符合上述标准, 或OB或DL不符合上述标准但含量较大且有明确药理作用则为候选化合物。
靶点预测 首先, 从3个分子靶向预测模型中获得了活性成分的生物学靶标, 这3个预测模型包括相似性综合方法SEA (http://sea.bkslab.org/)、STITCH (http://stitch.embl.de/)以及化学成分综合模型。其次, 将活性化合物输入草药成分目标数据库(HIT数据库, http://lifecenter.sgst.cn/hit/)、治疗靶点数据库(TTD, http://bidd.nus.edu.sg/group/ttd/)和DrugBank获得文献支持的化合物-靶点相互作用, 最后将上述两步获得的植物成分的靶点信息发送到TTD、PharmGKB (http://www.pharmgkb.org)、京都百科全书基因组数据库(KEGG, http://www.genome.jp/kegg/)和毒物基因组比较数据库(CTD, http://ctdbase.org/)以发现靶点相关的疾病。根据靶点相关疾病以及这些疾病的组织分布, 与动脉血管系统、肝病以及代谢相关的靶点均得以保留, 其他的被排除。
网络构建 为解析毛菊苣的潜在分子机制, 本研究构建了化合物-靶点(C-T)网络、化合物-靶点-疾病(C-T-D)网络、化合物-靶点-通路(C-T-P)网络。所有可视化网络图由Cytoscape 3.5.1构建[27]。
分子对接验证 本研究采用分子对接技术对系统药理学预测部分靶点进行验证。从RCSB PDB数据库(http://www.rcsb.org/)中下载获得靶蛋白结构, 采用autodock vina软件对配体和受体进行对接[28], 记录连接位点并计算亲和能, 采用PyMol 1.5软件作图。
数据统计 统计学检验采用SPSS 17.0统计软件进行分析, 数据以x±s表示, 各组间差异采用单因素方差分析, 两两比较采用ANOVA检验, P < 0.05为差异有统计学意义。
结果与讨论 1 毛菊苣对T2DM-NAFLD大鼠的治疗效果 1.1 一般状态观察对照组大鼠精神状态良好, 毛色有光泽, 饮食饮水及尿量正常, 体重呈增加趋势; 而模型组大鼠精神萎靡, 毛色泛黄, 出现“三多一少”症状; 毛菊苣给药组大鼠也出现模型组大鼠的症状, 但症状较轻。
1.2 对大鼠血液生化指标的影响大鼠实验流程见图 2A。模型组大鼠的血糖、胰岛素以及FFA水平较对照组均显著升高, 而给予毛菊苣提取物后, 其指标相应降低, 其中血糖(图 2B)和胰岛素(图 2C)水平有显著差异(P < 0.001);而毛菊苣提取物与模型组相比, 其FFA变化无显著差异(图 2D)。
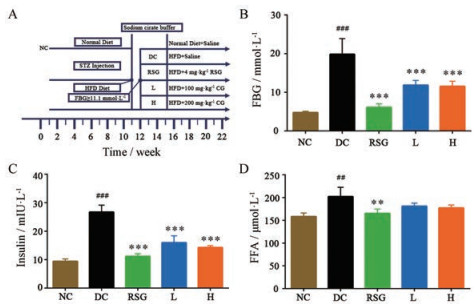
|
Figure 2 Animal experiment procedure and the levels of biochemical indicators. A: Procedure of animal experiment; B: Level of fasting blood glucose (FBG); C: Level of insulin; D: Level of free fatty acid (FFA). HFD: High-fat diet; NC: Normal group; DC: Model group; RSG: Rosiglitazone, 4 mg·kg-1·d-1; L: Cichorium glandulosum low-dosage group, 100 mg·kg-1·d-1; H: Cichorium glandulosum high-dosage group, 200 mg·kg-1·d-1. n = 4, x±s. ##P < 0.01, ###P < 0.001 vs NC group; *P < 0.05, **P < 0.01, ***P < 0.001 vs DC group |
给药10周后大鼠血清生化指标见表 1。模型组大鼠的TC、TG、LDL-C水平较对照组均显著升高(P < 0.005、P < 0.05)而HDL-C水平显著降低(P < 0.005)。与模型组大鼠相比, 毛菊苣提取物给药组可以明显降低T2DM-NAFLD大鼠的TC、TG、LDL-C水平, 其中TG和LDL-C水平显著降低(P < 0.01、P < 0.001), HDL-C水平提高(P < 0.001)。结果表明, 毛菊苣可降低TC、TG、LDL-C、增加HDL-C, 起到降血脂的功效。
| Table 1 Effect of Cichorium glandulosum on T2DM-NAFLD rats. n = 4, x±s. #P < 0.05, ##P < 0.01, ###P < 0.001 vs NC group; *P < 0.05, **P < 0.01, ***P < 0.001 vs DC group. TC: Total cholesterol; TG: Triglyceride; HDL-C: High-density lipoprotein-cholesterol; LDL-C: Low-density lipoprotein-cholesterol; AST: Aspartate transaminase; ALT: Alanine transaminase |
模型组AST、ALT水平较对照组均显著升高(P < 0.01、P < 0.001), 给予毛菊苣提取物后, 高剂量组AST、ALT水平显著降低(P < 0.05、P < 0.01)。结果表明毛菊苣提取物可减轻肝脏损伤。
1.3 对大鼠血糖及糖耐量的影响大鼠禁食的OGTT实验结果见图 3。口服给予葡萄糖(2 g·kg-1)后大鼠的血糖水平在30 min内提高, 并在接下来的90 min内停留在高血糖水平, 120 min时血糖几乎降到初始水平。在口服给予葡萄糖之后, 毛菊苣提取物治疗大鼠的血糖上升趋势得到抑制。以120 min内血糖的曲线下面积(AUC)表示OGTT的结果, 模型组的血糖AUC较对照组显著升高, 差异显著(P < 0.05)。与模型组相比, 毛菊苣给药组可显著降低血糖AUC (P < 0.05)。说明毛菊苣给药组大鼠对葡萄糖耐受性较强, 且降糖作用显著。
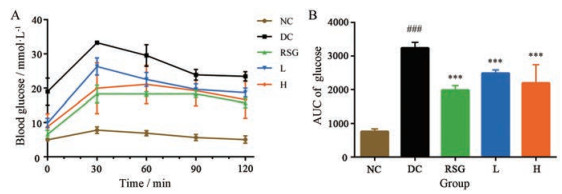
|
Figure 3 The effect of Cichorium glandulosum on OGTT in T2DM-NAFLD rats. n = 4, x±s. ###P < 0.001 vs NC group; ***P < 0.001 vs DC group |
实验大鼠的肝脏组织形态学变化见图 4。对照组大鼠肝细胞形态正常, 排列有序。模型组大鼠肝脏有严重的肝细胞损伤, 肝脏脂肪变形, 肝细胞体积膨大, 细胞索排列紊乱。而与对照组大鼠相比, 毛菊苣给药组大鼠肝脏中未发现明显的组织病理学异常。上述结果表明, 毛菊苣提取物可通过缓解肝细胞排列紊乱、减少肝脏脂质沉积等起到缓解肝脏损伤的作用。
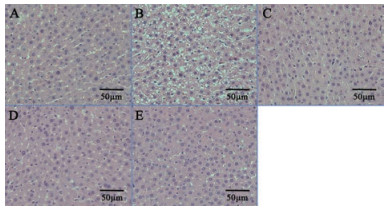
|
Figure 4 The effect of Cichorium glandulosum on histomorphology of liver in T2DM-NAFLD rats. A: NC group; B: DC group; C: RSG group; D: L group; E: H group (400×) |
通过文献挖掘得到了毛菊苣中的174个候选成分。对包括水解去糖基产物在内的214个成分以OB≥30%、DL≥0.18为指标筛选活性成分, 若化合物符合上述标准, 或OB或DL不符合上述标准但含量较大且有明确药理作用则为活性化合物。共得到29个活性成分, 包括10个黄酮类、11个萜类、3个苯丙素类、2个有机酸类和3个生物碱类。所有成分的详细信息见表 2。
| Table 2 Active compounds in Cichorium glandulosum and corresponding ADME parameters |
首先, 引入SEA、STITCH和化学基因组学模型在内的预测模型综合计算方法获得活性成分的生物学靶点; 其次, 系统挖掘HIT、TTD和DrugBank数据库获得活性成分的靶点, 取上述两步所得靶点的并集, 共鉴定得到了毛菊苣中29个活性成分的198个靶点。通过KEGG数据库收集靶点的117个与T2DM或NAFLD相关通路。通过CTD、KEGG、PharmGKB和TTD等数据库收集得到81个与T2DM或NAFLD相关的疾病。
2.3 C-T网络构建毛菊苣的C-T网络如图 5所示, 包括29个化合物和198个靶点的547个相互作用。29个活性成分degree的平均值为18.9。degree值最高的前10个化合物分别为槲皮素(degree=100)、山柰酚(degree=41)、胡萝卜苷(degree=32)、豆甾醇(degree=28)、异鼠李素(degree=26)、玉米核黄素-qt (degree=24)、蒲公英甾醇(degree=24)、β-谷甾醇(degree=24)、毛蕊异黄酮(degree=21)、5, 8, 3', 4'-四羟基-7-甲氧基黄酮(degree=20)。另一方面, 很多靶点被不同数量的化合物靶向, 如PIK3R1、GLB1、GLUT2、G6PD等。毛菊苣的靶点信息分析结果如图 6所示, 对所有相关靶点的生化类型进行分析, 靶点主要分为酶(58.64%)、膜受体(19.37%)、转录因子(5.24%)、转运体(5.24%)等(图 6A)。在112个酶中, 36个酶是氧化还原酶, 36个酶是转移酶、28个水解酶和12个裂合酶(图 6B)。在靶点对应的疾病方面, 主要与营养和代谢性疾病、消化系统疾病和心血管疾病有关(图 6C)。

|
Figure 5 C-T network of Cichorium glandulosum. Triangles are candidate compounds, and yellow triangles are important compounds. Similarly, rounds represent potential targets, green rounds are important targets |

|
Figure 6 The analysis results of targets information in Cichorium glandulosum |
如图 7所示, C-T-P网络中包含了344个节点(29个化合物, 198个靶点, 117个通路)和1 388个相互作用。106个靶点与T2DM有关, 88个靶点与NAFLD有关, 其中T2DM和NAFLD共同的靶点有56个, 这些共同靶点主要和胰岛素抵抗和炎症有关。Degree值最高的6个通路依次为代谢通路(degree=55)、钙信号通路(degree=31)、cAMP通路(degree=29)、cGMP-PKG通路(degree=22)、MAPK通路(degree=20)和PI3K/Akt通路(degree=19)。此外, 与T2DM-NAFLD均相关的通路如胰岛素通路、胰岛素抵抗、NF-κB通路中毛菊苣分别影响15、12、12个靶点。代谢通路包含一系列的下游通路, 如能量代谢、糖水化合物和脂代谢等, 在代谢性疾病发挥着重要作用。NF-κB通路是免疫反应的调节者之一, 在肥胖相关的代谢性疾病中具有关键作用[29, 30]。MAPK通路可以激活调节糖转运体的表达[31]。PI3K/Akt通路可以调节T2DM大鼠肝糖元合成[32]。抑制cAMP通路可减缓糖尿病心脏微血管损伤进而减少糖尿病并发症的发生[33]。上述结果表明, 毛菊苣可能通过调节代谢通路、MAPK、PI3K/Akt等通路发挥治疗T2DM-NAFLD作用。
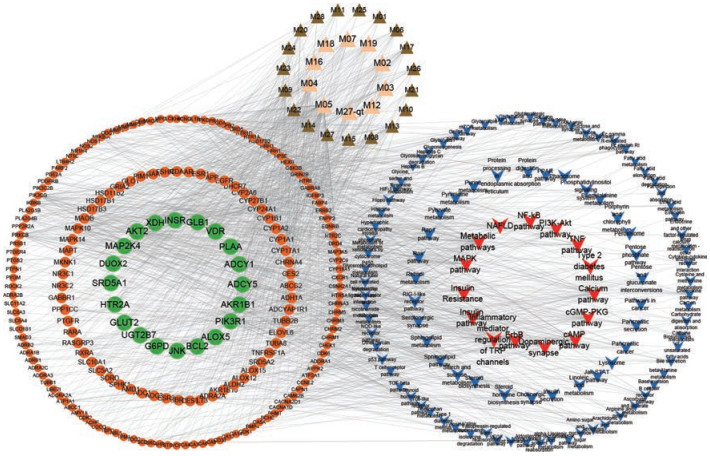
|
Figure 7 C-T-P network of Cichorium glandulosum. Triangles are candidate compounds; yellow triangles are important compounds. Similarly, rounds represent potential targets, green rounds are important targets. V represent pathways, red V are important pathways |
C-T-D网络图如图 8所示, 包含308个节点(29个化合物, 198个靶点, 81个疾病)和933个相互作用。degree值最高的前6个疾病依次为高血压、肝硬化、T2DM、糖尿病、炎症和肥胖, 依次为29、27、27、19、19、16。106个靶点与T2DM有关, 88个靶点与NAFLD有关, 值得注意的是, 56个靶点为T2DM和NAFLD共有, 主要涉及胰岛素抵抗和炎症。PIK3R1具有最高的degree值, 随后依次为PTGS2、G6PD、HTR2A、INSR, 其中PIK3R1和INSR与糖尿病及糖尿病相关疾病(包括T2DM、胰岛素抵抗和NAFLD)的关系最密切, 而PTGS2、G6PD、HTR2A与糖尿病并发症有关。NAFLD相关的靶点包括INSR、IKBKB、PIK3R1、GSK3B、TNFRSF1A都与T2DM有关, 表明毛菊苣可能通过上述靶点对T2DM-NAFLD起治疗作用。Degree最高的前10个化合物(异鼠李素、槲皮素、β-谷甾醇、胡萝卜苷、豆甾醇、蒲公英甾醇、毛蕊异黄酮、山柰酚、玉米核黄素-qt和5, 8, 3', 4'-四羟基-7-甲氧基黄酮)都与NAFLD、炎症和糖尿病包括T2DM直接相关。
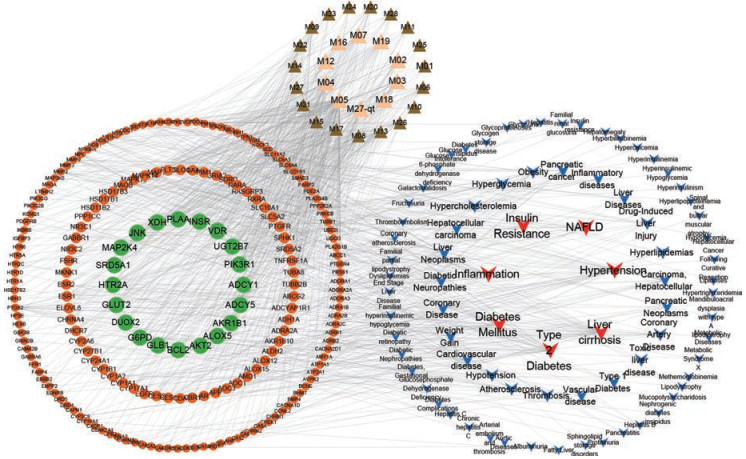
|
Figure 8 C-T-D network of Cichorium glandulosum. Triangles are candidate compounds, and yellow triangles are important compounds. Similarly, rounds represent potential targets, green rounds are important targets. V represent diseases, red V are important diseases |
从系统药理学预测的靶点中选取PIK3R1、PTGS2、G6PD、HTR2A、INSR 5个关键靶蛋白, 对其配体进行分子对接并计算亲和力。亲和力最高的5个靶蛋白及其配体的分子对接图如图 9所示, 这5组靶蛋白和配体组合分别为PTGS2和M05、INSR和M09、PIK3R1和M06、HTR2A和M24、G6PD和M22。5个靶蛋白及其在系统药理学预测的活性化合物之间的亲和力及连接位点见表 3。结果表明, 这5个靶蛋白与所对应的配体之间均具有良好的亲和性。

|
Figure 9 The results of molecular docking. A: The interaction of PTGS2 and M05; B: The interaction of INSR and M09; C: The interaction of PIK3R1 and M06; D: The interaction of HTR2A and M24; E: The interaction of G6PD and M22 |
| Table 3 The results of molecular docking of PTGS2, INSR, PIK3R1, HTR2A, G6PD and their corresponding ligands |
目前系统药理学主要用于一味或多味中药对一个疾病的作用机制研究, 如Yue等[34]通过系统药理学明确了当归红花片对血瘀症的作用机制。本课题组[35]通过系统药理学研究了没食子抗溃疡性结肠炎的物质基础和作用机制。但研究者往往忽略了系统药理学(或网络药理学)作为一件强大的科学工具可用于适应证或复杂适应证的分析上。用于复杂症候分析的工作并不多见, 如清华大学李梢课题组[36]通过网络药理学工具对中医的复杂症候“寒”和“热”症候和药性进行了分析, 相对清晰地勾勒了药物-靶点-疾病的轮廓。类似的, 本工作分析了一种植物药对T2DM和NAFLD两种疾病之间的作用靶点以及两种疾病T2DM和NAFLD之间的关系, 为科学扩展和梳理药物的适应证提供了有益参考。
一个靶点对应的疾病可能会涉及不同系统的疾病, 而草药中多个化合物对应的靶点信息复杂, 相关的疾病多种多样。因为本工作所研究疾病为T2DM和NAFLD, 因此与这两种疾病相关的疾病被保留下来, 如T2DM涉及的疾病包括各种大小血管并发症, 以及相关的代谢性疾病和心血管疾病; NAFLD涉及的肝硬化、肝纤维化等疾病也得以保留。
结论动物实验表明, 毛菊苣可以显著改善T2DM-NAFLD大鼠的血糖血脂水平, 改善糖耐量并减少AST、ALT, 改善肝脏细胞排列, 减少肝脏脂质沉积的作用。系统药理学结果表明, 毛菊苣可能通过调节代谢通路、钙信号通路、PI3K/Akt、cAMP、MAPK等通路治疗T2DM-NAFLD, 共筛选和预测得到了29个活性化合物、198个靶点、117个通路和81个疾病。涉及T2DM的靶点有106个, 涉及NAFLD的靶点有88个, T2DM和NAFLD共有的靶点有56个, 主要与胰岛素抵抗和炎症有关, 198个靶点主要参与了代谢通路、钙信号通路、PI3K/Akt信号通路、cAMP通路、MAPK通路等。本研究为毛菊苣治疗2型糖尿病伴随非酒精性脂肪肝提供了理论和实验基础。
| [1] | Cusi K, Sanyal AJ, Zhang S, et al. Non-alcoholic fatty liver disease (NAFLD) prevalence and its metabolic associations in patients with type 1 diabetes and type 2 diabetes[J]. Diabetes Obes Meta, 2017, 19: 1630–1634. DOI:10.1111/dom.12973 |
| [2] | Barb D, Portillo-Sanchez P, Cusi K. Pharmacological management of nonalcoholic fatty liver disease[J]. Metabolism, 2016, 65: 1183–1195. DOI:10.1016/j.metabol.2016.04.004 |
| [3] | Bril F, Cusi K. Management of nonalcoholic fatty liver disease in patients with type 2 diabetes: a call to action[J]. Diabetes Care, 2017, 40: 419–430. DOI:10.2337/dc16-1787 |
| [4] | Smith BW, Adams LA. Nonalcoholic fatty liver disease and diabetes mellitus: pathogenesis and treatment[J]. Nat Rev Endocrinol, 2011, 7: 456–465. DOI:10.1038/nrendo.2011.72 |
| [5] | Cernea S, Cahn A, Raz I. Pharmacological management of nonalcoholic fatty liver disease in type 2 diabetes[J]. Expert Rev Clin Phar, 2017, 10: 1–13. |
| [6] | Li W, Yuan G, Pan Y, et al. Network pharmacology studies on the bioactive compounds and action mechanisms of natural products for the treatment of diabetes mellitus: a review[J]. Front Pharmacol, 2017, 8: 74–78. |
| [7] | Liu Q, Zhu L, Cheng C, et al. Natural active compounds from plant food and Chinese herbal medicine for nonalcoholic fatty liver disease[J]. Curr Pharm Design, 2017, 23: 5136–5162. |
| [8] | Cheng WC, Jia HJ, Aw WP, et al. Beneficial effects of soluble dietary Jerusalem artichoke (Helianthus tuberosus) in the prevention of the onset of type 2 diabetes and non-alcoholic fatty liver disease in high-fructose diet-fed rats[J]. Brit J Nutr, 2014, 112: 709–717. DOI:10.1017/S0007114514001421 |
| [9] | Yang WZ, Hao W, Jing S, et al. Chemical constituents from Cichorium glandulosum[J]. Chin J Nat Med, 2009, 7: 193–195. DOI:10.3724/SP.J.1009.2009.00193 |
| [10] | Committee CP. Pharmacopoeia of the People's Republic of China: the 2015 edition. 1st section (中华人民共和国药典2015版, 第一部)[S]. Beijing: The Medicine Science and Technology Press of China, 2015. |
| [11] | Qin D, Nie Y, Wen Z. Protection of rats from thioacetamide-induced hepatic fibrosis by the extracts of a traditional Uighur medicine Cichorium glandulosum[J]. Iran J Basic Med Sci, 2014, 17: 879–885. |
| [12] | Chen HJ, Qin HY, Long F, et al. Screening of high-affinity α-glucosidase inhibitors from Cichorium glandulosum Boiss. et Hout seed based on ultrafiltration liquid chromatography-mass spectrometry and molecular docking[J]. Chin J Anal Chem (分析化学), 2017, 45: 889–897. |
| [13] | Ding L, Liu JL, Hassan W, et al. Lipid modulatory activities of Cichorium glandulosum Boiss et Huet are mediated by multiple components within hepatocytes[J]. Sci Rep, 2014, 4: 4715–4724. |
| [14] | Xin XL, Yang WJ, Yasen M, et al. The mechanism of hepatoprotective effect of sesquiterpene rich fraction from Cichorum glandulosum Boiss. et Huet on immune reaction-induced liver injury in mice[J]. J Ethnopharmacol, 2014, 155: 1068–1075. DOI:10.1016/j.jep.2014.06.014 |
| [15] | Yao X, Zhu L, Chen Y, et al. In vivo and in vitro antioxidant activity and α-glucosidase, α-amylase inhibitory effects of flavonoids from Cichorium glandulosum seeds[J]. Food Chem, 2013, 139: 59–66. DOI:10.1016/j.foodchem.2012.12.045 |
| [16] | Tong J, Ma B, Ge L, et al. Dicaffeoylquinic acid-enriched fraction of Cichorium glandulosum seeds attenuates experimental type 1 diabetes via multipathway protection[J]. J Agric Food Chem, 2015, 63: 10791–10802. DOI:10.1021/acs.jafc.5b04552 |
| [17] | Qin H, Chen H, Zou Y, et al. Systematic investigation of the mechanism of Cichorium glandulosum on type 2 diabetes mellitus accompanied with non-alcoholic fatty liver ratsliver rats[J]. Food Funct, 2019, 10: 2450–2460. DOI:10.1039/C8FO02284D |
| [18] | Hopkins AL. Network pharmacology: the next paradigm in drug discovery[J]. Nat Chem Biol, 2008, 4: 682–690. DOI:10.1038/nchembio.118 |
| [19] | Tang J, Aittokallio T. Network pharmacology strategies toward multi-target anticancer therapies: from computational models to experimental design principles[J]. Curr Pharm Design, 2014, 20: 23–36. DOI:10.2174/13816128113199990470 |
| [20] | Ru J, Li P, Wang J, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminformatics, 2014, 6: 13–18. DOI:10.1186/1758-2946-6-13 |
| [21] | Li JL, Liang H, Cai SZ, et al. Mechanism of detoxification of Chebulae Fructus against Aconiti kusnezoffii radix toxicity based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2018, 53: 1670–1679. |
| [22] | Liu J, Mu J, Zheng C, et al. Systems-pharmacology dissection of traditional Chinese medicine compound Saffron Formula reveals multi-scale treatment strategy for cardiovascular diseases[J]. Sci Rep, 2016, 6: 19809–19818. DOI:10.1038/srep19809 |
| [23] | Wang C, Ren Q, Chen XT, et al. System pharmacology-based strategy to decode the synergistic mechanism of Zhi-zhu Wan for functional dyspepsia[J]. Front Pharmacol, 2018, 9: 841–856. DOI:10.3389/fphar.2018.00841 |
| [24] | Wang Y, Yang L. Systems pharmacology-based research framework of traditional Chinese medicine[J]. World Chin Med (世界中医药), 2013, 8: 801–808. |
| [25] | Zhai YY, Liu QN, Xu J, et al. Network pharmacology-based study on mechanism of liver protection of Erzhi Pill[J]. Acta Pharm Sin (药学学报), 2018, 53: 567–573. |
| [26] | Yang Y, Li Y, Wang J, et al. Systematic investigation of Ginkgo biloba leaves for treating cardio-cerebrovascular diseases in an animal model[J]. ACS Chem Biol, 2017, 12: 1363–1372. DOI:10.1021/acschembio.6b00762 |
| [27] | Shannon P, Markiel A, Ozier O, et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J]. Genome Res, 2003, 13: 2498–2504. DOI:10.1101/gr.1239303 |
| [28] | Oleg T, Olson AJ. AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading[J]. J Comput Chem, 2010, 31: 455–461. |
| [29] | Hotamisligil GS. Inflammation and metabolic disorders[J]. Nature, 2006, 444: 860–867. DOI:10.1038/nature05485 |
| [30] | Catrysse L, Loo GV. Inflammation and the metabolic syndrome: the tissue-specific functions of NF-κB[J]. Trends Cell Biol, 2017, 27: 417–429. DOI:10.1016/j.tcb.2017.01.006 |
| [31] | Fujishiro M, Gotoh Y, Katagiri H, et al. MKK6/3 and p38 MAPK pathway activation is not necessary for insulin-induced glucose uptake but regulates glucose transporter expression[J]. J Biol Chem, 2001, 276: 19800–19806. DOI:10.1074/jbc.M101087200 |
| [32] | Liu TY, Shi CX, Gao R, et al. Irisin inhibits hepatic gluconeogenesis and increases glycogen synthesis via the PI3K/Akt pathway in type 2 diabetic mice and hepatocytes[J]. Clin Sci, 2015, 129: 839–850. DOI:10.1042/CS20150009 |
| [33] | Wang D, Luo P, Wang Y, et al. Glucagon-like peptide-1 protects against cardiac microvascular injury in diabetes via a cAMP/PKA/Rho-dependent mechanism[J]. Diabetes, 2013, 62: 1697–1708. DOI:10.2337/db12-1025 |
| [34] | Yue SJ, Xin LT, Fan YC, et al. Herb pair Danggui-Honghua: mechanisms underlying blood stasis syndrome by system pharmacology approach[J]. Sci Rep, 2017, 7: 40318–40332. DOI:10.1038/srep40318 |
| [35] | Yu W, Li Z, Long F, et al. A systems pharmacology approach to determine active compounds and action mechanisms of Xipayi KuiJie'an enema for treatment of ulcerative colitis[J]. Sci Rep, 2017, 7: 1189–1205. DOI:10.1038/s41598-017-01335-w |
| [36] | Ma T, Tan C, Zhang H, et al. Bridging the gap between traditional Chinese medicine and systems biology: the connection of cold syndrome and NEI network[J]. Mol Biosyst, 2010, 6: 613–619. DOI:10.1039/b914024g |
 2019, Vol. 54
2019, Vol. 54