类风湿关节炎(rheumatoid arthritis, RA)是一类病因病机尚不明确的自身免疫系统性疾病, 全球范围内的发病率约为5%[1]。若患者没有接受长期正规的治疗, 可致关节损伤甚至肢体残疾[2]。在引起关节软骨和骨破坏的关节滑膜自身抗原的免疫刺激中, 基因因素(主要组织相容性复合体Ⅱ位点的基因多态性)和环境因素(生活作息、吸烟、饮食)协同发挥作用[3]。目前治疗RA的药物主要包括改善病情类抗风湿药、非甾体类抗炎药和新型生物制剂等。尽管这些药物可在一定程度上改善RA患者身体机能, 抑制骨破坏, 但会诱发RA患者感染、肺结核和高血压等严重的不良反应[4]。中医药在自身免疫性疾病中具有较为理想的疗效, 与抗RA一线药物甲氨喋呤(methotrexate, MTX)等联用具有增效减毒的功效[5]。
芍药苷(paeoniflorin, PAE)源自于毛茛科植物芍药根和牡丹根, 在中药白芍中含量丰富, 也是临床用免疫调节剂白芍总苷的主要生物活性单体成分, 具有抗炎、免疫调节、镇痛、抗肿瘤及保护心肌急性缺血等多种生物学功能, 在RA中具有较大的应用潜能[6]。现有药理研究表明, PAE可抑制RA滑膜细胞异常增殖、炎性应答和骨破坏, 其机制与其对抑制性G蛋白、RANKL/ RANK/OPG比值和NF-κB活化的调节有关[7, 8]。然而, 其抗RA的作用机制尚未完全阐明。本研究基于佐剂诱导型关节炎(adjuvant-induced arthritis, AIA)大鼠模型, 运用网络药理学、分子对接和实验验证相结合的方法, 为深入探讨PAE抗RA的作用机制提供新思路和新方法。
材料与方法 数据收集与整理已知RA相关基因收集和整理 基于DrugBank数据库(https://www.drugbank.ca/, version 5.1.3)[9]、OMIM数据库(http://www.omim.org/, Last updated: October 31, 2013)[10]、GAD数据库[11] (Genetic Association Database, http://geneticassociationdb.nih.gov/, Last updated: August 18, 2013)和KEGG通路数据库(http://www.genome.jp/kegg/, Last updated: October 16, 2012)[12], 共收集到208个已知RA相关基因。
白芍候选靶标预测 采用drug-CIPHER-CS软件, 预测白芍所含化学成分的候选靶标分子[13], 选择Hitting time大于中位数的靶标作为白芍的候选靶标。接着, 通过查询DrugBank数据库, 考察白芍候选靶标与已知抗RA药物的相关性。
网络构建与分析白芍候选靶标-已知RA相关基因相互作用网络的建立 基于String数据库(http://string-db.org/, version 10.5), 提取白芍候选靶标分子与已知RA相关基因的相互作用信息, 并构建药物靶标分子网络。采用Navigator software (Version 2.2.1)进行网络可视化。
网络拓扑特征值计算 计算上述白芍候选靶标-已知RA相关基因互作网络中网络节点的拓扑特征值(连接度、介度、紧密度), 筛选三者均大于相应中位数的节点为关键网络靶标, 进行下一步通路富集分析。
通路富集分析 通过生物学信息注释数据库(the Database for Annotation, Visualization and Integrated Discovery, DAVID, https://david.ncifcrf.gov/, version 6.7)[14]对白芍抗RA潜在网络靶标进行GO生物学过程富集分析, 研究其靶点生物过程, 并进行KEGG信号通路富集分析(Bonferroni法矫正: P < 0.01; DAVID平台列表与背景: Homo sapiens), 探究白芍关键靶标所参与的主要信号通路。
分子对接 分别采用SystemsDock (http://systemsdock.unit.oist.jp/iddp/home/index)[15]和AutoDock[16]分子对接技术, 计算白芍抗RA关键网络靶标与其主要成分PAE的结合能力。在SystemsDock对接化合物-靶标结合能力评分中, 对接分数大于4.25表示对接化合物与靶标之间有一定的亲和力, 大于5.0表示对接化合物与靶标之间有较好的亲和力, 大于7.0表示两者之间有很强的亲和力[17]。在AutoDock对接化合物-靶标结合能力评分中, 对接分数小于等于-5.0表示对接化合物与靶标之间有较强的亲和力[18]。
实验动物 雄性Lewis大鼠, 清洁级, 购自北京维通利华实验动物技术有限公司, 6~8周龄, 体重200 ± 20 g。动物许可证号: SCXK (京) 2007-0017, SCXK (京) 2009-0017, 实验期间自由饮水, 饲固体饲料, 恒温、恒湿, 喂养于中国中医科学院基础所实验动物中心。本研究有关动物的所有操作均按照中国医学科学院实验动物护理中心的伦理标准进行。
实验药品、试剂及仪器 白芍(Radix Paeoniae Alba)购自北京同仁堂药店; MTX购自上海信谊药厂有限公司, 国药准字H31020644; M tuberculosis H37 Ra结核杆菌(货号: 231141)购自美国BD Difco公司; PAE (货号: S-010-180416)购自融诚鑫德有限公司; 丙酮(批号: 20101223)购自北京化工厂; 液体石蜡(批号: 150702)购自江西德成制药有限公司; 二甲基亚砜(dimethyl sulfoxide, DMSO, 货号: D2650)购自上海联硕生物科技有限公司; Elisa试剂盒白介素1β (interleukin-1 beta, IL-1β, 货号: 85-88-6010-22)、肿瘤坏死因子α (tumor necrosis factor alpha, TNF-α, 货号: 85-88-7340-22)购自美国eBioscience公司; 白介素6 (interleukin-6, IL-6, 货号: KJ0087)、干扰素γ (interferon γ, IFN-γ, 货号: KY0031)购自康佳宏原生物科技有限公司; 白介素17 (interleukin-17, IL-17, 货号: 70-EK317, 杭州联科生物技术股份有限公司)。丙氨酸转氨酶(alanine aminotransferase, ALT, 货号: Lb20701)、门冬氨酸氨基转移酶(aspertate aminotransferase, AST, 货号: Lb20702)、尿素(urea, CREA, 货号: Lb20101)购自德国Prodia Diagnostics公司; 肌酸酐(creatinine, CREA, 货号: 105-000492-00, 深圳迈瑞生物医疗股份公司); 基质金属蛋白酶1 (matrix metalloproteinase-1, MMP1)一抗(货号: 10371-2-AP, Proteintech公司); 基质金属蛋白酶3 (matrix metalloproteinase-3, MMP3)一抗(货号: ab53015, 美国Abcam公司); Von frey hair疼痛测试仪(美国Stoeltingco公司); 热辐射疼痛测试仪(意大利Ugo Basile公司); 旋涡混合器(北京金北德工贸有限公司); Multiskan MK3酶标仪(Thermo Fisher Scientific公司); 日立7600全自动生化仪(日本Hitachi公司); Tanon 5200化学发光成像系统(上海天能科技有限公司)。
药物制备 在本课题组前期研究中, 出自《金匮要略》的经典名方乌头汤(WTD)在7.5 mg·mL-1 (临床4倍等效剂量)可显著降低RA模型大鼠的临床积分和关节肿胀度等, 改善RA模型大鼠疾病严重度[19]。本研究运用超高效液相色谱-质谱/质谱(UPLC-MS/MS)系统(美国Waters公司)对WTD中所含的PAE进行定量分析, 发现1 mg WTD冻干粉(出粉率27%)中含有10 889.2 ng PAE, 因此, PAE在7.5 mg·mL-1 WTD中的含量为2 201.32 μg·mL-1。本项实验中, PAE用不超过1%的DMSO溶解, 加水稀释至1 g·mL-1备用。
AIA动物模型造模及给药 选用健康6~8周龄雄性Lewis大鼠, 每只大鼠单次尾根皮内注射0.1 mL完全弗式佐剂(10 mg·mL-1热灭活的结核分枝杆菌酪酸的液体石蜡混悬液, Difco), 诱导AIA模型[20]。
雄性Lewis大鼠30只, 每组5只。组别如下:空白组、空白组+DMSO组、AIA模型组、AIA模型+DMSO组、AIA模型+PAE组和AIA模型+MTX组。大鼠给药按照1 mL/100 g体重灌胃, 从免疫当天开始给药, PAE和DMSO每给药6天, 间歇1天。MTX每给药3天, 间歇1天。同时, 空白组和AIA模型组灌服等容积蒸馏水。给药至免疫第25天。
AIA疾病严重度评价 关节炎临床积分:自免疫8天开始, 每2~3天进行一次临床积分(双人目测), 计算出临床积分, 40分制(定义每只大鼠关节炎评分≥0.5分为关节炎发病; 关节炎评分≥1.5分为造模成功)[21, 22]; 关节肿胀度:自免疫8天开始, 每2~3天用游标卡尺测量大鼠的右后肢直径, 截止至取材前一天; 体重:自免疫第一天开始, 每周测量大鼠体重2次, 截止至取材前一天; 胸腺/脾脏指数:取材后, 称取胸腺和脾脏重量, 计算脏器指数(胸腺或脾脏重量/大鼠体重, mg·g-1)。
疼痛指标检测 分别通过Von frey hair机械疼痛测试仪、热辐射疼痛测试仪和丙酮来检测空白组、AIA模型组和各给药组大鼠的机械痛[23]、热辐射痛[24]和丙酮痛[25]。分别在造模前、造模后测量(每隔2天测量1次), 每次测量维持3个周期, 中间间隔5 min, 最后计算取平均值。
AIA大鼠血清炎性因子水平检测 以酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)测定空白组、AIA模型组和各给药组大鼠血清中TNF-α、IL-6、IL-1β、IL-17、IFN-γ含量。
取材及组织处理方法 在给药至免疫第25天取材, 运用10%水合氯醛(3 mL·kg-1)腹腔注射麻醉各组大鼠后, 腹主动脉取血, 3 000 r·min-1离心15 min取上清, -80 ℃保存, 用于ELISA和生化检测; 取大鼠胸腺、脾脏、肝脏和肾脏, 称重计算脏器指数; 使用灭菌器械, 无菌条件下取大鼠左右后肢膝、踝关节, 剥去皮毛, 放置-80 ℃用于Western blot检测。
统计学分析 应用Graphpad prism (Version 6.0)进行统计学分析。计量资料以均数±标准差表示。各项指标的组间比较均采用方差分析。P值小于0.05表明组间差异具有统计学意义。采用Adobe photoshop CS6进行图表制作。
结果 1 白芍作用于RA的关键网络靶标预测采用drug-CIPHER-CS软件, 针对白芍所含化学成分, 共预测得到486个候选靶标, 经DrugBank数据库挖掘, 发现其中有19个白芍候选靶标为已知抗RA药物的治疗靶标(表 1)。
| Table 1 Detailed information of the known putative targets of paeoniflorin (PAE) and corresponding FDA approved drugs in the treatment of rheumatoid arthritis (RA) |
接着, 基于白芍候选靶标和已知RA相关基因间的相互作用关系, 构建“白芍候选靶标-已知RA相关基因相互作用网络”, 包含612个节点和5 712对相互作用。为筛选关键网络靶标, 计算上述网络节点的拓扑特征值, 包括连接度、介度和紧密度, 它们的中位数分别为0.000 77、13.000 00和0.345 12, 选择三者均大于相应中位数的关键网络靶标, 共计196个, 其中有146个为白芍的候选靶标。根据上述关键网络靶标的功能, 将其互作网络划分为3个功能模块, 分别与炎症-免疫失衡、骨破坏和血管新生等3个病理环节调节相关(图 1)。
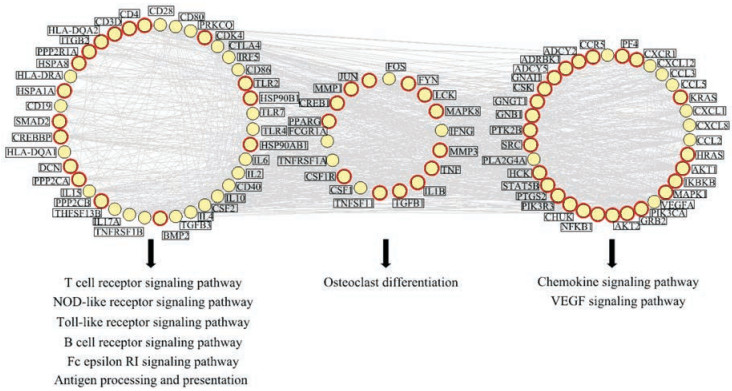
|
Figure 1 Interaction network of key putative targets of Radix Paeoniae Alba and RA-related genes, and its involved pathways. The nodes in red circles refer to the key putative targets of Radix Paeoniae Alba interfering with RA |
针对上述196个关键网络靶标的功能和通路进行富集分析, 结果表明, 白芍抗RA的关键网络靶标显著富集于多条RA相关通路, 如Toll样受体信号通路、RA信号通路(富集因子最大)、T细胞受体信号通路、破骨细胞分化、NOD样受体信号通路和B细胞受体通路等(图 2A)。其中, 参与RA信号通路的白芍关键网络靶标共有10个, 分别为HLA-DQA2、IL1B、ITGB2、JUN、MMP1、MMP3、TGFB1、TLR2、TNF和TNFSF11 (图 2B)。因此, 推测与关节软骨破坏有关的IL1B-TNF-TLR2-JUN-MMP1-MMP3信号轴可能是白芍发挥抗RA药效的作用通路之一。

|
Figure 2 Pathway enrichment analysis of key putative targets in the interaction network of Radix Paeoniae Alba and RA-related genes, and their relations with RA signaling pathway. A: Pathway enrichment analysis of key putative targets in the interaction network of Radix Paeoniae Alba and RA-related genes; B: Mapping chart of key putative targets of Radix Paeoniae Alba in the drug-disease interaction network into the RA signaling pathway |
本研究采用SystemsDock和AutoDock对接方法来考察白芍抗RA关键网络靶标与PAE的结合能力。如表 2所示, SystemsDock对接结果显示PAE与MMP1、MMP3、IL1B、ITGB2和TLR2的系统对接得分值均大于5.0。AutoDock对接结果显示, PAE与MMP1、MMP3、IL1B、ITGB2、TLR2、TNF和TNFSF11的对接分数小于-5.0。综合PAE和白芍关键网络靶标分子的SystemsDock和AutoDock分子对接结果, PAE与MMP1和MMP3的结合力最强。PAE与MMP1和MMP3的配体对接后的复合体三维结构图, 如图 3所示。
| Table 2 Binding affinity of PAE and putative targets of Radix Paeoniae Alba in the treatment of RA via molecular docking. N/A: No binding affinity between chemical compound and corresponding putative targets |
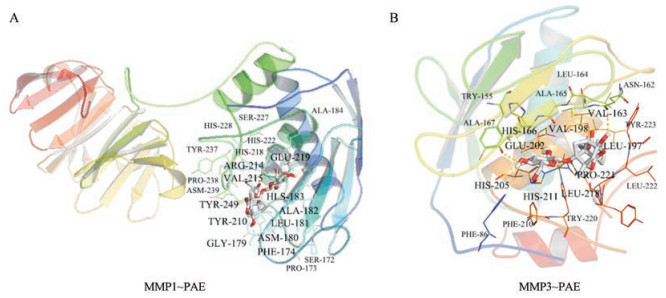
|
Figure 3 Complex three-dimensional structure of PAE docking with matrix metalloproteinase-1 (MMP1, A) and matrix metalloproteinase-3 (MMP3, B) |
本研究通过在雄性Lewis大鼠中构建AIA模型来探究PAE对关节炎的疗效。AIA模型组大鼠的首次发病时间为造模后第10天, 发病率为100%, 关节出现红肿、畸形、体重下降。PAE可显著改善其红肿等症状(图 4A), 表现为降低AIA模型组大鼠的关节评分(均P < 0.001, 图 4B)、右后肢肿胀度(均P < 0.001, 图 4C), 升高体重(均P < 0.001, 图 4D)。此外, PAE还降低在AIA模型组大鼠中异常升高的胸腺和脾脏指数(均P < 0.001, 图 4E、F), 其药效与阳性药MTX相比无显著性差异(均P > 0.05) (各项疾病严重度指标在空白组与空白组+DMSO组, 以及AIA模型组和AIA模型+DMSO组中无显著性差异, 因此, 1%浓度的DMSO对PAE的抗RA药效可忽略不计)。

|
Figure 4 Improvement effects of PAE on the severity of arthritis in adjuvant-induced arthritis (AIA) rats in terms of macroscopic evidence of arthritis (A), arthritis score (B), the diameter of the limbs (C), body weight (D), thymus index (E) and spleen index (F). n = 5, x± s. #P < 0.05, ##P < 0.01, ###P < 0.001 vs the normal control group (Con); ***P < 0.001 vs the AIA model group. MTX: Methotrexate |
与空白组相比, AIA模型组大鼠的痛阈(机械痛、热辐射痛和丙酮痛)明显降低, PAE具有镇痛作用, 自造模第10天至第25天实验结束, 可显著升高AIA模型组大鼠的机械痛(均P < 0.05, 图 5A)、热辐射痛(P < 0.05, 图 5B)和丙酮痛(P < 0.05, P < 0.001, 图 5C), 其调节作用与阳性药MTX相比无显著性差异(均P > 0.05) (各项痛阈在空白组与空白组+DMSO组, 以及AIA模型组和AIA模型+DMSO组中无显著性差异, 因此, 1%浓度的DMSO对PAE的痛阈影响可忽略不计)。
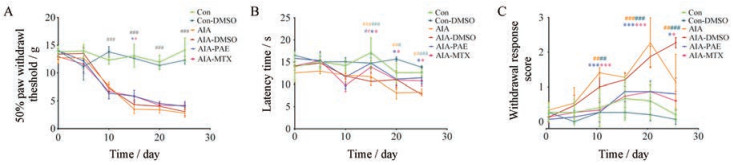
|
Figure 5 Effects of PAE on the pain thresholds of AIA rats. A: Mechanical-induced hyperalgesia; B: Thermal-induced hyperalgesia; C: Acetone-induced hyperalgesia. n = 5, x± s. #P < 0.05, ##P < 0.01, ###P < 0.001 vs the normal control group (Con); *P < 0.05, ***P < 0.001 vs the AIA model group |
与空白组相比, AIA模型组大鼠血清的炎性因子IL-1β、TNF-α、IL-6、IL-17和IFN-γ水平显著升高(均P < 0.001)。PAE可显著降低AIA模型组大鼠血清中IL-1β (均P < 0.001, 图 6A)、TNF-α (均P < 0.001, 图 6B)、IL-6 (均P < 0.001, 图 6C)、IL-17 (均P < 0.001, 图 6D)和IFN-γ (均P < 0.001, 图 6E)的表达水平, 其药效与阳性药MTX相比无显著性差异(均P > 0.05) (各炎性因子在空白组与空白组+DMSO组, 以及AIA模型组和AIA模型+DMSO组中无显著性差异, 因此, 1%浓度的DMSO对AIA大鼠血清炎性因子表达水平的影响可忽略不计)。
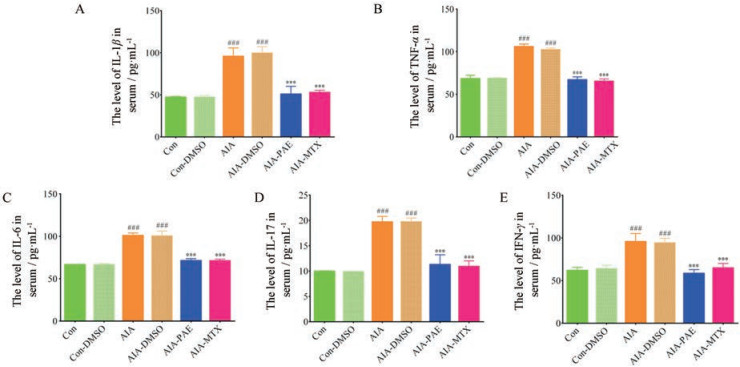
|
Figure 6 Inhibitory effects of PAE on the level of inflammatory cytokines including interleukin-1 beta (IL-1β, A), tumor necrosis factor alpha (TNF-α, B), interleukin-6 (IL-6, C), interleukin-17 (IL-17, D) and interferons-γ (IFN-γ, E) in AIA rats. n = 5, x± s. ###P < 0.001 vs the normal control group (Con); ***P < 0.001 vs the AIA model group |
与空白组相比, AIA模型组大鼠踝关节组织中MMP1和MMP3蛋白表达水平显著升高(均P < 0.001)。PAE可显著下调AIA模型组大鼠中MMP1 (均P < 0.001, 图 7A)和MMP3 (均P < 0.001, 图 7B)蛋白异常表达, 且作用与阳性药MTX相比无显著性差异(均P > 0.05) (MMP1和MMP3表达在空白组与空白组+DMSO组, 以及AIA模型组和AIA模型+DMSO组中无显著性差异, 因此, 1%浓度的DMSO对AIA大鼠踝关节组织中两种蛋白表达水平的影响可忽略不计)。

|
Figure 7 Modulatory effects of PAE on the expression of matrix metalloproteinase-1 (MMP1, A) and matrix metalloproteinase-3 (MMP3, B) in the ankle tissues of AIA rats. n = 5, x± s. ###P < 0.001 vs the normal control group (Con); ***P < 0.001 vs the AIA model group |
RA在全球范围内有5%的高发病率, 患者通常表现为滑膜炎症、关节肿胀、骨和软骨破坏等, 其生活质量受到严重影响[2]。PAE是中药白芍的主要活性成分, 具有抗炎和免疫等多种生物学功能[6]。已有研究表明, PAE不仅通过抑制成纤维滑膜细胞增生, 调节IL-1、PGE2、IL-6、VEGF、G蛋白和COX-2的表达[26], 还可以作用于mTOR信号通路, 从而起到抑制关节炎大鼠的炎症反应和缓解疾病严重度的作用[27]。然而, 现阶段PAE抗RA作用机制尚未被完全阐明。本课题组前期研究发现, 含有白芍的治疗寒痹经方WTD对于RA具有一定的病情改善作用, 且其机制可能是通过扭转神经-内分泌-免疫系统失衡和调节RA关键病理环节相关的MMP1/MMP13、IL-1β/TNF-α和HIF-1α/VEGF信号轴来实现的[28]。PPAR-γ共激活因子介导的产热通路可能是WTD发挥其热药性, 从而缓解寒证RA的潜在作用靶点之一[19]。在上述研究的基础上, 本研究旨在结合网络药理学分析、分子对接虚拟计算和实验验证, 探索PAE发挥抗RA的潜在分子机制。
“网络药理学”是一种对药物多靶点和多途径形成的相互作用的研究策略, 从药物靶标和疾病间相互作用的整体性和系统性出发, 在疾病-基因-药物多层次网络的基础上, 研究药物作用于机体的生物学基础, 是中医药现代化研究的有力工具[29]。本研究首先基于网络药理学研究策略, 构建了白芍候选靶标-已知RA相关基因相互作用网络, 并筛选出白芍干预RA相关失衡网络的关键候选靶标。通路富集发现白芍的关键候选靶标显著富集于多条与RA病理环节相关通路, 如Toll样受体信号通路、RA信号通路、T细胞受体信号通路和破骨细胞分化通路等, 其中包括与软骨破坏相关的IL1B-TNF-TLR2-JUN-MMP1-MMP3通路。此信号通路中的成员蛋白质, 尤其是MMP1和MMP3, 与RA病理进程中的软骨破坏紧密相关。MMPs属于锌依赖性肽链内切酶超家族成员, 是通过降解基底膜和细胞外基质蛋白引起RA患者成纤维滑膜细胞浸润的主要蛋白酶, 在正常关节组织中有低表达, 而在关节炎组织中的表达剧增[30, 31]。MMPs的异常表达是引起RA的主要病理变化, 即软骨损伤的重要因素。其中。MMP1和MMP3是与RA患者软骨破坏相关的主要MMPs[32]。MMP1属于胶原酶亚族成员, 是特异性降解Ⅱ型胶原的关键酶, 引起软骨基质降解和损伤[33]。MMP3属于基质溶解酶家族成员, 主要降解蛋白多糖和纤连蛋白等软骨基质成分, 促进破骨细胞吸收。它还可活化促MMP1、MMP9和MMP13等其他MMP酶原[34]。MMP1和MMP3的表达水平能够反映关节炎病变和软骨破坏程度[35]。RA受累关节中的多种炎症因子TNF-α和IL-1β等可诱导MMPs分泌[36]。MMPs的生成也受丝裂原激活蛋白激酶类等信号转导通路调节, 其中, c-Jun氨基端激酶在RA滑膜中被激活, 在调节MMPs相关基因表达中发挥重要作用[37]。TLR2属于Toll样受体家族, 是一类表达于免疫细胞和成纤维滑膜细胞中的免疫受体蛋白, 它也可以通过参与炎性因子和MMP的释放促进炎症, 是引起RA关节破坏的重要介质, 抑制其表达可缓解关节炎大鼠疾病严重度[38, 39]。有临床研究表明, 白芍总苷胶囊联合MTX可显著降低RA患者血清MMP1、MMP3、MMP9和MMP13表达水平, 治疗RA疗效显著[40]。青藤碱配伍白芍可下调关节炎模型大鼠血清中TNF-α和IL-1β含量, 以及骨组织中其他MMPs (MMP2和MMP9)表达水平, 改善大鼠关节损伤[41]。
在上述网络药理学发掘所得白芍抗RA作用靶标的基础上, 本研究运用分子对接虚拟计算来探究白芍所含主要成分PAE与软骨破坏相关IL1B-TNF-TLR2-JUN-MMP1-MMP3信号通路中相关蛋白的结合能力。分子对接是一种预测蛋白质与配体结合能力和结合模式的计算工具, 其原理是基于蛋白质与小分子配体间相互作用的“锁-匙模型”, 计算并预测配体在蛋白活性位点的构象和取向, 从而判断其结合程度, 在药物生物体内靶标预测中发挥重要作用[42, 43]。SystemsDock和AutoDock是两种较为常用的分子对接方法。SystemsDock是一种基于网络药理学预测和分析的网络服务器, 运用高精度对接模拟和分子通路映射来表征配体的选择性和对复杂分子网络的作用模式。具有操作简易、预测方法考虑全面和预测结果准确度高的特点[15, 24]。AutoDock由Scripps研究所开发, 运用拉马克遗传算法和模拟退火来探求蛋白质与配体间的最佳结合位置, 并依照半经验自由能函数评估对接结果, 耗时久, 但精度很高[44]。本研究中, 运用SystemsDock和AutoDock两种分子对接工具均发现PAE与IL1B-TNF-TLR2-JUN-MMP1-MMP3信号通路中的MMP1和MMP3蛋白有很高的亲和力(SystemsDock scores均大于5.0; AutoDock scores均小于-5.0)。因此, 本研究选择MMP1和MMP3作为拟验证靶点。进一步, 基于AIA大鼠模型的实验验证揭示, PAE对AIA大鼠关节炎严重度有明显改善作用, 并可显著抑制AIA大鼠受累踝关节组织中MMP1和MMP3蛋白的异常表达升高, 表明PAE可通过调控MMP1和MMP3的表达量发挥其缓解RA进展中软骨损伤的药效, 这也进一步印证了上述网络药理学分子和分子对接虚拟计算的准确性和可靠性。
综上, 本研究采用网络药理学分析、分子对接虚拟计算和基于AIA大鼠模型的实验验证相结合的研究策略, 发现PAE可显著改善AIA大鼠的疾病严重度, 其机制与其对IL1B-TNF-TLR2-JUN-MMP1-MMP3通路的调节有关。相关研究结果将为白芍以及PAE的抗RA药理作用提供理论依据, 也为中药抗炎活性成分的机制研究提供方法学参考。
| [1] | Myasoedova E, Crowson CS, Kremers HM, et al. Is the incidence of rheumatoid arthritis rising?: results from Olmsted County, Minnesota, 1955-2007[J]. Arthritis Rheum, 2010, 62: 1576–1582. DOI:10.1002/art.27425 |
| [2] | Abbasi M, Mousavi MJ, Jamalzehi S, et al. Strategies toward rheumatoid arthritis therapy; the old and the new[J]. J Cell Physiol, 2019, 234: 10018–10031. DOI:10.1002/jcp.27860 |
| [3] | Viatte S, Barton A. Genetics of rheumatoid arthritis susceptibility, severity, and treatment response[J]. Semin Immunopathol, 2017, 39: 395–408. DOI:10.1007/s00281-017-0630-4 |
| [4] | Aletaha D, Smolen JS. Diagnosis and management of rheumatoid arthritis: a review[J]. JAMA, 2018, 320: 1360–1372. DOI:10.1001/jama.2018.13103 |
| [5] | Yu XR, Cao F, Chen ZY. Application progress of TGP in autoimmune diseases[J]. Acta Chin Med Pharmacol (中医药学报), 2019, 47: 127–130. |
| [6] | Su J, Zhang P, Zhang JJ, et al. Effects of total glucosides of paeony on oxidative stress in the kidney from diabetic rats[J]. Phytomedicine, 2010, 17: 254–260. DOI:10.1016/j.phymed.2009.07.005 |
| [7] | Zhang LL, Wei W, Wang P, et al. Paeoniflorin suppresses inflammatory mediator production and regulates G protein-coupled signaling in fibroblast-like synoviocytes of collagen induced arthritic rats[J]. Inflamm Res, 2008, 57: 388–395. DOI:10.1007/s00011-007-7240-x |
| [8] | Lai X, Wei J, Ding X. Paeoniflorin antagonizes TNF-α-induced L929 fibroblastoma cells apoptosis by inhibiting NF-κBp65 activation[J]. Dose Response, 2018, 16: 1559325818774977. |
| [9] | Wishart DS, Knox C, Guo AC, et al. DrugBank: a knowledgebase for drugs, drug actions and drug targets[J]. Nucleic Acids Res, 2008, 36: D901–D906. DOI:10.1093/nar/gkm958 |
| [10] | Hamosh A, Scott AF, Amberger JS, et al. Online Mendelian inheritance in man (OMIM), a knowledgebase of human genes and genetic disorders[J]. Nucleic Acids Res, 2005, 33: D514–D517. |
| [11] | Becker KG, Barnes KC, Bright TJ, et al. The genetic association database[J]. Nat Genet, 2004, 36: 431–432. DOI:10.1038/ng0504-431 |
| [12] | Wixon J, Kell D. The Kyoto encyclopedia of genes and genomes—KEGG[J]. Yeast, 2000, 17: 48–55. |
| [13] | G Jr Dennis, Sherman BT, Hosack DA, et al. DAVID: database for annotation, visualization, and integrated discovery[J]. Genome Biol, 2003, 4: P3. DOI:10.1186/gb-2003-4-5-p3 |
| [14] | Huang DW, Sherman BT, Lempicki RA. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nat Protoc, 2009, 4: 44–57. DOI:10.1038/nprot.2008.211 |
| [15] | Hsin KY, Matsuoka Y, Asai Y, et al. systemsDock: a web server for network pharmacology-based prediction and analysis[J]. Nucleic Acids Res, 2016, 44: W507–W513. DOI:10.1093/nar/gkw335 |
| [16] | Trott O, Olson AJ. AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading[J]. J Comput Chem, 2010, 31: 455–461. |
| [17] | Hsin KY, Ghosh S, Kitano H. Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J]. PLoS One, 2013, 8: e83922. DOI:10.1371/journal.pone.0083922 |
| [18] | Morris GM, Huey R, Olson AJ. Using AutoDock for ligand-receptor docking[J]. Curr Protoc Bioinformatics, 2008, Chapter 8: Unit 8. 14. |
| [19] | Zhang Y, Mao X, Guo Q, et al. Pathway of PPAR-gamma coactivators in thermogenesis: a pivotal traditional Chinese medicine-associated target for individualized treatment of rheumatoid arthritis[J]. Oncotarget, 2016, 7: 15885–15900. |
| [20] | Guo Q, Mao X, Zhang Y, et al. Guizhi-Shaoyao-Zhimu decoction attenuates rheumatoid arthritis partially by reversing inflammation-immune system imbalance[J]. J Transl Med, 2016, 14: 165. DOI:10.1186/s12967-016-0921-x |
| [21] | Brenner M, Meng HC, Yarlett NC, et al. The non-major histocompatibility complex quantitative trait locus Cia10 contains a major arthritis gene and regulates disease severity, pannus formation, and joint damage[J]. Arthritis Rheum, 2005, 52: 322–332. DOI:10.1002/art.20782 |
| [22] | Mossiat C, Laroche D, Prati C, et al. Association between arthritis score at the onset of the disease and long-term locomotor outcome in adjuvant-induced arthritis in rats[J]. Arthritis Res Ther, 2015, 17: 184. DOI:10.1186/s13075-015-0700-8 |
| [23] | Shinoda K, Hruby VJ, Porreca F. Antihyperalgesic effects of loperamide in a model of rat neuropathic pain are mediated by peripheral delta-opioid receptors[J]. Neurosci Lett, 2007, 411: 143–146. DOI:10.1016/j.neulet.2006.10.027 |
| [24] | Baddack-Werncke U, Busch-Dienstfertig M, González-Rodríguez S, et al. Cytotoxic T cells modulate inflammation and endogenous opioid analgesia in chronic arthritis[J]. J Neuroinflammation, 2017, 14: 30. DOI:10.1186/s12974-017-0804-y |
| [25] | Bardin L, Malfetes N, Newman-Tancredi A, et al. Chronic restraint stress induces mechanical and cold allodynia, and enhances inflammatory pain in rat: relevance to human stress-associated painful pathologies[J]. Behav Brain Res, 2009, 205: 360–366. DOI:10.1016/j.bbr.2009.07.005 |
| [26] | Zhu L, Wei W, Zhen YQ. Effect and mechanism of action of total glucosides of paeony on synoviocytes from rats with collagen-induced arthritis[J]. Acta Pharm Sin (药学学报), 2006, 41: 166–170. |
| [27] | Zheng YQ, Wei W, Zhu L, et al. Effects and mechanisms of paeoniflorin, a bioactive glucoside from paeony root, on adjuvant arthritis in rats[J]. Inflamm Res, 2007, 56: 182–188. DOI:10.1007/s00011-006-6002-5 |
| [28] | Zhang Y, Bai M, Zhang B, et al. Uncovering pharmacological mechanisms of Wu-tou decoction acting on rheumatoid arthritis through systems approaches: drug-target prediction, network analysis and experimental validation[J]. Sci Rep, 2015, 5: 9463. DOI:10.1038/srep09463 |
| [29] | Hopkins AL. Network pharmacology[J]. Nat Biotechnol, 2007, 25: 1110–1111. DOI:10.1038/nbt1007-1110 |
| [30] | Konttinen YT, Ainola M, Valleala H, et al. Analysis of 16 different matrix metalloproteinases (MMP-1 to MMP-20) in the synovial membrane: different profiles in trauma and rheumatoid arthritis[J]. Ann Rheum Dis, 1999, 58: 691–697. DOI:10.1136/ard.58.11.691 |
| [31] | Yoshihara Y, Nakamura H, Obata K, et al. Matrix metalloproteinases and tissue inhibitors of metalloproteinases in synovial fluids from patients with rheumatoid arthritis or osteoarthritis[J]. Ann Rheum Dis, 2000, 59: 455–461. DOI:10.1136/ard.59.6.455 |
| [32] | Cawston T. Matrix metalloproteinases and TIMPs: properties and implications for the rheumatic diseases[J]. Mol Med Today, 1998, 4: 130–137. DOI:10.1016/S1357-4310(97)01192-1 |
| [33] | Goldring MB. The role of the chondrocyte in osteoarthritis[J]. Arthritis Rheum, 2000, 43: 1916–1926. DOI:10.1002/1529-0131(200009)43:9<1916::AID-ANR2>3.0.CO;2-I |
| [34] | Nagase H. Activation mechanisms of matrix metalloproteinases[J]. Biol Chem, 1997, 378: 151–160. |
| [35] | Tseng WY, Huang YS, Chiang NY, et al. Increased soluble CD4 in serum of rheumatoid arthritis patients is generated by matrix metalloproteinase (MMP)-like proteinases[J]. PLoS One, 2013, 8: e63963. DOI:10.1371/journal.pone.0063963 |
| [36] | Wong CK, Chen DP, Tam LS, et al. Effects of inflammatory cytokine IL-27 on the activation of fibroblast-like synoviocytes in rheumatoid arthritis[J]. Arthritis Res Ther, 2010, 12: R129. DOI:10.1186/ar3067 |
| [37] | Hammaker DR, Boyle DL, Inoue T, et al. Regulation of the JNK pathway by TGF-beta activated kinase 1 in rheumatoid arthritis synoviocytes[J]. Arthritis Res Ther, 2007, 9: R57. DOI:10.1186/ar2215 |
| [38] | Page K, Ledford JR, Zhou P, et al. A TLR2 agonist in German cockroach frass activates MMP-9 release and is protective against allergic inflammation in mice[J]. J Immunol, 2009, 183: 3400–3408. DOI:10.4049/jimmunol.0900838 |
| [39] | Joosten LA, Koenders MI, Smeets RL, et al. Toll-like receptor 2 pathway drives streptococcal cell wall-induced joint inflammation: critical role of myeloid differentiation factor 88[J]. J Immunol, 2003, 171: 6145–6153. DOI:10.4049/jimmunol.171.11.6145 |
| [40] | Zhen N, Lu HQ, Lan SM, et al. Influence of total glucosides of paeony on serum levels of MMPs expression in patients with different syndromes of rheumatoid arthritis[J]. Pharm Today (今日药学), 2015, 25: 781–783. |
| [41] | Gu J. The Therapeutic Effects And Molecular Mechanism of Caulis Sinomenii In Combination With Radix Paeoniae Alba In The Treatment of Rheumatoid Arthritis With Cold Syndrome (青风藤配伍白芍对类风湿关节炎风寒湿痹证的作用及机制研究)[D]. Hunan: Hunan university of traditional Chinese medicine, 2016. |
| [42] | Zhou G, Liang GC, Han XY, et al. Synthesis, biological activity and molecular docking research of N-{[(4-oxo-thiochroman-3-yl) phenyl]-methy} acetamide derivatives as α-glucosidase inhibitors[J]. Acta Pharm Sin (药学学报), 2016, 51: 93–99. |
| [43] | Song XL, Zhou W, Chen Chao, et al. Study on material base of Ligusticum wallichii for treating brain ischemia and its molecular mechanism based on molecular docking[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 2195–2198. |
| [44] | Qi XB, Zhen H, Fang HS. Research progress on the docking of polypeptide and proteins[J]. Comp Applied Chem (计算机与应用化学), 2010, 27: 747–750. |
 2019, Vol. 54
2019, Vol. 54


