2. 中国中医科学院中药研究所, 北京 100700;
3. 天津国际生物医药联合研究院, 中药新药研发中心, 天津 300457
2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
3. Tianjin International Biomedical Research Institute, Chinese Medicine New Drug Research and Development Center, Tianjin 300457, China
随着人们生活水平的提高和人口老龄化的加剧, 心脑血管疾病已成为危害人类健康的第一杀手, 全世界每年死于心脑血管疾病的人数高达数千万。血栓的形成在心脑血管疾病的发生和发展中起着重要的作用, 而血小板功能的异常是导致血栓形成的核心因素。血小板是从骨髓成熟的巨核细胞胞浆脱落下来的小块胞质, 在血栓和止血、炎症和免疫、动脉粥样硬化及肿瘤转移中起重要作用[1-4]。黏附、聚集、分泌是血小板的三大基本功能, 血小板与非血小板表面的黏着称为血小板黏附, 由病理因素引起的血小板过度活化可促进血小板与内皮细胞及细胞外基质的黏附从而引起血栓性疾病。血小板表面富含的各种糖蛋白在血小板的黏附中具有重要作用, 血小板在未活化的情况下, 糖蛋白GPIIb/IIIa以静息血小板的低亲和力构像形式存在, 其可结合固定的且不可溶的纤维蛋白原[5]; 当受到一些外界因素如作用于ADP或凝血酶等G-蛋白偶联受体(G protein coupled receptors, GPCRs)的诱导剂刺激时, 信号由内向外传导, 导致GPIIb/IIIa构象从低亲和力状态到高亲和力状态发生变化, GPIIb/IIIa的激活使得能够结合可溶性血浆蛋白, 包括血管性血友病因子(von Willebrand factor, vWF)、纤维蛋白和主要的GPIIb/IIIa配体纤维蛋白原[6-8], 从而诱发血小板黏附。
目前市场上抗血小板药物如环氧化酶抑制剂阿司匹林、P2Y12抑制剂氯吡格雷和糖蛋白GPIIb/IIIa抑制剂阿昔单抗在降低动脉血栓形成相关疾病方面具有显著效果, 然而这些药物具有一定的不良反应, 如常见阿司匹林抵抗(aspirin resistance, AR)[9, 10]及胃肠道出血等现象的发生。活血化瘀中药在血液流变学、血液黏度、血小板功能、抗凝、保护血管及内皮细胞等方面具有重要的作用[11], 同时具有多成分、多途径、多靶点且不良反应少等优点[12]。而血小板的黏附作为血栓形成的始发阶段发挥着重要作用, 因此通过抗血小板黏附介导的血栓形成来从常用的活血化瘀中成药中寻找最佳的中药配伍组合并研究其分子机制的方法[13], 对未来临床上活血化瘀类中药抗血小板黏附和抗血栓治疗的合理用药具有重要的指导意义。
材料与方法实验动物 SD (Sprague-Dawley)雄性大鼠, SPF级, 10只, 体重220~260 g, 购自那瑞增(天津)生物科技有限公司提供, 合格证: SCXK (京) 2009-0004。动物的使用经天津国际生物医药联合研究院动物伦理委员会批准, 符合伦理审查标准。
试剂 二磷酸腺苷、凝血酶(牛源)、纤维蛋白原(人源)、前列腺素E1 (prostaglandin E1, PGE1)、乙二醇双(2-氨基乙基醚)四乙酸(ethylene glycol-bis (2-amino-ethylether)-N, N, N, N-tetraacetic acid, EGTA)、氢氧化钠(NaOH)、氯化钙(CaCl2)、柠檬酸(Citrate acid)、三羟甲基氨基甲烷(Tris base)、葡萄糖(D-(+) glucose)、磷酸氢二钾(KH2PO4)、氯化镁(MgCl2)、碳酸氢钠(NaHCO3)、柠檬酸钠(sodium citrate)、氯化钠(NaCl) (美国Sigma公司, 货号分别为M3763、T4648、F3879、P5515、E3889、S8045、C5670、C8610、T8060、G8270、P5655、M8266、S5761、C8532、S5886);聚乙二醇辛基苯基醚(Triton X-100)、牛血清白蛋白(bovine serum albumin, BSA) (北京索莱宝科技有限公司, 货号分别为T8200, A8020);对硝基苯磷酸(p-nitropheny1 phosphate disodium, pNPP) (上海生工生物工程股份有限公司, 货号为A610365-0005);水合氯醛(上海国药集团化学试剂有限公司, 货号为30037517); 0.9%生理盐水(山东华鲁, 货号为20120422)。
方剂来源 本实验室前期构建了活血化瘀复方中成药提取物库[14, 15], 共包含58种市售活血化瘀中成药, 根据剂型分为C胶囊剂(capsules) 19种, T片剂(tablets) 16种, D滴丸(dropping pills) 2种, P丸剂(pills) 8种, G颗粒剂(granules) 5种, I注射剂(injections) 8种。具体如下: C-1参松养心胶囊(北京以岭药业, 批号1108021); C-2康尔心胶囊(长春银诺克药业, 批号20110311); C-3抗栓胶囊(哈尔滨大洋制药, 110901); C-4利脑心胶囊(吉林敖东延边药业, 批号1110002); C-5脑络通胶囊(四川泰华堂制药, 批号120101); C-6芪苈强心胶囊(石家庄以岭药业, 批号111202); C-7天丹通络胶囊(山东凤凰制药, 批号1109224); C-8通心络胶囊(石家庄以岭药业, 批号110939); C-9心可宁胶囊(吉林金宝药业, 批号110601); C-10心可舒胶囊(山东沃华医药科技, 批号110202); C-11心脑康胶囊(长春银诺克药业, 批号20120104); C-12血府逐瘀胶囊(天津宏仁堂药业, 批号B03020); C-13步长脑心通胶囊(陕西咸阳步长制药, 批号111186); C-14灯盏生脉胶囊(云南生物谷灯盏花药业, 批号20120905); C-15逐瘀通脉胶囊(哈药集团三精千鹤制药, 批号20121002); C-16脑安胶囊(辽源誉隆亚东药业, 批号120101); C-17血栓心脉宁胶囊(吉林华康药业, 批号120910); C-18正心泰胶囊(贵州百祥制药, 批号20120701); C-19复方血栓通胶囊(广东众生药业, 批号120821); T-1丹七片(天津同仁堂, 批号B89001); T-2复方丹参片(北京) (北京同仁堂, 批号12126606); T-3复方丹参片(云南) (云南白药, 批号20110477); T-4冠脉宁片(长春万德制药, 批号20120202); T-5活血通脉片(云南省玉溪市维和制药, 批号120367); T-6精制冠心片(河南华茸堂药业, 批号211002); T-7脑得生片(哈尔滨华雨制药, 批号20120302); T-8脑血栓片(吉林龙泰制药, 批号20111101); T-9消栓通络片(北京同仁堂, 批号1124634); T-10心可舒片(山东沃华医药, 批号110606); T-11养心氏片(青岛国风药业, 批号110616); T-12脂降宁片(通化金恺威药业, 批号120103); T-13冠脉通片(天津同仁堂, 批号82001); T-14荷丹片(南昌济顺制药, 批号20121006); T-15通脉降脂片(吉林百姓堂药业, 批号20120401); T-16血府逐瘀片(陕西海天制药, 批号120801); D-1复方丹参滴丸(天津天士力制药, 批号111123); D-2芪参益气滴丸(天津天士力制药, 批号120509); P-1华佗再造丸(广州奇星药业, 批号1426); P-2活心丸(广东白云山制药, 批号1120001); P-3人参再造丸(吉林天强制药, 批号111201); P-4消栓再造丸(北京同仁堂, 批号1013528); P-5血府逐瘀丸(药都制药, 批号120413); P-6通脉养心丸(天津中新药业乐仁堂制药, 批号B107253); P-7心宝丸(广东心宝制药, 批号20120501); P-8益心丸(广东万年青制药, 批号110905); G-1乐脉颗粒(四川川大华西药业, 批号120114); G-2通脉颗粒(修正药业, 批号111110); G-3血府逐瘀颗粒(江苏晨牌药业, 批号110926); G-4稳心颗粒(山东步长制药, 批号120821); G-5丹芎通脉颗粒(成都恩威药业, 批号1111002); I-1丹红注射液(菏泽步长制药, 批号13081025); I-2香丹注射液(湖北天圣康迪制药, 批号20120404); I-3疏血通注射液(牡丹江友搏药业, 批号11111122); I-4醒脑静注射液(大理药业, 批号1112091); I-5脉络宁注射液(南京金陵制药厂, 批号20111006); I-6血必净注射液(天津红日药业, 批号1207161); I-7参附注射液(雅安三九药业, 批号110804); I-8参麦注射液(正大青春宝药业, 批号1107201)。
药物配制 根据徐叔云教授主编的《药理实验方法学》[16]中“大鼠的等效剂量=人口服剂量/体重×6.3 (人体重: 60 kg)”换算公式计算中成药母液浓度。药物均溶解于双蒸水中, 振荡溶解后超声30 min, 再次涡旋振荡直至无大颗粒或团块。室温离心(10 000 r·min-1, 10 min), 吸取上清后二次室温离心(10 000 r·min-1, 10 min), 吸取上清为母液作为储液备用, 工作液浓度为储液浓度的1/40。
血小板制备 SD大鼠腹腔注射10%水合氯醛(0.35 mL/100 g)麻醉, 用装有10%~15% ACD (38 mmol·L-1柠檬酸, 75 mmol·L-1柠檬酸钠, 124 mmol·L-1葡萄糖)溶液的10 mL无菌注射器以腹主动脉分叉处向近心端1~3 mm处穿刺取血。全血室温200×g离心10 min, 取上清分离得富血小板血浆(PRP), 加入1 μmol·L-1前列腺素E1 (抑制血小板在操作中由于环境变化、振荡等原因引起的自身活化), 室温孵育10 min, 800×g离心10 min后将血小板重悬于Buffer A缓冲液(130.0 mmol·L-1氯化钠, 10 mmol·L-1柠檬酸, 9 mmol·L-1碳酸氢钠, 6 mmol·L-1葡萄糖, 0.9 mmol·L-1氯化镁, 0.8 mmol·L-1磷酸氢二钾, 10 mmol·L-1三羟甲基氨基甲烷, 调pH≈7.4)中, 调节血小板密度为每毫升1×108个, 稀释5倍后待用。
抗血小板黏附高通量活性筛选 纤维蛋白原(0.1 mg·mL-1)用0.9%生理盐水于37 ℃水浴溶解后, 均匀地铺到96孔板中(每孔50 μL), 适度振荡, 室温放置30 min, 4 ℃冰箱包被过夜。黏附实验开始前吸出纤维蛋白原溶液用磷酸盐缓冲液(PBS)洗2遍, 用1% BSA (每孔50 μL)室温封闭1 h阻断非特异性黏附, 再用PBS洗板2遍。把58种活血化瘀中成药和阳性药EGTA分别与血小板37 ℃共孵育20 min后, 按照实验分组设置空白组、阴性组、阳性组、阳性药组(EGTA)和样品组分别加入96孔微孔板中(每组设置3个复孔), 除空白组和阴性组外其他组分别加入激动剂ADP (10 μmol·L-1)或凝血酶(0.1 U·mL-1)诱导血小板与纤维蛋白原于37 ℃孵箱进行黏附30 min, 如表 1。黏附反应结束后用PBS洗去未黏附的血小板, 再每孔加入显色溶液pNPP (0.1 mol·L-1柠檬酸钠, 5 mmol·L-1对硝基苯磷酸, 0.1%聚乙二醇辛基苯基醚, 调pH≈5.4) 150 μL, 室温静置1 h。用4 mol·L-1氢氧化钠(每孔50 μL)溶液终止显色反应, 反应产物用FlexStation® 3在波长为405 nm处检测OD值[17, 18]。根据公式:血小板黏附率=(OD样品组-OD空白组)/(OD阳性组-OD空白组)×100%;抑制率=100-(OD样品组-OD空白组)/(OD阳性组-OD空白组)×100%, 按照比色法显色反应对所得的数据进行定量处理。
| Table 1 Experimental grouping. "-" means no addition. EGTA: Ethylene glycol-bis (2-amino-ethylether)-N, N, N, N-tetraacetic acid |
数据处理和统计学分析方法 数据处理采用Origin 8.5软件, 对数据进行绘制。统计学分析采用SPSS 17.0软件, 对数据进行单因素方差分析(one-way ANOVA), 运用LSD检验方法对数据进行显著性分析, 设置不同的显著性水平: *P < 0.05、**P < 0.01或***P < 0.001, 独立实验分别重复4次, 以Mean ± SEM表示。
数据分析 通过中医传承辅助平台(V2.0)中“方剂优化分析”功能, 对活血化瘀中成药进行组方规律分析, 根据系统中“数据查询”功能, 提取录入中成药的单味药频次统计、用药模式, 并可实现网络可视化展示。IPA以GPCRs介导的血小板黏附为模型进行检索, 获取识别到的中药单体及相关分子靶点, 然后二者进行“Path Explorer”作用关系分析, 并通过“Canonical Pathways”功能分析与血小板黏附相关的通路及蛋白互作获取关键靶点。
分子对接验证 首先通过Chembiodraw和OpenBabel软件绘制配体化合物的三维结构, 其次在RCSB (http://www.rcsb.org/pdb/home/home.do)蛋白数据库中获得已发表且含配体的靶蛋白晶体结构, 并定义其蛋白的结合口袋, 在Pymol软件上显示小分子配体与探针进行的形状相似性的结构匹配及互补(氢键的受体、供体以及疏水位点也结合在一起), 最后依次将靶蛋白和配体分子输入Autodock4.2 (http://autodock.scripps.edu/)软件中, 按默认参数进行分子对接, 得到对应化合物的不同对接能量值。根据结合自由能越小, 配体与受体结合越稳定的原理, 取对接能量最低值的构象, 并与原有的配体对接值进行比对, 且使均方根偏差(root-mean-square deviation, RMSD)的变化尽可能小。
结果 1 活血化瘀中成药抑制ADP诱导的体外血小板黏附活性比较以剂型的不同对58种市售活血化瘀中成药进行分组, 比较在ADP诱导体外血小板黏附下的作用, 在有统计学意义的前提下, 如图 1所示, 58种市售中成药中有50.0%的中成药能够抑制ADP诱导的体外血小板黏附, 6.9%的中成药促进ADP诱导的体外血小板黏附。其中抑制效果较强的中成药为: G-5 (丹芎通脉颗粒, 抑制率96.5%); P-5 (血府逐瘀丸, 抑制率89.7%); G-1 (乐脉颗粒, 抑制率79.4%)。
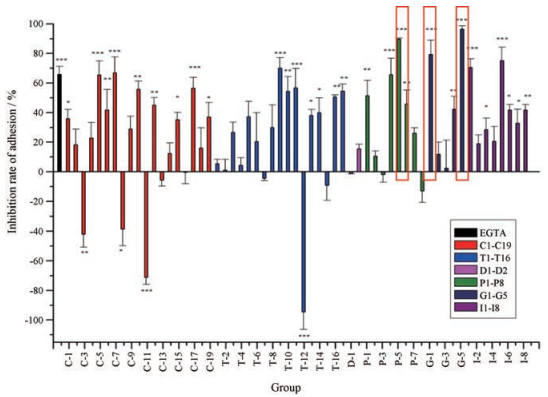
|
Figure 1 Comparison of adenosine diphosphate-induced platelet adhesion activities in vitro of 58 PBCRBS Chinese patent medicines. C1-C19: Capsules 1-19; T1-T16: Tablets 1-16; D1-D2: Dripping pills 1-2; P1-P8: Pills 1-8; G1-G5: Granules 1-5; I1-I8: Injections 1-8. Red frames indicated the three Chinese patent medicines with the highest inhibition rate of adhesion. n = 4, mean ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 vs exciting group. PBCRBS: Promoting blood circulation and removing blood stasis |
以剂型的不同对58种市售活血化瘀中成药进行分组, 比较在凝血酶诱导体外血小板黏附下的作用, 在有统计学意义的前提下, 如图 2所示, 58种市售中成药中有96.6%的中成药能够抑制凝血酶诱导的体外血小板黏附, 其中抑制效果较强的中成药为: I-5 (脉络宁注射液, 抑制率99.3%); T-10 (心可舒片, 抑制率98.9%); G-1 (乐脉颗粒, 抑制率98.2%)。
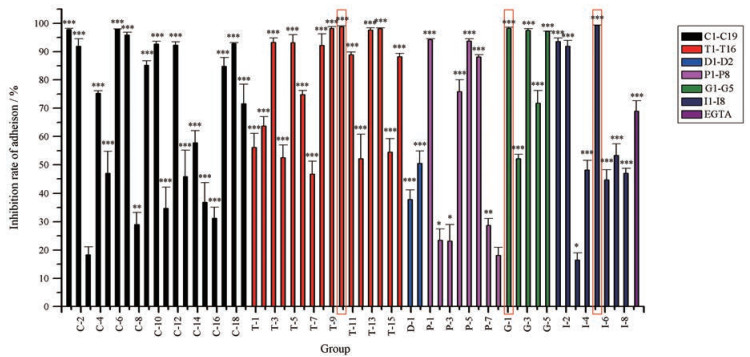
|
Figure 2 Comparison of thrombin-induced platelet adhesion activities in vitro of 58 PBCRBS Chinese patent medicines. Red frames indicated the three Chinese patent medicines with the highest inhibition rate of adhesion. n = 4, mean ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 vs exciting group |
收集抑制GPCRs介导的体外血小板黏附活性排前20的中成药, 其中共含93种不同的单味药, 如表 2。排名前10的单味药频次统计结果显示, 无论在抑制ADP还是凝血酶诱导的体外血小板黏附结果中, 丹参和川芎两味中药出现频率都是最高的, 如表 3。
| Table 2 Ranking of anti-platelet adhesion activities of the top 20 PBCRBS Chinese patent medicines |
| Table 3 Frequency statistics of single-herbs in the top 20 PBCRBS Chinese patent medicines with superior activities (The red indicates herbs to be focused in the following analysis) |
活血化瘀组方配伍规律结果显示, 抑制GPCRs (ADP和凝血酶)介导的体外血小板黏附活性排前20的共有28种活血化瘀中成药, 共包含93种不同的单味药, 其中配伍使用最多的是丹参-川芎, 如表 4。同时含有这2味药的代表中成药有丹芎通脉颗粒、乐脉颗粒、消栓通络片、天丹通络胶囊等。
| 表 4 Co-appearance frequency of the top 20 PBCRBS Chinese patent medicines with superior activities. support number 6, confidence 0.9 (The red indicates herbal pairs to be focused in the following analysis) |
通过设置不同的支持度, 既能体现不同药物组合间的特征, 又能显示药物间的核心组合。分别对抑制ADP (图 3A)、凝血酶(图 3B)、ADP和凝血酶(图 3C)诱导的体外血小板黏附活性较好的前20种活血化瘀中成药核心药物组合进行深度分析, 结果显示, 随着支持度的增加, 可以明显看出对于抑制ADP和凝血酶诱导的体外血小板黏附的活血化瘀组方中丹参-川芎之间的配伍关系, 随着支持度的递减除了活血化瘀中药丹参和川芎外, 一些补气、行气、清热等药物的配伍也得以体现。
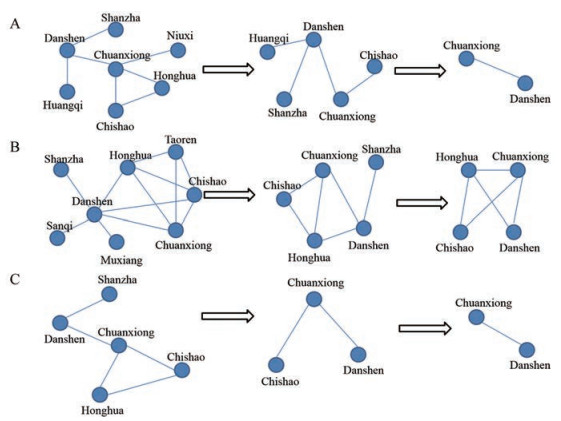
|
Figure 3 In-depth analysis of the core drug combinations of the top 20 PBCRBS Chinese patent medicines with superior activities. A: Adenosine diphosphate-induced platelet adhesion; B: Thrombin-induced platelet adhesion; C: Adenosine diphosphate and thrombin-induced platelet adhesion |
通过中医传承辅助平台对活性较好的活血化瘀中成药的数据挖掘分析, 不管是在用药频率还是在核心药物组合方面, 丹参和川芎都是最明显的。接下来运用IPA的“Path Explorer”进一步分析预测丹参-川芎抗血小板黏附的作用靶点, 得出两者所含的16个活性成分(丹参8个, 川芎10个)和10个血小板黏附相关的靶点之间协同网络关系, 如图 4A。由IPA的“Canonical Pathways”功能分析, 按照代表通路相关性的-Log P-value进行排序, 相关性较高的为动脉粥样硬化、神经炎症及趋化因子信号通路, 如图 4B。并通过蛋白互作分析出最为关键的3个靶点IL-1、APP和CCL2, 如图 4C。

|
Figure 4 Targets and related pathways for anti-platelet adhesion activity by Danshen and Chuanxiong components. A: Network relationship between active components of Danshen-Chuanxiong and platelet adhesion targets; B: Correlation sequencing of signal pathways; C: Key targets analysis |
利用计算化学中的分子对接技术, 对分析出的丹参和川芎中共有活性化合物绿原酸与靶点CCL2进行了配体-受体分子相互作用验证。选择经验自由能函数和遗传算法, 通过靶蛋白活性口袋准备和配体分子对接, 分子对接的格点为40×40×38, 格点间距为0.375 Å, 形成的空间体积为22 800 Å3, 每次扫描进行50次独立的对接操作, 在0.1 nm RMSD标准下分组, 选取对接操作次数最多的分组中结合能最低的构象, 分析其合理性, 最终得到CCL2与绿原酸相互作用的结合位点。如图 5A显示了CCL2表面的势能分布。图 5B显示了结合的活性口袋中, 绿原酸通过与CCL2第28位的天冬酰胺(Asn-28)、第42位的酪氨酸(Tyr-42)和第44位的甘氨酸(Gly-44)可形成稳定的氢键, 相应的原子距离分别为2.4 Å、3.1 Å、3.5 Å和2.8 Å, 证实了绿原酸与CCL2的分子相互作用关系。

|
Figure 5 Autodock and binding sites analysis of CCL2 (PDB code: 2liq) and chlorogenic acid. A: CCL2 surface potential energy distribution; B: Stable hydrogen bond distribution of chlorogenic acid and CCL2 in binding pockets |
本课题组前期通过对搜集的224种活血化瘀中成药进行用药规律和网络药理分析, 发现抑制炎症相关分子及通路为含丹参、川芎和红花活血化瘀中成药抗血栓作用的关键机制[14]。在此基础上, 本研究更加深入地以血栓形成的关键环节血小板黏附为模型, 将技术与理论结合, 通过对58种市售活血化瘀中成药体外抗血小板黏附进行活性筛选和用药规律分析, 进一步探究抗血小板黏附的最佳中药配伍组合及分子机制。结果显示, 大多数的活血化瘀中成药能够抑制凝血酶诱导的体外血小板黏附, 但对于ADP诱导的体外血小板黏附, 部分中成药却表现出促进作用。一是可能因为对于这些中成药来说, 给药浓度偏高, 造成血小板的物理吸附或毒性; 二是影响血栓形成有3种主要因素, 这些中成药虽然没有体现抗血小板与细胞外基质纤维蛋白原黏附的活性, 但可能是通过降低血液凝固性或改变血流状态来发挥抗血栓的作用。对于本研究主要是筛选抗血小板黏附活性较好的活血化瘀中成药来分析其药用规律, 对于活性未体现的中成药在后续实验需进行更深入的研究。
多数验证药物在抗血栓作用时, 一般采用抗血小板聚集方法[19, 20]。但此方法需要的血小板量较多, 然而1只标准的大鼠提供的血小板量非常少, 若要进行高通量活性筛选花费成本较高。在本研究中采用了抗血小板黏附的筛选方法, 节约了时间和成本, 也有利于样本活性之间的平行对比, 为寻找中药组分中的活性单体提供了又一有效快捷的方法, 并且其还可以应用于血小板与血管性血友病因子或胶原的黏附[21-24]。
活血化瘀中成药具有通利血脉、促进血行、消散血瘀作用, 其处方组成多由古(经)方发展而来, 具有一定的用药规律[25, 26]。结合活性筛选和用药规律分析, 发现抗血小板黏附活性较好的活血化瘀中成药中, 丹参-川芎两味中药配伍使用最为频繁。丹参(Salvia miltiorrhiza Bge.)具有活血祛瘀, 通经止痛, 清心除烦, 凉血消痈之功效。在抗氧化、抗血栓、抗炎、调节高血压、减少动脉粥样硬化斑块等方面发挥重要作用[27]。川芎(Ligusticum chuanxiong Hort.)常用于活血行气, 祛风止痛, 行气开郁, 具有舒张血管、增加脑循环、降脂、抗血小板聚集等作用[28]。丹参为血中之静品, 川芎为血中之动品, 以行气为主, 二者配伍, 静中有动, 使人体内气血通畅运行[29]。临床上常以丹参、川芎合用治疗心脑血管疾病, 其代表方剂有冠心宁注射液、参芎胶囊、乐脉颗粒、丹参川芎嗪注射液等。其中冠心宁注射液由丹参、川芎两味药组成, 擅于活血化瘀, 通脉养心, 常用于冠心病心绞痛[30]和脑卒中[31]等心脑血管疾病[29]。此外, 以丹参素和川芎嗪为主要成分制成的丹参川芎嗪注射液, 可治疗闭塞性脑血管疾病, 如脑供血不全、脑血栓形成等及缺血性心血管疾病(如心绞痛、心肌梗塞、缺血性脑卒中等)。由此可见, 丹参-川芎合用在临床治疗血栓性心脑血管疾病具有良好的疗效。
Yildirim等[32]较早提出“网络药理学”观念, 通过分析药物与其靶点间的关系, 提出“多种药物可作用于同一靶点, 单一药物也可作用于多个靶点”的观点。关于中医一直以来所坚持的整体观和辨证观与中药多成分、多途径的特点以及方剂中君臣佐使、七情配伍等原则都与网络药理学的整体性、系统性存在一定的共性[33-36]。因此本研究使用了网络药理学对最佳配伍组合丹参-川芎的作用靶点及其通路进行了分析预测, 得出主要是通过调控动脉粥样硬化、神经炎症及趋化因子信号通路所涉及的IL-1、APP、CCL2等靶点来发挥抗血小板黏附作用。例如, 淀粉样前体蛋白APP是淀粉样蛋白Aβ肽的前体, 一般充当黏附受体可促进整合素活化进而介导细胞黏附。而在血小板中, 它主要调节凝血和静脉血栓形成, 当ADP或凝血酶诱导血小板的活化时, APP一般会促进其与固定Aβ肽的黏附, 导致Aβ肽在动脉粥样硬化斑块中不断累积, 进而形成血栓[37]。其次, 当内皮细胞完整的情况下, 血小板与内皮细胞基本不发生黏附反应, 但当内皮细胞受到凝血酶等刺激损伤后会释放IL-1等多种炎症因子, 这些因子会引起血小板膜上的黏附相关蛋白的高度表达, 从而引起血小板与受损的内皮细胞通过黏附蛋白发生黏附作用, 并且会增加促凝因子的释放, 抑制溶解纤维蛋白的活性, 从而也会造成血栓的形成[38, 39]。最后, 血栓和炎症的整合可导致血小板介导的白细胞募集, 在动脉粥样硬化壁的内皮细胞与平滑肌细胞共培养模型中, 白细胞中的单核细胞优先通过内皮细胞黏附血小板贴壁, 而单核细胞的特异性是通过内皮细胞产生趋化因子CCL2形成, CCL2可优先稳定血小板P-选择素从流动的全血中捕获单核细胞黏附[40]。以上也说明了丹参-川芎在发挥抗血小板黏附作用时3个关键的靶点密切相关。
综上所述, 本研究通过结合活性筛选和用药规律分析发现, 在抗血小板黏附方面活血化瘀中药丹参-川芎配伍使用最为频繁。进而对其发挥作用的相关通路和靶点进行网络分析, 得出通过调节IL-1、APP和CCL2等靶点介导的动脉粥样硬化、神经炎症和趋化因子信号通路可能为丹参-川芎药对抗血小板黏附的分子机制, 并且运用分子对接技术进一步验证了丹参-川芎中共有的活性化合物绿原酸与靶点CCL2间相互作用。为活血化瘀类中药以抗血小板黏附为靶标的抗血栓治疗策略提供配伍用药理论依据和作用机制参考。
| [1] | Coller BS, Shattil SJ. The GPⅡb/Ⅲa (integrin alphaⅡbbeta3) odyssey: a technology-driven saga of a receptor with twists, turns, and even a bend[J]. Blood, 2008, 112: 3011–3025. DOI:10.1182/blood-2008-06-077891 |
| [2] | Smyth SS, Woulfe DS, Weitz JI, et al. G-protein-coupled receptors as signaling targets for antiplatelet therapy[J]. Arterioscler Thromb Vasc Biol, 2009, 29: 449–457. DOI:10.1161/ATVBAHA.108.176388 |
| [3] | Boilard E, Nigrovic PA, Larabee K, et al. Platelets amplify inflammation in arthritis via collagen-dependent microparticle production[J]. Science, 2010, 327: 580–583. DOI:10.1126/science.1181928 |
| [4] | Leslie M. Beyond clotting: the powers of platelets[J]. Science, 2010, 328: 562–564. DOI:10.1126/science.328.5978.562 |
| [5] | Niiya K, Hodson E, Bader R, et al. Increased surface expression of the membrane glycoprotein Ⅱb/Ⅲa complex induced by platelet activation. Relationship to the binding of fibrinogen and platelet aggregation[J]. Blood, 1987, 70: 475–483. DOI:10.1182/blood.V70.2.475.475 |
| [6] | Bennett JS. Structure and function of the platelet integrin alphaⅡbbeta3[J]. J Clin Invest, 2005, 115: 3363–3369. DOI:10.1172/JCI26989 |
| [7] | McFadyen JD, Schaff M, Peter K. Current and future antiplatelet therapies: emphasis on preserving haemostasis[J]. Nat Rev Cardiol, 2018, 15: 181–191. DOI:10.1038/nrcardio.2017.206 |
| [8] | Li ZY, Delaney MK, O'Brien KA, et al. Signaling during platelet adhesion and activation[J]. Arterioscler Thromb Vasc Biol, 2010, 30: 2341–2349. DOI:10.1161/ATVBAHA.110.207522 |
| [9] | Yassin AS, Abubakar H, Mishra T, et al. Aspirin resistance: cardiovascular risk game changer[J]. Am J Ther, 2018. DOI:10.1097/MJT.0000000000000780 |
| [10] | Clavijo LC, AL-Asady N, Dhillon A, et al. Prevalence of high on-treatment (aspirin and clopidogrel) platelet reactivity in patients with critical limb ischemia[J]. Cardiovasc Revasc Med, 2018, 19: 516–520. DOI:10.1016/j.carrev.2017.10.013 |
| [11] | Liu JL. Research progress on antithrombotic effect of promoting blood circulation and removing stasis[J]. China Mod Med (中国当代医药), 2013, 20: 15–17. |
| [12] | Xia M, Chen XH. The antithrombotic effect research progress of traditional Chinese medicine for promoting blood circulation and removing blood stasis[J]. Guide J Tradit Chin Med (中医药导报), 2012, 18: 83–84, 87. |
| [13] | Tao J, Jiang M, Chen LY, et al. Mechanism study of prescription to treat Xiaoke based on the property and flavor theory of Chinese medicine and network pharmacology[J]. Acta Pharm Sin (药学学报), 2017, 52: 236–244. |
| [14] | Lv M, Wang TY, Tian XX, et al. Anti-inflammatory-antithrombotic effects of common Chinese medicine for promoting blood circulation and removing blood stasis revealed by network pharmacology analysis[J]. Acta Pharm Sin (药学学报), 2015, 50: 1135–1141. |
| [15] | Meng YZ, Wang ZL, Su JC, et al. The compatibility of prescriptions for the evaluation of antiplatelet aggregation activity of 58 kinds of traditional Chinese medicines for promoting blood circulation and removing phlegm[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2016, 22: 187–193. |
| [16] | Xu SY, Bian RL, Chen X, et al. Pharmacological Experimental Methodology (药理实验方法学)[M]. Beijing: People's Medical Publishing House, 2002: 202. |
| [17] | Zhao T, Chang L, Zhang B, et al. Specific combination of salvianolic acids as core active ingredients of Danhong injection for treatment of arterialthrombosis and its derived dry gangrene[J]. Front Pharmacol, 2017, 8: 361. DOI:10.3389/fphar.2017.00361 |
| [18] | Tian X, Chang L, Ma G, et al. Delineation of platelet activation pathway of scutellarein revealed its intracellular target as protein kinase C[J]. Biol Pharm Bull, 2016, 39: 181–191. DOI:10.1248/bpb.b15-00511 |
| [19] | Wang XY, Tian XX, Zhang Y, et al. Selective inhibition of platelet aggregation by Puhuang and Radix Paeoniae Alba based on activity screening and target network prediction[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2017, 23: 120–126. |
| [20] | Wang HG, Kong LL, Wang R, et al. Comparative study on antithrombotic effect of salvianolic acid A and aspirin[J]. Acta Pharm Sin (药学学报), 2019, 54: 301–307. |
| [21] | Stellos K, Sauter R, Fahrleitner M, et al. Binding of oxidized low-density lipoprotein on circulating platelets is increased in patients with acute coronary syndromes and induces platelet adhesion to vascular wall in vivo--brief report[J]. Arterioscler Thromb Vasc Biol, 2012, 32: 2017–2020. DOI:10.1161/ATVBAHA.111.244707 |
| [22] | Schaff M, Tang C, Maurer E, et al. Integrin alpha6beta1 is the main receptor for vascular laminins and plays a role in platelet adhesion, activation, and arterial thrombosis[J]. Circulation, 2013, 128: 541–552. DOI:10.1161/CIRCULATIONAHA.112.000799 |
| [23] | Baldissera L Jr, Monteiro PF, De Mello GC, et al. Platelet adhesion and intracellular calcium levels in antigen-challenged rats[J]. Pulm Pharmacol Ther, 2010, 23: 327–333. DOI:10.1016/j.pupt.2010.03.006 |
| [24] | Oberprieler NG, Roberts W, Graham AM, et al. Inhibition of ADP-induced platelet adhesion to immobilised fibrinogen by nitric oxide: evidence for cGMP-independent mechanisms[J]. Biochem Pharmacol, 2007, 73: 1593–1601. DOI:10.1016/j.bcp.2007.01.017 |
| [25] | Yuan XF. Analysis of the application of proprietary Chinese medicine in cardiovascular and cerebrovascular diseases[J]. J Clin Med Liter (临床医药文献电子杂志), 2018, 5: 185, 188. |
| [26] | Qiao QY. Research progress on compatibility of proprietary Chinese medicines[J]. Heilongjiang Med J (黑龙江医药), 2010, 23: 602–603. |
| [27] | Jiang X, Shi L. Research progress on active ingredients and pharmacological effects of Salvia miltiorrhiza[J]. J Pharm Res (药学研究), 2017, 36: 166–169. |
| [28] | Yang LJ. Research progress in pharmacological effects of Chuanxiong[J]. Heilongjiang Med J (黑龙江医药), 2010, 23: 599–600. |
| [29] | Zhang CY. Research progress of Danshen Chuanxiong and its prescription of Guanxinning in the treatment of cardiovascular and cerebrovascular diseases[J]. Chin Tradit Pat Med (中成药), 2017, 39: 1018–1024. |
| [30] | Wu GF, Wang Q. Clinical Observation of Guanxinning injection in treating angina pectoris of coronary heart disease[J]. J Emerg Tradit Chin Med (中国中医急症), 2012, 21: 1185–1186. |
| [31] | Liu HQ. Observation on the effect of Guanxinning injection in the treatment of cerebral infarction[J]. China Mod Med (中国当代医药), 2016, 23: 61–63. |
| [32] | Yildirim M, Gob K, Cusick M, et al. Drug-target network[J]. Nat Biotechnol, 2007, 25: 1119–1126. DOI:10.1038/nbt1338 |
| [33] | Zhang Y, Li H, Li KN, et al. Research progress in pharmacology of compound Chinese medicine network[J]. Chin Tradit Pat Med (中成药), 2018, 40: 1584–1588. |
| [34] | Tang PP, Bai M, Miao MS. Research on traditional Chinese medicine and network pharmacology[J]. Acta Chin Med (中医学报), 2012, 27: 1112–1115. |
| [35] | Xing XR, Lv DY, Chai YF, et al. Research progress of network pharmacology in the mechanism of action of traditional Chinese medicine[J]. J Pharm Pract (药学实践杂志), 2018, 36: 97–102. |
| [36] | Liu ZQ, Wang BL. Research progress in screening and target prediction of pharmacological components of traditional Chinese medicine network pharmacology[J]. Chin Tradit Pat Med (中成药), 2019, 41: 171–178. |
| [37] | Visconte C, Canino J, Guidetti GF, et al. Amyloid precursor protein is required for in vitro platelet adhesion to amyloid peptides and potentiation of thrombus formation[J]. Cell Signal, 2018, 52: 95–102. DOI:10.1016/j.cellsig.2018.08.017 |
| [38] | Aksu K, Donmez A, Keser G. Inflammation-induced thrombosis: mechanisms, disease associations and management[J]. Curr Pharm Des, 2012, 18: 1478–1493. DOI:10.2174/138161212799504731 |
| [39] | Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease[J]. N Engl J Med, 2017, 377: 1119–1131. DOI:10.1056/NEJMoa1707914 |
| [40] | Ed Rainger G, Chimen M, Harrison MJ, et al. The role of platelets in the recruitment of leukocytes during vascular disease[J]. Platelets, 2015, 26: 507–520. DOI:10.3109/09537104.2015.1064881 |
 2019, Vol. 54
2019, Vol. 54


