糖尿病是一种由于葡萄糖代谢紊乱而导致血糖水平过高的疾病。糖尿病可以导致一系列的并发症, 降低患者的生活质量, 增加患者死亡率[1]。近年来, 2型糖尿病发病率逐年攀升, 其主要特点是胰岛素抵抗和胰岛β细胞功能障碍导致, 而胰岛素抵抗参与了2型糖尿病的全过程, 主要体现在葡萄糖不耐受和血管功能障碍[2]。其发病原因主要由于遗传基因和不良的生活方式造成的。目前无法治愈, 只有通过药物、运动、饮食来调理。由此可见, 寻找2型糖尿病的新靶点以及开发新药受到了越来越多研究人员的关注, 并渴望从传统中医药以及天然植物中寻找有价值的潜在化合物。
刺五加为五加科植物刺五加Acanthopanax senticosus (Rupr.et Maxim.) Harms的干燥根和根茎。广泛分布于中国、韩国、日本的一种植物。刺五加的各个部分, 包括根、茎、叶, 在很长的一段时间里被用作保肝、补肾、补骨、刺激食欲、提高记忆力的中药[3]。对刺五加的研究发现, 刺五加根茎部位的主要化学成分是苷类化合物[4], 目前已有研究表明刺五加总苷具有明显的预防糖尿病并发症以及降糖活性[5]。但其作用机制却鲜有研究, 然而鉴于中药的多成分、多靶点、多通路的特点, 刺五加总苷抗2型糖尿病的作用机制利用传统的分离单体和药理学研究方法将耗资巨大, 周期长, 难以被阐明。其混合物活性成分靶点的不明确性, 严重影响进一步的药物筛选与开发。
网络药理学是近年来新兴的一种研究药物、疾病、靶点之间相互作用关系的网络分析方法, 利用现代计算机信息技术结合生物信息学、药理学、分子生物学、统计学等多学科交叉。通过反向分子对接技术预测成分的潜在靶点, 并对这些靶点进行生物信息学分析, 建立“成分-靶点”和“成分-靶点-通路”网络来分析预测多种药物成分在体内的相互作用关系。网络药理学强调信号通路的多靶点多途径调节, 在新药研发特别是在中药的创新药物研发中可发挥重要作用[6]。因此常被用来预测与揭示中药多成分、多靶点的作用机制, 能够大幅降低不确定性和盲目性, 大大节约初期药物筛选的成本, 越来越得到了研究人员的重视。为传统中医药的现代化提供了新的思路。本研究将使用网络药理学方法, 对刺五加总苷主要成分进行分析, 揭示其潜在的抗2型糖尿病作用机制, 为今后的实验研究以及药物筛选和开发奠定了基础。
材料与方法刺五加总苷化合物的获取和筛选 刺五加根茎的主要成分为酚苷类化合物, 通过文献检索选取含量较高的苷类成分, 使用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)检索得到刺五加总苷化合物的结构文件。
刺五加总苷化合物的靶点预测 将准备好的刺五加总苷化合物的结构文件, 导入SwissTargetPrediction (http://www.swisstargetprediction.ch/)平台[7]进行反向分子对接靶点预测, 设置种属为“homo sapiens”来预测活性靶点, 平台自动将化合物与后台靶点数据库进行计算机模拟对接, 选择亲和力最高的前15位潜在活性靶点。
2型糖尿病疾病靶点的获取 利用GeneCards在线数据库(http://www.genecards.org/)检索2型糖尿病英文名“type 2 diabetes”, 得到与2型糖尿病相关的基因, 下载后存为Excel文件并备用。
刺五加总苷“成分-靶点”网络的建立 通过对刺五加总苷的相关靶点预测, 在String平台(https://string-db.org/)构建疾病-靶点蛋白相互作用关系, 置信度设置为0.9, 与刺五加总苷潜在靶点取交集后将结果导入到Cytoscape3.6.1软件中并建立成分-靶点相互作用网络并做网络分析。
GO富集分析 将靶点的基因名利用DAVID6.8 (https://david.ncifcrf.gov/)[8, 9]转换成基因ID, 基因ID是基因的唯一标识码, 并对刺五加总苷的核心靶点可能存在的生物过程、分子功能、细胞组分进行GO富集分析(P < 0.05), 并根据P值绘制柱状图。
KEGG通路富集分析 通过DAVID6.8, 设置P < 0.05, 导入刺五加总苷靶点的Gene ID后进行KEGG通路富集分析, 并根据富集程度和P值并使用R 3.6.1软件对其可视化作图。筛选出2型糖尿病主要信号通路导入到Cytoscape3.6.1进行“成分-靶点-通路”相互作用网络的构建并可视化。
分子对接验证 采用在线平台系统对接平台Systems Dock (http://systemsdock.unit.oist.jp/iddp/home/index)对筛选出来的核心成分靶点进行进一步的分子对接验证。Systems Dock以对接分数(score)评价活性成分与靶点交互作用[10]。对接分数是实验解离/抑制常数值(pKd/pKi)的负对数, 数值通常为0~10之间(由弱至强), 当对接分数 > 4.25时, 认为具有一定的结合活性; 当对接分数 > 5时, 认为结合活性较好; 当对接分数 > 7时, 认为有强烈的结合活性[11]。再次证明靶点和活性成分结合的性能。
结果 1 刺五加总苷成分筛选结果通过文献报道[12], 刺五加总苷主要有7种苷类成分, 并且根和根茎部分含量丰富, 分别占干药材重量的0.6%~0.9%和0.6%~1.5%。这7种主要成分分别是刺五加苷A (eleutheroside A)、刺五加苷B (eleutheroside B)、刺五加苷B1 (eleutheroside B1)、刺五加苷C (eleutheroside C)、还有刺五加苷D和E (eleutheroside D, eleutheroside E)、芝麻素(sesamin)。并且刺五加苷B和刺五加苷E在茎中的含量高于根部[13]。这7种苷类化合物的成分比大约为8:30:10:12:4:2:1, 构成了刺五加根茎苷类化合物的主要成分, 以此作为本文研究对象。
2 活性靶点预测利用SwissTargetPrediction平台预测活性化合物的潜在靶点, 共获得105个基因靶点。在GeneCards检索到的2型糖尿病靶点共有511个, 整理合并后得到刺五加总苷抗2型糖尿病的潜在相互作用靶点共35个靶点, 如表 1所示。
| Table 1 The information of potential target proteins |
将筛选出的与2型糖尿病相关的靶点构建疾病-靶点相互作用网络, 并与成分建立关联, 导入Cytoscap3.6.1中, 合并成“成分-靶点”相互作用关系。利用Cytoscape3.6.1中内置的Networkanalyzer工具对网络关系的特性进行拓扑学分析, 得到“度值(degree)”、“节点紧密度(closeness)”和“节点介度(betweenness)”等拓扑学参数信息如表 2所示。
| Table 2 Network characteristics of key component-target network nodes |
使用DAVID6.8对刺五加总苷7个化合物的靶基因进行了GO富集分析(P < 0.05)。富集分析结果如图 1所示, 包括生化过程, 细胞组分, 分子功能。结果可以看出, 刺五加总苷可能参与众多过程, 包括葡萄糖稳态、药物反应、MAPK活性、JNK活性等。
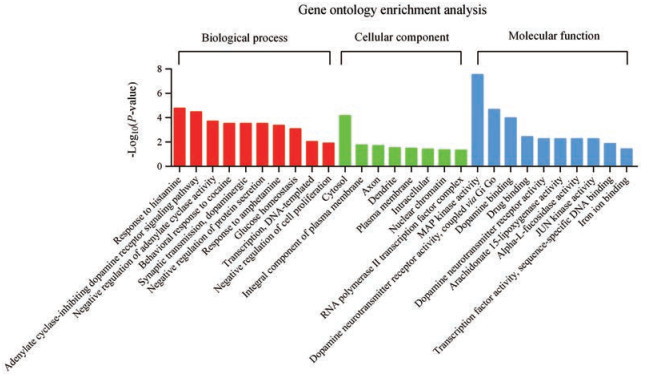
|
图 1 Gene ontology enrichment analysis result |
对刺五加总苷7个化合物预测的靶点使用DAVID6.8进行KEGG通路富集分析, 筛选出与2型糖尿病相关的8条主要通路, 包括胰岛素抵抗信号通路、FoxO信号通路和MAPK信号通路等, 并将其结果可视化, 如图 2所示。
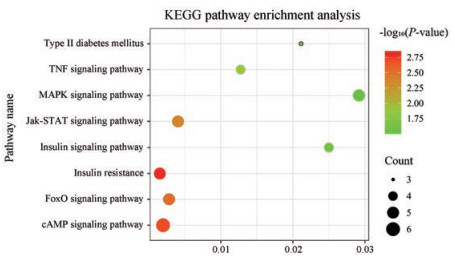
|
Figure 2 KEGG pathway enrichment analysis result |
根据KEGG通路富集分析的结果, 本研究筛选出8条主要与2型糖尿病相关的信号通路, 同时与参与相关通路的靶点建立联系。并与“成分-靶点”将相互作用关系整合并导入Cytoscape3.6.1中, 并可视化得到“成分-靶点-通路”网络图, 如图 3所示。
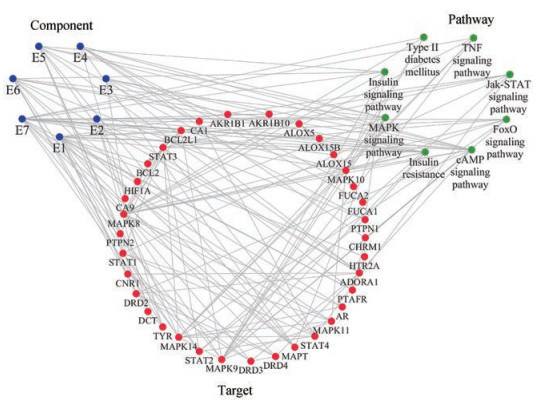
|
Figure 3 "Component-target-pathway" network |
结合上述KEGG富集分析结果, 从胰岛素抵抗、细胞凋亡和炎症3个方面选取了胰岛素抵抗信号通路、Jak-STAT3信号通路和TNF信号通路, 并结合网络药理学预测的靶点作为关键靶蛋白并与其对应的成分进行分子对接, 并选择商品化小分子抑制剂作为阳性对照, 详细信息和对接情况如表 3所示。由前面的对接标准可以得知, 当对接分数 > 4.25时, 说明具有一定的结合活性; 当对接分数 > 5时, 说明结合活性较好; 当对接分数 > 7时, 说明有强烈的结合活性。结果显示, 相对于商品化的小分子抑制剂而言, 筛选出来的核心成分与靶点均具有较好的结合活性, 其中刺五加苷D和PTPN1还具有强烈的结合活性。对接空间图和部分相互作用的氨基酸残基如图 4所示, 由图可以看出, 除E1_刺五加苷A与STAT3对接之外, 其余成分与靶点对接均有丰富的氨基酸残基与其相互作用。
| Table 3 The information and scores of molecular docking of main active ingredients of total eleutheroside. Comp: Component; PC: Positive control |
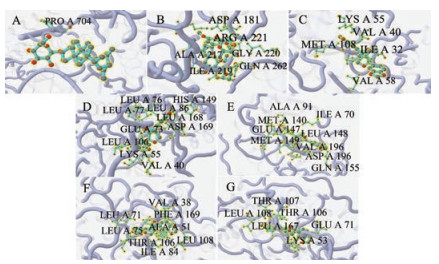
|
Figure 4 Molecular docking diagram. A: Eleutheroside A docked in STAT3; B: Eleutheroside D docked in PTPN1; C: Sesamin docked in JNK1; D: Sesamin docked in JNK2; E: Sesamin docked in JNK3; F: Sesamin docked in p38α; G: Sesamin docked in p38β |
通过分析结果可以看出, 刺五加总苷主要是通过调控2型糖尿病、胰岛素抵抗、TNF信号通路、Jak-SATA信号通路、FoxO信号通路、胰岛素信号通路、cAMP信号通路、MAPK信号通路来起到治疗糖尿病的作用。根据KEGG富集分析的结果绘制了刺五加总苷治疗糖尿病的主要通路, 并且筛选出刺五加总苷中的核心成分, 分别包括E1_刺五加苷A、E5_刺五加苷D、E6_刺五加苷E和E7_芝麻素4个化合物。如图 5所示黄色代表刺五加总苷的潜在干预靶点。
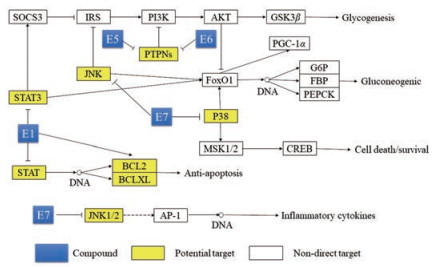
|
Figure 5 Potential anti-type 2 diabetes pathway. SOCS3: Suppressor of cytokine signaling 3; IRS: Insulin receptor substrate; PI3K: Phosphoinositide 3-kinase; AKT: Protein kinase B; GSK3β: Glycogen synthase kinase3β; FoxO1: Forkhead box protein O1; PGC-1α: Peroxisome proliferator-activated receptor γ coactivator-1α; G6P: Glucose-6-phosphatase; PEPCK: Phosphoenolpyruvate carboxykinase; FBP: Fructose-1, 6-bisphosphatase I; MSK1/2: Mitogen- and stress-activated protein kinase 1/2; AP-1: Activator protein 1; CREB: cAMP-response element binding protein |
不难看出, E1_刺五加苷A的潜在靶点是STATs, 并且在总苷中含量较高, 通过对STAT3进行进一步的分子对接验证可以看出, E1_刺五加苷A和STAT3具有良好的亲和力, 在与阳性对照化合物氯硝柳胺(niclosamide)的分子对接对比中可以发现, E1_刺五加苷A与STAT3的亲和力明显高于氯硝柳胺。目前对E1_刺五加苷A在抗糖尿病方面的研究仍然比较浅显。Sheng等[14]研究发现, E1_刺五加苷A是一种α-葡萄糖苷酶抑制剂, 并且效果明显强于已经上市的阿卡波糖。Gao等[15]的研究发现, E1_刺五加苷A是一种良好的过氧化物酶体增殖物激活受体β (peroxisome proliferators-activated receptor β, PPARβ)激动剂。但E1_刺五加苷A在体内的降糖作用机制尚未有研究涉及。本研究利用网络药学预测出了其对STAT3具有良好的亲和力, 而STAT3可以通过作用于SOCS3来影响胰岛素受体底物1 (insulin receptor substrate-1, IRS-1)的活性[16], SOCS3已被认为可介导肥胖患者的中枢瘦素抵抗[17]。下丘脑瘦素信号转导能调控肝脏葡萄糖和脂代谢[18], 并且调控肝脏糖异生[19]。由此可以看出STAT3在调节糖代谢紊乱方面起着重要的作用。因此, E1_刺五加苷A可能通过该途径来抑制STATs, 从而提高IRS的活性降低FoxO1活性, 提高胰岛素敏感性, 抑制肝脏糖异生。暗示E1_刺五加苷A通过STAT3对调节葡萄糖稳态具有重大开发价值。不仅如此, 在2型糖尿病中, 胰岛素抵抗合并内脏肥胖会导致葡萄糖毒性效应, 使胰岛β细胞异常凋亡[20]。STATs基因和凋亡密切相关[21, 22], 根据KEGG分析发现E1_刺五加苷A能够通过STATs影响BCL2和BCLXL表达, 而BLC2和BCLXL同样也是E1_刺五加苷A的靶点。Jiang等[23]研究发现在神经细胞中, E1_刺五加苷A能通过上调BCL2起到抗凋亡作用, 这与本研究预测抗凋亡作用相类似。并推测E1_刺五加苷A对在高糖环境下导致的神经细胞损伤具有保护作用, 甚至在保护胰岛β细胞方面也可能存在着类似作用, 结论有待进一步研究去论证。因此由图 6可以得出结论, E1_刺五加苷A可能通过共同作用STATs、BCL2和BCLXL来治疗由于高血糖导致的细胞异常凋亡。
E5_刺五加苷D和E6_刺五加苷E都可以作用于PTPN1和PTPN2, 可能与它们的化学结构类似有关, 为紫丁香树脂酚葡萄糖苷的两种不同构型, 通过以E5_刺五加苷D为例与PTPN1蛋白进行分子对接验证, 发现E5_刺五加苷D的结合性能略优于商品化小分子抑制剂PTP1B-IN-1。目前已有文献[24]报道, E6_刺五加苷E能够改善2型糖尿病db/db小鼠胰岛素抵抗, 能在Ser473位点磷酸化AKT, 但深入机制尚未研究。而PTPN1的缺陷可以改善PI3K的活性, 从而提高胰岛素敏感性[25], PTPN2同样也是负调控胰岛素信号通路[26], 本研究解释了E6_刺五加苷E可能是通过PTPN1途径从而间接激活AKT。不仅如此, E5_刺五加苷D和E6_刺五加苷E还可以作用于PTPN2, 而PTPN2可以减弱肝脏中的SATA3活性和胰岛素信号通路, 从而调节糖异生[27], 这说明E5_刺五加苷D和E6_刺五加苷E还可能通过抑制肝脏中PTPN2可以改善2型糖尿病和肥胖。
糖尿病患者在整个病程中都会伴随着炎症反应, 肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)、白介素6 (interleukin-6, IL-6)和白介素1B (interleukin-1B, IL1B)等炎症因子含量会上升[28], E7_芝麻素的潜在靶点是MAPK8、MAPK9、MAPK10、MAPK11和MAPK14, 也分别被称作JNK1、JNK2、JNK3、p38α和p38β。炎症反应常常与MAPKs有关, 包括JNK信号通路[29], 抑制JNK可以改善由于炎症导致的细胞损伤。由分子对接结果可以看出, E7_芝麻素与JNK商品化小分子抑制剂tanzisertib相比具有相似的亲和能力, 以及比SB202190 (FHPI)更优良的p38结合力。Fan等[30]和刘彦群等[31]的研究证实这一结论, E7_芝麻素可以通过JNK和p38来抑制炎症反应和细胞凋亡。而p38可以使FoxO1核移位[32], 因此本研究推断E7_芝麻素可能通过阻断p38来抑制肝脏的糖异生。不仅如此, 抑制JNK同样可以激活IRS[33]和抑制FoxO1[34]。说明E7_芝麻素在抗炎、改善胰岛素抵抗和抑制肝脏糖异生方面具有良好的治疗潜力。Mohammad等[35]的研究结果表明, E7_芝麻素具有明显的抗炎活性, 能显著降低人体TNF-α和IL-6的水平, 与本研究预测的抗炎结果相一致。说明E7_芝麻素可能通过直接作用JNK来控制糖尿病发生的炎症反应, 还可能通过共同作用JNK和p38下调FoxO1来抑制肝脏糖异生的发生来调节血糖。
由此可见, 刺五加总苷调节其中多条通路, 在2型糖尿病导致的胰岛素抵抗、炎症、细胞凋亡等方面都可能发挥重要的作用, 这是传统“一药一靶点”模式难以做到的, 而这也符合中药多成分、多靶点、多通路对疾病起到综合治疗作用的特点。
网络药理学是一门基于高通量统计分析的新兴学科, 为传统中医药的研究提供了一条独特的创新之路, 包括单组分和多组分的作用机制。本研究利用网络药理学的方法, 对刺五加苷类化合物的主要成分进行了研究, 构建了“成分-靶点”网络和“成分-靶点-通路”网络, 挖掘了其可能存在的机制, 并利用分子对接与文献验证了其预测的结果, 证明了网络药理学具有一定的准确性, 并对刺五加总苷抗糖尿病的机制进行了预测和猜想, 大大节省了前期探索的人力物力, 减少了后续对刺五加总苷研究过程中的不确定性和盲目性, 使探索目的更加明确。但预测结果不能完全证明其正确性, 所以本课题组也将根据本研究的结果开展系统严谨的生物学验证。
| [1] | Baena-Díez JM, Peñafiel J, Subirana I, et al. Risk of cause-specific death in individuals with diabetes: a competing risks analysis[J]. Diabetes Care, 2016, 39: 1987–1995. DOI:10.2337/dc16-0614 |
| [2] | De Fronzo RA. Insulin resistance, lipotoxicity, type 2 diabetes and atherosclerosis: the missing links. The Claude Bernard Lecture 2009[J]. Diabetologia, 2010, 53: 1270–1287. DOI:10.1007/s00125-010-1684-1 |
| [3] | Huang LZ, Huang BK, Ye Q. Bioactivity-guided fractionation for anti-fatigue property of Acanthopanax senticosus[J]. J Ethnopharmacol, 2011, 133: 213–219. DOI:10.1016/j.jep.2010.09.032 |
| [4] | Cao XL, Li LZ. Experimental study on Acanthopanax senticosus[J]. Chin Tradit Herb Drugs (中草药), 1980, 11: 277–283. |
| [5] | Chang JX, Liu WB, Wang SB, et al. Analysis on antidiabetic Effect of Acanthopanax senticosus total glycosides extract by GC-MS metabonomics[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2017, 23: 101–107. |
| [6] | Zhou CC, Hong GJ, Yan HY. Predicting and validating the mechanism of Trichosanthes mediated anti-myocardial ischemia-reperfusion injury by network pharmacology[J]. Acta Pharm Sin (药学学报), 2019, 54: 1234–1240. |
| [7] | Gfeller D, Michielin O, Zoete V. Shaping the interaction landscape of bioactive molecules[J]. Bioinformatics, 2013, 29: 3073–3079. DOI:10.1093/bioinformatics/btt540 |
| [8] | Huang da W, Sherman BT, Lempicki RA. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nat Protoc, 2009, 4: 44–57. DOI:10.1038/nprot.2008.211 |
| [9] | Huang da W, Sherman BT, Lempicki RA. Bioinformatics enrichment tools: paths toward the comprehensive functional analysis of large gene lists[J]. Nucleic Acids Res, 2009, 37: 1–13. DOI:10.1093/nar/gkn923 |
| [10] | Li BT, Zhai XY, Li J, et al. Network pharmacology-based study on mechanisms of antipyretic action of Pueraria radix[J]. Acta Pharm Sin (药学学报), 2019, 54: 1409–1416. |
| [11] | Li GY, Chen YG, Zeng TC, et al. Action mechanism of total flavonoids of Diaphragma Juglandis Fructus in treating type 2 diabetes mellitus based on network pharmacology and cellular experimental validation of AKT/FoxO1 signaling pathway[J]. Drug Eval Res (药物评价研究), 2019, 42: 30–40. |
| [12] | Gao YY, Li WH, Kou N, et al. Advances in research on chemical constituents and pharmacological effects of Acanthopanax senticosus[J]. Inf Tradit Chin Med (中医药信息), 2019, 36: 113–116. |
| [13] | Kang JS, Linh PT, Cai XF, et al. Quantitative determination of eleutheroside B and E from Acanthopanax species by high performance liquid chromatography[J]. Arch Pharm Res, 2001, 24: 407–411. DOI:10.1007/BF02975184 |
| [14] | Sheng Z, Dai H, Pan S, et al. Isolation and characterization of an alpha-glucosidase inhibitor from Musa spp. (Baxijiao) flowers[J]. Molecules, 2014, 19: 10563–10573. DOI:10.3390/molecules190710563 |
| [15] | Gao D, Zhang YL, Xu P, et al. In vitro evaluation of dual agonists for PPARγ/β from the flower of Edgeworthia gardneri (wall.) Meisn[J]. J Ethnopharmacol, 2015, 162: 14–19. DOI:10.1016/j.jep.2014.12.034 |
| [16] | Rui L, Yuan M, Frantz D, et al. SOCS-1 and SOCS-3 block insulin signaling by ubiquitin-mediated degradation of IRS1 and IRS2[J]. J Biol Chem, 2002, 277: 42394–42398. DOI:10.1074/jbc.C200444200 |
| [17] | Rodrigues AL, de Moura EG, Passos MC, et al. Postnatal early overfeeding induces hypothalamic higher SOCS3 expression and lower STAT3 activity in adult rats[J]. Nutr Biochem, 2011, 22: 109–117. DOI:10.1016/j.jnutbio.2009.11.013 |
| [18] | Morton GJ, Schwartz MW. Leptin and the central nervous system control of glucose metabolism[J]. Physiol Rev, 2011, 91: 389–411. DOI:10.1152/physrev.00007.2010 |
| [19] | Cheng L, Yu Y, Szabo A, et al. Palmitic acid induces central leptin resistance and impairs hepatic glucose and lipid metabolism in male mice[J]. Nutr Biochem, 2015, 26: 541–548. DOI:10.1016/j.jnutbio.2014.12.011 |
| [20] | Mandrup-Poulsen T. Beta-cell apoptosis: stimuli and signaling[J]. Diabetes, 2001, 50: 58–63. DOI:10.2337/diabetes.50.2007.S58 |
| [21] | Anuradha R, Saraswati M, Kumar KG, et al. Apoptosis of beta cells in diabetes mellitus[J]. DNA Cell Biol, 2014, 33: 743–748. DOI:10.1089/dna.2014.2352 |
| [22] | Kisseleva T, Bhattacharya S, Braunstein J, et al. Signaling through the JAK/STAT pathway, recent advances and future challenges[J]. Gene, 2002, 285: 1–24. DOI:10.1016/S0378-1119(02)00398-0 |
| [23] | Jiang LH, Yuan XL, Yang NY, et al. Daucosterol protects neurons against oxygen-glucose deprivation/reperfusion-mediated injury by activating IGF1 signaling pathway[J]. J Steroid Biochem Mol Biol, 2015, 152: 45–52. DOI:10.1016/j.jsbmb.2015.04.007 |
| [24] | Ahn J, Um MY, Lee H, et al. Eleutheroside E, an active component of Eleutherococcus senticosus, ameliorates insulin resistance in type 2 diabetic db/db mice[J]. Evid Based Complement Alternat Med, 2013, 2013: 934183. |
| [25] | Sugiyama M, Banno R, Mizoguchi A, et al. PTP1B deficiency improves hypothalamic insulin sensitivity resulting in the attenuation of AgRP mRNA expression under high-fat diet conditions[J]. Biochem Biophys Res Commun, 2017, 488: 116–121. DOI:10.1016/j.bbrc.2017.05.019 |
| [26] | Meng TC, Buckley DA, Galic S, et al. Regulation of insulin signaling through reversible oxidation of the protein-tyrosine phosphatases TC45 and PTP1B[J]. Biol Chem, 2004, 279: 37716–37725. DOI:10.1074/jbc.M404606200 |
| [27] | Fukushima A, Loh K, Galic S, et al. T-cell protein tyrosine phosphatase attenuates STAT3 and insulin signaling in the liver to regulate gluconeogenesis[J]. Diabetes, 2010, 59: 1906–1914. DOI:10.2337/db09-1365 |
| [28] | Stein SA, Lamos EM, Davis SN. A review of the efficacy and safety of oral antidiabetic drugs[J]. Expert Opin Drug Saf, 2013, 12: 153–175. DOI:10.1517/14740338.2013.752813 |
| [29] | Davis RJ. Signal transduction by the JNK group of MAP kinases[J]. Cell, 2000, 103: 239–252. DOI:10.1016/S0092-8674(00)00116-1 |
| [30] | Fan D, Yang Z, Yuan Y, et al. Sesamin prevents apoptosis and inflammation after experimental myocardial infarction by JNK and NF-κB pathways[J]. Food Funct, 2017, 8: 2875–2885. DOI:10.1039/C7FO00204A |
| [31] | Liu YQ, Yan GH, Qin XZ, et al. Sesamin attenuates mast cell-mediated inflammatory cytokines release through suppressing p38 and NF-κB activation[J]. Immunol J (免疫学杂志), 2014, 30: 1073–1076. |
| [32] | Wang Y, Yan S, Xiao B, et al. Prostaglandin F2α facilitates hepatic glucose production through CaMKⅡγ/p38/FOXO1 signaling pathway in fasting and obesity[J]. Diabetes, 2018, 67: 1748–1760. DOI:10.2337/db17-1521 |
| [33] | Aguirre V, Uchida T, Yenush L, et al. The c-Jun NH2-terminal kinase promotes insulin resistance during association with insulin receptor substrate-1 and phosphorylation of Ser307[J]. Biol Chem, 2000, 275: 9047–9054. DOI:10.1074/jbc.275.12.9047 |
| [34] | Xing YQ, Li A, Yang Y, et al. The regulation of FOXO1 and its role in disease progression[J]. Life Sci, 2018, 193: 124–131. DOI:10.1016/j.lfs.2017.11.030 |
| [35] | Mohammad SM, Zakerzadeh M, Zakerkish M, et al. Effect of sesamin supplementation on glycemic status, inflammatory markers, and adiponectin levels in patients with type 2 diabetes mellitus[J]. Diet Suppl, 2017, 14: 65–75. DOI:10.1080/19390211.2016.1204404 |
 2019, Vol. 54
2019, Vol. 54


