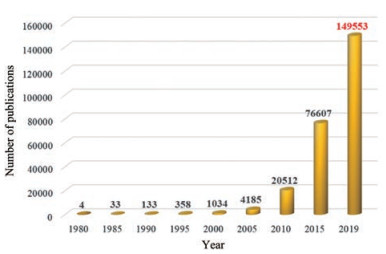
得益于新材料和新技术的不断发展, 制药工业已进入了药物递送系统(drug delivery systems, DDS)的新时代。过去几十年里, 一些新型药物递送系统如缓控释、经皮、肺部、长效及纳米递药系统在临床药物治疗中发挥了极其重要的作用, 反映在其销售额上, 正呈逐年攀升趋势[1]。从药物治疗的角度来看, 药物递送的终极目标是将活性药物分子(active pharmaceutical ingredients, API)精准递送到病灶部位发挥疗效, 同时极大地降低其毒副作用。近年来, 随着纳米技术的整体迅速发展, 其在药物递送领域的应用也呈快速发展趋势, 纳米药物载体被广泛研究并被赋予药物递送的使命[2]。当前正处于纳米给药系统(NDDS)研发的热潮之中, 并已催生了具有里程碑意义的纳米药物产品, 如多柔比星长循环脂质体(Doxil®)、紫杉醇白蛋白纳米粒(Abraxane®)等。然而, 目前纳米递药系统的研发投入和产出存在着巨大的反差[3, 4]。由图 1可知, 始于1980年, 截止至2019年7月1日, 纳米递送领域的论文发表数就有149 553篇之多, 而成功上市的纳米制剂产品却只有寥寥数十个, 其中一部分还是以提高溶出速率为目的的纳米结晶制剂。纳米药物的研发似乎遇到了不可逾越的瓶颈, 学术界和工业界均对其发展前景产生了怀疑, 其中不乏“纳米悲观”论调。据悉, 美国国家癌症研究所(NCI)将于明年开始停止资助其所有9所癌症-纳米技术研究中心。
|
Figure 1 The cumulative number of publications obtained by searching Web of Science Core Collection using the key words "nano*" and "drug delivery" (accessed to Jul 1, 2019) |
然而, NDDS在增效减毒方面的作用不容忽视, 当前亟需分析限制其临床转化的原因, 从而找出应对方法, 推进研发进程。原因多方面的:首先是工业化问题, 由于纳米制剂的生产工艺完全不同于传统制剂, 需要研发新设备、新工艺; 从目前来看, 纳米制剂的生产仍存在批量受限、批间差异大和质控难等问题[4, 5], 但是这些问题可通过纳米制造技术的进步而逐步或正在得到解决[6], 已成功上市的产品就提供了很好的例证。当前, 纳米制剂临床转化遇到的最大挑战在于对其体内行为与作用机制的解析。NDDS一般由功能性高分子材料包载药物而成, 系统地阐明NDDS的三要素“纳米载体粒子-药物分子-高分子材料”在体内的药动学、分布、代谢和排泄过程, 对于理解纳米制剂的药理和毒理作用机制具有十分重要的意义[7, 8]。然而, 目前对于纳米制剂在人体内的转运过程仍然知之甚少, 认知仅停留在药物分子的体内过程层面, 并且由于无法区分体内游离药物与包裹状态的药物, 对结果的分析尚存在很大的偏差; 而对纳米载体粒子本身以及高分子材料的体内行为几乎是一无所知[9]。因此, 也无从知晓体内药物释放与粒子动态降解过程等关键科学信息。假如纳米粒在进入体循环后, 药物分子可快速从纳米粒中泄漏, 纳米载体因此而空载, 将导致进入靶部位(如肿瘤)的仅仅是空纳米粒而未载药[10, 11], 这与当前靶向DDS的设计初衷背道而驰。有研究者试图通过适宜的手段分离血浆样品中游离的药物和包裹态的药物, 但是分离操作过程中, 也可能发生药物泄露或纳米粒被破坏, 从而不能真实地反映实际情况[12, 13]。因此, 采用适宜的方法来阐明纳米粒在体内的时空命运, 对于优化纳米制剂, 促进其研发进程具有重要的指导意义。
1 荧光染料在纳米粒体内示踪中的应用概况众多研究者已逐渐意识到揭示纳米粒体内行为的重要性, 并尝试采用各种手段监测纳米粒[14, 15]。为了能够全面地了解纳米粒的体内行为, 首先希望能够通过影像手段直接观察纳米粒[16, 17], 并进一步借助各种定性和定量方法探索其体内过程[18, 19]。少数纳米粒(如无机纳米粒)或其组成成分可提供能够直接被检测的信号[14], 而大部分有机纳米粒必须通过标记实现体内示踪[20]。放射和荧光标记是目前最常用的两种方式[21, 22], 在应用上各有优缺点。放射标记具有很强的专属性, 体内干扰少, 但是需要在特殊的实验室进行, 且大多需要通过化学合成的手段进行标记, 标记分子在体内脱离纳米载体后仍可检测到放射信号; 目前采用荧光染料标记更为常用, 适用性较强, 但是普通荧光探针在纳米粒内部和释放后均发射同样的荧光。因此标记手段所存在的共性问题是如何准确地区分纳米粒信号和游离探针信号[17]。
一般来说, 纳米载体的荧光标记可采用物理包埋[23]和化学键合[24]两种方式。如果纳米载体本身是不可生物降解的, 如聚苯乙烯纳米粒, 并且标记物分子与纳米载体在体内循环中可牢固结合, 探针信号即代表纳米粒[25]。但是, 绝大多数纳米药物载体均具有生物降解性, 标记物分子伴随着降解过程而被释放, 但其信号并未消失, 这无疑对纳米粒信号造成了干扰。Hollis等[26]采用杂化结晶技术以近红外荧光探针FPI-749标记紫杉醇纳米结晶, 静脉注射后发现在肿瘤及其他组织中荧光信号可存续长达7天, 但是一般认为纳米结晶在体内存续时间非常有限, 由此他们认为观察末期的荧光信号是由游离探针带来的, 并非纳米结晶自身信号。普通探针在指示纳米粒方面具有明显的缺陷, 必须寻找更优的探针分子以准确实时监测纳米粒的体内行为。
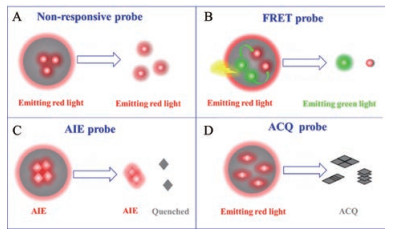
2 环境响应型荧光染料的应用原理及特点近年来, 环境响应荧光染料被广泛应用于分子影像领域, 这类分子受一些环境因素如pH值、酶、特定分子和空间距离等影响[27, 28], 导致荧光光谱发生变化, 据此可以检测体内生理或病理状态的变化[29, 30], 如肿瘤的分子影像监测。其中, 部分环境响应荧光染料可用于指示纳米粒在体内的变化, 主要有三大类, 其原理分别基于荧光共振能量转移(Förster resonance energy transfer, FRET)、聚集诱导发光(aggregation-induced emission, AIE)和聚集导致淬灭(aggregation-caused quenching, ACQ) (图 2)。这些荧光染料被包载于纳米粒内部和从纳米粒释放后可呈现不同的发射荧光。
|
图 2 Schematic demonstration of the principles of labelling particles with non-responsive (A), Förster resonance energy transfer (FRET) (B), aggregation-induced emission (AIE) (C) and aggregation-caused quenching (ACQ) (D) fluorescent dyes |
早在20世纪初, Francis Perrin第一次观察到共振能量转移现象, 随后Theodor Förster于1948年发现某些荧光分子的共振能量转移现象, 由此提出了FRET的概念[31]。FRET效应是指距离很近的两个荧光分子间产生的一种能量转移现象, 即当供体荧光分子的发射光谱与受体荧光分子的吸收光谱重叠超过30%[32], 并且两个分子的距离在10 nm内时, 就会发生一种非辐射性的能量转移, 通过激发供体荧光分子所产生的发射光可使受体分子发出的荧光大大增强(敏化荧光), 同时供体荧光淬灭; 当距离超过10 nm时, FRET效应消失[33]。FRET的荧光转移效率与分子之间的实际距离及Förster距离有关, 因此, 将可发生FRET效应的两种荧光分子(如Cy5.5和Cy7)同时包载于纳米粒中, 由于分子间距离大幅缩短, 即可产生FRET效应, 而当纳米结构解体后, FRET荧光分子被释放, 分子间距离变大, 导致FRET效应消失[34]。基于此原理, FRET效应已被应用于纳米粒体内外完整性、细胞内药物释放及体内命运的研究。
2.1.2 优势及局限性FRET染料对供体-受体的荧光信号切换主要是基于分子间的距离, 而与体内环境无关, 其响应极其灵敏, 可准确地反映荧光分子之间的相对位置, 从而间接地反映纳米粒的结构变化信息。因此, FRET效应被广泛用于动态可视化地监控药物的包载和释放过程[35]。同时, 根据荧光分子之间的距离和相对位置, FRET效应可用于鉴定纳米药物的精细结构, 如均相混合物、核壳结构或多层结构的纳米载体等[36]。另外, 大多数环境响应型荧光染料均具有结构专属性, 对特定pH值和酶等响应, 不具有普适性, 需要针对特定环境定制分子结构。而FRET效应是通过选择合适的染料分子对进行标记, 目前市售的许多染料只要满足产生FRET的条件, 均可有效地组合成FRET染料对, 尤其是结构类似的染料系列, 如近红外花菁染料DiD/DiR及Cy5/Cy7等[37, 38]。近年来, 上转换纳米粒、量子点和碳点等荧光材料也被广泛用于组成FRET染料对[39, 40]。通过选择具有不同波长和组织穿透深度的FRET染料对可对纳米粒体外和体内的完整性、转运过程及命运进行探索。
尽管FRET效应在应用方面具有一定的优势, 但也存在很多缺陷: ①FRET染料对(尤其是花菁类近红外染料)多数具有较强的脂溶性, 与细胞膜具有很强的亲和力, 被释放后可能会重新聚集于细胞膜或某些疏水结构中使FRET荧光复现[41], 这将误导对结果的判断; ② FRET染料的荧光复现将导致FRET比值(FRET荧光强度与供体荧光强度之间的比例关系)与纳米粒质量之间的比例关系失调[42], 无法对纳米粒进行准确定量; ③不同波长的荧光其组织穿透深度不同, 从而影响FRET比值[43]; ④由于纳米粒骨架的空间较大, 单纯通过物理包埋的方式很难产生FRET效应, 因此常采用将聚合物材料和荧光染料共价结合的方式[38], 不方便应用; ⑤ FRET效应是由供体荧光分子发射光激发受体分子发射荧光, 所以其荧光强度较弱, 易受检测条件限制[42]; ⑥通过IVIS检测体内荧光时, 只能检测到表面荧光而非组织深层的荧光[43], 这也是荧光成像技术所具有的通病。因此, FRET荧光技术有待进一步发展, 目标为获得更加可靠、效率更高、选择性更高和组织穿透能力更强的染料对。
2.2 聚集诱导发光 2.2.1 AIE效应原理2001年, Tang等[44]发现一系列噻咯分子在溶液状态不发光而在聚集状态发射强荧光的现象, 并据此提出聚集诱导发光(AIE)效应。其主要机制是染料分子在溶液状态下可自由旋转导致激发状态能量非辐射失活而不发光, 而当染料分子内旋转发生抑制时(如发生聚集或分散在载体中), 即发射荧光[45]。因此, AIE染料在黏度较大、压力较大或温度较低的环境下均可发射荧光[45]。另外, 形成J-聚体、构象平面化及激发态分子内质子转移也是产生AIE现象的原因。大多数有机荧光分子因π-π堆叠效应形成H-聚体而发生荧光淬灭, 当分子间距离延长并倾斜堆叠而形成J-聚体时, 即可促进荧光发射, 目前已观察到多个AIE分子J-聚体的形成[45]。噻咯荧光分子在水-乙醇的混合溶剂中, 当水含量超过90%时, 由于溶解度降低而导致分子聚集, 荧光量子产率可达到0.21, 比在乙醇中高333倍[46]。将AIE染料包载于纳米粒中, 由于空间位阻的原因, 染料分子自由旋转被抑制, 从而发射荧光, 而当纳米粒解体后, 染料分子游离于体液环境中, 荧光极弱, 藉此可对纳米粒的体内转运行为进行研究[47, 48]。
2.2.2 优势及局限性AIE现象已被广泛应用于多个研究领域, 基于Web of Science数据库的检索表明, 近年来与AIE有关的文章发表数每年均超过1 000篇以上。AIE荧光染料避免了因ACQ效应导致的荧光浓度淬灭效应, 大大提升了固体荧光材料的发光效率[49]。在生物医学领域, AIE染料可用于一些生物检测, 如利用AIE染料与蛋白质结合后发出荧光的特点可进行蛋白质分析[50]。另外, AIE染料具有很好的光稳定性、高灵敏度和选择性, 近年来逐渐用于研究纳米载体的体内外行为[44]。
然而, AIE染料由于疏水性强, 释放后可能会发生聚集而发射荧光, 从而导致荧光淬灭不完全, 造成背景干扰; 也可能会被蛋白吸附而限制其分子内自由旋转, 导致体内荧光复现[51]。有研究[52]将AIE染料键合到亲水性材料骨架上, 以该材料制成纳米粒或胶束, 当载体结构发生破坏后, 荧光发生淬灭, 由于亲水性材料的介入使AIE染料不易发生聚集, 从而减少荧光复现, 但这种方法操作繁琐, 不具有普适性。
2.3 聚集导致淬灭 2.3.1 ACQ效应原理ACQ现象是大多数荧光染料具有的特点, 尤其是具有平面结构或分子内含有多个芳环共轭结构的荧光分子, 在低浓度下可发射强荧光, 而随着浓度的升高, 荧光强度减弱甚至淬灭, 这在发光领域通常被称为浓度淬灭(concentration quenching)现象[53]。这一现象最早由Förster和Kasper在研究芘的荧光现象时发现, 后来发现该现象普遍存在于大多数芳香共轭荧光分子中[54], 1970年Birks将其定义为ACQ现象[53]。一般来讲, 大多数荧光分子含有多个共轭芳环结构, 在水中溶解性较差, 易溶于有机溶剂, 因此当荧光分子分散在水性介质中时, 受疏水作用力驱使, 分子间发生π-π堆叠而导致分子聚集, 进而发生荧光淬灭现象[55]。所形成的聚集体是一种热力学和动力学稳定的分散体系, 可以均匀地分散在水性溶液中而不产生沉淀[53]。聚集体分子间的作用力非常强, 除非溶液环境发生巨大的变化, 否则聚集体不易解离[56]。ACQ现象在水环境中发生, 环境中的水含量与染料的荧光强度呈正相关[57]。当水含量增加超过一个阈值(如大于70%)时, 染料分子迅速发生聚集, 导致荧光完全淬灭[48, 58], 其荧光发射现象与AIE恰恰相反。利用ACQ染料的这种On→Off的信号切换特点可以用来指示纳米载体在体内的存续状态。
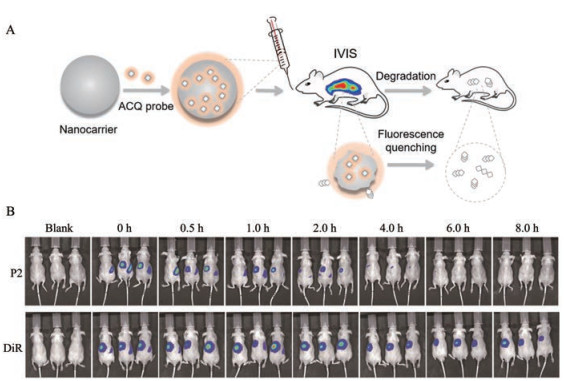
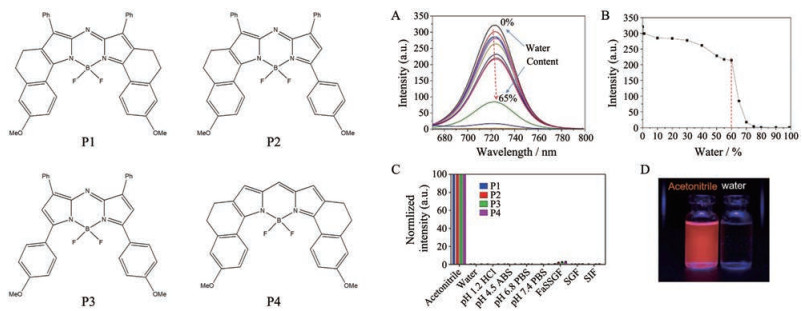
2.3.2 优势及局限性将ACQ染料包载于纳米载体中, 染料分子高度分散于疏水核中, 发射荧光信号, 随着纳米粒在体内不断降解, 染料分子被释放进入体液中, 分子间较强的π-π相互作用及疏水作用导致分子间发生聚集, 而后荧光完全淬灭[48] (图 3)。因此, 荧光信号即代表纳米粒的信号, 通过追踪体内荧光即可研究纳米粒在体内的转运和分布过程[59, 60]。ACQ染料具有结构多样性, 大部分基于BODIPY母核结构的染料均具有较强的ACQ效应, 并且可通过改变其分子结构而调节荧光发射波长, 以适用于多种仪器设备, 如激光共聚焦显微镜一般在低于650 nm下检测, 而小动物活体成像仪则在700 nm以上检测[61]。Aza-BODIPY类的荧光分子量子产率较高, 且光稳定性好, 极低浓度即可产生较强荧光, 避免荧光分子在载体内部因浓度过高而发生淬灭[62] (图 4)。ACQ染料一般具有较大的共轭平面结构, 遇水可快速发生聚集而导致荧光淬灭, 确保信号切换灵敏, 提高了准确性[63]。另外, ACQ染料遇水后, 其荧光强度可降至零[48], 这也极大地提高了检测的准确性。
|
Figure 3 The schematic demonstration of principles indicating intact nanocarriers in vivo by ACQ dyes (A) and a comparison of monitoring SLNs in vivo lipolysis process by ACQ dye P2 and conventional dye DiR respectively (B). Cited from reference[59] with permission. Copyrights 2019 Elsevier |
|
Figure 4 The chemical structures of four typical ACQ probes and water sensitivity in binary solvent system of acetonitrile and water. A: Fluorescence spectra of P2 in binary solvents with different contents of water; B: The curve of fluorescence of P2 vs water content indicating the water-sensitivity threshold; C: ACQ effect upon dispersing the acetonitrile solution of four probes into a 100% aqueous medium (ABS: Acetate buffered saline; PBS: Phosphate buffered saline; FaSSGF: Fasted-state simulated gastric fluid; SGF: Simulated gastric fluid; SIF: Simulated intestinal fluid); D: Visualized ACQ effect of P2 in acetonitrile (emitted) and water (quenched). Reprint from references[48, 59] with permission. Copyrights 2015 Elsevier |
ACQ染料也具有一定局限性。一方面, 大多数具有ACQ现象的荧光染料不具备遇水迅速且完全淬灭的性质, 在指示纳米载体完整性方面缺乏灵敏性; 另一方面, ACQ染料仅可用于脂质和疏水性聚合物形成的纳米载体[10, 48, 64, 65]。脂质载体如固体脂质纳米粒(SLN)、纳米结构脂质载体(NLC)及纳米乳等均具有强疏水性骨架, 染料可完全溶解其中而发射强荧光。强疏水性可阻止水分的渗入, 从而避免荧光提前淬灭的假阳性结果。然而, ACQ染料不适用于亲水性纳米载体, 这主要是因为水分可快速渗入亲水性骨架中, 导致染料分子在载体内部提前发生淬灭[66]。另外, ACQ染料的淬灭聚集体可能与其他分子发生疏水相互作用, 从而解聚, 导致荧光复现[56]。荧光分子重新分配进入疏水域而导致荧光复现是一个自然过程, 无法通过改变环境而消除, 但是只要能限制聚集体的解离即可减少荧光的复现, 因此可通过优化染料结构, 增加淬灭聚集体的内聚力, 进而避免发生解离导致荧光复现。
3 环境响应型染料在纳米粒体内命运研究中的应用FRET效应在研究纳米粒与细胞之间的相互作用及体内转运过程中有较好的应用[43]。AIE效应的应用主要集中在细胞水平阐释纳米粒的摄取及转运机制[44], 在其体内命运研究中应用较少, 这可能与大多数AIE荧光染料波长较短、组织穿透能力弱有关, 因此也有研究[67]通过FRET效应使AIE染料的发射波长红移。ACQ现象普遍存在于有机荧光分子中, 在发光研究领域通常被认为是不利因素, 应设法避免; 然而, ACQ效应对水环境的敏感性和实时响应恰好可被用来标记示踪纳米粒, 对其体内命运进行研究[59]。
3.1 聚合物胶束两亲性聚合物在水中自组装形成核-壳结构的纳米载体, 对于难溶性药物具有很好的包载能力[68], 其中紫杉醇聚合物胶束(Genexol-PM®)已在韩国上市[69]。胶束经注射后的体内过程一直备受争议[70], 一般认为胶束(包括聚合物胶束)进入体内后, 被血液稀释, 其浓度迅速降低至其临界胶束浓度(CMC)以下, 从而导致胶束结构被破坏[71, 72]; 但也不可否认的是胶束体系是最为常见的药物递送载体之一, 显然CMC在阐释其体内行为时参考意义并不大[73]。将FRET染料对DiO/DiI包裹于聚乙二醇聚乳酸(PEG-PDLLA)胶束中, 其FRET比例接近0.89, 静脉注射后观察到FRET效应快速降低, 结果提示胶束在体内有可能会迅速解离[74]。Morton等[34]将Cy5.5和Cy7分别与聚乙二醇聚炔丙基左旋谷氨酸酯(PEG-PPLG)连接, 然后将其制成胶束而产生FRET效应, 研究表明空白胶束在静脉注射后72 h内仍然有50%~85%保持完整, 而载药胶束只有约37%保持完整, 这表明胶束载药后在体内可加速解聚。He等[60]通过ACQ染料标记聚乙二醇聚己内酯(PEG-PCL)胶束研究了胶束粒子在体内的动力学行为, 发现完整胶束粒子可在血液中实现一定时间的长循环, 这与Morton等[34]结果类似, 说明胶束并不像其他研究报道[60]的那样不稳定。Li等[75]在斑马鱼模型上发现转铁蛋白修饰的PEG-PCL胶束可完整穿透小肠上皮细胞而被吸收。
Liow等[51]将AIE分子四苯乙烯(TPE)与聚氧乙烯/聚氧丙烯双亲性聚合物化学键合, 该聚合物可自组装形成具有温敏性的聚合物胶束。该胶束载多柔比星后局部注射到肿瘤部位, 多柔比星信号可持续维持14天之久, 而多柔比星溶液注射后24 h肿瘤部位就已经观察不到信号; 18天后升高肿瘤部位的温度, 温敏胶束迅速降解, 这表明胶束在肿瘤部位可保持长期稳定。Zhang等[76]用聚乙二醇磷脂酰乙醇胺(PEG-DSPE)同时包载了AIE荧光分子双(4-(N-(2-萘基)苯氨基)苯基)富马腈(NPAPF)和金纳米粒实现双模态成像, 观察到胶束在血液循环中具有较长的半衰期, 且可在肿瘤中蓄积。
3.2 聚合物纳米粒聚合物纳米粒作为递药载体, 可发挥靶向、促进吸收和提高药物稳定性等多方面的作用[77, 78]。聚合物的种类繁多且性质多样, 其纳米粒在体内的命运也不尽相同。聚合物纳米粒粒径较胶束大, 将染料包裹于纳米粒中, 由于其分散空间较大, 较难产生FRET效应。但是Li等[79]利用聚苯乙烯纳米粒的“膨胀-收缩”性质将DiD/DiR同时包载其中, 可产生明显的FRET效应, 据此对纳米粒口服后的体内过程进行了研究, 发现其胃肠转运与形状密切相关, 且可被完整转运进入淋巴。Zhao等[38]将Cy7和Cy5.5分别与PLGA及不同亲脂性的成分连接后组装成纳米粒, 研究其体内释放过程, 通过FRET效应表明所有载药纳米粒在体内都会发生突释现象, 且随着药物脂溶性增强, 其释放速度减缓。
聚合物纳米粒骨架具有一定的刚性, 可限制AIE染料分子内的旋转, 因此可以采用AIE染料进行荧光标记, 以研究其体内过程。采用AIE染料TPE-TPA-DCM标记白蛋白纳米粒, 注射给予荷瘤小鼠后, 发现荧光信号在肿瘤部位蓄积, 这表明完整的白蛋白纳米粒具有肿瘤靶向性[80]。也有研究采用纳米粒增强AIE分子的荧光, 从而用于分子影像的研究[81]。此外, 还有通过纳米粒包载AIE荧光分子进行光动力效应的研究[82]。
ACQ染料最适合用来研究疏水性纳米粒的体内命运。He等[83]以ACQ染料P2标记聚乙二醇化聚己内酯(mPEG-PCL)纳米粒, 静脉注射后, 发现PEG修饰可以延长纳米粒在体内的循环时间, 但是显然不如通常所报道的滞留时间长。通过荧光半定量及药物定量对粒子动力学和药物(紫杉醇)动力学进行了对比分析, 发现纳米粒进入血液后, 药物迅速泄露, 两者呈现出完全不同的动力学行为, 更多的空纳米粒分布进入组织[83]。Meng等[84]采用DiR标记PLGA纳米粒对其体内分布进行了研究, 但由于DiR具有浓度淬灭效应且无法完全淬灭, 体内监测结果具有一定的局限性。同时ACQ染料也被用于研究纳米粒眼部给药的转运过程, 发现玻璃体内注射可更有效地将完整纳米粒递送至视网膜, 纳米粒从视网膜快速消除, 而释放的药物分子可渗透进入视网膜[85]。
3.3 脂质纳米粒脂质纳米粒主要包括SLN、NLC及脂质药物共轭物(LDC)三种形式[86], 已被广泛用于提高难溶性或蛋白类药物的口服生物利用度。由于其主要组成成分为脂肪酸甘油酯, 因此可在胃肠道内被胰脂肪酶所降解[87, 88]。Hu等[48]采用ACQ染料P2标记SLN后, 首次研究了SLN在大鼠胃肠道内的实时脂解过程, 结果表明SLN在胃中滞留时间较长, 而进入肠道后可被迅速降解, 同时清楚地观察到大鼠在禁食、饱腹、高脂饮食及摄入脂肪酶抑制剂(奥利司他)状态下SLN的胃肠道转运和降解情况。另外, SLN促进药物口服吸收的机制一直存在争议, 有报道认为SLN自身可以被细胞摄取并转运进入血液循环, 从而促进吸收。Hu等[61]通过ACQ染料标记发现SLN难以穿透生物膜, 难以经口服吸收。Ma等[64]研究则在肝脏中观察到SLN的微弱荧光信号, 表明SLN有经口服被少量吸收的可能性。以较短波长ACQ染料(P4)进行标记, 共聚焦显微镜观察发现SLN和混合胶束均可被Caco-2细胞大量摄取, 但很难穿透细胞单层[61, 64]。ACQ染料标记的SLN在活体动物体内可实时观察到SLN在肺部沉积的情况[89], 不过肺部存在大量的生理性表面活性物质, 可能会造成较为严重的荧光复现, 从而干扰观察与测定。
Zhao等[90]将Cy7与脂质连接, 并将QD710物理包埋于脂质纳米粒中, 注射后30 min即观察到纳米粒在肿瘤中聚集, 并且荧光逐渐淬灭, 表明纳米粒发生了解聚。而通过Cy7的荧光追踪发现脂质被肝和肾所摄取, 进而在肾中消除。通过QD610-Cy5.5标记脂质纳米粒研究了纳米粒在体内的解聚动力学, 表明纳米粒在血液中的解聚半衰期为42 min[90]。目前还未见AIE染料用于研究脂质纳米粒体内命运的报道。
3.4 纳米乳与微乳将Cy5.5和Cy7包载于纳米乳内核可产生FRET效应, 体外研究证实FRET比例与纳米乳完整性相关, 注射后6 h在血液中有71%保持完整, 而在肿瘤中仅有40%保持完整[91]。而通过ACQ染料标记纳米乳, 注射后发现在血液中迅速被破坏, 30 min后只有大约30%纳米乳保持完整结构, 这与FRET效应所得结果有一定差异[92]。因此, 有必要在同等条件下比较各种方法的优劣和适用性。Xia等[65]对纳米乳经口服后体内的消化过程进行了可视化研究。通过活体成像观察发现, 纳米乳在胃肠道中的消化和细胞摄取具有粒径依赖性, 并发现一部分纳米乳粒子可通过淋巴转运被吸收并分布于肝脏和肺部。在透皮研究中发现80 nm的纳米乳能扩散进入活性表皮但无法完整穿透, 而纳米乳粒子可以沿着毛孔迁移到真皮以下588 μm[93], 药物释放后可进一步扩散进入真皮组织。Ahmad等[94]通过ACQ染料标记纳米乳, 研究了经鼻给药后的转运过程, 证实完整纳米载体很难通过鼻脑通路进入脑部, 而所载药物分子在释放后可部分入脑。
3.5 纳米结晶纳米结晶可用于口服、注射及透皮等多种给药途径, 在促进难溶性药物口服生物利用度方面有广泛的应用[95], 已有多个品种上市, 如非诺贝特(Tricor®)、阿瑞匹坦(Emend®)、甲地孕酮(Megace ES®)和帕利哌酮(Invega Sustenna®)等。纳米结晶进入体内后的变化过程一直是学术界讨论的热点。最初, 有人选择一些自身具有荧光的模型药物(如香豆素-6), 将其制成纳米结晶后去研究其体内过程, 但遗憾的是只有极少数的药物具有自发荧光[96]。受杂化纳米结晶的启发, 有研究者将荧光分子(如荧光素、罗丹明B、DiD、DiR、Cy5等[97])杂化入药物纳米结晶晶格中, 从而实现了对纳米结晶体内过程的实时观察[98]。但这些染料不具有环境响应性, 无法准确区分药物的结晶和溶解状态。Gao等[99]首先采用AIE染料(TPE)研究了纳米结晶在肿瘤细胞中的溶解动力学过程, 表明纳米结晶可被细胞直接摄取并在胞浆中逐步溶解。但是由于TPE波长较短, 不适合进行体内过程研究。Wang等[100]采用ACQ染料(P2)标记了姜黄素纳米结晶, 注射给药后发现大量纳米结晶在血中被迅速清除, 最终分布至肝和肺, 但是少部分结晶可在血液循环中维持48 h。Shen等[101, 102]进一步以ACQ染料研究了环孢素纳米结晶口服后的体内过程, 活体成像研究表明纳米结晶可在胃肠道中存续12~18 h, 其中一部分纳米结晶可通过上皮细胞转运吸收进入血液循环, 随后分布于肝和肺。另外, 可在Caco-2细胞单层模型的基底侧检测到荧光杂化纳米结晶, 这也表明纳米结晶以整体形式被转运穿透上皮细胞[102]。
3.6 脂质体脂质体是较早应用于临床的纳米制剂, 但是其在体内的完整性及转运过程仍然不甚清晰。FRET荧光染料对可被包载于脂质双分子层中而产生FRET效应, Li等[42]利用FRET效应研究了脂质体在细胞内转运过程中的完整性。体外结果表明, 当脂质体膜被完全破坏后, 仍有50%以上的FRET荧光保留。这主要是由于脂质膜与染料分子具有较强的亲和性, 当脂质体膜被破坏成为碎片后, 可能转变为胶束, 仍然可以保留部分荧光; 细胞研究结果表明, 大量脂质体可被完整地摄取进入细胞内, 而只有约10%的完整脂质体可被转运跨过细胞单层。也有研究利用FRET效应, 发现仅有小于0.1%的完整脂质体可跨过血脑屏障[103]。环境响应型荧光染料在脂质体体内命运研究中的应用依然有待进一步探索。
4 结论与展望纳米制剂发展到今天, 临床转化遇到的最大障碍在于缺少对其体内行为的准确认知, 而体内行为的研究依赖于各种标记手段, 因此发展能准确反映纳米载体自身体内存续状态的标记手段具有极其重要的作用。FRET、AIE及ACQ染料由于具有环境响应特性, 将其包载于纳米载体中可发射强荧光, 伴随着纳米载体骨架的降解, 探针分子被释放后发生信号切换或荧光淬灭。利用这一特点, 可实现对纳米粒体内命运的实时准确监测, 藉此可进一步对纳米载体在体内的转运、释药、降解甚至排泄过程进行全面的考察。本文所介绍的三类染料在研究纳米粒体内命运方面都具有一定的优势; 综合考量, ACQ染料更适合于体内命运研究。ACQ染料对生物介质中的水响应、灵敏度高, 且遇水完全淬灭、背景干扰小和普适性强, 已成功应用于系列纳米载体经不同途径给药后的体内命运研究。但是, ACQ效应是一个由疏水作用力驱使的自发过程, 仅适用于具有强疏水骨架或内核的纳米载体, 不适用于由亲水性聚合物组成的纳米载体; 另一方面, 荧光分子聚集体在体内亦可解聚, 重新分配进入生理疏水域中而导致荧光复现, 在一定程度上对检测造成了干扰。因此, 未来的工作可针对ACQ染料的缺陷对其进行结构优化, 进而更加准确地示踪纳米载体的体内行为, 为推动纳米制剂的临床转化提供可靠的研究工具。
| [1] | Park K. Drug delivery of the future: chasing the invisible gorilla[J]. J Control Release, 2016, 240: 2–8. DOI:10.1016/j.jconrel.2015.10.048 |
| [2] | Etheridge ML, Campbell SA, Erdman AG, et al. The big picture on nanomedicine: the state of investigational and approved nanomedicine products[J]. Nanomedicine, 2013, 9: 1–14. DOI:10.1016/j.nano.2012.05.013 |
| [3] | Shi J, Kantoff PW, Wooster R, et al. Cancer nanomedicine: progress, challenges and opportunities[J]. Nat Rev Cancer, 2017, 17: 20–37. DOI:10.1038/nrc.2016.108 |
| [4] | Tran S, DeGiovanni PJ, Piel B, et al. Cancer nanomedicine: a review of recent success in drug delivery[J]. Clin Transl Med, 2017, 6: 44. DOI:10.1186/s40169-017-0175-0 |
| [5] | Wicki A, Witzigmann D, Balasubramanian V, et al. Nanomedicine in cancer therapy: challenges, opportunities, and clinical applications[J]. J Control Release, 2015, 200: 138–157. DOI:10.1016/j.jconrel.2014.12.030 |
| [6] | Coty JB, Vauthier C. Characterization of nanomedicines: a reflection on a field under construction needed for clinical translation success[J]. J Control Release, 2018, 275: 254–268. DOI:10.1016/j.jconrel.2018.02.013 |
| [7] | Faria M, Bjornmalm M, Thurecht KJ, et al. Minimum information reporting in bio-nano experimental literature[J]. Nat Nanotechnol, 2018, 13: 777–785. DOI:10.1038/s41565-018-0246-4 |
| [8] | Manaia EB, Abucafy MP, Chiari-Andreo BG, et al. Physicochemical characterization of drug nanocarriers[J]. Int J Nanomedicine, 2017, 12: 4991–5011. DOI:10.2147/IJN.S133832 |
| [9] | Park K. Facing the truth about nanotechnology in drug delivery[J]. ACS Nano, 2013, 7: 7442–7447. DOI:10.1021/nn404501g |
| [10] | He H, Jiang S, Xie Y, et al. Reassessment of long circulation via monitoring of integral polymeric nanoparticles justifies a more accurate understanding[J]. Nanoscale Horiz, 2018, 3: 397–407. DOI:10.1039/C8NH00010G |
| [11] | Shi Y, van der Meel R, Theek B, et al. Complete regression of xenograft tumors upon targeted delivery of paclitaxel via pi-pi stacking stabilized polymeric micelles[J]. ACS Nano, 2015, 9: 3740–3752. DOI:10.1021/acsnano.5b00929 |
| [12] | Su C, Yang H, Sun H, et al. Bioanalysis of free and liposomal amphotericin B in rat plasma using solid phase extraction and protein precipitation followed by LC-MS/MS[J]. J Pharm Biomed Anal, 2018, 158: 288–293. DOI:10.1016/j.jpba.2018.06.014 |
| [13] | Su C, Liu Y, He Y, et al. Analytical methods for investigating in vivo fate of nanoliposomes: a review[J]. J Pharm Anal, 2018, 8: 219–225. DOI:10.1016/j.jpha.2018.07.002 |
| [14] | Feliu N, Docter D, Heine M, et al. In vivo degeneration and the fate of inorganic nanoparticles[J]. Chem Soc Rev, 2016, 45: 2440–2457. DOI:10.1039/C5CS00699F |
| [15] | Wang B, He X, Zhang Z, et al. Metabolism of nanomaterials in vivo: blood circulation and organ clearance[J]. ACC Chem Res, 2013, 46: 761–769. DOI:10.1021/ar2003336 |
| [16] | Jin Y, Kim D, Roh H, et al. Tracking the fate of porous silicon nanoparticles delivering a peptide payload by intrinsic photoluminescence lifetime[J]. Adv Mater, 2018, 30: e1802878. DOI:10.1002/adma.201802878 |
| [17] | Hu X, Dong X, Lu Y, et al. Bioimaging of nanoparticles: the crucial role of discriminating nanoparticles from free probes[J]. Drug Discov Today, 2017, 22: 382–387. DOI:10.1016/j.drudis.2016.10.002 |
| [18] | Zhu M, Nie G, Meng H, et al. Physicochemical properties determine nanomaterial cellular uptake, transport, and fate[J]. ACC Chem Res, 2013, 46: 622–631. DOI:10.1021/ar300031y |
| [19] | Bertrand N, Grenier P, Mahmoudi M, et al. Mechanistic understanding of in vivo protein corona formation on polymeric nanoparticles and impact on pharmacokinetics[J]. Nat Commun, 2017, 8: 777. DOI:10.1038/s41467-017-00600-w |
| [20] | He X, Ma Y, Li M, et al. Quantifying and imaging engineered nanomaterials in vivo: challenges and techniques[J]. Small, 2013, 9: 1482–1491. DOI:10.1002/smll.201201502 |
| [21] | Shaffer TM, Harmsen S, Khwaja E, et al. Stable radiolabeling of sulfur-functionalized silica nanoparticles with copper-64[J]. Nano Lett, 2016, 16: 5601–5604. DOI:10.1021/acs.nanolett.6b02161 |
| [22] | Stremersch S, Brans T, Braeckmans K, et al. Nucleic acid loading and fluorescent labeling of isolated extracellular vesicles requires adequate purification[J]. Int J Pharm, 2018, 548: 783–792. DOI:10.1016/j.ijpharm.2017.10.022 |
| [23] | Pellach M, Margel S. Preparation and characterization of uniform near IR polystyrene nanoparticles[J]. Photochem Photobiol, 2014, 90: 952–956. |
| [24] | Huang M, Yu R, Xu K, et al. An arch-bridge-type fluorophore for bridging the gap between aggregation-caused quenching (ACQ) and aggregation-induced emission (AIE)[J]. Chem Sci, 2016, 7: 4485–4491. DOI:10.1039/C6SC01254J |
| [25] | Wang T, Wang L, Li X, et al. Size-dependent regulation of intracellular trafficking of polystyrene nanoparticle-based drug-delivery systems[J]. ACS Appl Mater Interfaces, 2017, 9: 18619–18625. DOI:10.1021/acsami.7b05383 |
| [26] | Hollis CP, Weiss HL, Leggas M, et al. Biodistribution and bioimaging studies of hybrid paclitaxel nanocrystals: lessons learned of the EPR effect and image-guided drug delivery[J]. J Control Release, 2013, 172: 12–21. DOI:10.1016/j.jconrel.2013.06.039 |
| [27] | Lee B, Park BG, Cho W, et al. BOIMPY: fluorescent boron complexes with tunable and environment-responsive light-emitting properties[J]. Chemistry, 2016, 22: 17321–17328. DOI:10.1002/chem.201603837 |
| [28] | Yang Z, Cao J, He Y, et al. Macro-/micro-environment-sensitive chemosensing and biological imaging[J]. Chem Soc Rev, 2014, 43: 4563–4601. DOI:10.1039/C4CS00051J |
| [29] | Suetsugu A, Shimizu M, Saji S, et al. Visualizing the tumor microenvironment by color-coded imaging in orthotopic mouse models of cancer[J]. Anticancer Res, 2018, 38: 1847–1857. |
| [30] | Yang X, Shen S, Guo L, et al. An enzyme-responsive "Turn-on" fluorescence polymeric superamphiphile as a potential visualizable phosphate prodrug delivery vehicle[J]. Macromol Biosci, 2018, 18: e1800045. DOI:10.1002/mabi.201800045 |
| [31] | Förster T. Zwischenmolekulare energiewanderung und fluoreszenz[J]. Ann Phys-berlin, 1948, 437: 55–75. DOI:10.1002/andp.19484370105 |
| [32] | Lovell JF, Chen J, Jarvi MT, et al. FRET quenching of photosensitizer singlet oxygen generation[J]. J Phys Chem B, 2009, 113: 3203–3211. DOI:10.1021/jp810324v |
| [33] | Li H, Luo Y, Sun X. Fluorescence resonance energy transfer dye-labeled probe for fluorescence-enhanced DNA detection: an effective strategy to greatly improve discrimination ability toward single-base mismatch[J]. Biosens Bioelectron, 2011, 27: 167–171. DOI:10.1016/j.bios.2011.06.037 |
| [34] | Morton SW, Zhao X, Quadir MA, et al. FRET-enabled biological characterization of polymeric micelles[J]. Biomaterials, 2014, 35: 3489–3496. DOI:10.1016/j.biomaterials.2014.01.027 |
| [35] | Chen T, Li C, Li Y, et al. Small-sized mPEG-PLGA nanoparticles of schisantherin A with sustained release for enhanced brain uptake and anti-parkinsonian activity[J]. ACS Appl Mater Interfaces, 2017, 9: 9516–9527. DOI:10.1021/acsami.7b01171 |
| [36] | Akita H, Kudo A, Minoura A, et al. Multi-layered nanoparticles for penetrating the endosome and nuclear membrane via a step-wise membrane fusion process[J]. Biomaterials, 2009, 30: 2940–2949. DOI:10.1016/j.biomaterials.2009.02.009 |
| [37] | Zou P, Chen H, Paholak HJ, et al. Noninvasive fluorescence resonance energy transfer imaging of in vivo premature drug release from polymeric nanoparticles[J]. Mol Pharm, 2013, 10: 4185–4194. DOI:10.1021/mp4002393 |
| [38] | Zhao Y, Fay F, Hak S, et al. Augmenting drug-carrier compatibility improves tumour nanotherapy efficacy[J]. Nat Commun, 2016, 7: 11221. DOI:10.1038/ncomms11221 |
| [39] | Saha J, Datta Roy A, Dey D, et al. Role of quantum dot in designing FRET based sensors[J]. Mater Today, 2018, 5: 2306–2313. |
| [40] | Yan F, Bai Z, Chen Y, et al. Ratiometric fluorescent detection of copper ions using coumarin-functionalized carbon dots based on FRET[J]. Sensor Actuator Chem, 2018, 275: 86–94. DOI:10.1016/j.snb.2018.08.034 |
| [41] | Chen H, Kim S, Li L, et al. Release of hydrophobic molecules from polymer micelles into cell membranes revealed by Förster resonance energy transfer imaging[J]. Proc Natl Acad Sci U S A, 2008, 105: 6596–6601. DOI:10.1073/pnas.0707046105 |
| [42] | Li D, Zhuang J, Yang Y, et al. Loss of integrity of doxorubicin liposomes during transcellular transportation evidenced by fluorescence resonance energy transfer effect[J]. Colloids Surf B Biointerfaces, 2018, 171: 224–232. DOI:10.1016/j.colsurfb.2018.07.022 |
| [43] | Chen T, He B, Tao J, et al. Application of Forster resonance energy transfer (FRET) technique to elucidate intracellular and in vivo biofate of nanomedicines[J]. Adv Drug Deliv Rev, 2019, 143: 177–205. DOI:10.1016/j.addr.2019.04.009 |
| [44] | Wang Y, Zhang Y, Wang J, et al. Aggregation-induced emission (AIE) fluorophores as imaging tools to trace the biological fate of nano-based drug delivery systems[J]. Adv Drug Deliv Rev, 2019, 143: 161–176. DOI:10.1016/j.addr.2018.12.004 |
| [45] | Hong Y, Lam JW, Tang BZ. Aggregation-induced emission: phenomenon, mechanism and applications[J]. Chem Commun (Camb), 2009, 29: 4332–4353. |
| [46] | Luo J, Xie Z, Lam JWY, et al. Aggregation-induced emission of 1-methyl-1, 2, 3, 4, 5-pentaphenylsilole[J]. Chem Commun (Camb), 2001, 21: 1740–1741. |
| [47] | Chen JI, Wu WC. Fluorescent polymeric micelles with aggregation-induced emission properties for monitoring the encapsulation of doxorubicin[J]. Macromol Biosci, 2013, 13: 623–632. DOI:10.1002/mabi.201200396 |
| [48] | Hu X, Zhang J, Yu Z, et al. Environment-responsive aza-BODIPY dyes quenching in water as potential probes to visualize the in vivo fate of lipid-based nanocarriers[J]. Nanomedicine, 2015, 11: 1939–1948. DOI:10.1016/j.nano.2015.06.013 |
| [49] | Ye JH, Wang ZH, Liu J. A novel fluorescent sensor for Ag+ and Fe3+ based on aggregation-induced emission[J]. Adv Mater Res, 2013, 821-822: 909–912. DOI:10.4028/www.scientific.net/AMR.821-822.909 |
| [50] | Tong H, Hong Y, Dong Y, et al. Protein detection and quantitation by tetraphenylethene-based fluorescent probes with aggregation-induced emission characteristics[J]. J Phys Chem B, 2007, 111: 11817. DOI:10.1021/jp073147m |
| [51] | Liow SS, Dou Q, Kai D, et al. Long-term real-time in vivo drug release monitoring with AIE thermogelling polymer[J]. Small, 2017, 13: 1603404. DOI:10.1002/smll.201603404 |
| [52] | Zhang C, Jin S, Li S, et al. Imaging intracellular anticancer drug delivery by self-assembly micelles with aggregation-induced emission (AIE micelles)[J]. ACS Appl Mater Interfaces, 2014, 6: 5212–5220. DOI:10.1021/am5005267 |
| [53] | Birks JB. Photophysics of Aromatic Molecules[M]. London: Wiley- InterScience, 1970. |
| [54] | Förster T, Kasper K. Ein konzentrationsumschlag der fluoreszenz des pyrens[J]. Z Phys Chem (Munich), 1955, 59: 976–980. |
| [55] | Ma X, Sun R, Cheng J, et al. Fluorescence aggregation-caused quenching versus aggregation-induced emission: a visual teaching technology for undergraduate chemistry students[J]. J Chem Edu, 2015, 93: 345–350. |
| [56] | Zhai D, Xu W, Zhang L, et al. The role of "disaggregation" in optical probe development[J]. Chem Soc Rev, 2014, 43: 2402–2411. DOI:10.1039/c3cs60368g |
| [57] | Kunzler J, Samha L, Zhang R, et al. Investigation of the effect of concentration on molecular aggregation of cyanine dyes in aqueous solution[J]. Am J Undegrad Res, 2011, 9: 1–4. |
| [58] | Hong Y, Lam JW, Tang BZ. Aggregation-induced emission[J]. Chem Soc Rev, 2011, 40: 5361–5388. DOI:10.1039/c1cs15113d |
| [59] | Qi J, Hu X, Dong X, et al. Towards more accurate bioimaging of drug nanocarriers: turning aggregation-caused quenching into a useful tool[J]. Adv Drug Deliv Rev, 2019, 143: 206–225. DOI:10.1016/j.addr.2019.05.009 |
| [60] | He H, Zhang J, Xie Y, et al. Bioimaging of intravenous polymeric micelles based on discrimination of integral particles using an environment-responsive probe[J]. Mol Pharm, 2016, 13: 4013–4019. DOI:10.1021/acs.molpharmaceut.6b00705 |
| [61] | Hu X, Fan W, Yu Z, et al. Evidence does not support absorption of intact solid lipid nanoparticles via oral delivery[J]. Nanoscale, 2016, 8: 7024–7035. DOI:10.1039/C5NR07474F |
| [62] | Eggeling C, Widengren J, Rigler R, et al. Photobleaching of fluorescent dyes under conditions used for single-molecule detection: evidence of two-step photolysis[J]. Anal Chem, 1998, 70: 2651–2659. DOI:10.1021/ac980027p |
| [63] | Cheung S, O'Shea DF. Directed self-assembly of fluorescence responsive nanoparticles and their use for real-time surface and cellular imaging[J]. Nat Commun, 2017, 8: 1885. DOI:10.1038/s41467-017-02060-8 |
| [64] | Ma Y, He H, Xia F, et al. In vivo fate of lipid-silybin conjugate nanoparticles: implications on enhanced oral bioavailability[J]. Nanomedicine, 2017, 13: 2643–2654. DOI:10.1016/j.nano.2017.07.014 |
| [65] | Xia F, Fan W, Jiang S, et al. Size-dependent translocation of nanoemulsions via oral delivery[J]. ACS Appl Mater Interfaces, 2017, 9: 21660–21672. DOI:10.1021/acsami.7b04916 |
| [66] | Kamaly N, Yameen B, Wu J, et al. Degradable controlled-release polymers and polymeric nanoparticles: mechanisms of controlling drug release[J]. Chem Rev, 2016, 116: 2602–2663. DOI:10.1021/acs.chemrev.5b00346 |
| [67] | Geng J, Zhu Z, Qin W, et al. Near-infrared fluorescence amplified organic nanoparticles with aggregation-induced emission characteristics for in vivo imaging[J]. Nanoscale, 2014, 6: 939–945. DOI:10.1039/C3NR04243J |
| [68] | He Z, Wan X, Schulz A, et al. A high capacity polymeric micelle of paclitaxel: implication of high dose drug therapy to safety and in vivo anti-cancer activity[J]. Biomaterials, 2016, 101: 296–309. DOI:10.1016/j.biomaterials.2016.06.002 |
| [69] | Ahn HK, Jung M, Sym SJ, et al. A phase Ⅱ trial of Cremorphor EL-free paclitaxel (Genexol-PM) and gemcitabine in patients with advanced non-small cell lung cancer[J]. Cancer Chemoth Pharm, 2014, 74: 277–282. DOI:10.1007/s00280-014-2498-5 |
| [70] | Zhang Y, Li Q, Welsh WJ, et al. Micellar and structural stability of nanoscale amphiphilic polymers: implications for anti-atherosclerotic bioactivity[J]. Biomaterials, 2016, 84: 230–240. DOI:10.1016/j.biomaterials.2015.12.028 |
| [71] | Sun X, Wang G, Zhang H, et al. The blood clearance kinetics and pathway of polymeric micelles in cancer drug delivery[J]. ACS Nano, 2018, 12: 6179–6192. DOI:10.1021/acsnano.8b02830 |
| [72] | Sakai-Kato K, Nishiyama N, Kozaki M, et al. General considerations regarding the in vitro and in vivo properties of block copolymer micelle products and their evaluation[J]. J Control Release, 2015, 210: 76–83. DOI:10.1016/j.jconrel.2015.05.259 |
| [73] | Ke XY, Ng VWL, Gao SJ, et al. Co-delivery of thioridazine and doxorubicin using polymeric micelles for targeting both cancer cells and cancer stem cells[J]. Biomaterials, 2014, 35: 1096–1108. DOI:10.1016/j.biomaterials.2013.10.049 |
| [74] | Chen H, Kim S, He W, et al. Fast release of lipophilic agents from circulating PEG-PDLLA micelles revealed by in vivo Förster resonance energy transfer imaging[J]. Langmuir, 2008, 24: 5213–5217. DOI:10.1021/la703570m |
| [75] | Li Y, Song X, Yi X, et al. Zebrafish: a visual model to evaluate the biofate of transferrin receptor-targeted 7 peptide-decorated coumarin 6 micelles[J]. ACS Appl Mater Interfaces, 2017, 9: 39048–39058. DOI:10.1021/acsami.7b12809 |
| [76] | Zhang J, Li C, Zhang X, et al. In vivo tumor-targeted dual-modal fluorescence/CT imaging using a nanoprobe co-loaded with an aggregation-induced emission dye and gold nanoparticles[J]. Biomaterials, 2015, 42: 103–111. DOI:10.1016/j.biomaterials.2014.11.053 |
| [77] | Pridgen EM, Alexis F, Farokhzad OC. Polymeric nanoparticle drug delivery technologies for oral delivery applications[J]. Expert Opin Drug Deliv, 2015, 12: 1459–1473. DOI:10.1517/17425247.2015.1018175 |
| [78] | Fonte P, Araújo F, Silva C, et al. Polymer-based nanoparticles for oral insulin delivery: revisited approaches[J]. Biotechnol Adv, 2015, 33: 1342–1354. DOI:10.1016/j.biotechadv.2015.02.010 |
| [79] | Li D, Zhuang J, He H, et al. Influence of particle geometry on gastrointestinal transit and absorption following oral administration[J]. ACS Appl Mater Interfaces, 2017, 9: 42492–42502. DOI:10.1021/acsami.7b11821 |
| [80] | Qin W, Ding D, Liu J, et al. Biocompatible nanoparticles with aggregation-induced emission characteristics as far-red/near-infrared fluorescent bioprobes for in vitro and in vivo imaging applications[J]. Adv Funct Mater, 2012, 22: 771–779. DOI:10.1002/adfm.201102191 |
| [81] | Wu WC, Chen CY, Tian Y, et al. Enhancement of aggregation-induced emission in dye-encapsulating polymeric micelles for bioimaging[J]. Adv Funct Mater, 2010, 20: 1413–1423. DOI:10.1002/adfm.200902043 |
| [82] | Wu W, Mao D, Hu F, et al. A highly efficient and photostable photosensitizer with near-infrared aggregation-induced emission for image-guided photodynamic anticancer therapy[J]. Adv Mater, 2017, 29: 1700548. DOI:10.1002/adma.201700548 |
| [83] | He H, Xie Y, Lv Y, et al. Bioimaging of intact polycaprolactone nanoparticles using aggregation-caused quenching probes: size-dependent translocation via oral delivery[J]. Adv Healthc Mater, 2018, 7: e1800711. DOI:10.1002/adhm.201800711 |
| [84] | Meng F, Wang J, Ping Q, et al. Quantitative assessment of nanoparticle biodistribution by fluorescence imaging, revisited[J]. ACS Nano, 2018, 12: 6458–6468. DOI:10.1021/acsnano.8b02881 |
| [85] | Wan B, Dai Y, Liu D, et al. Intraocular fate of polycaprolactone nanoparticles administered via intravitreal and various periocular routes: bioimaging of integral nanoparticles using environment-sensitive fluorophores[J]. J Biomed Nanotechnol, 2017, 13: 960–972. DOI:10.1166/jbn.2017.2404 |
| [86] | Qi J, Lu Y, Wu W. Absorption, disposition and pharmacokinetics of solid lipid nanoparticles[J]. Curr Drug Metab, 2012, 13: 418–428. DOI:10.2174/138920012800166526 |
| [87] | Mu H, Hoy CE. The digestion of dietary triacylglycerols[J]. Prog Lipid Res, 2004, 43: 105–133. DOI:10.1016/S0163-7827(03)00050-X |
| [88] | Porter CJ, Trevaskis NL, Charman WN. Lipids and lipid-based formulations: optimizing the oral delivery of lipophilic drugs[J]. Nat Rev Drug Discov, 2007, 6: 231. DOI:10.1038/nrd2197 |
| [89] | Huang Z, Huang Y, Ma C, et al. Endotracheal aerosolization device for laboratory investigation of pulmonary delivery of nanoparticle suspensions: in vitro and in vivo validation[J]. Mol Pharm, 2018, 15: 5521–5533. DOI:10.1021/acs.molpharmaceut.8b00668 |
| [90] | Zhao Y, van Rooy I, Hak S, et al. Near-infrared fluorescence energy transfer imaging of nanoparticle accumulation and dissociation kinetics in tumor-bearing mice[J]. ACS Nano, 2013, 7: 10362–10370. DOI:10.1021/nn404782p |
| [91] | Bouchaala R, Mercier L, Andreiuk B, et al. Integrity of lipid nanocarriers in bloodstream and tumor quantified by near-infrared ratiometric FRET imaging in living mice[J]. J Control Release, 2016, 236: 57–67. DOI:10.1016/j.jconrel.2016.06.027 |
| [92] | Yang J, Dong Z, Liu W, et al. Discriminating against injectable fat emulsions with similar formulation based on water quenching fluorescent probe[J]. Chinese Chem Lett, 2019. DOI:10.1016/j.cclet.2019.07.016 |
| [93] | Su R, Fan W, Yu Q, et al. Size-dependent penetration of nanoemulsions into epidermis and hair follicles: implications for transdermal delivery and immunization[J]. Oncotarget, 2017, 8: 38214. |
| [94] | Ahmad E, Feng Y, Qi J, et al. Evidence of nose-to-brain delivery of nanoemulsions: cargoes but not vehicles[J]. Nanoscale, 2017, 9: 1174–1183. DOI:10.1039/C6NR07581A |
| [95] | Junyaprasert VB, Morakul B. Nanocrystals for enhancement of oral bioavailability of poorly water-soluble drugs[J]. Asian J Pharm Sci, 2015, 10: 13–23. DOI:10.1016/j.ajps.2014.08.005 |
| [96] | Pawar VK, Singh Y, Meher JG, et al. Engineered nanocrystal technology: in-vivo fate, targeting and applications in drug delivery[J]. J Control Release, 2014, 183: 51–66. DOI:10.1016/j.jconrel.2014.03.030 |
| [97] | Hollis CP, Weiss HL, Evers BM, et al. In vivo investigation of hybrid paclitaxel nanocrystals with dual fluorescent probes for cancer theranostics[J]. Pharm Res, 2014, 31: 1450–1459. DOI:10.1007/s11095-013-1048-x |
| [98] | Zhao R, Hollis CP, Zhang H, et al. Hybrid nanocrystals: achieving concurrent therapeutic and bioimaging functionalities toward solid tumors[J]. Mol Pharm, 2011, 8: 1985–1991. DOI:10.1021/mp200154k |
| [99] | Gao W, Lee D, Meng Z, et al. Exploring intracellular fate of drug nanocrystals with crystal-integrated and environment-sensitive fluorophores[J]. J Control Release, 2017, 267: 214–222. DOI:10.1016/j.jconrel.2017.08.031 |
| [100] | Wang T, Qi J, Ding N, et al. Tracking translocation of self-discriminating curcumin hybrid nanocrystals following intravenous delivery[J]. Int J Pharm, 2018, 546: 10–19. DOI:10.1016/j.ijpharm.2018.05.020 |
| [101] | Shen C, Yang Y, Shen B, et al. Self-discriminating fluorescent hybrid nanocrystals: efficient and accurate tracking of translocation via oral delivery[J]. Nanoscale, 2018, 10: 436–450. DOI:10.1039/C7NR06052A |
| [102] | Xie Y, Shi B, Xie F, et al. Epithelia transmembrane transport of orally administered ultrafine drug particles evidenced by environment sensitive fluorophores in cellular and animal studies[J]. J Control Release, 2018, 270: 65–75. DOI:10.1016/j.jconrel.2017.11.046 |
| [103] | Dai T, Jiang K, Lu W. Liposomes and lipid disks traverse the BBB and BBTB as intact forms as revealed by two-step Forster resonance energy transfer imaging[J]. Acta Pharm Sin B, 2018, 8: 261–271. DOI:10.1016/j.apsb.2018.01.004 |
 2019, Vol. 54
2019, Vol. 54


