2. 吉林医药学院 临床医学院, 吉林 吉林 132013;
3. 吉林医药学院 药学院, 吉林 吉林 132013
2. The Clinical Medicine of Jilin Medical University, Jilin 132013, China;
3. The Pharmacy College of Jilin Medical University, Jilin 132013, China
在糖尿病引起的多系统并发症中, 糖尿病性心肌病最为严重。其中, 心肌成纤维细胞(cardiac fibroblasts, CFb)过度增殖所致的心肌纤维化是糖尿病心肌病(diabetic cardiomopathy, DCM)的早期病理变化[1], 可影响心脏的收缩和舒张功能[2, 3]。因此, 在细胞水平研究高糖(high glucose, HG)对CFb的影响, 以确定有效靶点, 对改善DCM具有重要意义。苦参总黄酮(Sophoral flavones, SF)是苦参中最具生物活性的化合物之一, 具有广泛的生理活性, 包括抗菌作用、抗氧化作用及抗炎作用等[4-7]。本研究团队前期研究发现, 在糖尿病大鼠模型上, 观察到SF有降低血糖的倾向, 与卡托普利联合用药, 降血糖的作用更加明显; SF单用或与卡托普利联合应用均可以改善糖尿病所致的心肌纤维化及心肌损伤[8]。在前期工作的基础上, 本研究进一步观察SF对高糖诱导CFb增殖的影响及其机制。
材料与方法动物 采用1~3日龄SD大鼠乳鼠, SPF级雌雄不限, 购自辽宁长生生物技术股份有限公司, 动物合格证号: SCXK (辽) 2015-0001。实验过程中对动物处置方案经吉林医药学院伦理审查委员会批准。
试剂 SF (纯度 > 80%, 西安草翠芯生物科技有限公司)溶于改良型DMEM高糖培养基(上海源培生物科技股份有限公司), 并用高糖培养基进一步稀释至所需质量浓度(12.5、25和50 mg·L-1); 转化生长因子-β1 (TGF-β1)、基质金属蛋白酶-2 (MMP-2)、Ⅰ和Ⅲ型胶原蛋白(collagen Ⅰ和Ⅲ) ELISA试剂盒(语纯生物科技股份有限公司); β-Actin、抗增殖蛋白(PHB)等多克隆抗体(美国Abcam公司); Triton X-100、BCA蛋白浓度测定试剂盒(BCA Protein Assay Kit)、细胞周期试剂盒和BeyoECL Moon (极超敏ECL化学发光试剂盒) (碧云天公司)。
CFb的原代培养 取1~3日龄SD大鼠乳鼠, 无菌消毒后开胸取心脏, 制备成1 mm3左右的组织于预冷磷酸盐缓冲液(PBS)中; 0.125%胰酶反复消化。收集消化液, 离心(1 000 r·min-1, 5 min), 弃上清, 加入含10%血清的DMEM培养液重悬细胞, 差速贴壁120 min后获得CFb。本实验采用2~4代CFb。
细胞活性检测 将CFb分为对照组(含葡萄糖5 mmol·L-1)、高糖模型组(25 mmol·L-1葡萄糖)和3个用药组(高糖25 mmol·L-1 + SF 12.5、25或50 mg·L-1)。各条件孵育48 h, 保留上清液, 用含10% MTT培养基作用4 h。二甲基亚砜(DMSO) 150 μL溶解甲瓒结晶, 450 nm测定吸光度值。
TGF-β1、MMP-2、collagen Ⅰ和collagen Ⅲ含量检测 根据ELISA试剂盒说明, 加入标准品50 μL, 样品10 μL。然后将辣根过氧化物酶(horseradish peroxidase, HRP)偶联剂100 μL加入各孔中, 胶条覆盖, 37 ℃孵育60 min, 冲洗后在每孔中加入溶液A和溶液B各50 μL。轻轻混合并在37 ℃恒温孵育箱中孵育15 min。最后, 在每孔中加入终止溶液50 μL。在15 min内于450 nm处读取吸光度值, 检测各组TGF-β1、MMP-2、collagen Ⅰ和collagen Ⅲ的含量。
细胞周期检测 收集各组细胞, 置于预冷的PBS中洗涤两次, 70%冰乙醇固定, 4 ℃过夜。用含50 μL RNase和25 μL碘化丙啶的染料缓冲液(535 μL)重悬样品。37 ℃避光孵育30 min, 过滤, 在流式细胞仪上检测。
免疫荧光染色检测PHB核转移 将细胞置于24孔板中, 每孔1×104个细胞, 按实验分组处理后, 用4%多聚甲醛固定30 min, 用0.1% Triton X-100渗透10 min, 5%山羊血清阻断非特异性结合。随后, FITC结合的山羊抗兔PHB多克隆抗体检测PHB, 并用BX51荧光显微镜对染色细胞进行可视化。
PHB蛋白表达分析 预冷PBS洗涤细胞样品两次, 裂解。BCA蛋白检测试剂盒测定蛋白质浓度。蛋白(每孔30 μg)在100 V电压下分离20 min, 200 V电压下分离50 min, 转膜120 min, 5%脱脂奶封闭1 h, 抗体孵育, 用化学发光法对膜进行扫描处理, 测定总蛋白/β-actin的吸光度值。
统计学分析 所有数据均以均值±标准差表示, 统计分析使用SPSS 16.0软件和GraphPad 5.0软件分析处理, 各组比较采用方差分析和t检验, P < 0.05被认为具有统计学差异。
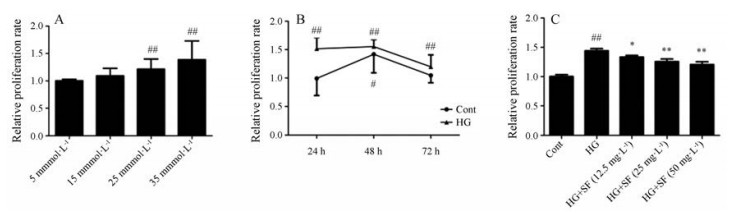
结果 1 高浓度葡萄糖对CFb活性的影响 1.1 不同浓度葡萄糖对CFb活性的影响选取15、25和35 mmol·L-1葡萄糖分别与CFb孵育48 h。结果显示, 与对照组相比, 25和35 mmol·L-1葡萄糖可提高CFb活力(P < 0.01)。后续实验采用25 mmol·L-1葡萄糖作用CFb制备增殖模型(图 1A)。
|
Figure 1 A: Effects of different concentrations of glucose on relative proliferation of cardiac fibroblasts (CFb). Following the incubation of CFb with normal (5 mmol·L-1) and high (15, 25, 35 mmol·L-1) D-glucose concentrations for 48 h. B: The effect of high glucose (HG) on the proliferation of CFb at different time points. The CFb were incubated with normal (5 mmol·L-1) and high (25 mmol·L-1) D-glucose concentrations for 24, 48 and 72 h, respectively. C: The effect of SF on the relative proliferation of CFb. Cells were incubated with normal (5 mmol·L-1), high (25 mmol·L-1) D-glucose concentrations and HG + (12.5, 25, 50 mg·L-1) Sophoral flavones (SF) for 48 h. n = 10, x ± s. #P < 0.05, ##P < 0.01 vs Cont (control) group; *P < 0.05, **P < 0.01 vs HG (model) group |
采用25 mmol·L-1葡萄糖分别处理CFb 24、48和72 h。结果显示, 与对照组24 h比较, 对照组细胞在48 h条件下有增殖(P < 0.05), 72 h增殖无统计学差异(P > 0.05), 高糖组在24和48 h均有增殖(P < 0.01) (图 1B)。因此, 采用25 mmol·L-1葡萄糖作用CFb 48 h制备CFb增殖模型, 作为高糖(HG)模型组。
2 SF对CFb活性的影响与HG模型组相比, SF (12.5~50 mg·L-1)处理48 h, CFb的活力显著降低(P < 0.05或P < 0.01), 且随SF剂量的增加, 改善CFb增殖作用增强(图 1C)。结果表明, SF (12.5~50 mg·L-1)可改善CFb增殖。因此, 采用12.5~50 mg·L-1 SF用于后续机制研究。
3 SF对CFb形态变化的影响将细胞分别培养48 h后, 用倒置相差显微镜观察各组细胞形态。结果可见, 对照组细胞较大, 胞浆丰富(图 2A); HG模型组细胞生长密集, 细胞体积较小, 增生活跃, 呈火焰状(图 2B); 与HG模型组比较, SF (12.5~50 mg·L-1)组细胞数量减少, 且随浓度增加, 药物抑制细胞增殖的作用增强(图 2C~E)。

|
Figure 2 Effect of SF on high glucose-induced morphological changes in CFb. Phase-contrast microscopy images are presented, showing the morphology of CFb following exposure to normal glucose (control, A), HG (model, 25 mmol·L-1, B), HG +12.5 mg·L-1 SF (C), HG + 25 mg·L-1 SF (D), HG+50 mg·L-1 SF (E). Magnification, × 200; bar = 100 μm |
与对照组比较, HG模型组的TGF-β1含量增加(P < 0.01); MMP-2含量在24和48 h增加(P < 0.01、P < 0.05); collagen Ⅰ分泌增加(P < 0.01); collagen Ⅲ在24和48 h分泌增多(P < 0.01) (表 1)。此结果验证了HG作用48 h可成功制备增殖模型。与HG模型组比较, 12.5~50 mg·L-1 SF可抑制MMP-2和collagen Ⅲ分泌(P < 0.01、P < 0.05); 25和50 mg·L-1 SF组可抑制TGF-β1和collagen Ⅰ分泌(P < 0.01、P < 0.05) (表 2)。结果表明, 12.5~50 mg·L-1 SF可通过改善细胞外基质含量而改善CFb增殖。
| Table 1 Effect of HG on transforming growth factor-β1 (TGF-β1), matrix metalloproteinase-2 (MMP-2), collagen Ⅰ and collagen Ⅲ content in CFb at different time points. n = 10, x ± s. # P < 0.05, ## P < 0.01 vs control group at same time |
| Table 2 Effect of SF on TGF-β1, MMP-2, collagen I and collagen III content in CFb induced by high glucose at 48 h. n = 4, x ± s. ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group |
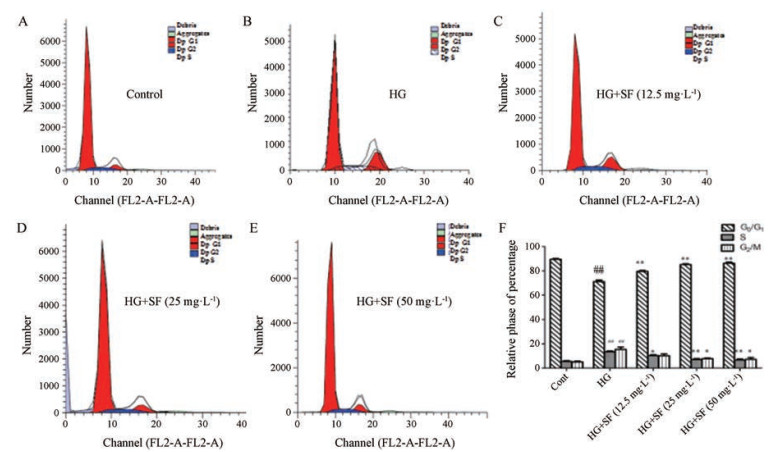
25 mmol·L-1葡萄糖可显著增加S期和G2期细胞数量, 减少G1期细胞数量。与HG模型组相比, SF组中G1期细胞数量明显增加, S期降低, 提示SF可使细胞周期阻滞在G1期(图 3A~F)。
|
Figure 3 Cell cycle charts at different stages. A: Control group; B: HG model group; C: HG + 12.5 mg·L-1 SF; D: HG + 25 mg·L-1 SF; E: HG + 50 mg·L-1 SF; F: Statistical analysis results. n = 3, x ± s. ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group |
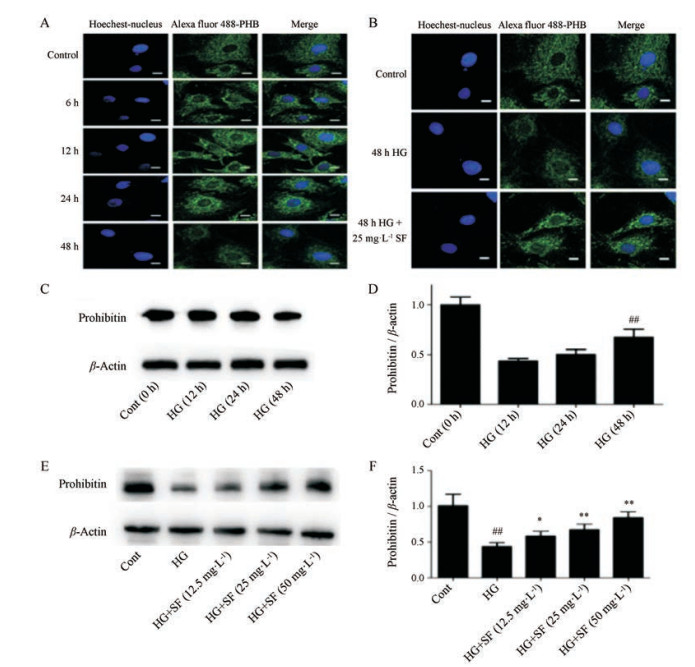
免疫荧光结果显示, 与对照组相比, HG模型组PHB在6、12和24 h表达增多, 48 h时PHB表达量减少。在25 mmol·L-1葡萄糖作用6 h后PHB从胞浆向胞核内转移, 胞核中PHB表达量增多(图 4A)。与HG模型组比较, 25 mg·L-1 SF作用细胞48 h可以促进PHB的表达, 但没有阻断PHB向核内转移(图 4B)。Western blot结果显示:与对照组比较, HG模型组PHB在12和24 h表达有升高趋势, 但无统计学差异, 48 h蛋白表达量降低(P < 0.01) (图 4C、D), 故在HG作用48 h条件下观察SF的作用; 与HG模型组比较, SF可促进PHB的表达, 随SF浓度增加, PHB表达量增多(P < 0.01, 图 4E、F)。
|
Figure 4 Prohibitin (PHB) expression and metastasis under high glucose at different time points (A). Effect of SF on PHB expression and metastasis under HG 48 h (B). PHB proteins are shown in green; Hoechst-labeled nucleus are shown in blue. Bar = 20 μm. Magnification, ×1 200. The effect of HG on the expression of PHB at different time points (C, D). The effect of SF on the expression of PHB under HG at 48 h (E, F). n = 3, x ± s. ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group |
糖尿病性心肌病发生于糖尿病患者, 排除高血压性心脏病、冠状动脉粥样硬化性心脏病及其他心脏病变的心肌疾病, 最终可发展为心力衰竭。心肌纤维化是糖尿病心肌病发展到一定阶段出现的病理现象, 主要表现为CFb过度增殖及细胞外基质(ECM)的过度沉积。本研究团队前期工作也证实, 在糖尿病大鼠模型上, 随着时间延长, 伴有心肌胶原含量增加, 心肌组织结构紊乱, 心脏功能受到抑制[8]。
本研究以5 mmol·L-1葡萄糖(即常规培养基中所含葡萄糖浓度)作为对照组, 观察不同浓度葡萄糖(15、25和35 mmol·L-1)在不同时间对CFb的影响。MTT结果表明, 15、25和35 mmol·L-1葡萄糖在48 h呈现出促进CFb增殖的趋势, 其中25和35 mmol·L-1的作用具有统计学意义。在作用持续时间方面, 高糖作用24、48和72 h都有促进CFb增殖作用。因此, 选取25 mmol·L-1葡萄糖作用于CFb 48 h为模型组。
机体内的TGF-β主要有3种类型, 其中TGF-β1不仅参与人体内多种器官的创伤与修复, 还通过激活成纤维细胞促使其分泌大量的ECM[9-11], 是主要的促纤维化因子[12]。研究表明, 高糖是诱导TGF-β1表达和活化的主要因素[9]。胶原是ECM的最重要成分, 在心脏内主要是Ⅰ型和Ⅲ型胶原蛋白。胶原蛋白的降解需要MMP-2的存在。在正常心脏结构中, MMP的表达和功能都受到严格的调控, 但在病理状态下, MMP的表达和活性增加会导致ECM失衡, 从而影响心脏的收缩、舒张功能[13]。研究中观察到25 mmol·L-1葡萄糖可促进TGF-β1、MMP-2的增多和细胞外基质Ⅰ型胶原蛋白、Ⅲ型胶原蛋白的过度分泌, 表明增殖模型建立成功。SF在12.5~50 mg·L-1内可抑制CFb增殖, 同时对以上指标均有改善作用, 细胞增殖周期也证实SF能够通过G0/G1阻滞改善高糖诱导的CFb增殖。
PHB家族是一种高度保守的多功能蛋白, 在酵母、植物、蠕虫、果蝇和哺乳动物中均有表达[14, 15], 其参与了细胞增殖、细胞凋亡、转录调控、发育及线粒体生物合成等过程[16]。PHB主要定位在线粒体中, 在细胞核及细胞质中也有表达, 其在不同位置的表达及其含量与其功能密切相关[17]。以往的研究表明, PHB表达的变化与ECM的沉积有关, PHB表达上调可有效缓解肺纤维化, 成为治疗组织纤维化的新靶点[18, 19]。本研究结果显示, PHB在CFb的胞浆及胞核中均有表达, 在高糖作用于CFb 6 h后PHB从胞浆向胞核内转移, 48 h整体表达量降低, 此结果与Western blot结果一致, 表明在高糖诱导CFb增殖过程中, PHB参与了调控。25 mg·L-1 SF可以促进PHB的表达, 提示在SF改善心肌纤维化过程中PHB参与其中, 但尚未观察到其对PHB核转移的影响。
综上所述, 本研究以高糖建立CFb增殖模型, SF具有改善细胞增殖的作用。在CFb增殖的过程中, 各靶点的变化时间是不一致的, 它们之间的关系是本研究下一步关注的内容。
| [1] | Yi X, Li XY, Zhou YL, et al. Hepatocyte growth factor regulates the TGF-β1-induced proliferation, differentiation and secretory function of cardiac fibroblasts[J]. Int J Mol Med, 2014, 34: 381–390. DOI:10.3892/ijmm.2014.1782 |
| [2] | Travers JG, Kamal FA, Robbins J, et al. Cardiac fibrosis: the fibroblast awakens[J]. Circ Res, 2016, 118: 1021–1040. DOI:10.1161/CIRCRESAHA.115.306565 |
| [3] | Zhou YM, Li MJ, Zhou YL, et al. Growth differentiation factor-15(GDF-15), novel biomarker for assessing atrial fibrosis in patients with atrial fibrillation and rheumatic heart disease[J]. Int J Clin Exp Med, 2015, 8: 21201–21207. |
| [4] | Chong ES, Hwang GB, Nho CW, et al. Antimicrobial durability of air filters coated with airborne Sophora flavescens nanoparticles[J]. Sci Total Environ, 2013, 444: 110–114. DOI:10.1016/j.scitotenv.2012.11.075 |
| [5] | Zhang L, Ravipati AS, Koyyalamudi SR, et al. Antioxidant and anti-inflammatory activities of selected medicinal plants containing phenolic and flavonoid compounds[J]. Agric Food Chem, 2011, 59: 12361–12367. DOI:10.1021/jf203146e |
| [6] | Jung HA, Jeong DM, Chung HY, et al. Re-evaluation of the antioxidant prenylated flavonoids from the roots of Sophora flavescens[J]. Biol Pharm Bull, 2008, 31: 908–915. DOI:10.1248/bpb.31.908 |
| [7] | Jin JH, Kim JS, Kang SS, et al. Anti-inflammatory and anti-arthritic activity of total flavonoids of the roots of Sophora flavescens[J]. J Ethnopharmacol, 2010, 127: 589–595. DOI:10.1016/j.jep.2009.12.020 |
| [8] | Chang Y, Lu Q, Wang Y, et al. Improvement effect of Sophora flavones combined with captopril on diabetic cardiomyopathy of rats[J]. J Jilin Univ (Med Ed) (吉林大学学报(医学版)), 2016, 42: 721–724. |
| [9] | Biernacka A, Dobaczewski M, Frangogiannis NG, et al. TGF-β signaling in fibrosis[J]. Growth Factors, 2011, 29: 196–202. DOI:10.3109/08977194.2011.595714 |
| [10] | Yang H, Feng AY, Lin SD, et al. Fibroblast growth factor-21 prevents diabetic cardiomyopathy via AMPK-mediated antioxidation and lipid-lowering effects in the heart[J]. Cell Death Dis, 2018, 9: 227. DOI:10.1038/s41419-018-0307-5 |
| [11] | Niu WX, Chen MH, Zhang N, et al. Pepstatin Pr show anti-fibrosis effect related to YAP-TGFβ-Smad pathway[J]. Acta Pharm Sin (药学学报), 2019, 54: 89–94. |
| [12] | Nuell MJ, Stewart DA, Walker L, et al. Prohibitin, an evolutionarily conserved intracellular protein that blocks DNA synthesis in normal fibroblasts and HeLa cells[J]. Mol Cell Biol, 1991, 11: 1372–1381. DOI:10.1128/MCB.11.3.1372 |
| [13] | Owczarczyk-Saczonek A, Drozdowski M, Maciejewska-Radomska A, et al. The effect of subcutaneous methotrexate on markers of metabolic syndrome in psoriatic patients-preliminary report[J]. Postepy Dermatol Alergol, 2018, 35: 53–59. DOI:10.5114/ada.2017.71358 |
| [14] | Dong WQ, Chao M, Lu QH, et al. Prohibitin overexpression improves myocardial function in diabetic cardiomyopathy[J]. Oncotarget, 2016, 7: 66–80. |
| [15] | Anderson CJ, Kahl A, Qian LP, et al. Prohibitin is a positive modulator of mitochondrial function in PC12 cells under oxidative stress[J]. J Neurochem, 2018, 146: 235–250. DOI:10.1111/jnc.14472 |
| [16] | Yang J, Li B, He QY. Significance of prohibitin domain family in tumorigenesis and its implication in cancer diagnosis and treatment[J]. Cell Death Dis, 2018, 9: 580. DOI:10.1038/s41419-018-0661-3 |
| [17] | Djehal A, Krayem M, Najem A, et al. Targeting prohibitin with small molecules to promote melanogenesis and apoptosis in melanoma cells[J]. Eur J Med Chem, 2018, 155: 880–888. DOI:10.1016/j.ejmech.2018.06.052 |
| [18] | Yuan C, Chen WX, Zhu JS, et al. IL-10 treatment is associated with prohibitin expression in the Crohn's disease intestinal fibrosis mouse model[J]. Mediat Inflamm, 2013, 2013: 617145. |
| [19] | Zhang F, Fan D, Mo XN. Prohibitin and the extracellular matrix are upregulated in murine alveolar epithelial cells with LPS-induced acute injury[J]. Mol Med Rep, 2018, 17: 7769–7773. |
 2019, Vol. 54
2019, Vol. 54


