hERG基因编码快速延迟整流钾通道的α亚基, 在动作电位3期复极化过程中起着重要的作用[1]。当hERG基因发生突变或hERG通道被阻滞时, 均可引起长QT综合征(LQTS), 诱发尖端扭转性心律失常, 致使患者发生心源性猝死[2]。而获得性LQTS的发生率远高于遗传性LQTS, 并且最常见的是多样化药物通过阻断hERG通道减小电流而导致的[3]。
小檗碱(berberine, BBR)是一种存在于多种植物中的异喹啉生物碱, 包括黄连和小檗碱属小檗碱等[4]。临床用于治疗2型糖尿病、神经退行性疾病、癌症, 以及用于高脂血症和高血压的辅助治疗[5, 6]。小檗碱通过稳定低密度脂蛋白受体信使RNA而达到降血脂作用, 这与传统他汀类药物降血脂作用不同[7]。研究表明, BBR还能够有效抑制动脉粥样硬化的发生发展, 将来很可能成为一种重要的治疗动脉粥样硬化乃至心血管疾病的药物。小檗碱的氢化衍生物二氢小檗碱(dihydroberberine, DHB)较小檗碱显示出更好的吸收和口服生物利用度[8], 是开发新药的潜在候选药物。格列本脲(glyburide; Gly)和瑞舒伐他汀(rosuvastatin, R)分别是临床上常用的降糖药和降脂药。川芎嗪(ligustrazine, L)具有抗血小板聚集、扩张小动脉、改善微循环和脑血流的作用, 临床常用于治疗闭塞性血管疾病和预防脑血栓形成。
应用大剂量他汀类药物治疗高血脂症时, 不仅剂量加倍后其降脂疗效非常有限, 且不良反应随着剂量的增加呈线性增高。因此, 将小檗碱与他汀类药物联合用药逐渐成为治疗高血脂症的新方案。脂质代谢紊乱是临床常见的糖尿病并发症, 一些患者降糖同时需加用降脂药物。此外, 研究表明在大鼠急性心肌梗塞模型中, 川芎嗪和小檗碱联合使用比两药单用对血小板活化和炎症反应的抑制效果更佳[9]。作者前期的研究表明, 小檗碱能阻断开放状态的hERG通道[10], 并延长非洲爪蟾动作电位时长[11], 二氢小檗碱同样会阻断hERG通道[8]。文献报道, 格列本脲[12, 13]和瑞舒伐他汀[14, 15]均能抑制hERG通道而延长QT间期, 具有潜在的诱发心律失常风险。小檗碱类药物、瑞舒伐他汀及格列本脲相互间联合应用时是否会增强对hERG通道的抑制作用尚不明确; 川芎嗪单独使用以及小檗碱与川芎嗪合用后对hERG通道的影响亦不确定。为此, 本研究利用全细胞膜片钳技术, 探究小檗碱类药物与瑞舒伐他汀、格列本脲以及川芎嗪联合应用时对hERG通道的影响, 评价其联合应用的安全性, 为这些药物临床安全用药提供理论依据。
材料与方法药品与试剂 胎牛血清(fetal bovine serum, FBS, Gibco公司); 遗传霉素(geneticin, G418, Invitrogen公司); DMEM (Hyclone公司); 小檗碱、瑞舒伐他汀(Sigma公司); 二氢小檗碱(成都克洛玛公司); 格列本脲(美伦生物公司); 川芎嗪(中国食品药品检定研究院)。
实验细胞及培养 本实验所使用的细胞为稳定表达hERG基因的HEK293细胞株(由加拿大蒙特利尔心脏研究所馈赠)。将细胞培养于含10% FBS和400 μmol·L-1 G418的DMEM培养液中, 于37 ℃、5% CO2饱和湿度孵箱培养。
药品配制 小檗碱:用42 ℃去离子水溶解, 配制成母液(3 mmol·L-1), 4 ℃保存; 二氢小檗碱:用少量DMSO与去离子水混合溶剂溶解, 配制成母液(10 mmol·L-1), 4 ℃保存; 瑞舒伐他汀:溶于HEPES缓冲液, 配制成母液(0.125 mmol·L-1), 4 ℃保存; 格列本脲:用少量DMSO与去离子水混合溶剂溶解, 配制成母液(5 mmol·L-1), 室温避光保存; 川芎嗪:溶于甲醇, 配制成母液(10 mmol·L-1), 4 ℃保存。
液体配制 台式液(mmol·L-1): NaCl 136、葡萄糖10、KCl 5.4、HEPES 5、MgCl2·6H2O 1和CaCl2 1, 用NaOH调pH值至7.4;电极内液(mmol·L-1): KCl 130、HEPES 10、Mg-ATP 5、EGTA 5、MgCl2·6H2O 1和GTP 0.1, 用KOH调pH值至7.3。
电生理记录 应用全细胞膜片钳技术记录hERG通道电流及其动力学。膜片钳实验前, 从细胞培养箱中取出细胞, 用PBS洗涤2~3遍, 加入胰酶进行细胞消化, 待消化到适当程度时, 加入细胞培养液终止消化, 吹散细胞使之成为单细胞悬液, 转移至离心管中, 1 500 r·min-1离心5 min, 弃去培养液, 加入用氧饱和度100%、pH值已校正过的含钙台式液将细胞沉淀重新悬浮并混匀, 稳定1.5 h后, 将单细胞悬液滴加到含有预置台式液的浴槽中, 静置10 min, 待细胞贴于浴槽底部后, 选取其中表面较清洁、边缘整齐和折光性好的细胞, 在室温(22~23 ℃)下用尖端阻值2~4 MΩ含有电极内液的玻璃微电极进行封接实验。形成全细胞构型后, 钳制5 min以获得稳定的膜电流和膜电位, 电压钳模式下记录hERG电流及通道动力学。实验过程由计算机软件pCLAMP9.2控制, 数模转换器完成刺激信号的产生、反馈信号的采集及数据分析。电极液和台式液之间的液接电位(10~11 mV)未补偿。信号输入经过1 kHz的滤波, 数据存于计算机硬盘以便分析。
统计学分析 膜片钳数据分析:记录的数据以pCLAMP软件, 将单个全细胞记录进行图形和数据转换, 用GraphPad Prism软件将数据进行曲线拟合, 绘制通道的标准化电流-电压曲线(I~V曲线), 并进行统计分析。数据选用Student's t检验应用两样本间的平均数比较, P < 0.05时, 认为有统计学意义, 实验数据用均值±标准误(x ± SEM)表示。电流密度(pA/pF) =电流强度/电容, 最大促进率Imax = (Idrug-Icontrol)/Icontrol。
结果 1 小檗碱与格列本脲联合应用对hERG通道的影响 1.1 小檗碱与格列本脲联合应用对hERG电流的抑制作用很多糖尿病患者都伴有高脂血症, 临床上常将小檗碱与格列本脲合用治疗糖尿病, 已有研究表明格列本脲单独使用对hERG通道具有抑制作用[13], 前期实验结果小檗碱抑制hERG电流的IC50值为3.1 μmol·L-1 [10], 利用膜片钳技术探究了小檗碱(3 μmol·L-1)与格列本脲(50 μmol·L-1, 临床常用量)合用对hERG通道电流的影响。将保持电压固定于-80 mV, 以10 mV为步阶, 施以-60 mV~+40 mV, 4 s去极化脉冲记录hERG稳态电流; 实验电压保持在-50 mV, 脉冲持续2 s记录hERG尾电流(图 1)。图 1A为代表图, 图 1B为hERG尾电流I~V曲线。小檗碱、格列本脲及二者合用后对hERG电流的抑制率分别为47.50%、44.76%和62.02%。结果表明, 在+40 mV时, 小檗碱与格列本脲合用后对hERG电流抑制作用明显强于二者单独使用(P < 0.05)。
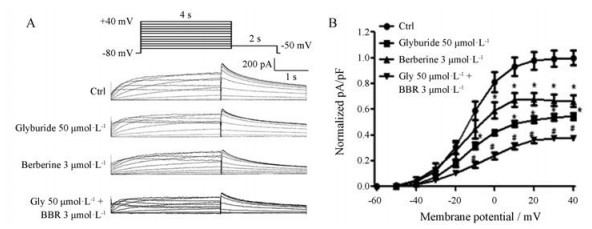
|
Figure 1 The inhibition of berberine (BBR), glyburide (Gly) and the combination of BBR with Gly on the hERG currents after instantaneous perfusion. Voltage clamp protocol and representative current traces before and after exposure to 3 μmol·L-1 BBR, 50 μmol·L-1 Gly and the combination (A). The normalized I-V relationships tail currents in the absence and presence of drugs (B). n = 10, x ± SEM. *P < 0.05 vs control (Ctrl) |
将不同测试电压下的hERG尾电流标准化, 所得数据经Boltzmann sigmoidal方程拟合, 得到hERG通道激活曲线(图 2A), 从实验结果中可以得出, 格列本脲与小檗碱合用后抑制hERG通道的激活(P < 0.05)。药物合用后对hERG通道稳态失活的影响进行了探究, 图 2B为相应刺激程序及代表图, 经Boltzmann sigmoidal方程拟合后, 得到稳态失活曲线(图 2C)。图 2C结果表明, 两药合用后对hERG通道稳态失活无影响; 检测药物对通道的失活时间常数及复活时间常数的影响, 相应刺激程序及代表图见图 2D、E; 图 2F为统计图, 结果证明格列本脲与小檗碱合用后对hERG通道复活时间常数无影响, 与对照组相比, 明显缩短通道的瞬时失活时间常数(P < 0.05), 但合用组与小檗碱组相比对失活的影响不明显。
|
Figure 2 The effects of BBR, Gly and the combination of BBR with Gly on the hERG channel kinetics after instantaneous perfusion. A: Voltage-dependent activation curves of the control and following exposure to BBR, Gly and the combination of BBR and Gly were best fit to a Boltzmann function; B: A double-pulse protocol with a step repolarization from 120 mV to +20 mV to elicit representative current tracing for steady-state inactivation and representative current tracing of steady-state inactivation; C: Normalized steady-state inactivation curves before and after exposure to the drugs; D: Voltage clamp protocol and representative current tracing for onset of hERG channel inactivation; E: Voltage clamp protocol and representative current tracing for the recovery from inactivation; F: Time constants for onset of inactivation and recovery from inactivation before and after exposure to the drugs. n = 6, x ± SEM. *P < 0.05 vs Ctrl |
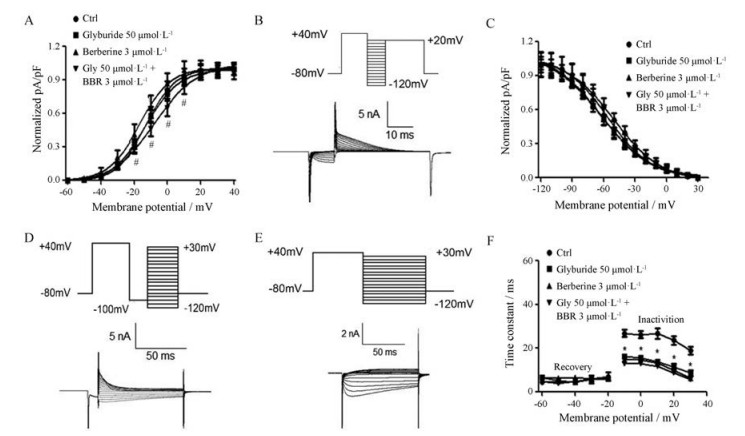
利用膜片钳技术确定了小檗碱与瑞舒伐他汀合用后对hERG电流的影响, 探讨3 μmol·L-1小檗碱与0.4 μmol·L-1 (临床用药剂量)瑞舒伐他汀合用后对hERG电流的抑制作用。将保持电压固定于-80 mV, 以10 mV为步阶, 施以-60 mV~+40 mV, 2 s去极化脉冲记录hERG稳态电流; 实验电压保持在-50 mV, 脉冲持续4 s, 记录hERG尾电流。图 3A为代表图; 图 3B为hERG尾电流I~V曲线, 如图所示, hERG尾电流I~V曲线表明瑞舒伐他汀与小檗碱合用后对hERG电流的抑制作用强于二者单独使用(P < 0.05)。在+40 mV时, 3 μmol·L-1小檗碱、0.4 μmol·L-1瑞舒伐他汀及两药合用对hERG通道的抑制率分别为54.99%、43.72%和68.66%。

|
Figure 3 The combination of BBR with rosuvastatin (R) inhibit hERG current but do not affect the hERG channel kinetics after instantaneous perfusion. A: Voltage clamp protocol and representative current traces before and after exposure to 3 μmol·L-1 BBR, 0.4 μmol·L-1 R and the combination; B: Normalized I-V relationships tail currents in the absence and presence of drugs. n = 11, x ± SEM. **P < 0.01, ***P < 0.001 vs Ctrl; C: Voltage-dependent activation curves of the control and following exposure to the combination of BBR and R were best fit to a Boltzmann function; D: Normalized steady-state inactivation curves before and after exposure to the two drugs; E: Time constants for onset of inactivation and recovery from inactivation before and after exposure to the two drugs. n = 8, x ± SEM |
将hERG尾电流标准化后, 数据经Boltzmann sigmoidal方程拟合, 得到hERG通道激活曲线(图 3C), 结果表明, 3 μmol·L-1小檗碱与0.4 μmol·L-1瑞舒伐他汀合用后对通道激活无明显影响。图 3D结果显示, 瞬时给药对hERG通道稳态失活没有明显影响。图 3E结果证明, 小檗碱与瑞舒伐他汀合用后对通道复活以及失活时间常数没有影响。
3 二氢小檗碱与格列本脲联合应用对hERG通道的影响 3.1 二氢小檗碱与格列本脲联合应用对hERG电流的抑制作用二氢小檗碱作为小檗碱的加氢衍生物, 稳定性更好, 有可能成为小檗碱的替代药物。前期研究结果得到二氢小檗碱抑制hERG电流的IC50值为10.5 μmol·L-1 [8], 本研究应用膜片钳技术探讨10 μmol·L-1二氢小檗碱与50 μmol·L-1格列本脲合用后对hERG通道电流的影响。由图 4A可见, 二氢小檗碱组抑制率36.13%、格列本脲组抑制率49.88%, 而二者合用组抑制率增大为60.55%。结果表明, 二氢小檗碱与格列本脲合用后对hERG电流的抑制作用强于二者单独使用(P < 0.05)。

|
Figure 4 Instantaneous effects of dihydroberberine (DHB), Gly, and the combination of DHB with Gly on the hERG currents. A: Representative current traces under control and exposure to 10 μmol·L-1 DHB, 50 μmol·L-1 Gly, and the combination. Normalized I-V relationships tail currents in the absence and presence of drugs. B: Voltage-dependent activation curves for the control and following exposure to the combination of drugs; C: Normalized steady-state inactivation curves before and after exposure to the drugs; D: Time constants for onset of inactivation and for recovery from inactivation before and after exposure to the combination. n = 10, x ± SEM. *P < 0.05 vs Ctrl. Traces in B-D were recorded using protocols shown in Figure 2 |
将hERG尾电流标准化后, 数据经Boltzmann sigmoidal方程拟合, 得到hERG通道激活曲线(图 4B), 从实验结果可以得出二氢小檗碱与格列本脲合用后对hERG通道的激活无影响; 由图 4C可知, 两药合用后对hERG通道稳态失活无影响。结果证明, 二氢小檗碱与格列本脲合用后对hERG通道复活时间常数无影响, 但是会缩短瞬时失活时间常数(P < 0.05);与二氢小檗碱组相比, 合用组对瞬时失活的影响不明显(图 4D)。
4 二氢小檗碱与瑞舒伐他汀联合应用对hERG通道的影响 4.1 二氢小檗碱与瑞舒伐他汀联合应用对hERG电流的抑制作用将保持电压固定于-70 mV, 以10 mV为步阶, 施以-60 mV~+40 mV, 2 s去极化脉冲记录hERG稳态电流; 实验电压保持在-50 mV, 脉冲持续2.7 s记录hERG尾电流。结果表明, 二氢小檗碱与瑞舒伐他汀合用对hERG电流的抑制作用明显强于二者单独使用, 在+40 mV, 二氢小檗碱、瑞舒伐他汀和二者合用的抑制率分别为36.13%、41.60%和55.52% (图 5A)。
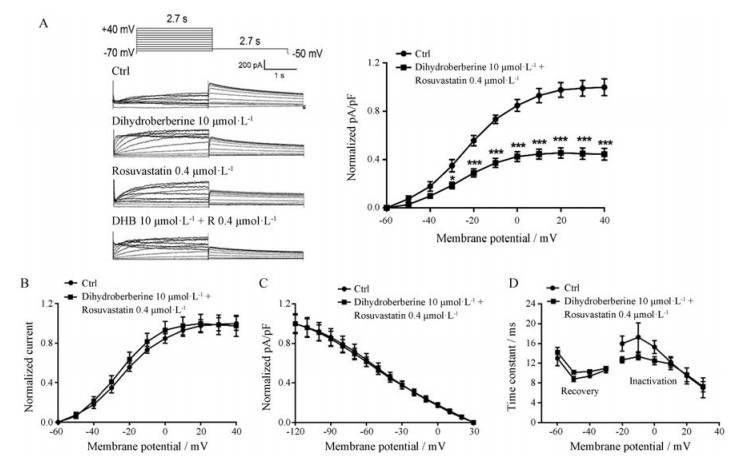
|
Figure 5 The combination of DHB with R inhibit hERG current but do not affect the hERG channel kinetics after instantaneous perfusion. A: Voltage clamp protocol and representative current traces before and after exposure to the combination were recorded using illustrated voltage clamp protocol (left). Normalized I-V relationships of tail currents in the absence and presence of drugs (right). n = 11, x ± SEM. *P < 0.05, ***P < 0.001 vs Ctrl; B: Voltage-dependent activation curves for the control and following exposure to the combination of drugs; C: Normalized steady-state inactivation curves before and after exposure to the two drugs; D: Time constants for onset of inactivation and for recovery from inactivation before and after exposure to the combination. Traces in B-D were recorded using protocols shown in Figure 2. n = 10, x ± SEM |
将hERG尾电流标准化后, 数据经Boltzmann sigmoidal方程拟合, 得到hERG通道激活曲线(图 5B), 结果证明, 二氢小檗碱与瑞舒伐他汀合用后对hERG通道激活无影响; 图 5C为稳态失活曲线, 二氢小檗碱与瑞舒伐他汀合用后对hERG通道的稳态失活无影响; 由图 5D可知, 二氢小檗碱与瑞舒伐他汀合用后对hERG通道的复活时间常数和瞬时失活时间常数均无影响。
5 小檗碱与川芎嗪联合应用对hERG电流的影响小檗碱与川芎嗪联合使用可明显改善心功能, 减少心肌坏死; 两药联用的保护作用比单用川芎嗪或小檗碱更为突出[9]。如图 6所示, 在+40 mV时, 川芎嗪对hERG电流促进4.52%, 与对照组相比无显著差异; 小檗碱组、小檗碱与川芎嗪合用组与对照组相比显著抑制hERG电流, 抑制率分别为44.68%和40.84%;小檗碱组与合用组相比无显著差异。结果说明, 小檗碱与川芎嗪合用后, 并没有增加小檗碱对hERG电流的抑制作用, 即二者合用心脏安全性较好。
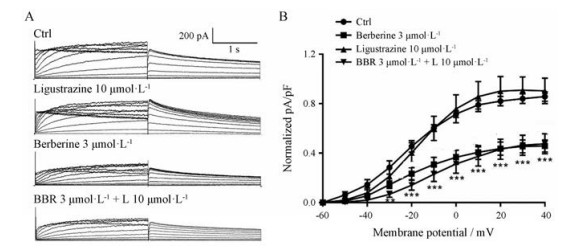
|
Figure 6 The effects of BBR, ligustrazine (L) and the combination of BBR with L on the hERG currents after instantaneous perfusion. A: Representative current traces before and after exposure to 3 μmol·L-1 BBR, 10 μmol·L-1 L and the combination; B: Normalized I-V relationships tail currents in the absence and presence of drugs. n = 8, x ± SEM. **P < 0.01, ***P < 0.001 vs Ctrl |
高血脂症是由于脂肪运转或代谢异常从而导致血浆中脂质含量异常的一种疾病。根据发病原因的不同可以分为原发性和继发性。原发性高脂血症主要与遗传和先天性因素有关; 继发性高脂血症的成因比较复杂, 饮食不当、雌激素治疗、糖尿病、甲状腺机能减退、红斑狼疮及慢性肾病等均可能促成高脂血症。高脂血症是心血管疾病的危险因素之一, 可直接引起一些严重危害人体健康的疾病, 如动脉粥样硬化、冠心病等。
高血糖是空腹血糖高于6.1 mmol·L-1的一种疾病, 主要由遗传因素或环境因素引起, 是许多急性环境中死亡的独立预测因子, 包括心肌梗死、创伤、头部损伤和中风等[16, 17]。与此同时, 高血糖还是感染的危险因素, 且与急性疾病的死亡率增加有关[18]。高血糖可以通过多种机制对人体造成伤害, 并且这种伤害在重症患者中更加明显, 可同时激活多种炎症过程。
联合用药具有增加药物的治疗功效和降低药物不良反应的优点。高脂血症和高血糖症在人体内往往相伴相生。故临床上常需将降脂药和降糖药合用, 而且降脂药与格列本脲联合应用不易发生低血糖现象, 不会加重胰岛素抵抗。他汀类药物瑞舒伐他汀为治疗高脂血症的首选药物, 一般来说, 他汀类药物发生严重的不良反应较少, 因此该类药物被认为是安全的[19, 20]。但是其不良反应(如肌肉毒性)降低了患者对他汀类药物的耐受性, 是导致药物停药或剂量减少的常见原因[21]。即使最强大的他汀类药物单用时, 也不能在最严重的家族性高胆固醇血症和心血管疾病风险很高的患者中优化低密度脂蛋白胆固醇水平, 因此他汀类药物与其他降脂药的联合治疗可能成为临床实践中的新选择[22, 23]。临床应用表明, 小檗碱用于治疗高血脂患者疗效较好, 而且适用于肝功能障碍患者。故小檗碱类药物与瑞舒伐他汀合用可能成为临床上治疗高脂血症的新方案。
本课题组前期研究发现, 小檗碱及其同系物二氢小檗碱, 以及瑞舒伐他汀和格列本脲对hERG电流均具有抑制作用, 同时研究显示小檗碱、瑞舒伐他汀均能明显延长豚鼠QT间期。hERG电流的抑制会导致动作电位3期复极化过程减慢, 动作电位时程延长, 进而导致LQTs的发生。研究表明, 小檗碱及其同系物二氢小檗碱与瑞舒伐他汀和格列本脲合用时对hERG电流的抑制作用均比单独使用一种药物时强, 为了明确其抑制hERG电流的离子机制, 探讨了以上药物对hERG通道动力学的影响。结果发现小檗碱、二氢小檗碱和瑞舒伐他汀合用对hERG通道的激活、稳态失活、复活及瞬时失活均无明显影响。由相关文献[15]可知, 小檗碱、二氢小檗碱及瑞舒伐他汀的作用位点均为hERG通道656、652位芳香族氨基酸苯丙氨酸F656和酪氨酸Y652, 二者可能因作用于相同位点而产生更强的抑制作用。小檗碱与格列本脲合用时, 对hERG通道的稳态失活及复活无明显影响, 但能够抑制hERG通道的激活, 同时缩短瞬时失活常数, 加快hERG通道的瞬时失活; 合用组与小檗碱组相比, 对失活的影响不明显。二氢小檗碱与格列本脲合用时, 对hERG通道的激活、稳态失活及复活无明显影响, 加快hERG通道的瞬时失活; 合用组与二氢小檗碱组相比, 对失活的影响不明显。上述结果说明单用小檗碱类及合用时, 因缩短瞬时失活常数, 加快hERG通道的瞬时失活, 最终导致hERG电流减少, 动作电位时程延长, 进而可能导致QT间期的延长, 合用时更易诱发。小檗碱与川芎嗪合用组对hERG电流抑制作用与小檗碱组相比无显著差异, 说明没有增加小檗碱的心脏毒性。由此得出, 当小檗碱与其他延长QT间期的药物联合用于治疗高脂血症及高血糖时, 有必要调整各自药物的剂量以避免产生严重的心脏毒性。
| [1] | Sanguinetti MC, Jiang CA, Curran ME, et al. A mechanistic link between an inherited and an acquird cardiac arrthytmia: HERG encodes the IKr potassium channel[J]. Cell, 1995, 81: 299–307. DOI:10.1016/0092-8674(95)90340-2 |
| [2] | Sanguinetti MC, Tristani-Firouzi M. hERG potassium channels and cardiac arrhythmia[J]. Nature, 2006, 440: 463–469. DOI:10.1038/nature04710 |
| [3] | Thurner P, Stary-Weinzinger A, Gafar H, et al. Mechanism of hERG channel block by the psychoactive indole alkaloid ibogaine[J]. J Pharmacol Exp Ther, 2014, 348: 346–358. DOI:10.1124/jpet.113.209643 |
| [4] | Imenshahidi M, Hosseinzadeh H. Berberis vulgaris and berberine: an update review[J]. Phytother Res, 2016, 30: 1745–1764. DOI:10.1002/ptr.5693 |
| [5] | Wang K, Feng XC, Chai LW, et al. The metabolism of berberine and its contribution to the pharmacological effects[J]. Drug Metab Rev, 2017, 49: 139–157. DOI:10.1080/03602532.2017.1306544 |
| [6] | Lan JR, Zhao YY, Dong FX, et al. Meta-analysis of the effect and safety of berberine in the treatment of type 2 diabetes mellitus, hyperlipemia and hypertension[J]. J Ethnopharmacol, 2015, 161: 69–81. DOI:10.1016/j.jep.2014.09.049 |
| [7] | Kong WJ, Wei J, Abidi P, et al. Berberine is a novel cholesterol-lowering drug working through a unique mechanism distinct from statins[J]. Nat Med, 2004, 10: 1344–1351. DOI:10.1038/nm1135 |
| [8] | Yu DH, Lv L, Fang L, et al. Inhibitory effects and mechanism of dihydroberberine on hERG channels expressed in HEK293 cells[J]. PLoS One, 2017, 12: e0181823. DOI:10.1371/journal.pone.0181823 |
| [9] | Zhang Y, Ma XJ, Guo CY, et al. Pretreatment with a combination of ligustrazine and berberine improves cardiac function in rats with coronary microembolization[J]. Acta Pharmacol Sin, 2016, 37: 463–472. DOI:10.1038/aps.2015.147 |
| [10] | Rodriguez-Menchaca A, Ferrer-Villada T, Lara J, et al. Block of HERG channels by berberine: mechanisms of voltage- and state-dependence probed with site-directed mutant channels[J]. J Cardiovasc Pharmacol, 2006, 47: 21–29. DOI:10.1097/01.fjc.0000191564.52242.00 |
| [11] | Li BX, Yang BF, Zhou J, et al. Inhibitory effects of berberine on IK1, IK, and HERG channels of cardiac myocytes[J]. Acta Pharmacol Sin, 2001, 22: 125–131. |
| [12] | Zunkler BJ. Human ether-a-go-go-related (HERG) gene and ATP-sensitive potassium channels as targets for adverse drug effects[J]. Pharmacol Ther, 2006, 112: 12–37. DOI:10.1016/j.pharmthera.2006.03.002 |
| [13] | Rosati B, Rocchetti M, Zaza A, et al. Sulfonylureas blockade of neural and cardiac HERG channels[J]. FEBS Lett, 1998, 440: 125–130. DOI:10.1016/S0014-5793(98)01444-6 |
| [14] | Plante I, Vigneault P, Drolet B, et al. Rosuvastatin blocks hERG current and prolongs cardiac repolarization[J]. J Pharm Sci, 2012, 101: 868–878. DOI:10.1002/jps.22809 |
| [15] | Feng PF, Zhang B, Zhao L, et al. Intracellular mechanism of rosuvastatin-induced decrease in mature hERG protein expression on membrane[J]. Mol Pharm, 2019, 16: 1477–1488. DOI:10.1021/acs.molpharmaceut.8b01102 |
| [16] | Mowery NT, Gunter OL, Guillamondegui O, et al. Stress insulin resistance is a marker for mortality in traumatic brain injury[J]. J Trauma, 2009, 66: 145–153. DOI:10.1097/TA.0b013e3181938c5e |
| [17] | Prakash A, Matta B. Hyperglycaemia and neurological injury[J]. Curr Opin Anaesthesiol, 2008, 21: 565–569. DOI:10.1097/ACO.0b013e32830f44e4 |
| [18] | Del Rio A, Cervera C, Moreno A, et al. Patients at risk of complications of Staphylococcus aureus bloodstream infection[J]. Clin Infect Dis, 2009, 48: S246–S253. DOI:10.1086/598187 |
| [19] | Armitage J. The safety of statins in clinical practice[J]. Lancet, 2007, 370: 1781–1790. DOI:10.1016/S0140-6736(07)60716-8 |
| [20] | Gotto AM Jr. Statins, cardiovascular disease, and drug safety[J]. Am J Cardiol, 2006, 97: 3C–5C. DOI:10.1016/S0002-9149(06)00602-3 |
| [21] | Arca M, Pigna G. Treating statin-intolerant patients[J]. Diabetes Metab Syndr Obes, 2011, 4: 155–166. |
| [22] | Duell PB, Jialal I. Modern management of familial hypercholesterolemia[J]. Metab Syndr Relat Disord, 2016, 14: 463–467. DOI:10.1089/met.2016.29011.due |
| [23] | Schiele F, Gale CP, Bonnefoy E, et al. Quality indicators for acute myocardial infarction: a position paper of the acute cardiovascular care association[J]. Eur Heart J Acute Cardiovasc Care, 2017, 6: 34–59. DOI:10.1177/2048872616643053 |
 2019, Vol. 54
2019, Vol. 54


