固有免疫系统是机体抵抗外源微生物病原体的第一道防线, 通过模式识别受体(pattern recognition receptors, PRRs)接收胞外、胞内的病原体相关分子模式(pathogen-associated molecular patterns, PAMP)和损伤相关分子模式(damage-associated molecular patterns, DAMPs), 与相应配体结合后PRRs激活下游通路引发适当的固有免疫反应并进一步调节适应性免疫系统[1], 干扰素基因刺激因子(stimulator of interferon genes, STING)是近年来新发现的一种胞内PRR。胞质内的DNA作为PAMPs或DAMPs中的一种, 可被环GMP-AMP合成酶(cyclic GMP-AMP synthase, cGAS)识别, 后者产生第二信使2'3'-cGAMP激活位于内质网膜上的STING蛋白, 继之激活干扰素调节因子(interferon regulatory factor 3, IRF3)和核因子κB (NF-κB), 分别促进Ⅰ型IFN和多种炎性因子(如CXCL10和IL6等)的转录和表达[2, 3]。研究表明, STING的突变失活或cGAS-STING信号通路的功能抑制与多种肿瘤的发生发展密切相关。因此, STING已成为一个重要的肿瘤免疫药物治疗靶点, 开发靶向STING激动剂对研发新型抗肿瘤药物具有重要意义。
本研究应用THP-1 Dual细胞和THP-1-Dual KO-STING细胞建立了STING激动剂的细胞筛选模型。THP-1 Dual细胞来源于人THP-1单核细胞系, 它不仅稳定表达完整的cGAS-STING信号通路, 而且还具有与IRF3转录相关的LUC报告基因(Lucia luciferase gene)。THP-1-Dual KO-STING细胞在THP-1 Dual细胞基础上稳定敲除了STING。THP-1-Dual细胞在cGAMP或STING激动剂的刺激下, 胞质内的IRF3被激活入核, 结合到LuciaTM荧光素酶(LUC)报告基因上启动转录, 最终产生可分泌到细胞外的LUC。细胞上清中荧光素酶的含量可通过LUC检测试剂QUANTI-LUCTM进行定量。本研究利用THP-1-Dual细胞和THP-1-Dual KO-STING细胞建立了STING激动剂的细胞筛选平台, 并通过阳性药物进一步对STING磷酸化情况和下游因子的表达情况进行了验证。
材料与方法细胞株 THP-1-Dual细胞和THP-1-Dual KO-STING细胞购自Invivogen公司。参照THP-1-Dual细胞和THP-1-Dual KO-STING细胞培养说明书, 细胞培养条件为2 mmol·L-1 L-谷氨酰胺、25 mmol·L-1 HEPES、10%热灭活Gibco FBS (56 ℃, 30 min)、青链霉素(100 u·mL-1、100 μg·mL-1)的RPMI 1640培养基。
试剂 2'3'-cGAMP、2'3'-c-di-AM(PS)2(Rp, Rp) (ADU-S100)、QUANTI-LUCTM购自Invivogen公司, CellTiter 96® Aqueous Non-Radioactive Cell Proliferation Assay (MTS)购自Promega公司, STING (D2P2F) rabbit mAb和phospho-STING (Ser366) (E9A9K) rabbit mAb购自Cell Signal Technology公司, mouse anti-β actin mAb购自中杉金桥, qPCR引物由Invitrogen公司合成。
仪器 PE公司EnVision多功能酶标仪Synergy H1, PerkinElmer公司EnSpire多功能读板仪, Tanon 5200 ECL蛋白印迹发光仪, 德国ANALYTIKJENA (耶拿) QTOWER实时荧光定量PCR仪。
THP-1 LUC检测 将180 μL状态良好的细胞以1×105个/孔铺至圆底96孔细胞培养板, 每孔分别加入20 μL不同浓度的2'3'-cGAMP、ADU-S100, 设立3个平行孔, 37 ℃、5% CO2细胞培养箱孵育20 h。之后取10 μL上清液加入至不透明白色酶标板, 随后每孔加入50 μL QUANTI-LucTM检测试剂, 轻轻拍打孔板数次混匀溶液, 并使用终点法检测化学发光值(EnSpire多功能读板仪)。
细胞增殖检测 为排除样品的细胞毒性对荧光值产生的影响, 用MTS对细胞活性进行检测。在经过LUC检测后剩余的细胞液中加入10 μL MTS试剂, 37 ℃静置3~4 h, 用酶标仪(EnVision)检测细胞液在492 nm下的吸光度(A)值。细胞生长抑制率(%) = (ANC-AT)/ANC×100%, 其中T代表待测化合物, NC代表阴性对照组。
Western blot 收集并清洗细胞, 加入一定体积的RIPA液, 冰上裂解, 12 000 r·min-1离心20 min得到上清蛋白溶液, 使用BCA蛋白定量试剂盒(Beijing Lablead Biotech公司)对蛋白浓度进行测定。将蛋白溶液与5×SDS上样缓冲液1:4混合, 95 ℃煮5 min。样品冷却后以20 μg的总蛋白量上样至10% SDS-PAGE胶中, 进行电泳(积层胶恒压70 V, 20 min; 分离胶恒压100 V, 80 min)。而后将凝胶上的蛋白电转移至0.45 μm PVDF膜上。将PVDF膜用含5%脱脂奶粉的TBST封闭1 h后, 使用p-STING、STING以及β-actin进行免疫杂交反应, 并在4 ℃摇床孵育过夜。次晨, 洗膜10 min×3次, 分别加入HRP标记的抗兔或者抗鼠二抗室温孵育1 h, 洗膜10 min×3次。PVDF膜取出, 在表面加上发光底物液(AB液等比例混合)置于ECL蛋白印迹系统中曝光和拍照, 得到Western blot图像。
qPCR 首先使用RNA快速提取试剂盒(ES Science公司)提取细胞总RNA, 大致方法如下:用500 μL裂解液裂解细胞并加入等体积无水乙醇混匀后移至离心柱, 4 000 ×g离心1 min。加入500 μL漂洗液, 12 000 ×g离心1 min。将离心柱移至1.5 mL RNase-free EP管上, 并加20~100 μL洗脱液至离心柱中央, 室温孵育1 min后12 000 ×g离心1 min得到RNA溶液。使用EnVision多功能酶标仪的核酸定量模块检测RNA的浓度, 而后用逆转录试剂盒逆转录得到cDNA溶液。为了检验IFN-β、CXCL10、IL6的mRNA水平, 本研究使用了SYBRgreen qPCR Mix和96孔实时荧光定量PCR仪, 并设计合成了一系列引物, 序列如下: 5'-GAACTTT GACATCCCTGAGGAGATT-3'和5'-TGCGGCGTCCT CCTTCT-3' (ifnβ), 5'-ATTTGCTGCCTTATCTTTCTG-3'和5'-CTTGATGGCCTTCGATTCTG-3' (cxcl10), 5'-CTTCGGTCCAGTTGCCTTCTC-3'和5'-GCCTCTTT GCTGCTTTCACAC-3' (il6), 5'-AAGGCTGTGGGCA AGGTCATC-3'和5'-AGGTGGAGGAGTGGGTGTCG-3' (gapdh)。以Folds = 2-ΔΔCt表示实验组与对照组目的基因表达的倍比关系, 公式如下: ΔΔCt = (Ct目的-Ct内参)实验组-(Ct目的-Ct内参)对照组。
ELISA检测 使用Quantikine® Human IFN-β免疫检测试剂盒对细胞上清液中的IFN-β进行定量, 大致方法如下:加50 μL Assay Diluent至反应孔, 并在相应孔中加入空白稀释液、标准片以及样品原液, 用封板纸密封后室温摇床孵育2 h。洗板后, 加200 μL IFN-β抗体液至反应孔, 密封后室温摇床孵育2 h。重复洗板操作, 向反应孔中加入配制好的反应底物, 避光室温孵育30 min。最后加入50 μL终止液, 轻拍混匀后使用多功能酶标仪(Synergy H1, BioTek公司)立即检测A450值。样品的浓度使用四参数分析法计算得出。
数据处理 本研究中实验均至少重复3次, 数据以平均值±标准误表示, 由Excel进行数据处理, 使用GraphPad Prism计算EC50并作图。
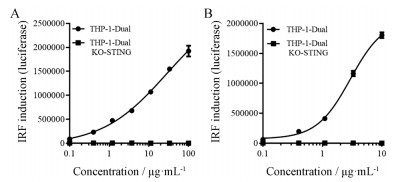
结果 1 STING激动剂筛选模型的建立本研究首先检测了THP-1-Dual细胞和THP-1-Dual KO-STING细胞对STING天然配体2'3'-cGAMP的反应性。使用一系列浓度的2'3'-cGAMP刺激THP-1 Dual细胞和THP-1 Dual KO-STING细胞, 随后用QUANTI-Luc试剂检测STING通路激活情况。结果显示(图 1A), THP1-Dual细胞上清液中分泌的LUC浓度与配体浓度呈正相关, 说明配体成功激活了STING-IRF通路。而在THP1-Dual KO-STING细胞中, 荧光强度随着配体浓度的增加并无改变。提示THP-1-Dual细胞对于STING配体具有反应性和特异性。
|
Figure 1 THP-1 Dual cell and THP-1 Dual KO-STING cell following 20 h treated with 2'3'-cGAMP (A) or ADU-S100 (B) demonstrate dose-dependent activation of STING with secretion of Lucia luciferase. 2'3'-cGAMP induced dose-dependent secretion of LUC with EC50 of 27.73 μg·mL-1. ADU-S100 is therefore around 10-fold more potent than cGAMP, with EC50 of 2.95 μg·mL-1 |
为确证本模型可用于化合物筛选, 本研究首先应用诺华公司与Aduro Biotech公司合作开发的位于Ⅰ期临床试验的药物环二核苷酸(cyclic dinucleotide, CDN)类STING激动剂ADU-S100作为阳性对照药对模型进行了验证。环二腺苷酸(cyclic diadenosine monophosphate, c-di-AMP)是在细菌中新发现的一种第二信使分子, 在哺乳动物体内可引起强烈的免疫反应[4]。ADU-S100是c-di-AMP的2'3'-双硫代磷酸酯类似物的Rp, Rp-异构体, 相较于c-di-AMP, ADU-S100对STING具有更高亲和力, 并且能够激活所有人源已知的STING等位基因[5]。结果显示, ADU-S100 (EC50=2.95 μg·mL-1)较2'3'-cGAMP (EC50=27.73 μg·mL-1)能够更加有效地促进THP-1 Dual细胞分泌LUC (图 1B), 且EC50值与文献报道相当[6]。证明该方法能够准确地检测化合物对STING的激动活性。
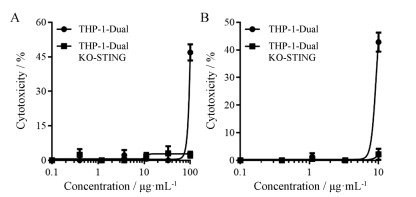
2 药物对THP-1增殖活性的影响化合物对细胞的生长抑制作用常常会在药物筛选过程中产生干扰, 使结果出现假阳性或者假阴性, 因此化合物的细胞毒性评价对于前体化合物的筛选具有重要作用。由于THP-1细胞为悬浮细胞, 本研究采用MTS方法进行药物的毒性评价。研究发现, 仅高浓度的2'3'-cGAMP (图 2A)和ADU-S100 (图 2B)对THP-1 Dual细胞有50%的生长抑制作用, 而其他浓度的药物对细胞增殖无显著影响。有趣的是, 高浓度药物对THP-1 Dual细胞的生长抑制作用并未在STING敲除的细胞中观测到, 且这种抑制作用与STING的激活情况一致。已有研究报道, STING信号可通过激活经典炎症小体(NLRP3/caspase-1)和非经典炎性小体(AIM2/caspase-11)导致细胞焦亡(pyrotosis)[7], 因此推测这种现象可能与STING激活相关。
|
Figure 2 Cytotoxicity to THP-1 Dual cell and THP-1 Dual KO-STING cell with increasing concentrations of 2'3'- cGAMP (A) or ADU-S100 (B) |
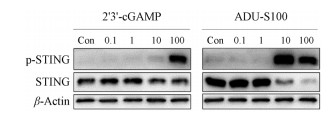
Liu等[8]发现位于STING C端结构域的S366蛋白被TANK结合激酶1 (TANK binding kinase 1, TBK1)磷酸化对于IRF3的结合和激活不可或缺。使用Western blot方法检测了天然配体2'3'-cGAMP和ADU-S100对该位点的磷酸化水平, 结果显示(图 3), 2'3'-cGAMP能够剂量依赖地增加STING的磷酸化水平, 从10 μg·mL-1剂量起磷酸化水平呈现增加趋势。而ADU-S100处理的细胞在10 μg·mL-1时磷酸化水平就达到了峰值, 说明ADU-S100对STING的激动活性强于2'3'-cGAMP, 此结果与EC50结果一致。
|
Figure 3 Validation of the screening models by Western blot. Phosphorylation of STING in THP-1 Dual cell following 4 h incubation with increasing concentrations of 2'3'-cGAMP and ADU-S100 (0.1, 1, 10 and 100 μg·mL-1) |
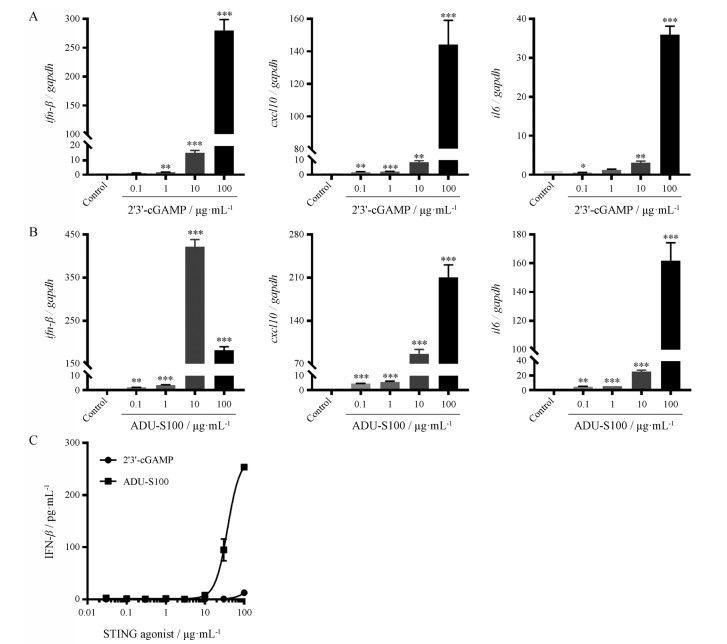
2'3'-cGAMP和ADU-S100作为STING的激动剂, 可使STING磷酸化并启动下游基因转录, 使IFN-β、IL6、CXCL10等表达增加[9]。Ⅰ型IFN是构成肿瘤免疫监视的基础, 在常规化疗、靶向免疫疗法甚至放射疗法都需要有完整的Ⅰ型IFN信号通路存在[10]。CXCL10也叫做干扰素诱导蛋白10 (interferon γ-induced protein 10, IP-10)被IFN-γ、IFN-α/β和NF-κB强烈诱导, 有研究证明CXCL10可作用于CD4+和CD8+ T细胞发挥抗肿瘤作用。CXCL10可抑制肺癌、黑色素瘤和胶质瘤骨髓瘤等肿瘤生长迁移[11]。IL-6作为一种炎性因子, 可调控代谢和肿瘤。肿瘤中的IL-6信号对肿瘤的生长、转移以及复发都有影响[12, 13]。因此, 本研究对上述3种因子进行mRNA水平检测。高浓度的2'3'-cGAMP (图 4A)和ADU-S100 (图 4B)能够使这3种因子的转录水平显著升高, 且与STING磷酸化水平一致。
|
Figure 4 Validation of the screening models by qPCR and ELISA. A, B: The mRNA expression levels of IFNβ, CXCL10 and IL6 of THP-1 Dual following 4 h incubation with 2'3'-cGAMP (A) or ADU-S100 (B) were assessed by real-time PCR and normalized to GAPDH expression. n = 3, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group; C: THP-1 Dual cell treated with 2'3'-cGAMP and ADU-S100 for 20 h incubation demonstrate dose-dependent activation of STING with secretion of IFN-β |
作为STING激动后最终的抗肿瘤效应细胞因子, IFN-β的分泌量在很大程度上决定了药物作用强度的高低。因此, 本研究通过ELISA方法进一步检测了药物刺激后细胞上清IFN-β的含量。如图 4C所示, 两个阳性药物均能刺激IFN-β, 且ADU-S100的效果更为显著, 与LUC检测结果相符。同时, LUC在低浓度下的响应值要明显好于检测IFN-β含量, 说明了本筛选模型具有很高的灵敏度。通过以上几种方法验证对比可知, 使用THP-1-Dual细胞建立的筛选模型是一种灵敏度高、稳定性好、快速准确且成本低廉的高通量筛选方法。
讨论胞质DNA作为一种重要的PAMP和DAMP, 不仅能够提示病原体入侵和自身损伤, 还在自身免疫病和癌症的发生发展过程中占据着重要的地位[14]。cGAS-STING通路在固有免疫系统中发挥至关重要的作用, 随着cGAS和cGAMP的发现, cGAS-cGAMP-STING信号通路才被完整地阐述出来[6, 15], 该信号通路在多种疾病中发挥的重要作用也被逐步发掘[5, 10, 16-19], 这无疑为研究者带来许多极具潜力的药物靶点, 以及治疗感染、癌症和自身免疫病的新途径。
研究表明, 多种肿瘤中存在STING的失活或该通路的缺陷, 进而促进肿瘤的发生或抗肿瘤效应的减弱。STING激活后产生的Ⅰ型IFN一方面有利于抗原交叉呈递和细胞毒性T细胞(cytotoxic T cell, TC或CTL)的抗肿瘤反应; 另一方面亦能够促进趋化因子的产生, 吸引更多的效应T细胞进入肿瘤微环境中[16], T细胞的反应性在STING缺陷的小鼠体内被大大削弱, Sting-/-小鼠无法产生有效的T细胞反应阻止黑色素瘤生长[17]。研究显示, 向肿瘤微环境中直接注射2'3'-cGAMP和经修饰的CDNs可产生强效的抗肿瘤效果[5]。癌症患者的胞质DNA识别通路常受到抑制, 以致受损细胞或肿瘤逃离免疫监视, 从而继续突变提高癌症的发病几率[20]。而STING的失活会使组织修复减缓, 导致黏膜表层受损使病原体更易入侵、扩散, 加速了DNA的破坏[21]。以往研究表明, 一些癌症细胞(如肠腺癌细胞) cGAS和STING表达沉默是由启动子区基因的表观修饰(如高度甲基化)所致[18], 使用DNA去甲基化物能够抑制肿瘤的发展。此外, cGAS-STING通路对免疫检查点抑制剂的抗癌作用亦有影响, 阻断细胞毒性T淋巴细胞相关蛋白4 (the cytotoxic T-lymphocyte-associated antigen 4, CTLA-4)和程序性死亡受体1 (programmed death 1, PD-1)对野生型小鼠的肿瘤有很好的疗效, 而在Sting-/-小鼠体内大部分治疗效果消失[17]。cGAS-STING通路介导的DNA识别还可以在一定程度上解释放射疗法和化学疗法的抗癌效果[22]。化疗药物(如顺铂、依托泊苷)通过破坏DNA促使细胞死亡, 加速DNA泄漏入细胞质激活cGAS-STING通路, 而后大量产生Ⅰ型IFN。相反, STING信号的缺失可能导致特定种类的肿瘤对化疗药物的耐受[19]。因此, 开发STING激动剂无疑是抗肿瘤免疫治疗的有效途径。
目前, STING激动剂的寻找已经成为了全球各大药企以及科研机构的研究热点。DMXAA是最早由哈佛医学院的Tim Mitchison课题组与诺华公司共同研发的STING激动剂, 其Ⅲ期临床试验的失败让人们开始重新审视STING激动剂的肿瘤免疫治疗作用; 但后续研究表明, DMXAA不是一个特异的STING激动剂, 并且对STING的激动存在种属差异。因此在后期开发中, 人们往往更倾向选择人源细胞和模型进行STING激动剂的寻找。THP1是来源于人的白血病细胞, 而之前用于DMXAA筛选的RAW264.7细胞是鼠源的巨噬细胞, 因此本实验所建立的筛选平台将更有助于STING激动剂的寻找和开发。截止目前, 默沙东和诺华目前各自都有处于临床Ⅰ期的合成CDN类STING激动剂。但这类激动剂均为核苷酸类, 分子量较大, 这使该类药物后续的开发受到很大的限制作用。因此, 本实验室也正在通过建立的平台, 对化合物库和定向合成的小分子STING激动剂进行筛选研究, 希望未来能够找到具有更好成药性的小分子STING激动剂。
综上所述, 本研究利用THP-1-Dual细胞和THP-1-Dual KO-STING细胞建立了针对STING激动剂的筛选模型, 并应用阳性药物, 通过考察STING磷酸化及下游信号蛋白和分泌蛋白, 对本模型进行了验证。该方法成本低、操作简单, 可用于高通量筛选, 使用人源细胞可同时排除种属差异, THP-1 Dual KO-STING细胞还能排除药物对STING上游蛋白的影响, 为结构新颖小分子STING激动剂的寻找开发奠定了坚实的基础。
| [1] | Takeuchi O, Akira S. Pattern recognition receptors and inflammation[J]. Cell, 2010, 140: 805–820. DOI:10.1016/j.cell.2010.01.022 |
| [2] | Ishikawa H, Barber GN. STING is an endoplasmic reticulum adaptor that facilitates innate immune signalling[J]. Nature, 2008, 455: 674–678. DOI:10.1038/nature07317 |
| [3] | Ishikawa H, Ma Z, Barber GN. STING regulates intracellular DNA-mediated, type Ⅰ interferon-dependent innate immunity[J]. Nature, 2009, 461: 788–792. DOI:10.1038/nature08476 |
| [4] | Woodward JJ, Iavarone AT, Portnoy DA. c-di-AMP secreted by intracellular Listeria monocytogenes activates a host type Ⅰ interferon response[J]. Science, 2010, 328: 1703–1705. DOI:10.1126/science.1189801 |
| [5] | Corrales L, Glickman LH, McWhirter SM, et al. Direct activation of STING in the tumor microenvironment leads to potent and systemic tumor regression and immunity[J]. Cell Rep, 2015, 11: 1018–1030. DOI:10.1016/j.celrep.2015.04.031 |
| [6] | Wu J, Sun L, Chen X, et al. Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA[J]. Science, 2013, 339: 826–830. DOI:10.1126/science.1229963 |
| [7] | Hu Q, Knight PH, Ren Y, et al. The emerging role of stimulator of interferons genes signaling in sepsis:inflammation, autophagy, and cell death[J]. Acta Physiol (Oxf), 2019, 225: e13194. DOI:10.1111/apha.13194 |
| [8] | Liu S, Cai X, Wu J, et al. Phosphorylation of innate immune adaptor proteins MAVS, STING, and TRIF induces IRF3 activation[J]. Science, 2015, 347: aaa2630. DOI:10.1126/science.aaa2630 |
| [9] | Liu Y, Jesus AA, Marrero B, et al. Activated STING in a vascular and pulmonary syndrome[J]. N Engl J Med, 2014, 371: 507–518. DOI:10.1056/NEJMoa1312625 |
| [10] | Zitvogel L, Galluzzi L, Kepp O, et al. Type Ⅰ interferons in anticancer immunity[J]. Nat Rev Immunol, 2015, 15: 405–414. DOI:10.1038/nri3845 |
| [11] | Tokunaga R, Zhang W, Naseem M, et al. CXCL9, CXCL10, CXCL11/CXCR3 axis for immune activation-a target for novel cancer therapy[J]. Cancer Treat Rev, 2018, 63: 40–47. DOI:10.1016/j.ctrv.2017.11.007 |
| [12] | Mauer J, Denson JL, Brüning JC. Versatile functions for IL-6 in metabolism and cancer[J]. Trends Immunol, 2015, 36: 92–101. DOI:10.1016/j.it.2014.12.008 |
| [13] | Ji M, Xue NN, Huang R, et al. Validation and application a cell-based screening model for IL-6/JAK/STAT3 inhibitor[J]. Acta Pharm Sin (药学学报), 2018, 53: 749–753. |
| [14] | O'Neill LA. Immunology. Sensing the dark side of DNA[J]. Science, 2013, 339: 763–764. DOI:10.1126/science.1234724 |
| [15] | Sun L, Wu J, Du F, et al. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type Ⅰ interferon pathway[J]. Science, 2013, 339: 786–791. DOI:10.1126/science.1232458 |
| [16] | Barber GN. STING:infection, inflammation and cancer[J]. Nat Rev Immunol, 2015, 15: 760–770. DOI:10.1038/nri3921 |
| [17] | Woo SR, Fuertes MB, Corrales L, et al. STING-dependent cytosolic DNA sensing mediates innate immune recognition of immunogenic tumors[J]. Immunity, 2014, 41: 830–842. DOI:10.1016/j.immuni.2014.10.017 |
| [18] | Xia T, Konno H, Ahn J, et al. Deregulation of STING signaling in colorectal carcinoma constrains DNA damage responses and correlates with tumorigenesis[J]. Cell Rep, 2016, 14: 282–297. DOI:10.1016/j.celrep.2015.12.029 |
| [19] | Ahn J, Ruiz P, Barber GN. Intrinsic self-DNA triggers inflammatory disease dependent on STING[J]. J Immunol, 2014, 193: 4634–4642. DOI:10.4049/jimmunol.1401337 |
| [20] | Curran E, Chen X, Corrales L, et al. STING pathway activation stimulates potent immunity against acute myeloid leukemia[J]. Cell Rep, 2016, 15: 2357–2366. DOI:10.1016/j.celrep.2016.05.023 |
| [21] | Ahn J, Konno H, Barber GN. Diverse roles of STING-dependent signaling on the development of cancer[J]. Oncogene, 2015, 34: 5302–5308. DOI:10.1038/onc.2014.457 |
| [22] | Deng L, Liang H, Xu M, et al. STING-dependent cytosolic DNA sensing promotes radiation-induced type Ⅰ interferon-dependent antitumor immunity in immunogenic tumors[J]. Immunity, 2014, 41: 843–852. DOI:10.1016/j.immuni.2014.10.019 |
 2019, Vol. 54
2019, Vol. 54


