肿瘤患者死亡的主要原因之一是肿瘤免疫逃逸引起的复发与转移, 而肿瘤免疫逃逸现象是肿瘤有效治疗的最主要障碍[1]。吲哚胺2, 3-双加氧酶1 (indoleamine 2, 3-dioxygenase 1, IDO1)是催化L-色氨酸的吲哚环氧化裂解生成犬尿氨酸(kynurenine, Kyn)的限速酶。虽然IDO1早在20世纪60年代就被克隆[2], 但直到近年才发现IDO1对免疫系统的重要调控作用[3-5]。其调控机制主要为: ① IDO1的高表达导致细胞局部的色氨酸耗竭, 诱导T细胞停滞在G1期, 从而抑制了T细胞的增殖[6]; ② IDO1降解色氨酸导致Kyn水平的增高, 诱导氧自由基介导的T细胞凋亡[7]; ③上调树突状细胞IDO1的表达, 通过降解局部色氨酸而加强局部调节性T细胞(Treg)介导的免疫抑制, 促使机体对肿瘤特异性抗原的外周免疫耐受[8, 9]。因此IDO1抑制剂能促进T细胞的增殖及活性, 有效抑制恶性肿瘤的生长, 而且毒副作用小。随着2018年Incyte和默沙东公司的IDO抑制剂epacadosta的Ⅲ期临床试验的失败, 之前IDO抑制剂的研发狂潮逐步趋向理性化。其失败的原因众说纷纭, 归纳为可能是化合物本身就存在缺陷、临床试验的设计不够合理和靶点本身的问题等。目前, 很多IDO抑制剂的临床试验仍还在进行中, 人类的探索也不会停止。IDO抑制剂未来临床试验的成功, 应该更多地从以下几个方面进行考虑, 即选择特异的临床适应症、优化临床方案设计、寻找合适IDO的生物标志物、寻找新型结构的IDO小分子抑制剂和寻找其他Kyn代谢通路的抑制剂。因此, 尽管几个IDO抑制剂的临床试验失败了, 但是研发IDO抑制剂仍具有现实意义, 特别是骨架结构全新的化合物。
本研究提出并设计构建了基于酶学-细胞水平的IDO1抑制剂的二级筛选模型, 再结合动物体内的验证方法, 能简单、快速、有效、高通量地筛选得到特异性IDO1抑制剂, 大大节约药物研发的时间和成本, 为寻找新型的IDO1小分子抑制剂提供了便利。
材料与方法材料 人胚胎肾细胞HEK293和人脑胶质瘤细胞A172均购自中国医学科学院基础医学研究所国家实验细胞资源共享服务平台。DH5α和BL21 (DE3)大肠杆菌购自北京全式金生物技术公司。质粒提取试剂盒购自Promega公司。Ni-NTA亲和层析树脂(镍柱)购自美国QIAGEN公司。阳性药NLG919、INCB024360和indoximod (1-MT)均购自Selleck公司。L-Kyn、抗坏血酸、过氧化氢酶、底物L-色氨酸(Trp)、α-氨基乙酰丙酸(ALA)和咪唑等化学试剂均购自Sigma-Aldrich公司。雌性C57小鼠(14~16 g)购自维通利华实验动物公司。EnSpire多模式微孔板检测仪免标记系统购自美国PerkinElmer公司; ImageQuant LAS 4000凝胶成像系统购自美国GE公司。
细胞培养 HEK293和A172细胞均于含5% CO2的37 ℃培养箱中培养传代, DMEM培养基添加10%胎牛血清及100 u·mL-1青霉素、100 u·mL-1链霉素。
质粒构建 委托和元生物技术(上海)股份有限公司按照核酸序列号为NM_002164.6的人IDO1基因序列全合成IDO1氨基酸序列, 并在两边分别添加EcoR I和Xho I酶切位点序列。然后将合成的人IDO1基因序列用T4连接酶连接到pET28a和pLVX-AcGFP1-N1两种质粒中, 分别用于表达纯化人IDO1蛋白和在人细胞中表达带有绿色荧光蛋白标记的IDO1蛋白, 将这两个质粒分别标记为pET28a-IDO1和pLVX-AcGFP1-N1-IDO1。两个质粒的酶切位点均为EcoR I和Xho I。
蛋白的表达纯化 将质粒pET28α-IDO1转化到表达菌株E. coli BL21(DE3), 在37 ℃、200 r·min-1振荡的条件下培养至菌液于600 nm吸光度(OD)值为0.6。将摇床温度降低到18 ℃后, 加入0.5 mmol·L-1异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)和血红素合成中间体ALA诱导IDO1蛋白的表达并获得活性蛋白。其中ALA能促进血红素的生成, 进而生成的亚铁血红素能保持IDO蛋白的活性。诱导表达16 h后, 将菌体置于4 ℃、5 000 ×g的条件下离心10 min。收集沉淀并重悬于Lysis Buffer (含100 mmol·L-1 Tris-Cl, 200 mmol·L-1 NaCl, 10 mmol·L-1咪唑, 蛋白酶抑制剂cocktail, 0.5 mg·mL-1溶菌酶, pH 8.0), 放置于冰上超声破碎30 min。然后于4 ℃、15 000 r·min-1离心15 min, 收集上清并用0.22 μm滤膜过滤。将过滤后的上清加至Ni-NTA亲和层析柱, 先用30 mmol·L-1咪唑洗去杂蛋白, 然后用200 mmol·L-1浓度咪唑洗脱并收集目标蛋白, 采用10 kD超滤管进行超滤浓缩, 并测定蛋白浓度。
Kyn标准曲线的检测 在96孔板中配制120 μL浓度分别为100、75、50、25、10、7.5、5、1、0 μmol·L-1的Kyn水溶液, 加入等体积的2% (w/v)对-二甲氨基苯甲醛的乙酸溶液混合, 放置5 min后490 nm检测OD值。在GraphPad Prism 8软件上以OD值为纵坐标、Kyn浓度为横坐标做图。
IDO1酶学活性的检测方法 通过纯化的IDO1蛋白, 在Littlejohn等[10]研究基础上建立并优化了IDO1体外高通量酶学筛选方法。实验在96孔透明板中进行, 即100 μL反应体系含50 mmol·L-1磷酸钾缓冲液(pH 6.5)、40 mmol·L-1抗坏血酸、200 μg·mL-1过氧化氢酶、20 μmol·L-1亚甲基蓝和待测浓度的筛选化合物, 最后加入终浓度为300 mmol·L-1底物L-色氨酸和10 μg·mL-1 rhIDO1酶, 37℃反应45 min。用30% (w/v)三氯乙酸20 μL终止反应。将96孔板直接放置于65 ℃水浴加热15 min, 使N-甲酰犬尿氨酸转化为Kyn。最后加入等体积2% (w/v)对-二甲氨基苯甲醛的乙酸溶液混合, 放置5 min后490 nm检测OD值。在GraphPad Prism 8软件上以OD值为纵坐标、浓度的lg值为横坐标, 拟合曲线做图求IC50值。
瞬时转染 于96孔板中每孔接种1万个HEK293细胞, 待培养于96孔板中的HEK293细胞融合度为60%~70%时, 利用Lipofectamine3000 (Invitrogen公司)转染试剂进行瞬时转染。方法同之前发表的文章[11], 即先配制Lipo溶液:每孔含0.15 μL lipofectamine3000+5 μL Opti-MEM培养基和质粒混合液:每孔含0.1 μg pLVX-AcGFP1-N1-IDO1质粒+0.2 μL P3000试剂+5 μL Opti-MEM培养基。将这两种溶液混合后室温孵育10 min, 于96孔板中每孔加入10 μL混合液, 孵育过夜后换成含有药物和底物色氨酸的培养基, 继续培养并取上清检测。
Western blot鉴定蛋白 详细方法见之前发表的文章[12], 简述如下, 将表达纯化的蛋白或是从细胞中提取的蛋白用于SDS-PAGE, 蛋白上样量为每孔60 μg。随后转印至PVDF膜上, 用含3%脱脂牛奶的TBS-T封闭0.5 h, 随后分别加入兔抗人IDO1抗体(1:1 000)或者兔抗His抗体(1:1 000)于4 ℃孵育过夜。TBS-T洗涤3次后, 加入HRP标记的山羊抗兔IgG二抗(1:1 000)继续孵育1 h。最后用ECL法发光、在凝胶成像仪显影。
IDO1细胞水平活性的检测方法 在IFNγ刺激模型中, 先在96孔板中接种体积为100 μL的A172细胞4×104个, 第二天, 用含10%血清的培养基配制含待测化合物的溶液, 该溶液中含有IFNγ的最终质量浓度为100 ng·mL-1, 底物Trp的最终浓度为1 mmol·L-1, 将配制好的溶液加到A172细胞中, 孵育48 h后取上清检测。两种细胞实验上清中Kyn的检测方法一致。即将100 μL上清加到新的96孔板中, 用30% (w/v)三氯乙酸20 μL终止蛋白反应。然后将96孔板直接放置于65 ℃水浴加热15 min, 使N-甲酰犬尿氨酸转化为Kyn。最后加入等体积2% (w/v)对-二甲氨基苯甲醛的乙酸溶液混合, 放置5 min后490 nm检测OD值。在GraphPad Prism 8软件上以OD值为纵坐标、浓度的lg值为横坐标, 拟合曲线做图求IC50值。
小鼠血浆中Trp和Kyn的含量测定 阳性药NLG919以吐温80助溶后加入0.5%羧甲基纤维素钠溶液配制为9 mg·mL-1悬液用于口服。一组共5只小鼠, 给药前禁食12 h。口服药物后0、1、2、4 h眼内呲采血, 血浆样品10 μL分别加入乙腈20 μL和内标(普萘洛尔, 0.2 μg·mL-1) 170 μL, 混旋后离心(14 000 r·min-1×5 min) 2次, 取上清液3 μL进行LC/MS/MS分析。其中LC/MS/MS条件为色谱柱: Zobax C18 (100 mm×2.1 mm, 3.5 μm); 柱温: 37 ℃, 流动相:乙腈-水(含0.1%甲酸)梯度; 流速: 0.2 mL·min-1; MRM正离子方式检测m/z 204.9→188 (Trp), m/z 208.8→192.1 (Kyn), m/z 260→183 (内标普萘洛尔)。
Z因子计算 Z=1-(3σcontrol+3σblank)/|μcontrol-μblank|, 其中σ为标准差, μ为均值, control为不加任何化合物时的数值, blank为不加底物时的背景数值。
统计学处理 采用GraphPad Prism 8软件进行绘图, 数据以x ± s表示, 数据分析采用Student's t-test检验, P<0.05为有统计学意义差异。
结果 1 IDO1酶水平高通量筛选方法的建立将IDO1蛋白序列插入到pET28a载体质粒中成功构建pET28a-IDO1重组质粒(图 1A), 然后将此质粒转化入感受态细胞BL21(DE3)。挑选出转化成功的BL21(DE3)-pET28a-IDO1单克隆菌后进行IDO1蛋白的表达纯化, 并用不同浓度的咪唑洗脱(图 1B), 根据图中结果最终选择30 mmol·L-1咪唑洗去杂蛋白, 然后用200 mmol·L-1浓度咪唑洗脱并收集目标蛋白。经Western blot结果鉴定, 表达纯化的蛋白为单一条带的带His标签的人重组IDO1蛋白(图 1C)。实验进一步检测了纯化的IDO1蛋白的酶学活性, 通过Kyn的标准曲线(图 1D), 选择了最佳的IDO1蛋白的反应浓度(图 1E) 10 μg·mL-1。根据公式计算, IDO1酶学高通量筛选的Z因子为0.74, 这说明该模型可靠、稳定, 可用于IDO1抑制剂的筛选。在该模型上验证了阳性化合物的抑制活性, 其中阳性化合物INCB024360的IC50为76 nmol·L-1, 与文献[13, 14]报道的一致(图 1F); 其中indoximod溶解度不够, 无法检测到理论上的IC50。

|
Figure 1 Establishment and optimization of an enzyme based indoleamine 2, 3-dioxygenase 1 (IDO1) inhibitor screening model. A: Constructed plasmid schematic; B: Optimization of IDO1 protein purification conditions; C: Identification of purified protein; D: Standard curve for kynurenine (Kyn); E: Investigation of the amount of IDO1 protein; F: Screening results of the positive compounds. 1: Bacterial sediment after sonication; 2: Supernatant after sonication; 3: 10 mmol·L-1 imidazole eluent; 4: 30 mmol·L-1 imidazole eluent; 5: 50 mmol·L-1 imidazole eluent; 6: 100 mmol·L-1 imidazole eluent; 7: 200 mmol·L-1 imidazole eluent; 8: 300 mmol·L-1 imidazole eluent |
IFNγ能刺激细胞内IDO蛋白的表达, 而给予IDO1抑制剂后能抑制IDO蛋白的酶学活性。基于此原理, 本研究建立了基于IFNγ刺激的细胞水平的IDO抑制剂高通量筛选模型。在方法的建立过程中, 主要考察了IFNγ的用量(图 2A)、IFNγ的作用时间(图 2B)、底物Trp的用量(图 2C)。结果显示, IFNγ的最适质量浓度为100 ng·mL-1, 最适作用时间为48 h, 底物Trp的最适浓度为1 mmol·L-1。根据公式计算, 该高通量筛选方法的Z因子为0.56, 表明该模型较为稳定可靠。方法建立后, 在此模型上考察了阳性药indoximod和INCB024360的抑制作用(图 2D), 其IC50分别为89.4 μmol·L-1和52.6 nmol·L-1, 阳性药结果与文献[13, 14]报道基本一致。
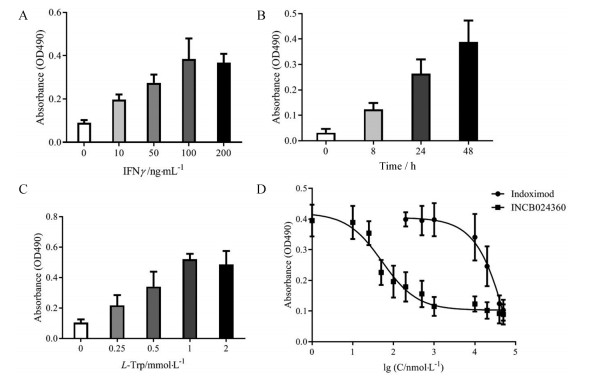
|
Figure 2 Establishment of a cell-based IDO1 inhibitor screening model with IFNγ stimulated A172 cells. A: Investigation of the amount of IFNγ; B: Optimization of the time of IFNγ stimulation; C: Determination of substrate tryptophan (Trp) concentration; D: Screening results of the positive compounds |
基于IFNγ刺激的IDO抑制剂筛选模型无法区别IDO抑制剂的特异性, 即IDO1、吲哚胺2, 3-双加氧酶2 (indoleamine 2, 3-dioxygenase 2, IDO2)和色氨酸双加氧酶2 (tryptophan dioxygenase 2, TDO2)抑制剂均能在此细胞模型上产生抑制作用。为了进一步建立特异性IDO1抑制剂细胞筛选模型, 在酶学筛选的基础上, 对阳性化合物的IDO1抑制剂的细胞水平的抑制活性考察, 本研究构建了能同时表达绿色荧光蛋白(GFP)和IDO1蛋白的表达质粒, 然后将此质粒瞬时转染到96孔板上的HEK293细胞中(图 3A), 图中绿色发亮的蛋白即为瞬时表达的IDO1蛋白。Western blot实验证实转染后细胞中确实高表达了IDO1蛋白(图 3B)。蛋白转染成功后, 本研究摸索了不同实验条件对96孔板中IDO1蛋白表达量(图中显示为吸光度)的影响, 结果表明, 转染48 h (图 3C)、IDO1质粒用量为0.1 μg (图 3D)、底物色氨酸用量为1 mmol·L-1 (图 3E)时, IDO1蛋白的瞬时表达量最高, 最适于抑制剂的筛选。转染成功后, 同时加入底物Trp和需筛选的化合物, 作用48 h后取100 μL细胞培养基上清检测Kyn的量。检测方法同IFNγ刺激的细胞筛选模型。方法建立并优化完后, 根据计算公式, 该模型的Z因子为0.69, 表明该模型稳定可靠, 可用于IDO1抑制剂的筛选。在此模型上, 考察了阳性药indoximod和INCB024360的抑制作用, 其IC50分别为77.2 μmol·L-1和17.3 nmol·L-1, 阳性药结果与文献[13, 14]报道基本一致(图 3F)。
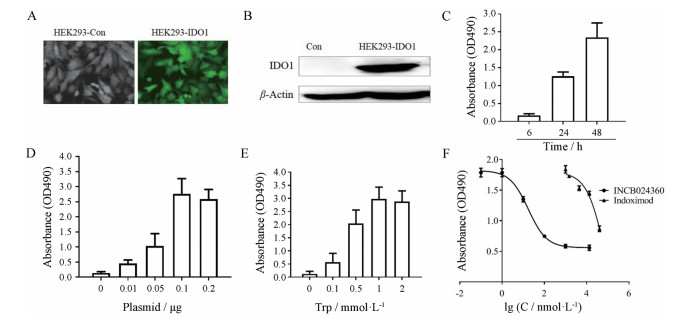
|
Figure 3 Establishment of a cell-based IDO1 inhibitor screening model with transient transfection. A: Transient transfection HEK293 cells with plasmid pLVX-AcGFP1-N1-IDO1; B: Identification of purified protein; C: Optimization of the time of transfection; D: Determination of pLVX-AcGFP1-N1-IDO1 plasmid concentration; E: Determination of substrate Trp concentration; F: Screening results of the positive compounds |
药物在体内的代谢过程在很大程度上也会影响化合物的药效。在蛋白水平和细胞水平具有较好IDO1抑制活性的化合物, 并不表示其在整体动物水平也具有较高活性。为了进一步确认化合物在体内的抑制活性, 本研究建立了基于C57BL/6小鼠的LC/MS/MS实验方法。即单次灌胃给予雌性C57BL/6小鼠剂量为90 mg·kg-1 NLG919, 在给药0、1、2和4 h后取小鼠眼内呲血检测血浆中Trp和Kyn的含量, 并以Kyn和Trp的比值计算IDO的抑制活性。如图 4A所示, 给药后小鼠体内的Kyn即刻开始下降, 在2 h时基本降到最低值, 之后Kyn数值开始恢复到给药前水平。图 4B显示给药后, 小鼠体内Trp的浓度没有显著的变化。图 4C显示给药后, IDO酶的活性即刻被抑制, 在2 h时抑制活性最强, 随后开始恢复到给药前水平。
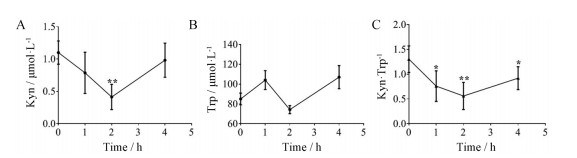
|
Figure 4 Establishment of an in vivo screening method for IDO1 inhibitors using LC/MS/MS method. A: Concentration of Kyn in mouse plasma; B: Concentration of Trp in mouse plasma; C: Inhibition of IDO activities by NLG919 in mice |
肿瘤免疫治疗已成为继手术、化疗、放疗后又一种有效的治疗方法而被广泛应用于临床[15, 16]。其中IDO作为其中的明星靶点之一, 受到了各大制药企业的关注。即使经历了多个临床试验的失败, 人们仍对此靶点持有相当大的期望。因此, 本研究致力于建立高效、系统、便捷的筛选模型, 为IDO1抑制剂的研发提供技术支撑。
在多数正常组织中, IDO1处于沉默状态或者低表达。而在多种实体肿瘤如肺癌、肝癌、乳腺癌和结肠癌等肿瘤组织中, IDO1持续高表达, 且与预后密切相关。因此, IDO1抑制剂对正常细胞没有显著作用, 表明IDO1抑制剂安全性较好。另外, 相比其他细胞, T细胞增殖的G1期对Trp缺乏非常敏感, 当IDO1在肿瘤组织过度表达后必然导致Trp浓度降低, T细胞缺乏足够的Trp就不能有效增殖, 容易发生凋亡而被清除。IDO1抑制剂可逆转由IDO1介导的肿瘤细胞免疫耐受, 从而抑制肿瘤细胞的增殖, 且安全性较好。
本研究中的酶学筛选方法基于Littlejohn等[10]研究基础, 相比于其他的筛选方法[17], 本实验体系小, 能在96孔板甚至于384孔板中进行, 可以实现高通量筛选。另外, 本实验还精简了实验步骤, 无需预热、离心等步骤, 操作更简便, 实验费用低。另外本实验提出在水浴锅中进行65 ℃加热, 可减少因加热产生的边缘效应, 相比直接烤箱65 ℃烘烤加热, 水浴加热提高了筛选结果的可靠性。
本研究建立了两种IDO1的细胞筛选方法, 这两种方法各有其优缺点。其中IFNγ刺激的A172细胞筛选体系操作相对简单、快速, 它不需要抽提质粒、进行转染等步骤。但是因为IFNγ不仅能激活IDO1酶的表达, 也能激活色氨酸代谢的另一种酶TDO, 因此这个筛选体系得到的抑制剂是色氨酸代谢通路的抑制剂, 即有可能是IDO1抑制剂, 也有可能是TDO抑制剂, 甚至其他相关的酶抑制剂, 特异性不强。而构建质粒并进行瞬时转染的方法, 虽然比较复杂, 需要构建质粒、质粒抽提纯化、转染等, 但是因为高表达的是特异性IDO1蛋白, 因此这种方法特异性较好。当然, 选择哪种方法进行实验, 还需根据具体的实验目的进行选择。
化合物的有效性最终得在动物体内进行验证。由于化合物的吸收代谢对药物的药效有很大的影响, 因此本研究在体外筛选的基础上, 进一步在整体动物上验证了化合物的抑制活性。整体动物体内IDO1抑制剂的验证方法适合于任何色氨酸代谢通路的抑制剂。比起传统的肿瘤模型的药效实验周期[17], 本研究中采用的验证方法大大降低了筛选的时间, 1~2天就能完成检测。通过体内模型的初步验证, 可以初步排除吸收差、生物利用率低、体内结构不稳定的化合物, 大大降低药物研发的风险和开发费用, 提高新药研发的效率。另外, 检测的时间点可根据药物的特点进行适当的改动, 如增加12和24 h等。另外, 关于小鼠品系的选择, 本文选用的是C57BL/6小鼠, 因为如果要进一步接种皮下移植瘤抗肿瘤实验时, C57小鼠使用概率更高。当然, 换成其他品系的小鼠也可以, 还需要具体检测小鼠血浆中的Kyn和Trp浓度。
综上所述, 本研究成功建立了基于酶学-细胞水平的系统的IDO1抑制剂筛选模型, 再加上IDO1抑制剂整体动物的体内验证方法, 该模型可大大提高药物筛选的效率和有效性, 为后续临床药物的研发提供强大的技术支撑。另外, 细胞模型中IFNγ刺激的A172细胞筛选方法和基于LC/MS/MS的体内筛选方法也适用于色氨酸通路抑制剂的筛选, 可推动基于色氨酸代谢通路的新型肿瘤免疫治疗剂的研发。
| [1] | Marin-Acevedo JA, Dholaria B, Soyano AE, et al. Next generation of immune checkpoint therapy in cancer:new developments and challenges[J]. J Hematol Oncol, 2018, 11: 39. DOI:10.1186/s13045-018-0582-8 |
| [2] | Yamamoto S, Hayaishi O. Tryptophan pyrrolase of rabbit intestine. D- and L-tryptophan-cleaving enzyme or enzymes[J]. J Biol Chem, 1967, 242: 5260–5266. |
| [3] | Prendergast GC, Malachowski WJ, Mondal A, et al. Indoleamine 2, 3-dioxygenase and its therapeutic inhibition in cancer[J]. Int Rev Cell Mol Biol, 2018, 336: 175–203. DOI:10.1016/bs.ircmb.2017.07.004 |
| [4] | Wu H, Gong J, Liu Y. Indoleamine 2, 3-dioxygenase regulation of immune response[J]. Mol Med Rep, 2018, 17: 4867–4873. |
| [5] | Amobi A, Qian F, Lugade AA, et al. Tryptophan catabolism and cancer immunotherapy targeting IDO mediated immune suppression[J]. Adv Exp Med Biol, 2017, 1036: 129–144. |
| [6] | Mellor A. Indoleamine 2, 3 dioxygenase and regulation of T cell immunity[J]. Biochem Biophys Res Commun, 2005, 338: 20–24. DOI:10.1016/j.bbrc.2005.08.232 |
| [7] | Munn DH, Mellor AL. Indoleamine 2, 3-dioxygenase and tumor-induced tolerance[J]. J Clin Invest, 2007, 117: 1147–1154. DOI:10.1172/JCI31178 |
| [8] | Rolinski J, Hus I. Breaking immunotolerance of tumors:a new perspective for dendritic cell therapy[J]. J Immunotoxicol, 2014, 11: 311–318. DOI:10.3109/1547691X.2013.865094 |
| [9] | Mellor AL, Lemos H, Huang L. Indoleamine 2, 3-dioxygenase and tolerance:where are we now?[J]. Front Immunol, 2017, 8: 1360. DOI:10.3389/fimmu.2017.01360 |
| [10] | Littlejohn TK, Takikawa O, Skylas D, et al. Expression and purification of recombinant human indoleamine 2, 3-dioxygenase[J]. Protein Expr Purif, 2000, 19: 22–29. DOI:10.1006/prep.2000.1214 |
| [11] | Lai FF, Niu F, Yang HZ, et al. Development of a novel screening assay for inhibitors targeting HIF-1α and P300 interaction[J]. Acta Pharm Sin (药学学报), 2014, 49: 849–853. |
| [12] | Tang K, Yang HZ, Li Y, et al. Anti-tumor activity and mechanism of T03 in vitro and in vivo[J]. Acta Pharm Sin (药学学报), 2014, 49: 861–868. |
| [13] | Liu X, Shin N, Koblish HK, et al. Selective inhibition of IDO1 effectively regulates mediators of antitumor immunity[J]. Blood, 2010, 115: 3520–3530. DOI:10.1182/blood-2009-09-246124 |
| [14] | Yang S, Li X, Hu F, et al. Discovery of tryptanthrin derivatives as potent inhibitors of indoleamine 2, 3-dioxygenase with therapeutic activity in Lewis lung cancer (LLC) tumor-bearing mice[J]. J Med Chem, 2013, 56: 8321–8331. DOI:10.1021/jm401195n |
| [15] | Janiak MK, Wincenciak M, Cheda A, et al. Cancer immunotherapy:how low-level ionizing radiation can play a key role[J]. Cancer Immunol Immunother, 2017, 66: 819–832. DOI:10.1007/s00262-017-1993-z |
| [16] | Yu CJ, Zheng MF, Kuang CX, et al. Oren-gedoku-to and its constituents with therapeutic potential in Alzheimer's disease inhibit indoleamine 2, 3-dioxygenase activity in vitro[J]. J Alzheimers Dis, 2010, 22: 257–266. DOI:10.3233/JAD-2010-100684 |
| [17] | Lai F, Liu Q, Liu X, et al. LXY6090-a novel manassantin A derivative-limits breast cancer growth through hypoxia-inducible factor-1 inhibition[J]. Onco Targets Ther, 2016, 9: 3829–3840. DOI:10.2147/OTT.S106925 |
 2019, Vol. 54
2019, Vol. 54


