白介素-17 (interleukin-17, IL-17)是重要的促炎症细胞因子, 该家族由6名成员组成, 分别是IL-17A、IL-17B、IL-17C、IL-17D、IL-17E (又名IL-25)和IL-17F。其中IL-17A和IL-17F在辅助性T细胞17 (T helper cell 17, Th17)细胞免疫中发挥重要作用。IL-17A和IL-17F具有50%的同源性, 它们可组成同源二聚体或者异源二聚体与IL-17RA/IL-17RC结合, 通过信号转导复合体IL-17R-Act1-TRAF6激活下游核因子κB (nuclear factor kappa B, NF-κB)和有丝分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路[1]。IL-17A和IL-17F广泛地参与了众多自身免疫性疾病的病理性进程, 如类风湿性关节炎、慢性阻塞性肺病、银屑病、系统性红斑狼疮、溃疡性结肠炎和多发性硬化症等[2-4]。目前有两个靶向IL-17A的单克隆抗体ixekizumab (Eli Lilly)和secukinumab (Novartis)及一个靶向IL-17RA的单克隆抗体brodalumab (Valeant)上市, 批准用于银屑病或银屑病性关节炎的治疗。虽然肿瘤坏死因子α (tumor necrosis factor α, TNFα)单抗已经占领银屑病市场, 但仍有高达40%的患者对TNFα阻断剂治疗不足或无反应。而IL-17A拮抗剂对TNFα单抗治疗效果不佳及出现严重不良反应而停药的银屑病患者同样有效。除了在银屑病中的重要作用外, IL-17A和IL-17F还参与肿瘤的生长、血管形成和肿瘤免疫调节[5-7]。IL-17能促进多种恶性肿瘤细胞分泌促血管生成因子血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)、前列腺素(prostaglandin E, PGE)、趋化因子和基质金属蛋白酶(matrix metalloproteinase, MMP) 2和9, 从而促肿瘤微血管的生成[8]。在肿瘤微环境中IL-17具有双重调节作用, 一方面可募集大量的骨髓来源的抑制性细胞(myeloid-derived suppressor cells, MDSCs), 抑制机体抗肿瘤免疫[9, 10]; 另一方面可以激活肿瘤特异的CD8+ T细胞, 从而杀伤肿瘤[11-13]。因此, 靶向IL-17新型小分子药物的研发具有重要的临床意义和市场前景, 不仅能极大地改善银屑病、银屑病关节炎及其他自身免疫性疾病的治疗, 而且在恶性肿瘤的治疗上也会有更广阔的应用前景。
为了筛选IL-17信号通路抑制剂, 本研究采用了Invivogen公司的HEK-Blue IL-17细胞。HEK-Blue IL-17细胞模型稳定表达人源IL-17RA/IL-17RC异二聚体受体和Act1衔接分子, 同时还表达NF-κB和AP-1诱导的碱性磷酸酶(secreted alkaline phosphatase, SEAP)报告基因。当IL-17A和IL-17F与IL-17RA / IL-17RC结合后, 活化的异二聚体募集AP-1调节子, 并诱导TNF受体诱导因子6 (TNF receptor associated factor 6, TRAF6)泛素化, 从而触发NF-κB和AP-1信号活化级联反应, 最终产生可分泌到细胞外的SEAP, 并通过与QUANTI-Blue反应在波长655 nm下检测SEAP的含量。本研究采用HEK-Blue IL-17细胞, 确立了用于筛选IL-17信号通路抑制剂的最佳条件, 并筛选发现了一些可抑制IL-17介导的信号通路的天然产物, 为后续研发IL-17小分子抑制剂奠定基础。
材料与方法细胞 HEK-Blue IL-17细胞购自法国Invivogen公司。
试剂与药物 人IL-17A重组蛋白、anti-hIL-17A-IgG、QUANTI-Blue、Normocin和HEK-Blue Selection购自法国Invivogen公司; 人IL-17F重组蛋白购自美国PeproTech公司。牛蒡子苷元由鲁南制药提供。表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)、咖啡酸苯乙酯、染料木素(genistein)均购自中国食品药品检定研究院。绿原酸由四川九章生物科技公司提供。化合物纯度均大于98%。
仪器与设备 Biotek全波长酶标仪(美国)。
细胞培养与传代 HEK-Blue IL-17细胞培养于DMEM培养基中(1× HEK-Blue Selection抗生素、100 μg·mL-1 Normocin、100 u·mL-1青霉素、100 μg·mL-1链霉素和10%灭活FBS), 置37 ℃、5% CO2孵育箱中贴壁生长。待细胞密度融合至70%~80%时, 将贴壁生长的细胞轻轻拍下(勿用胰酶消化或吹打细胞), 1 200 r·min-1离心5 min, 用37 ℃预热的完全培养基重悬培养。
HEK-Blue IL-17细胞筛选模型的验证及条件优化 参照Ji等[14]的方法, 取对数生长期的HEK-Blue IL-17细胞计数, 按照5×104个/孔的密度接种于96孔细胞培养板中(每孔180 μL), 随后向每孔加入20 μL不同质量浓度(0.000 01~100 ng·mL-1)的细胞因子IL-17A或IL-17F, 对照组加入完全培养基(每孔20 μL), 在37 ℃、5% CO2细胞孵育箱中培养16 h。从该96孔板中移取20 μL培养上清至新的96孔板, 再向每孔加入180 μL 37 ℃预热的QUANTI-Blue显色液, 37 ℃孵育不同时间后, 于λ655 nm下测定吸收度值(A)。在确定最佳刺激条件下, 并检测不同浓度(0.01~1 000 ng·mL-1)的anti-hIL-17A-IgG对该信号通路的抑制活性。
化合物筛选 参照上述方法, 每孔加入160 μL细胞悬液(5×104个/孔)置孵育箱中培养4 h, 待细胞沉降贴壁后加入20 μL不同浓度的检测化合物孵育1 h, 随后加入20 μL IL-17A或IL-17F细胞因子(终质量浓度: IL-17A, 10 ng·mL-1; IL-17F, 100 ng·mL-1)继续培养16 h。阳性对照药为anti-hIL-17A-IgG。体系中的DMSO含量≤1‰。阴性对照组为40 μL完全培养基+160 μL的细胞悬液。阳性对照组为20 μL IL-17A/IL-17F细胞因子+20 μL完全培养基+160 μL的细胞悬液。从96孔板中移取20 μL培养上清至新的96孔板, 向每孔加入180 μL 37 ℃预热的QUANTI-Blue显色液, 37 ℃孵育不同时间后, 于λ655 nm下测定A值。
免疫印迹法检测p-p65、p-p38和p-ERK1/2蛋白表达 收集不同浓度牛蒡子苷元和EGCG处理过的HEK-Blue IL-17细胞, 用预冷的RIPA裂解液冰上裂解30 min, 用BCA蛋白检测试剂盒定量蛋白浓度。蛋白样品经过丙烯酰胺凝胶电泳(SDS-PAGE), 随后转印至PVDF膜上, 经过一抗、二抗孵育, ECL化学发光, 凝胶成像仪显影。
统计学分析 采用GraphPad Prism 8软件进行绘图, 数据以平均值±标准差(x ± s)表示, 数据分析采用Student's t-test检验, P<0.05为有统计学意义差异。计算化合物对IL-17信号通路的抑制率, 公式如下:抑制率(%)=1-(Acomp-Av)/(AP-Av)×100%, 其中Comp为待测化合物, V为阴性对照组, P为阳性对照组。
结果 1 模型的验证首先检测了人源细胞因子IL-17A和IL-17F对HEK-Blue-IL17细胞的激活作用, 结果见图 1。10 ng·mL-1 IL-17A和IL-17F均可显著激活HEK-Blue IL-17细胞下游NF-κB和AP-1信号活化级联反应, 促进细胞外SEAP的产生。而同剂量的IL-17A对该信号通路的刺激活性强于IL-17F (P≤0.000 1)。在此基础上, 本研究检测了不同浓度的IL-17A和IL-17F对HEK-Blue IL-17细胞信号通路的活化作用, 以及生成的SEAP与QUANTI-Blue反应不同时间的吸收度值。如图 2所示, 随着IL-17A和IL-17F浓度的增加, HEK-Blue IL-17细胞信号通路的活化程度越强, 产生的SEAP量越多, 与QUANTI-Blue反应值越高。10和100 ng·mL-1剂量下的IL-17A对HEK-Blue IL-17细胞信号刺激效应基本无差异, 反应值分别在1.53和1.67。而100 ng·mL-1剂量下的IL-17F对HEK-Blue IL-17细胞信号刺激效应可达10 ng·mL-1剂量下的约2倍, 反应值分别在1.43和0.80。100 ng·mL-1剂量下的IL-17F与10 ng·mL-1剂量下的IL-17A在HEK-Blue IL-17细胞上的反应值基本相当。此外, SEAP与QUANTI-Blue反应1和3 h所测的吸收度值基本接近。因此, 本实验最终选用的条件为: IL-17A和IL-17F的刺激浓度分别为10 ng·mL-1和100 ng·mL-1, SEAP与QUANTI-Blue反应1 h在λ655 nm下测定吸收度值即可。
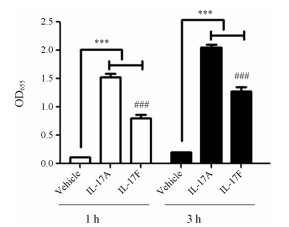
|
Figure 1 The activated effect of IL-17A and IL-17F on HEK-Blue IL-17 cells. (50 000 cells per well, cytokine incubation for 16 h, reaction time of QUANTI-Blue: 1, 3 h. n = 3, x ± s. ***P≤0.001 vs vehicle; ###P≤0.001 vs IL-17A |
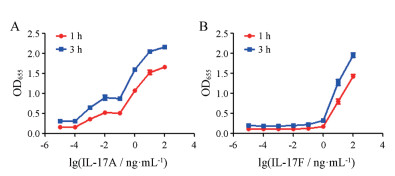
|
Figure 2 The activated effect of different dosage of IL-17A (A) and IL-17F (B) on HEK-Blue IL-17 cells |
在确定HEK-Blue-IL17细胞的最佳反应条件的基础上, 本研究首先验证了anti-hIL-17A-IgG对IL-17A活化该细胞信号通路的抑制作用。由图 3可见, anti-hIL-17A-IgG可呈浓度依赖性地抑制IL-17A介导的信号通路, 其半数抑制浓度(IC50)为10.16 ng·mL-1 (1 h)、10.59 ng·mL-1 (3 h)。综上可见, 该反应条件可以实现在HEK-Blue IL-17细胞对IL-17信号通路抑制剂的筛选。
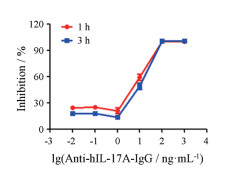
|
Figure 3 The inhibitory effect of anti-hIL-17A-IgG on IL-17A-mediated signaling pathway |
本研究检测了3种天然产物在HEK-Blue IL-17细胞模型上对IL-17A和IL-17F介导的信号通路的作用。由表 1可见, 阳性药anti-hIL-17A-IgG可剂量依赖性地抑制IL-17A刺激的信号通路活化, 对IL-17F刺激的信号通路活化不影响。这提示, anti-hIL-17A-IgG有很好的选择性。牛蒡子苷元和EGCG对IL-17A和IL-17F介导的信号通路均显示一定程度的抑制作用, 而染料木素对IL-17A和IL-17F介导的信号通路无影响。同时, 细胞增殖抑制实验显示该条件下牛蒡子苷元、EGCG和染料木素对HEK-Blue IL-17细胞的增殖无影响。这提示, 牛蒡子苷元和EGCG对IL-17A和IL-17F介导的信号通路的抑制作用不是由于抑制细胞增殖所致。
| Table 1 The inhibitory effect of natural products on IL-17A/F-mediated signaling pathway |
本研究检测了牛蒡子苷元和EGCG对IL-17A刺激的NF-κB和MAPK信号通路关键信号分子表达量的影响。由图 4可见, IL-17A可以激活NF-κB信号通路中p-p65的表达, 但对MAPK信号通路中p-p38和p-ERK1/2几乎不影响。牛蒡子苷元、EGCG和阳性药anti-hIL-17A-IgG均有降低p-p65表达的作用。此外, 牛蒡子苷元显示抑制p-ERK1/2表达的作用, 而EGCG有降低p-p38表达的作用。
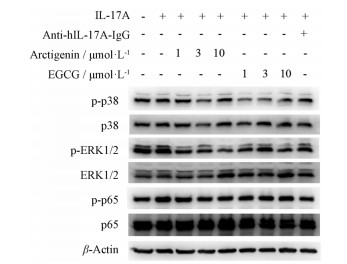
|
Figure 4 The expressions of key molecules in NF-κB and MAPK signaling pathway after exposure to arctigenin and EGCG |
IL-17A和IL-17F作为Th17细胞的主要标志产物, 在机体的天然免疫和获得性免疫系统中均发挥着重要作用。它们参与机体抗感染免疫、自身免疫性疾病相关的病理性炎症反应及肿瘤发生和进展等过程。其中, IL-17A对维持银屑病斑块的炎症反应起着关键性的作用。它通过促进上皮细胞产生促炎细胞因子、趋化因子和抗微生物肽诱导皮肤炎症反应[15]。而IL-17在调节恶性肿瘤进程中具有双重作用。在促进肿瘤发展方面, IL-17通过促进一些炎症因子的分泌和募集髓系抑制细胞, 从而促进肿瘤血管生成和转移[9]; 在抑制肿瘤发展方面, IL-17可增强细胞毒性T细胞的免疫清除能力[13]。因此, 阻断IL-17信号通路可成为治疗自身免疫性疾病和肿瘤的一个新策略。
目前, 针对靶向筛选IL-17信号通路抑制剂的报道较少, 仅有Xu等[16]报道的针对CNS2-IL17A-RORE建立的双荧光素酶报告基因方法。该方法可用于筛选影响IL-17转录的化合物。而该实验优化的HEK-Blue IL-17细胞模型筛选方法操作简单、所需检测试剂廉价, 并可实现高通量筛选。该细胞模型是用于筛选对IL-17A、IL-17F介导的信号通路具有抑制作用的化合物。这两种模型是针对IL-17信号通路不同层面的筛选方法, 可作为相互补充, 用于不同类型的IL-17抑制剂的研发。研究中发现同剂量的IL-17A比IL-17F激活该信号通路的能力强, 这可能与IL-17A对IL-17RA/IL-17RC亲和能力强有关[1]。因此, 目前开发的靶向IL-17的抑制剂均以抑制IL-17A的作用为主。由于没有找到IL-17F特异性中和抗体, 本研究只采用了anti-hIL-17A-IgG对该细胞模型进行了验证。Anti-hIL-17A-IgG显示出强效并特异性地抑制IL-17A介导的信号通路活化。这提示, 该模型可以用于选择性IL-17抑制剂的筛选。在化合物筛选过程中发现, 牛蒡子苷元和EGCG对IL-17A刺激的信号通路表现出与IL-17F刺激的信号通路基本一致的抑制活性。这提示, 牛蒡子苷元和EGCG有可能作用于IL-17RA / IL-17RC或者其介导的NF-κB和AP-1信号通路, 而不是作用于IL-17A或IL-17F本身。由于IL-17F与肿瘤免疫密切相关, 本研究也检测了一些其他天然产物对IL-17F介导的信号通路的影响, 包括绿原酸、小白菊内酯衍生物和咖啡酸苯乙酯。20 μmol·L-1绿原酸对IL-17F介导的信号通路抑制活性可达34.59%, 而小白菊内酯衍生物和咖啡酸苯乙酯对IL-17F介导的信号通路的IC50分别为7.38和11.69 μmol·L-1。在此基础上, 本研究进一步检测了牛蒡子苷元和EGCG对IL-17A刺激的NF-κB和MAPK信号通路关键信号分子的表达情况。牛蒡子苷元和EGCG对IL-17A诱导的p-p65活化有一定的抑制作用。以上结果说明, 牛蒡子苷元和EGCG抑制HEK-Blue IL-17细胞IL-17A的信号通路可能与抑制NF-κB信号通路密切相关。
| [1] | Toy D, Kugler D, Wolfson M, et al. Cutting edge:interleukin 17 signals through a heteromeric receptor complex[J]. J Immunol, 2006, 177: 36–39. DOI:10.4049/jimmunol.177.1.36 |
| [2] | Kotake S, Udagawa N, Takahashi N, et al. IL-17 in synovial fluids from patients with rheumatoid arthritis is a potent stimulator of osteoclastogenesis[J]. J Clin Invest, 1999, 103: 1345–1352. DOI:10.1172/JCI5703 |
| [3] | Antonysamy MA, Fanslow WC, Fu F, et al. Evidence for a role of IL-17 in alloimmunity:a novel IL-17 antagonist promotes heart graft survival[J]. Transplant Proc, 1999, 31: 93. DOI:10.1016/S0041-1345(98)01453-5 |
| [4] | Kugyelka R, Kohl Z, Olasz K, et al. Enigma of IL-17 and Th17 cells in rheumatoid arthritis and in autoimmune animal models of arthritis[J]. Mediators Inflamm, 2016, 2016: 6145810. |
| [5] | Numasaki M, Watanabe M, Suzuki T, et al. IL-17 enhances the net angiogenic activity and in vivo growth of human non-small cell lung cancer in SCID mice through promoting CXCR-2-dependent angiogenesis[J]. J Immunol, 2005, 175: 6177–6189. DOI:10.4049/jimmunol.175.9.6177 |
| [6] | Zhang Q, Liu S, Xiong Z, et al. Interleukin-17 promotes development of castration-resistant prostate cancer potentially through creating an immunotolerant and pro-angiogenic tumor microenvironment[J]. Prostate, 2014, 74: 869–879. DOI:10.1002/pros.22805 |
| [7] | Numasaki M, Fukushi J, Ono M, et al. Interleukin-17 promotes angiogenesis and tumor growth[J]. Blood, 2003, 101: 2620–2627. DOI:10.1182/blood-2002-05-1461 |
| [8] | Li J, Lau GK, Chen L, et al. Interleukin 17A promotes hepatocellular carcinoma metastasis via NF-κB induced matrix metalloproteinases 2 and 9 expression[J]. PLoS One, 2011, 6: e21816. DOI:10.1371/journal.pone.0021816 |
| [9] | Starnes T, Robertson MJ, Sledge G, et al. Cutting edge:IL-17F, a novel cytokine selectively expressed in activated T cells and monocytes, regulates angiogenesis and endothelial cell cytokine production[J]. J Immunol, 2001, 167: 4137–4140. DOI:10.4049/jimmunol.167.8.4137 |
| [10] | Li Q, Liu L, Zhang Q, et al. Interleukin-17 indirectly promotes M2 macrophage differentiation through stimulation of COX-2/PGE2 pathway in the cancer cells[J]. Cancer Res Treat, 2014, 46: 297–306. DOI:10.4143/crt.2014.46.3.297 |
| [11] | Benchetrit F, Ciree A, Vives V, et al. Interleukin-17 inhibits tumor cell growth by means of a T-cell-dependent mechanism[J]. Blood, 2002, 99: 2114–2121. DOI:10.1182/blood.V99.6.2114 |
| [12] | Nunez S, Saez JJ, Fernandez D, et al. T helper type 17 cells contribute to anti-tumour immunity and promote the recruitment of T helper type 1 cells to the tumour[J]. Immunology, 2013, 139: 61–71. DOI:10.1111/imm.12055 |
| [13] | Martin-Orozco N, Muranski P, Chung Y, et al. T helper 17 cells promote cytotoxic T cell activation in tumor immunity[J]. Immunity, 2009, 31: 787–798. DOI:10.1016/j.immuni.2009.09.014 |
| [14] | Ji M, Xue NN, Huang R, et al. Validation and application a cell-based screening model for IL-6/JAK/STAT3 inhibitor[J]. Acta Pharm Sin (药学学报), 2018, 53: 749–753. |
| [15] | Harper EG, Guo C, Rizzo H, et al. Th17 cytokines stimulate CCL20 expression in keratinocytes in vitro and in vivo:implications for psoriasis pathogenesis[J]. J Invest Dermatol, 2009, 129: 2175–2183. DOI:10.1038/jid.2009.65 |
| [16] | Xu T, Wang X, Zhong B, et al. Ursolic acid suppresses interleukin-17(IL-17) production by selectively antagonizing the function of RORγt protein[J]. J Biol Chem, 2011, 286: 22707–22710. DOI:10.1074/jbc.C111.250407 |
 2019, Vol. 54
2019, Vol. 54


