前列腺癌(prostate cancer, PCa)是男性泌尿生殖系统最常见的恶性肿瘤之一。在美国, 前列腺癌的发病率已经超过肺癌, 成为危害男性健康的第一位肿瘤[1]。对于前列腺癌的治疗, 传统的治疗方案是去势治疗, 去势治疗也称为雄激素剥夺治疗, 通过阻断雄激素和雄激素受体结合来抑制肿瘤的生长。但由于经过中位时间约为18~30个月缓解后, 绝大多数患者会逐渐对激素产生非依赖性, 进而发展为去势抵抗前列腺癌, 目前临床上仍急需用于治疗前列腺癌的药物[2, 3]。信号传导与活化转录因子3 (signal transducer and activator of transcription 3, STAT3)是表皮生长因子受体(epidermal growth factor receptor, EGFR)、白介素6/蛋白酪氨酸激酶(IL-6/Janus kinase, Jak)、Src等多个致癌性酪氨酸激酶信号通道的交汇点, 在多种肿瘤细胞和组织中都被激活, 如乳腺癌、卵巢癌、头颈部鳞状细胞癌、前列腺癌、恶性黑色素瘤、多发性骨髓瘤、淋巴瘤、脑瘤、非小细胞肺癌和各种白血病等[4], 目前被认为是潜在的预防、治疗肿瘤的重要靶点[5]。目前, 对STAT3介导前列腺癌发生发展的具体作用机制尚不明确, 但在前列腺癌细胞中发现有持续活化的STAT3蛋白存在[6]。已有文献报道, 前列腺癌细胞中持续活化的STAT3蛋白与细胞因子IL-6、白介素11 (IL-11)的信号转导有关, 并发现这一过程通过EGFR及Jak家族介导[7, 8]。
在非激素依赖性的前列腺癌中, IL-6/Jak2/STAT3信号传导通路的激活与肿瘤细胞的生长、增殖和浸润密切相关。文献报道, 在应用免疫组化SP法检测29例正常前列腺组织和38例前列腺癌组织STAT3蛋白表达情况, 结果显示:分化程度较低、非激素依赖型前列腺癌的STAT3表达水平较分化程度较高、对激素治疗敏感的前列腺癌明显偏高。并且随着分化程度的降低, STAT3的表达呈逐渐增强趋势[9]。在非激素依赖性的前列腺癌细胞系PC-3、DU145中, p-STAT3表达量明显高于激素依赖性的前列腺癌细胞系LNCaP。在PC-3、DU145中, p-STAT3表达量较低的PC-3对顺铂的敏感性高于DU145, 所以STAT3在非激素依赖性的前列腺癌中可能发挥着重要作用, 且与顺铂的耐药机制有关[10]。
Bt354是本课题组在北京协和医学院药物研究所样品库1 566个化合物中筛选所得到的一个具有较强活性的STAT3通路小分子抑制剂。为了全面地研究Bt354对肿瘤的生长抑制作用, 本课题组[11]已发表的文章选取了多株肿瘤细胞, 采用Western blot方法检测了这些肿瘤细胞中STAT3的表达丰度。结果提示, DU145细胞的STAT3表达丰度较高, MDA-MB-436细胞的表达稍低, 而PC3细胞中几乎没有STAT3的蛋白表达, 该结果与文献[11]报道PC3是一株STAT3缺失的细胞一致。DU145细胞是从前列腺癌脑转移肿瘤中分离出来的, 分化程度低, 为雄激素非依赖的前列腺癌细胞, 具有强大的转移潜能, 缺乏内源性的雄激素受体的表达[12]。本文主要进行了Bt354的体外、体内抗前列腺癌药效学评价, 并深入研究其抗肿瘤作用的分子机制, 为将Bt354开发为口服治疗前列腺癌的新型靶向药物提供了基础数据支持。
材料与方法细胞与动物 人前列腺癌细胞DU145购自中国医学科学院基础医学研究所细胞中心, 由本实验室传代并保种。所有细胞置于37 ℃、5% CO2的孵箱中培养, 根据细胞生长状态进行传代。Balb/c裸鼠购自北京斯贝福实验动物技术有限公司。
药物和试剂 Bt354由本所药物化学研究室许恒教授课题组提供, HPLC测定纯度≥98%, 多西他赛购自深圳万乐药业有限公司, Napabucasin (BBI608)购自Selleck公司。MTT粉末购自Sigma-Aldrich公司。EdU细胞增殖检测试剂盒购自北京索莱宝科技有限公司。TUNEL试剂盒(11684795910)购自罗氏公司。
MTT检测 将对数生长期的DU145细胞用胰酶消化后配制成浓度为每毫升2×104个的细胞液, 96孔板每孔接种100 μL (2 000个细胞)。次日每孔加入不同浓度Bt354及溶剂对照的新鲜培养基100 μL (DMSO终浓度<0.2%), 每组设3个平行孔, 于37 ℃继续培养48 h后, 弃上清, 每孔加50 μg·mL-1 MTT溶液, 37 ℃孵育4 h后弃上清, 加入DMSO振荡混匀后, 用酶标仪在570 nm波长下测定其光吸收值[13]。
EdU染色荧光显微镜观察实验 使用培养液1 000:1稀释EdU溶液, 在每孔加入100 μL的50 μmol·L-1 EdU的培养液孵育2 h后, PBS清洗细胞后使用4%多聚甲醛室温固定30 min, 弃去固定液。在每孔加入50 μL的2 mg·mL-1甘氨酸, 脱色摇床孵育5 min后弃去溶液。再在每孔加入100 μL PBS, 清洗5 min后弃去PBS。在每孔加入100 μL 1×Apollo®染色反应液, 避光室温、脱色摇床孵育30 min后, 弃染色液。再加入100 μL渗透剂脱色摇床清洗2次, 每次10 min, 弃渗透剂。用去离子水按100:1的比例稀释试剂盒中F试剂, 制备适量1× Hoechst33342反应液, 每孔加入100 μL该反应液, 避光室温、脱色摇床孵育30 min进行DNA染色后, 弃染色反应液; 每孔每次加入100 μL PBS清洗2次, 最后每孔加入500 μL PBS保存。经显微镜拍照后, 采用IPP (Ipwin32)软件对阳性细胞进行统计。
小鼠皮下移植瘤模型的建立 在无菌条件下, 收集对数生长期的人前列腺癌细胞DU145, 用灭菌生理盐水调整细胞密度至每毫升5×107个, 取0.2 mL接种于裸鼠腋窝皮下, 待肿瘤生长至直径1 cm大小, 无菌条件下取出, 切成1 mm×1 mm大小的瘤块, 均匀接种于裸鼠腋窝皮下[14]。当肿瘤体积接近200~400 mm3, 分组给药并称重, 每组6只[11]。随机分组为溶剂对照组(Ctrl组)、docetaxol (10 mg·kg-1, ip)、napabucasin (20 mg·kg-1, ip)、Bt354 (10 mg·kg-1, po)、Bt354 (20 mg·kg-1, po)、Bt354 (40 mg·kg-1, po)。给药频率为每3天1次。每周称量体重2次, 并用游标卡尺测量肿瘤的长度和宽度, 按照公式V=a×b2/2计算肿瘤体积, 其中a为肿瘤的长度, b为肿瘤的宽度。采用颈椎脱臼法将裸鼠处死, 然后取出肿瘤组织块并称重, 最后计算肿瘤抑制率, 并将肿瘤组织一部分浸泡于4%多聚甲醛固定, 另一部分-80 ℃冻存。
免疫组化 石蜡切片脱蜡水化; 3% H2O2室温孵育10 min, 以消除内源性过氧化物酶的活性; 枸橼酸盐缓冲液微波热修复; 5%正常山羊血清封闭, 室温孵育10 min; 滴加适当比例稀释的一抗工作液, 37 ℃孵育1 h或4 ℃过夜; 滴加适当比例稀释的二抗, 37 ℃孵育30 min; 显色剂3, 3-氮二氨基联苯胺盐(3, 3-N-diaminobenzidine tetrahydrochloride, DAB)显色; 封片。每组样品染色时均同批进行空白对照。在光学显微镜下按单盲法观察全部切片, 每张切片随机选取10个高倍视野照相。免疫组化切片采用IPP5.1图像分析系统进行图像分析, 所有切片均采用同一放大倍数[11]。
外周血中白细胞数目检测 给药周期结束后, 在裸鼠处死前, 取眼眶血20 μL, 加入到血细胞稀释液(2 mL)中, 采用日本光电Nihon Kohden血细胞分析仪进行白细胞数量检测。
细胞迁移实验 将细胞置于37 ℃、5% CO2的孵箱培养18 h后, 取出Transwell小室, 弃去孔中培养液, 用无钙的PBS洗2遍, 甲醇固定30 min, 将小室适当风干。0.1%结晶紫染色20 min, 用棉签轻轻擦掉上层未迁移细胞, 用PBS洗3遍。400倍显微镜下随机3个视野观察细胞, 计数。
TUNEL法细胞凋亡检测 冷冻保存的组织切片在4%多聚甲醛中固定20 min, PBS洗涤, 用新制备的细胞通透液(0.1% Triton X-100溶于0.1%柠檬酸钠)在冰上渗透2 min。再次用PBS洗涤, 将载玻片覆上TUNEL反应混合物(100 μL), 37 ℃下孵育1 h。最后, 在PBS中洗涤细胞, 用盖玻片将含DAPI的ProLong® Gold液态封固剂固定在载玻片上(P36931, Invitrogen)。细胞用荧光显微镜(AX70, Olympus)成像。组织学照片的放大倍数为20倍。
细胞免疫荧光实验 将对数生长期的DU145细胞经消化后制成单细胞悬液, 加入1 mL细胞悬液(2×l04个细胞)于Confocal小皿, 次日, 加入Bt354或溶剂对照培养12 h后, 弃去细胞培养基, 用预冷PBS洗涤2次, 加入4%多聚甲醛室温固定20 min, PBS洗涤3次, 每次5 min, 用含0.3% Triton X-100的PBS溶液室温静置20 min, 进行细胞透化。PBS洗涤3次, 加入5%的BSA室温孵育1 h, 弃上清, 分别加入1% BSA的PBS稀释的兔抗STAT3 (1:100稀释)单克隆抗体, 4 ℃过夜孵育。次日, 弃去一抗, 用PBS洗涤3次, 每次5 min, 加入用含1% BSA的PBS稀释的驴抗兔的荧光二抗Alex a Flour 647 (1:100稀释)室温避光孵育1 h, 其中阴性对照组只加相应的荧光二抗。孵育结束后, 用PBS避光清洗3次, 每次5 min, 最后将上清吸干, 滴加含1 μg·mL-1 DAPI的抗荧光猝灭封片剂进行封片, 并于奥林巴斯(FV1000 MPE, 德国)激光共聚焦显微镜(60倍油镜)进行细胞观察及拍照, 并采用FV10-ASW软件对图像进行处理。
统计学分析 使用GraphPad Prism进行数据统计和计算。实验数据以x ± s表示, 裸鼠实验两组间比较采用one-way ANOVA。
结果 1 Bt354对肿瘤细胞的增殖抑制作用经MTT检测, Bt354作用于DU145细胞48 h后, IC50值为0.3±0.02 μmol·L-1。在MTT实验结果的基础上, 通过EdU染色并使用荧光显微镜观察, 确认化合物Bt354 (图 1A)作用24 h对DU145细胞增殖的影响。Bt354减少EdU染色呈阳性的DU145细胞数, 统计结果有显著性差异。这一结果确认了Bt354对Jak2-STAT3信号通路过度激活的前列腺癌细胞具有较强的增殖抑制作用(图 1B、C)。

|
Figure 1 Bt354 inhibited the proliferation of DU145 cancer cells. A: Chemical structure of Bt354; B: Anti-proliferative effects of Bt354 in DU145 evaluated by using immunofluorescence staining with EdU; C: Change in the number of EdU-labeled DU145 cells. The results are representative of three independent experiments. ***P < 0.001 vs Ctrl group |
经过体外实验可知Bt354对DU145细胞具有较强的增殖抑制作用。接下来, 通过建立DU145细胞皮下移植瘤模型, 判断Bt354在小鼠体内的抗肿瘤效果。用箭头表示给药时间(图 2A), 第25天终止实验。实验期间docetaxol组出现3只动物死亡, napabucasin组出现2只动物死亡。结果显示, docetaxol组瘤体积相对肿瘤增殖率(T/C)为18.1%, 瘤重抑制率为77.4%。Napabucasin组瘤体积T/C为58.9%, 瘤重抑制率为57.8%。Bt354口服给药组, 10、20和40 mg·kg-1组瘤体积T/C分别为45.2%、41.3%和30.0%, 瘤重抑制率分别为58.8%、62.7%和73.5%。终止实验时, 检测外周血细胞含量发现, Bt354对外周血细胞含量无明显影响(图 2、表 1)。

|
Figure 2 Antitumor activity of Bt354 in DU145 xenograft mice model. A, B: Change of tumor volume and body weight; C: Tumor weight of the stripped tumors of DU145 xenograft mice; D: White blood cell (WBC), red blood cell (RBC) and blood platelet (PLT) count of mice treated with docetaxel and different doses of Bt354. n = 7, x ± s |
| Table 1 Antitumor activity of Bt354 in DU145 xenograft mice model. One-way ANOVA, ***P < 0.001 vs Ctrl group. TGI: Tumor growth inhibition; T/C: Mean tumor volume of treated group/mean tumor volume of vehicle group. n = 7, x ± s |
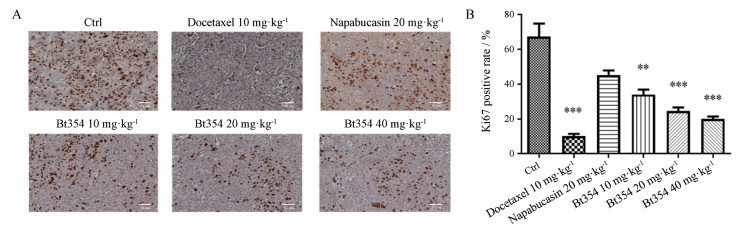
采用免疫组化染色, 验证Bt354对裸鼠DU145异位移植瘤的抗肿瘤作用。染色结果显示, 在给予10、20和40 mg·kg-1的Bt354组内, 均可见DU145移植瘤组织中Ki 67阳性细胞的数量显著降低。提示Bt354能够有效抑制DU145细胞裸鼠异位移植瘤模型中肿瘤组织增殖的作用(图 3)。
|
Figure 3 The number of Ki 67 positive cells in the tumor sections. A: Sections of individual tumors from 6 groups immunohistochemically stained with Ki 67 to evaluate cell proliferation (×200); B: Change in the number of Ki 67 positive cells. **P < 0.01, ***P < 0.001 vs Ctrl group |
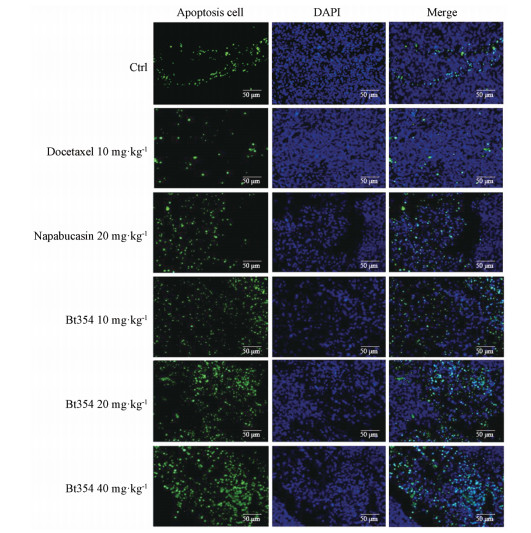
使用TUNEL法检测细胞凋亡, 结果显示: docetaxol给药组可见DU145肿瘤组织出现细胞凋亡, Bt354口服给药组可见随着给药剂量增加, 肿瘤组织出现的细胞凋亡现象增多, 提示Bt354诱导凋亡能力随着给药剂量的增加而加强。以上结果提示, Bt354在体内能诱导DU145肿瘤组织的凋亡(图 4)。
|
Figure 4 Tumor sections from DU145 cells to detect apoptosis in tumor tissue. Scale length is 50 μm |
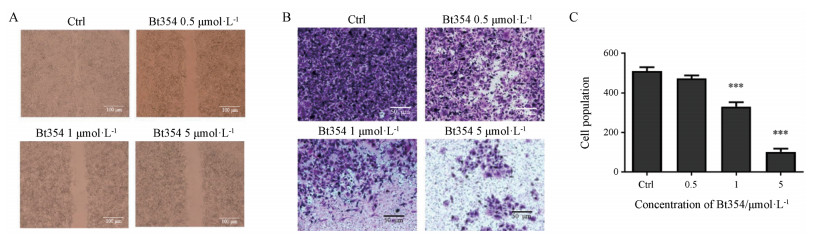
采用细胞划痕实验与Transwell实验进一步验证Bt354在体外对前列腺癌迁移能力的影响(图 5)。在细胞划痕实验中, 在0.5、1和5 μmol·L-1 Bt354刺激24 h后, DU145细胞向划痕区域的生长受到明显抑制。由此证明, Bt354能够在体外抑制DU145细胞的迁移能力。
|
Figure 5 Effect of Bt354 on the invasion and metastasis of tumor cells. A: DU145 cells treated with different concentrations of Bt354 were detected by wound healing assay; B: DU145 cells treated with different concentrations of Bt354 were detected by cell migration assay; C: Change in the population of DU145 cells. ***P < 0.001 vs Ctrl group |
为进一步确认Bt354对DU145迁移能力的影响, 本研究进行了Transwell实验。结果显示, 在Bt354加入Transwel小室上孔中24 h后, 能够明显抑制DU145细胞穿过基底膜的能力, 并且这种抑制效果呈明显的剂量依赖性。在1 μmol·L-1时, 此抑制效果即达到35.3%, 具有显著性差异。这一结果也再次确认了Bt354在体外影响DU145细胞的迁移能力。
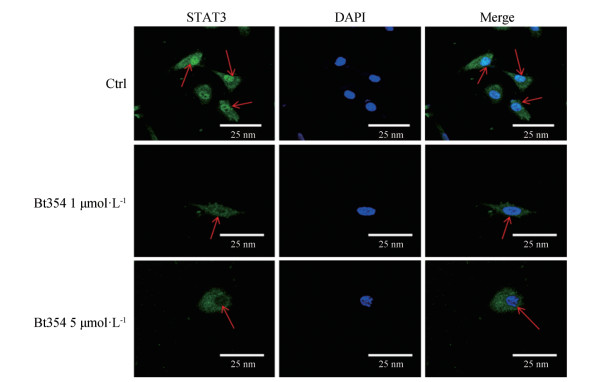
6 Bt354对STAT3入核的影响1和5 μmol·L-1 Bt354分别作用于DU145细胞24 h后, 用免疫荧光法进行检测。结果如图 6所示, 在对照组细胞中, STAT3呈胞浆和胞核散在分布, 且胞核中浓度高于胞浆中的STAT3浓度。经Bt354处理后, DU145细胞中STAT3在细胞核中的分布明显降低, 在5 μmol·L-1 Bt354作用下, 降低作用较1 μmol·L-1 Bt354更强(图 6)。以上结果提示, Bt354能有效地抑制肿瘤细胞中STAT3转移到细胞核中。
|
Figure 6 Bt354 inhibited the nuclear translocation of STAT3 in DU145 cells |
在正常细胞中, STAT3被短暂激活, 在人类肿瘤细胞中则与之相反, STAT3呈持续活化状态。针对这一现象, STAT3被认为是一个很有前景的肿瘤药物靶点。目前已经发现了多个小分子的STAT3抑制剂, 但尚未有针对STAT3靶点的药物获批[15]。
之前本实验室已经报道Bt354在乳腺癌上的抗肿瘤作用及作用机制, 本文首次阐明Bt354对前列腺癌的抗肿瘤作用及作用机制。通过EdU细胞增殖实验发现, Bt354剂量依赖性地降低了EdU阳性染色的DU145细胞, 确认了Bt354对STAT3过度活化的前列腺癌细胞具有较强的增殖抑制作用。接下来针对STAT3高表达的DU145细胞株进行了裸鼠异体皮下移植瘤动物模型的建立, 考察Bt354的体内抗肿瘤活性。结果显示, 在终止实验时: docetaxol组瘤体积T/C为18.1%, 瘤重抑制率为77.4%, napabucasin组瘤体积T/C为58.9%, 瘤重抑制率为57.8%。而Bt354口服给药低、中、高剂量组体积T/C分别为45.2%、41.3%和30.0%, 体重均有轻微下降。另外, Bt354对外周血总白细胞(WBC)、总红细胞(RBC)和血小板(PLT)水平无明显影响, 提示没有明显血液毒性。通过免疫组化检测DU145移植瘤组织中的Ki 67阳性细胞数量, 及检测DU145移植瘤组织中的细胞凋亡状态。给予了Bt354的裸鼠DU145移植瘤组织中Ki 67阳性细胞的数量显著降低且细胞凋亡现象增多。结果提示: Bt354能够减少体内DU145裸鼠异位移植瘤模型中肿瘤细胞的增殖, 诱导体内DU145裸鼠异位移植瘤模型中肿瘤组织的凋亡。
STAT3参与肿瘤细胞的增殖、生存、侵袭转移、血管生成、免疫逃逸等功能[16, 17]。细胞划痕和Transwell实验结果显示, Bt354能有效抑制DU145细胞的侵袭迁移能力。在体外细胞划痕与Transwell实验中, 24 h即出现抑制侵袭转移作用。在凋亡检测中, 给予5 μmol·L-1 Bt354刺激48 h后呈现出明显的诱导凋亡的作用。前期的机制研究发现, 在乳腺癌细胞中, Bt354能有效抑制STAT3与目标DNA的结合, 导致下游靶基因(Bcl-2、Mcl-1、Survivin等)表达下调; 同时, Bt354能够导致乳腺癌细胞STAT3入核减少[11]。在本研究中, 经细胞免疫荧光检测发现相似结果:在Bt354刺激的DU145细胞中STAT3在细胞核中的分布明显降低, 其中5 μmol·L-1 Bt354的降低作用较1 μmol·L-1 Bt354更强。
综上所述, 本研究主要针对本课题组成功筛选到的小分子STAT3抑制剂Bt354进行研究, 之前未见他人对其STAT3抑制活性的报道。药效学研究结果表明: Bt354对前列腺癌DU145具有良好的体内体外抗肿瘤活性。进一步分子作用机制研究表明, Bt354通过影响STAT3入核, 从而进一步影响其与DNA的结合, 最终达到抑制前列腺癌细胞生长的作用。故以Bt354为母体化合物, 有望进一步开发出治疗非激素依赖性的前列腺癌的安全有效药物。
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69: 7–34. DOI:10.3322/caac.21551 |
| [2] | Wang YE, Wu JF. Advances in treatment of castration-resistant prostate cancer[J]. Chin Med J Metall Indus (中国冶金工业医学杂志), 2018, 35: 144–145. |
| [3] | Lassi K, Dawson NA. Update on castrate-resistant prostate cancer:2010[J]. Curr Opin Oncol, 2010, 22: 263–267. DOI:10.1097/CCO.0b013e3283380939 |
| [4] | Xiong H, Zhang ZG, Tian XQ, et al. Inhibition of JAK1, 2/STAT3 signaling induces apoptosis, cell cycle arrest, and reduces tumor cell invasion in colorectal cancer cells[J]. Neoplasia, 2008, 10: 287–297. DOI:10.1593/neo.07971 |
| [5] | Aggarwal BB, Sethi G, Ahn KS, et al. Targeting signal-transducer-and-activator-of-transcription-3 for prevention and therapy of cancer:modern target but ancient solution[J]. Ann N Y Acad Sci, 2006, 1091: 151–169. DOI:10.1196/annals.1378.063 |
| [6] | Dauer DJ, Ferraro B, Song L, et al. STAT3 regulates genes common to both wound healing and cancer[J]. Oncogene, 2005, 24: 3397–3408. DOI:10.1038/sj.onc.1208469 |
| [7] | Song Y, Qian L, Song S, et al. FRA-1 and STAT3 synergistically regulate activation of human MMP-9 gene[J]. Mol Immunol, 2008, 45: 137–143. DOI:10.1016/j.molimm.2007.04.031 |
| [8] | Kesanakurti D, Chetty C, Rajasekhar Maddirela D, et al. Essential role of cooperative NF-κB and STAT3 recruitment to ICAM-1 intronic consensus elements in the regulation of radiation-induced invasion and migration in glioma[J]. Oncogene, 2013, 32: 5144–5155. DOI:10.1038/onc.2012.546 |
| [9] | Xie TX, Wei D, Liu M, et al. STAT3 activation regulates the expression of matrix metalloproteinase-2 and tumor invasion and metastasis[J]. Oncogene, 2004, 23: 3550–3560. DOI:10.1038/sj.onc.1207383 |
| [10] | Han H, Li CY, Liu X, et al. Relationship of STAT3 activity with chemosensitivity to cisplatin in prostate cancer cell lines[J]. Acad J Sec Mil Med Uni (第二军医大学学报), 2012, 33: 150–154. |
| [11] | Chen Y, Ji M, Zhang S, et al. Bt354 as a new STAT3 signaling pathway inhibitor against triple negative breast cancer[J]. J Drug Target, 2018, 26: 920–930. DOI:10.1080/1061186X.2018.1452244 |
| [12] | Stone KR, Mickey DD, Wunderli H, et al. Isolation of a human prostate carcinoma cell line (DU 145)[J]. Int J Cancer, 2010, 21: 274–281. |
| [13] | Ji M, Yao HP, Zhou J, et al. Antitumor activity of a novel PARP1/2 inhibitor YHP-743[J]. Acta Pharm Sin (药学学报), 2018, 53: 938–943. |
| [14] | Tang K, Yang HZ, Li Y, et al. Anti-tumor activity and mechanism of T03 in vitro and in vivo[J]. Acta Pharm Sin (药学学报), 2014, 49: 861–868. |
| [15] | Costantino L, Barlocco D. STAT3 as a target for cancer drug discovery[J]. Curr Med Chem, 2008, 15: 834–843. DOI:10.2174/092986708783955464 |
| [16] | Levy DE, Lee CK. What does STAT3 do?[J]. J Clin Invest, 2002, 109: 1143–1148. DOI:10.1172/JCI0215650 |
| [17] | Chen Y, Ji M, Chen XG. Research progress of relationship between STAT3 and tumor[J]. Acta Pharm Sin (药学学报), 2017, 52: 1351–1358. |
 2019, Vol. 54
2019, Vol. 54


