2. 南方医科大学南方医院胸外科, 广东 广州 510515
2. Department of Thoracic Surgery, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
2018年全球癌症统计指出, 食管癌在世界范围内发病率居于恶性肿瘤第7位(572 000新病例), 然而其死亡率排名却位居第六(509 000人死亡)[1]。在全球范围内, 最常见的食管癌组织学类型是食管鳞状细胞癌(esophageal squamous cell carcinoma ESCC)[2]。以顺铂为基础的联合化疗对于有无手术机会的ESCC患者均是不可缺少的治疗手段[3-5], 然而, 对铂类联合化疗的耐药性是晚期ESCC患者预后不良的主要原因[6]。因此, 提高食管鳞癌对顺铂化疗敏感性是提高ESCC患者生存率的关键。
雷帕霉素靶蛋白(mammalian/mechanistic target of rapamycin, mTOR)信号通路参与了许多肿瘤的发生发展过程[7]。包含DEP域的与哺乳类动物雷帕霉素靶蛋白相互作用的蛋白(DEP-domain containing mTOR-interacting protein, DEPTOR)是mTOR的内源性抑制蛋白, 参与许多细胞通路的调控, 如细胞增殖、细胞凋亡、细胞自噬和血管生成等, 是肿瘤研究领域的热点[8]。研究表明, DEPTOR与肝细胞癌对索拉非尼的耐药[9]及肺腺癌对吉非替尼的耐药有关[10]。然而在不同的食管鳞癌细胞系中, DEPTOR对顺铂化疗敏感性存在不同的影响[11]。深入研究ESCC细胞中DEPTOR与化疗敏感性的关系具有十分重要的意义。
细胞死亡的减少是化疗抵抗产生的最重要的机制之一[12]。近年来, 细胞焦亡作为一种新型的程序性死亡方式备受关注。研究表明, 一些化疗药物可以诱导肿瘤细胞发生焦亡[13], 增强这种死亡效应有望为提高肿瘤化疗敏感性提供新的治疗思路。细胞焦亡最显著的特征是细胞膜结构完整性的破坏、细胞肿胀以及胞内物质的释放。目前, 已发现的细胞焦亡路径主要有两种, 分别为经典焦亡路径和非经典焦亡路径。经典焦亡路径主要步骤为炎性小体的激活和半胱氨酸蛋白酶-1 (cysteine-aspartic proteases-1, Caspase-1)的活化, Caspase-1活化后可切割焦亡关键底物Gasdermin家族成员D (Gasdermin D, GSDMD)并促进白细胞介素1β (interleukin-1β, IL-1β)和白细胞介素18 (interleukin-18, IL-18)前体的成熟。GSDMD裂解产生的N末端通过寡聚化在细胞膜表面形成孔道, 导致细胞肿胀、细胞膜溶解及IL-1β和IL-18的释放。非经典焦亡路径可分为两种:一种是以人Caspase-4/5 (或鼠Caspase-11)作为胞内脂多糖(lipopolysaccharide, LPS)受体, 直接激活并切割GSDMD导致细胞焦亡。另一种通过激活凋亡通路转而切割GSDME, 介导细胞焦亡的发生[14]。此外, 有研究表明Caspase-1的低活性可能与恶性黑色素瘤的耐药相关[15], 而且在某些黑色素瘤细胞中缺失GSDME可导致依托泊苷的耐药[16]。
本研究发现在ESCC细胞中减少DEPTOR的表达, 可使细胞焦亡的发生减少, 最终促使细胞对顺铂产生耐药。本研究揭示了DEPTOR对ESCC细胞顺铂化疗敏感性的影响, 为改善ESCC顺铂化疗敏感性从而提高ESCC患者生存率提供了新思路。
材料与方法细胞 人食管鳞状细胞癌细胞KYSE150、KYSE510购自中国赛库公司。
试剂与药物 顺铂(cisplatin)购自中国麦克林公司; 嘌呤霉素购自中国碧云天公司; 抗DEPTOR抗体、抗β-tubulin抗体购自美国Cell Signaling Technology公司; 抗Caspase-1抗体、抗GSDMD抗体购自美国Proteintech公司; 抗IL-18抗体、抗IL-1β抗体购自英国Abcam公司; CCK8试剂购自中国凯基生物公司; Trizol购自美国Thermo Fisher Scientific公司; PrimeScriptTMRT Master Mix (Perfect Real Time)、TB GreenTMPremix Ex TaqTM (Tli RNaseH Plus)购自日本Takara公司。
仪器与设备 Olympus IX71显微镜(日本); Biotek全波长酶标仪(美国); BIO-RAD GelDoc XR+凝胶成像分析系统(美国); RocheLightCycler®480系统(美国)。
细胞培养 参照KYSE150、KYSE510细胞培养说明书, 使用RPMI-1640培养基(含10%胎牛血清、1%青链霉素双抗)于37 ℃、5% CO2环境下对食管鳞癌细胞进行常规培养, 对数生长期进行传代处理。
细胞稳转株的建立 自苏州吉玛基因公司购买构建成功的DEPTOR敲减组(shDEPTOR)及空白对照组(sh-con)的慢病毒载体。将细胞以3×105~5×105个/孔的密度接种于6孔板, 预留1个计数孔。铺板后第2天, 将计数孔的细胞消化计数, 以最佳的MOI值转染细胞。转染2~3天后, 用含有嘌呤霉素的完全培养基筛选细胞7~10天, 倒置荧光显微镜下观察绿色荧光蛋白(GFP)的表达。
细胞焦亡形态观察 细胞以40%~50%密度接种于6孔板后, shDEPTOR组和sh-con组分别加入20 μg·mL-1顺铂刺激18 h, 使用Olympus IX71相差显微镜观察细胞焦亡形态。
CCK8检测细胞活力 取对数生长期的食管鳞癌细胞, 用胰蛋白酶进行消化、离心并计数。根据计数结果, 取适量细胞悬液, 根据分组将细胞以3 000个/孔接种于96孔板。次日根据分组分别加入100和150 μg·mL-1顺铂处理6 h。将待测96孔板中细胞上清液去除, 加入培养基+CCK8试剂混合液(90 μL培养基+10 μL CCK8), 将96孔板放回37 ℃、5% CO2细胞培养箱中孵育30 min, 振荡混匀后, 用酶标仪在450 nm波长下测定OD值。细胞活力计算公式:细胞活力(%)=[OD实验组-OD空白]/[OD对照组-OD空白]×100%。
实时荧光定量聚合酶链式反应(Q-PCR) 使用Trizol提取细胞总RNA, 并根据PrimeScriptTMRT Master Mix (Perfect Real Time)说明书对样本进行逆转录。参照TB GreenTMPremix Ex TaqTM (Tli RNaseH Plus)说明书在RocheLightCycler®480仪器中进行qRT-PCR, 每组设3个复孔, 计算复孔的Ct平均值, 并按照2-ΔΔCt相对定量计算公式得到相对定量结果。
蛋白免疫印迹(Western blot) 将shDEPTOR组和sh-con组细胞分别加入预冷的RIPA裂解液(含1%蛋白酶抑制剂和0.5%磷酸酶抑制剂), 充分裂解后提取蛋白于预冷的1.5 mL EP管内。BCA法测定蛋白浓度后, 依比例将蛋白样品的浓度进行归一化后, 100 ℃金属浴加热10 min。变性后的蛋白通过SDS-PAGE凝胶分离, 并转移到NC膜上。在孵育一抗和二抗后, 加入ECL化学发光底物反应液进行凝胶成像检测。
数据处理 所有数据应用GraphPad Prism 5软件进行统计分析。每组实验重复3次, 实验数据用均数±标准差(x ± s)表示。
结果 1 构建DEPTOR敲减的ESCC稳定表达株为研究DEPTOR对ESCC细胞化疗敏感性的影响, 选取2株ESCC细胞系: KYSE150和KYSE510细胞系。构建DEPTOR敲减慢病毒(shDEPTOR)及空白对照慢病毒(sh-con), 分别转染KYSE150和KYSE510细胞系。倒置荧光显微镜观察慢病毒转染后shDEPTOR组及sh-con组中绿色荧光蛋白表达情况(图 1A)。通过Q-PCR法和Western blot法分别检测DEPTOR的mRNA及蛋白表达水平。结果表明, shDEPTOR组的DEPTOR mRNA及蛋白表达水平与sh-con组相比显著降低(P<0.001, 图 1B~D)。

|
Figure 1 Construction of stable DEPTOR knockdown ESCC cell lines. A: Fluorescence of the stable cells were observed after infection of the constructed lentiviruses using fluorescence microscopy; B-D: The mRNA (B) and protein expression (C, D) of DEPTOR in each group. Experiments have been repeated for three times independently. n = 3, x ± s. ***P < 0.001. DEPTOR: DEP-domain containing mTOR-interacting protein; ESCC: Esophageal squamous cell carcinoma |
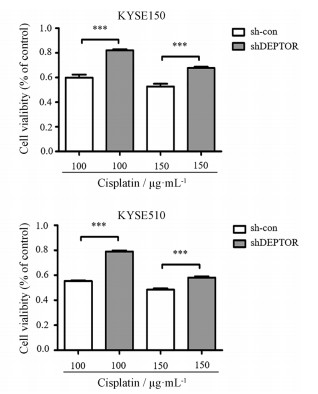
在DEPTOR敲减的ESCC稳定表达株构建成功后, 在sh-con组及shDEPTOR组加入两种不同浓度的顺铂(100和150 μg·mL-1)处理6 h后, 通过CCK8方法检测各组细胞活力。结果显示, 两种不同浓度顺铂处理下, 与sh-con组相比, sh-DEPTOR组细胞活率均明显上升。并且, 低浓度顺铂(100 μg·mL-1)处理组差异更为明显(图 2)。
|
Figure 2 CCK-8 assay was performed to determine the cell viability. Experiments have been repeated for three times independently. n = 3, x ± s. ***P < 0.001 |
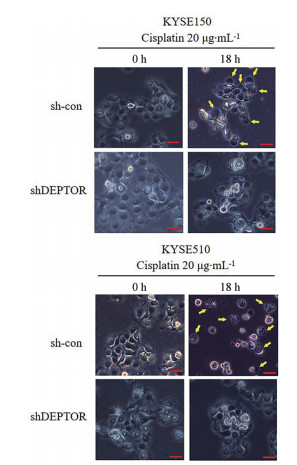
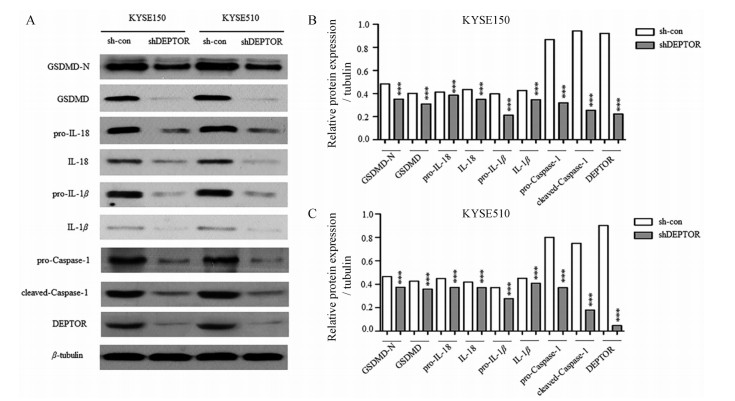
为探究敲减DEPTOR使ESCC细胞产生顺铂耐药的原因, 用20 μg·mL-1顺铂处理细胞18 h, 用相差显微镜观察细胞形态。结果表明, sh-con组可观察到典型的细胞焦亡形态学改变, 而在shDEPTOR组该现象减少(图 3)。为探究两组细胞产生形态学差异的机制, 本研究通过Western blot检测细胞焦亡信号通路相关蛋白Caspase-1、GSDMD、GSDMD-N、pro-IL-18、IL-18、pro-IL-1β和IL-1β的表达及活化水平。结果显示, 与sh-con组比较, shDEPTOR组的Caspase-1蛋白及其活化形式cleaved-Caspase-1表达减少, GSDMD、GSDMD-N、pro-IL-18、IL-18、pro-IL-1β和IL-1β等细胞焦亡信号通路相关分子表达及活化减少(图 4)。
|
Figure 3 Phase-contrast cell images. Arrow: Pyroptotic cells |
|
Figure 4 A: The protein expression of pro-Caspase-1, cleaved-Caspase-1, GSDMD, GSDMD-N, pro-IL-18, IL-18, pro-IL-1β, IL-1β, DEPTOR in each group. B-C: Protein levels of pro-Caspase-1, cleaved-Caspase-1, GSDMD, GSDMD-N, pro-IL-18, IL-18, pro-IL-1β, IL-1β, DEPTOR were also measured of β-tubulin. Experiments have been repeated for three times independently. n = 3, x ± s. ***P < 0.001 vs sh-con group. GSDMD: Gasdermin D; IL: Interleukin |
食管鳞状细胞癌是食管癌最常见的组织病理学亚型[2], 基于顺铂的联合化疗方案被广泛应用于晚期食管鳞状细胞癌的一线治疗[3-5]。然而, 天然耐药和获得性耐药性严重限制了顺铂的临床使用[6]。因此, 寻找食管鳞状细胞癌潜在的耐药机制以恢复肿瘤细胞对顺铂的敏感性至关重要。
DEPTOR作为mTOR的内源性抑制蛋白, 参与许多细胞信号通路的调控[8], 一些研究表明DEPTOR与索拉非尼[9]、吉非替尼[10]耐药有关。然而DEPTOR在肿瘤化疗耐药的作用及机制尚未完全阐明。既往研究发现, DEPTOR可以调节食管鳞状细胞癌对化疗药物的敏感性[11]。因此, 深入研究DEPTOR在化疗敏感性的作用机制具有十分重要的意义。
细胞焦亡作为一种新型的细胞死亡方式, 具有鲜明的形态学特点和独特的分子机制[14]。研究表明, 细胞焦亡现象广泛参与了肿瘤的发生发展过程[17-21]。其中, Caspase-1是细胞焦亡经典途径活化的关键分子。细胞焦亡是化疗药物发挥抗肿瘤作用的机制之一。据报道, Caspase-1活性的降低可能与化疗耐药相关[22]。因此, 细胞焦亡可能参与化疗敏感性的调节。
本文在细胞水平对DEPTOR、细胞焦亡、顺铂化疗敏感性三者的关系进行了初步探讨。在成功构建了DEPTOR敲减的ESCC稳定表达株后, 通过CCK-8法进行细胞活率测定, 证实了DEPTOR敲减的食管鳞癌细胞对顺铂的化疗敏感性降低。为探究DEPTOR敲减组与对照组之间顺铂敏感性差异产生的原因, 本文采用顺铂长时间处理以上两组细胞, 并用相差显微镜观察两组细胞的形态学变化。结果显示, 正常表达DEPTOR的食管鳞状细胞癌细胞在顺铂处理下可观察到典型的细胞焦亡形态学改变, 而DEPTOR敲减组发生典型形态改变的细胞较对照组明显减少。为证实DEPTOR敲减是通过减少细胞焦亡的发生从而发挥其诱导化疗耐药的功能, 本研究进一步检测了细胞焦亡相关蛋白的表达及其活化。Western blot结果显示, 在DEPTOR敲减细胞中Caspase-1的表达及活化形式cleaved-Caspase-1显著降低, 并且细胞焦亡信号通路的相关分子GSDMD、pro-IL-18、pro-IL-1β及其活化形式GSDMD-N、IL-18、IL-1β的表达明显减少。
综上所述, 本研究首次证明DEPTOR可以通过Caspase-1介导的经典细胞焦亡通路提高食管鳞状细胞癌细胞对顺铂的化疗敏感性, 将为改善食管鳞状细胞癌对顺铂的耐药性提供新思路。
| [1] | Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394–424. DOI:10.3322/caac.21492 |
| [2] | Arnold M, Soerjomataram I, Ferlay J, et al. Global incidence of oesophageal cancer by histological subtype in 2012[J]. Gut, 2015, 64: 381–387. DOI:10.1136/gutjnl-2014-308124 |
| [3] | Miyazaki T, Sohda M, Tanaka N, et al. Phase Ⅰ/Ⅱ study of docetaxel, cisplatin, and 5-fluorouracil combination chemoradiotherapy in patients with advanced esophageal cancer[J]. Cancer Chemother Pharmacol, 2015, 75: 449–455. DOI:10.1007/s00280-014-2659-6 |
| [4] | Hashimoto J, Kato K, Ito Y, et al. Phase Ⅱ feasibility study of preoperative concurrent chemoradiotherapy with cisplatin plus 5-fluorouracil and elective lymph node irradiation for clinical stage Ⅱ/Ⅲ esophageal squamous cell carcinoma[J]. Int J Clin Oncol, 2019, 24: 60–67. DOI:10.1007/s10147-018-1336-x |
| [5] | Kato K, Muro K, Minashi K, et al. Phase Ⅱ study of chemoradiotherapy with 5-fluorouracil and cisplatin for stage Ⅱ-Ⅲ esophageal squamous cell carcinoma:JCOG trial (JCOG 9906)[J]. Int J Radiat Oncol Biol Phys, 2011, 81: 684–690. DOI:10.1016/j.ijrobp.2010.06.033 |
| [6] | Yu X, Li W, Xia Z, et al. Targeting MCL-1 sensitizes human esophageal squamous cell carcinoma cells to cisplatin-induced apoptosis[J]. BMC Cancer, 2017, 17: 449. DOI:10.1186/s12885-017-3442-y |
| [7] | Guertin DA, Sabatini DM. Defining the role of mTOR in cancer[J]. Cancer Cell, 2007, 12: 9–22. DOI:10.1016/j.ccr.2007.05.008 |
| [8] | Catena V, Fanciulli M. DEPTOR:not only a mTOR inhibitor[J]. J Exp Clin Cancer Res, 2017, 36: 12. DOI:10.1186/s13046-016-0484-y |
| [9] | Yang Z, Zhang J, Lin X, et al. Inhibition of neddylation modification by MLN4924 sensitizes hepatocellular carcinoma cells to sorafenib[J]. Oncol Rep, 2019, 41: 3257–3269. |
| [10] | Zhou X, Guo J, Ji Y, et al. Reciprocal negative regulation between EGFR and DEPTOR plays an important role in the progression of lung adenocarcinoma[J]. Mol Cancer Res, 2016, 14: 448–457. DOI:10.1158/1541-7786.MCR-15-0480 |
| [11] | Dong X, Wang L, Han Z, et al. Different functions of DEPTOR in modulating sensitivity to chemotherapy for esophageal squamous cell carcinoma[J]. Exp Cell Res, 2017, 353: 35–45. DOI:10.1016/j.yexcr.2017.03.003 |
| [12] | Johnstone RW, Ruefli AA, Lowe SW. Apoptosis:a link between cancer genetics and chemotherapy[J]. Cell, 2002, 108: 153–164. DOI:10.1016/S0092-8674(02)00625-6 |
| [13] | Wang Y, Gao W, Shi X, et al. Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a gasdermin[J]. Nature, 2017, 547: 99–103. DOI:10.1038/nature22393 |
| [14] | Man SM, Karki R, Kanneganti TD. Molecular mechanisms and functions of pyroptosis, inflammatory caspases and inflammasomes in infectious diseases[J]. Immunol Rev, 2017, 277: 61–75. DOI:10.1111/imr.12534 |
| [15] | Westbom C, Thompson JK, Leggett A, et al. Inflammasome modulation by chemotherapeutics in malignant mesothelioma[J]. PLoS One, 2015, 10: e145404. |
| [16] | Lage H, Helmbach H, Grottke C, et al. DFNA5(ICERE-1) contributes to acquired etoposide resistance in melanoma cells[J]. FEBS Lett, 2001, 494: 54–59. DOI:10.1016/S0014-5793(01)02304-3 |
| [17] | Li J, Yang C, Li Y, et al. lncRNA GAS5 suppresses ovarian cancer by inducing inflammasome formation[J]. Biosci Rep, 2017. DOI:10.1042/BSR20171150 |
| [18] | Wang Y, Yin B, Li D, et al. GSDME mediates caspase-3-dependent pyroptosis in gastric cancer[J]. Biochem Biophys Res Commun, 2018, 495: 1418–1425. DOI:10.1016/j.bbrc.2017.11.156 |
| [19] | Pizato N, Luzete BC, Kiffer L, et al. Omega-3 docosahexaenoic acid induces pyroptosis cell death in triple-negative breast cancer cells[J]. Sci Rep, 2018, 8: 1952. DOI:10.1038/s41598-018-20422-0 |
| [20] | Wang F, Liu W, Ning J, et al. Simvastatin suppresses proliferation and migration in non-small cell lung cancer via pyroptosis[J]. Int J Biol Sci, 2018, 14: 406–417. DOI:10.7150/ijbs.23542 |
| [21] | So D, Shin HW, Kim J, et al. Cervical cancer is addicted to SIRT1 disarming the AIM2 antiviral defense[J]. Oncogene, 2018, 37: 5191–5204. DOI:10.1038/s41388-018-0339-4 |
| [22] | Westbom C, Thompson JK, Leggett A, et al. Inflammasome modulation by chemotherapeutics in malignant mesothelioma[J]. PLoS One, 2015, 10: e145404. |
 2019, Vol. 54
2019, Vol. 54


