1956年, 德国科学家Warburg发现肿瘤细胞存在代谢异常, 即为著名的“Warburg effect”, 又称为有氧糖酵解(aerobic glucolysis)[1-3]。随着研究的深入, 能量代谢重编程已经成为肿瘤细胞的一个重要的标志特征[4-6]。而异常脂肪酸代谢是肿瘤的一项重要代谢特征, 其有助于恶性肿瘤细胞生长、存活及侵袭, 为其提供了至关重要的物质和能量[7, 8]。而酮体作为脂肪酸在肝脏分解的必然产物, 很多研究证明, 肿瘤可以将酮体作为线粒体燃料, 促进肿瘤生长和转移扩散[9, 10]。琥珀酰辅酶A转移酶(succinyl-CoA transferase, SCOT)作为酮体代谢过程中的限速酶, 与肿瘤发生、发展密切相关, 并在肿瘤的侵袭和转移过程中扮演着重要的角色。
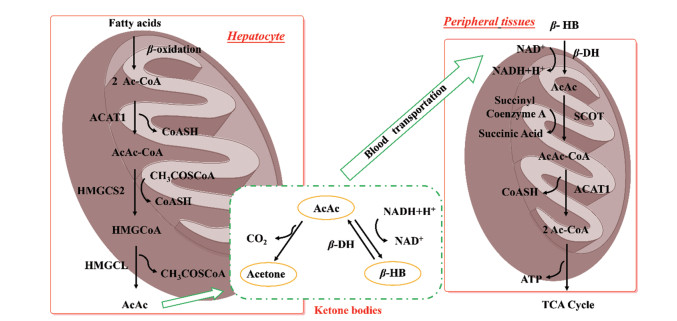
1 酮体代谢酮体是脂肪酸氧化分解的中间产物, 包括乙酰乙酸(30%)、β-羟丁酸(70%)和丙酮(微量)[11]。酮体生成是由肝线粒体中的羟甲基戊二酸单酰-辅酶A合成酶(hydroxymethyl glutaric acid monoacyl-coenzyme A synthase, HMGCS)将两分子的乙酰辅酶A缩合成羟甲基戊二酸单酰-辅酶A (hydroxymethyl glutaryl CoA, HMG CoA), 再由HMG CoA裂解酶(hydroxymethyl glutaric acid monoacyl-coenzyme A lyase, HMGCL)释放乙酰辅酶A, 生成乙酰乙酸。大多数乙酰乙酸被β-羟丁酸脱氢酶(β-hydroxybutyrate dehydrogenase, βDH)进一步代谢为β-羟丁酸, 少量乙酰乙酸转变为丙酮[12-15]。然而, 肝组织具有活性较强的酮体合成酶, 却缺乏利用酮体的酶, 而肝外许多组织, 特别是在心、脑和肾, 具有活性很强的酮体代谢酶, 能将酮体重新裂解成乙酰辅酶A, 并通过三羧酸循环彻底氧化[16]。所以酮体在肝生成后, 首先通过血液运输转运到肝外靶组织, 再在线粒体代谢酶的作用下进行氧化分解。乙酰乙酸首先在SCOT的作用下获得辅酶A, 生成乙酰乙酰辅酶A, 接着在乙酰乙酰辅酶A硫解酶或乙酰乙酰辅酶A乙酰基转移酶(acetoacetate thiokinase, ACAT1)的作用下, 重新生成乙酰辅酶A, 最终进入三羧酸循环, 产生能量[12] (图 1)。而β-羟丁酸的利用是先在βDH催化下, 脱氢生成乙酰乙酸, 再经乙酰乙酸的代谢途径, 最终生成乙酰辅酶A被彻底氧化。含量最少的丙酮则主要经肺排出体外, 也有一小部分可以转化为丙酮酸或者乳酸参加糖异生反应[17, 18]。
|
Figure 1 Ketone bodies metabolism. Ketone bodies are metabolic products that are produced in excess during breakdown of fatty acids, which occurs in the liver-mitochondria. But ketone bodies are not consumed in normal adult liver cells for lack of ketone-utilizing enzymes in liver tissue. Therefore, ketone bodies produced in the liver need to be transported by blood to extrahepatic tissues for oxidative utilization. Ac-CoA: Acetyl-CoA; SCOT: Succinyl-CoA transferase; ACAT1: Acetoacetate thiokinase; AcAc-CoA: Acetoacetyl-CoA; HMGCS: Hydroxymethyl glutaric acid monoacyl-coenzyme A synthase; HMG CoA: Hydroxymethyl glutaryl CoA; HMGCL: Hydroxymethyl glutaric acid monoacyl-coenzyme A lyase; AcAc: Acetoacetate; βHB: β-Hydroxybutyrate; βDH: β-Hydroxybutyrate dehydrogenase |
SCOT又称3-氧代酸辅酶A转移酶1 (3-oxoacid CoA-transferase 1, OXCT1), 是一种由521个氨基酸组成的线粒体转移酶。人源SCOT基因位于第5号染色体上, 其跨度超过100 kb, 包括17个外显子[19, 20]。2013年, Shafqat等[21]通过测定SCOT的晶体结构证明SCOT是具有两个活性位点的二聚体, SCOT蛋白的每个单体亚基由氨基末端和羧基末端结构域构建, 其活性位点与辅酶A结合, 从而催化酮解的第一步反应。酮体代谢过程中主要有3种酶参与, 分别是SCOT、ACAT和βDH。其中ACAT和βDH在酮体生成中也发挥作用, 故SCOT是酮体代谢中关键酶[16]。
SCOT催化酮解的第一个限速反应, 将琥珀酰上的辅酶A基团转移至乙酰乙酸上, 形成乙酰乙酰辅酶A, 然后乙酰乙酰辅酶A在线粒体中的ACAT作用下产生两分子乙酰辅酶A, 乙酰辅酶A进入三羧酸循环产生ATP[13-15]。SCOT可在所有肝外组织中检测到, 但不在肝细胞中表达[22], 这可能是由于其启动子活性在肝组织中受到抑制[15, 23]。β-羟丁酸作为另一种酮体化合物, 一旦被靶组织吸收, 又被同一种酶即βDH催化为乙酰乙酸, 然后乙酰乙酸进行上述分解代谢过程。这种生成和代谢方式也被解释为阻止了β-羟丁酸合成和利用在肝脏中的无效循环[12]。综上所述, 在肝外组织的线粒体中, SCOT蛋白催化氧化酮体, 为生物体新陈代谢提供能量, 从而实现酮体作为生物体新陈代谢的一种能量的价值。
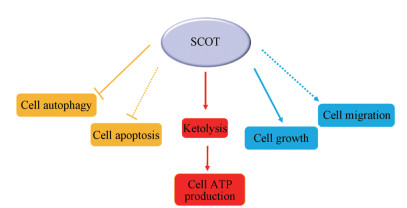
3 SCOT与肿瘤的关系正常情况下, 血中酮体的含量很少, 在饥饿或糖利用障碍时, 脂肪动员加强, 酮体生成增加。然而, 一些研究已经证实, 除了正常细胞, 肿瘤细胞也可以利用酮体, 如上皮癌细胞可以利用酮体(3-羟基丁酸和乙酰乙酸)作为线粒体燃料, 促进肿瘤的生长和转移[10]。研究报道, 在MDA-MB-231人乳腺癌细胞中过度表达酮体再利用的关键酶SCOT和ACAT1/2, 结果显示, 过表达酮体分解代谢所需酶的MDA-MB-231细胞呈现肿瘤生长和转移能力显著增加[9, 24]。张松[25]研究发现非小细胞肺癌(NSCLC)细胞和组织中的酮体分解代谢酶SCOT的表达相对于正常组织显著上调, 并且在降低了细胞中SCOT表达后, NSCLC的生长和迁移受到了明显地抑制, 并诱导细胞凋亡, 降低了细胞的ATP和线粒体的增殖。2009年, Lisanti课题组[26]提出“反向Warburg效应”的新概念, 即有氧糖酵解实际上发生在与肿瘤有关的成纤维细胞中, 而不是在肿瘤细胞本身产生。即肿瘤微环境中的成纤维细胞通过有氧糖酵解产生线粒体燃料(乳酸和酮体), 以促进肿瘤细胞的生长、增殖、浸润和转移。Ozsvari等[27]更是定义了“mitoketoscins”, 即“有丝分裂素”的新概念, 来肯定酮体利用在抗肿瘤治疗中的重要作用以及酮体利用酶可作为药物开发的新的重要治疗靶点。总之, 目前研究已表明, SCOT在多种肿瘤细胞中, 可以抑制细胞自噬和凋亡, 同时在细胞增殖、迁移、线粒体增殖和细胞ATP生成等过程中发挥重要作用(图 2)。
|
Figure 2 The role of SCOT in cancer cells: inhibiting apoptosis and autophagy, promoting cell growth and migration, and providing energy ATP for cells through ketolysis process |
酮体虽然在肝脏中产生, 但在正常的成人肝细胞中却不被消耗, 而是在肝外组织中氧化代谢, 转换为乙酰辅酶A, 进入三羧酸循环, 产生ATP。而研究发现, 在营养缺乏的情况下, 酮体分解代谢在肝细胞癌(HCC)细胞中被重新激活[28]。2016年, 研究发现, SCOT通过血清饥饿引发的mTORC2-AKT-SP1信号, 可以在肝癌细胞中被重新诱导[23]。而增强的肝癌细胞癌酮解过程则通过抑制AMPK活性和保护肝癌细胞免于过度自噬, 来促进肿瘤生长[29, 30]。此外, 对临床HCC样本分析显示, SCOT的蛋白表达量在肝癌患者组织样本中还与肿瘤的恶性程度呈正相关, SCOT表达增加可预测患者较高的死亡率[31]。由此可见, SCOT可能是潜在的肝癌患者预后指标, 但是其机制尚未明确, 有待进一步的数据研究。对于营养缺乏的HCC细胞, 沉默SCOT的表达可以减少ATP产生, 进而减缓肝癌细胞的生长; 与此同时, 对于普通肝癌, 沉默SCOT是否具有同样的作用, 仍有待进一步地深入研究[25]。
3.2 非小细胞肺癌有研究利用cBioProtal FOR CANCER GENOMICS软件分析了SCOT基因在不同类型的肺癌临床样本中的变化情况, 结果发现SCOT在所研究的肺鳞状细胞癌、肺腺癌及非小细胞肺癌中分别出现16.9%、9.6%和8.8%的扩增(TCGA、TCGA、TCGA)[15]。这说明SCOT在肺癌的发生发展中可能存在重要的价值。进一步研究, 以3株NSCLC细胞(H1299、H292、SPC-A1)以及正常人支气管上皮细胞(HBE)为实验对象, 收集HBE细胞和上述3株NSCLC细胞的蛋白进行Western blot分析, 结果显示, 与HBE细胞相比, SCOT蛋白水平在3株NSCLC细胞中的表达水平均上调。干扰SCOT的表达后, 通过结晶紫染色实验和克隆集落形成实验发现NSCLC细胞的集落形成能力和增殖生长均受到了明显地抑制。NSCLC患者的肺癌组织和癌旁组织的SCOT蛋白表达和NSCLC细胞中表达趋势一致, 均为上升[20]。以上研究说明, SCOT在肺癌的治疗中具有潜在价值, 但其调控机制以及能否实现靶向治疗肺癌仍有待进一步研究探讨。
3.3 乳腺癌目前, 有研究者通过qRT-PCR技术检测了3株肿瘤细胞系中酮体代谢酶βDH1和SCOT编码基因的表达情况, 结果显示, βDH1和SCOT在乳腺癌MDA-MB-231细胞株、565细胞株以及SKBR-3细胞株中均呈现不同程度的高表达[32]。利用代谢组基因组学方法检测酮体对MCF7乳腺癌细胞转录谱的影响, 发现酮体诱导的mRNA表达和干性与乳腺癌十分相关[33]。通过计算机模拟技术, 根据已知的SCOT和ACAT1的3D结构, 筛选出在空间上适合这些酶的活性位点的潜在化合物, 进一步通过表型筛选, 确定其对能量的影响, 最终选出几个最具潜力的、在功能上抑制肿瘤干细胞活性和增殖的化合物, 推测这些化合物是通过部分模拟了辅酶A的结构, 从而发挥抑制作用[22]。综上, SCOT与多株乳腺癌细胞关系密切, 未来针对此类化合物能否实现靶向治疗乳腺癌有待研究。
3.4 前列腺癌研究表明, 前列腺癌是雄激素依赖性疾病, 目前有效地治疗雄激素依赖性前列腺癌的治疗方法有限。2013年, Locke等[34]利用细胞培养中氨基酸的稳定同位素标记和质谱联用, 评估了lncap细胞系及其雄激素依赖的lncap-sf这两个细胞系的差异表达, 结果发现在lncap-sf细胞中ACAT1、βDH1、HMGCl和SCOT这些酶的表达均有增加, 并通过蛋白质印迹法也进一步证实。为了确定这些酶在临床样本中是否上调, 对人前列腺癌组织进行了免疫组化检测, 从中观察到与正常组织(25%)和低级别样本(27%)相比, SCOT在高级别前列腺癌(66%)中的染色强度有所增加[35]。以上研究表明, SCOT可能作为前列腺癌恶性程度的生物指标, 在前列腺癌治疗中也存在潜在意义。
3.5 神经胶质瘤酮体分子小, 溶于水, 不仅能在血液中传输, 还能通过血脑屏障的毛细血管, 很容易被运输到脑中利用。脑组织虽然不能氧化分解脂肪酸, 却能有效利用酮体, 在葡萄糖供应不足或利用障碍时, 酮体是脑组织的主要能源物质[36]。由此可见, 酮体代谢在脑的能量供应方面发挥着重要作用。研究发现, 酮体对神经细胞具有保护作用[37], 酮解过程中的关键酶, 如SCOT、ACAT等蛋白及mRNA表达在正常脑组织中较脑肿瘤细胞高[38], 即SCOT作为酮体供能代谢中的关键酶, 在多种脑肿瘤中表达下调, 表明脑肿瘤细胞酮体利用障碍[39, 40]。这同时也引起了一些研究者的好奇, 神经元恶化后是如何改变代谢获得更多能量?随着生酮疗法在儿童癫痫治疗中的应用[41, 42], 越来越多的学者将生酮疗法用于研究各种神经疾病, 如阿尔茨海默病(AD)、帕金森病(PD)、脑卒中、神经损伤、肌萎缩侧索硬化、自闭症、头痛、疼痛和睡眠障碍等[43]。Chang等[44]将其和恶性胶质瘤联系起来, 探讨恶性胶质瘤中酮解酶和糖酵解酶的表达谱对生酮饮食疗法的意义。通过特异性抗体免疫组化的方法, 研究了几种参与葡萄糖和酮体代谢的关键酶, HK2、PKM2、SCOT、ACAT及βDH1在人间变性胶质瘤(WHO Ⅲ级)和胶质母细胞瘤(WHO Ⅳ级)样本中的表达。结果发现, 与之前研究结果几乎一致, 酮解的关键酶SCOT和βDH1的表达很低。进一步研究在这些酶的差异表达情况下的生酮疗法的敏感性, 发现在酮解限速酶SCOT表达低的胶质瘤患者中生酮疗法的效果更佳[44]。因此, 未来能否将酮解关键酶SCOT的表达作为生酮疗法敏感与否的生物标志物, 同时通过抑制SCOT的表达来扩大生酮疗法的治疗瘤谱, 有待进一步研究验证。
4 小结和展望SCOT是一种重要的肿瘤细胞代谢酶, 在肿瘤的发生发展中具有复杂、不可或缺的作用。随着肿瘤代谢研究的日渐深入, 作为酮体代谢的关键限速酶, SCOT与肿瘤的密切关系日益显现。一方面, 在癌细胞中, SCOT抑制细胞自噬和凋亡, 同时促进细胞增殖、迁移、线粒体增殖, 并通过酮体代谢途径为细胞提供能量ATP[9]。因此, 针对SCOT的抑制剂研究迫在眉睫。那么, SCOT在不同肿瘤中的代谢表达差异是否具有特异性, 从而将这类药物的研究推向抗肿瘤治疗的新视角, 有待进一步研究。并且, SCOT如何发挥抗肿瘤的机制以及如何接受基因调控等尚未明了。另一方面, 酮体对神经具有保护作用, SCOT在脑肿瘤中普遍低表达, 使得酮体在脑肿瘤中氧化代谢受阻, 从而发现了高酮体、低糖代谢饮食的生酮疗法, 随着越来越多的研究将生酮疗法和酮体代谢酶的表达联系起来[32, 45], 这是否可以打开抗肿瘤治疗的新联合方法, 即将SCOT抑制剂与生酮饮食联合, 从而扩大生酮疗法的瘤谱, 也有待于进一步深入研究。总之, SCOT及酮体代谢在肿瘤的发生发展与治疗中的角色的复杂性远不止文中所提及的, 这有待研究者未来进一步研究与探讨。
| [1] | Bensinger SJ, Christofk HR. New aspects of the Warburg effect in cancer cell biology[J]. Semin Cell Dev Biol, 2012, 23: 352–361. DOI:10.1016/j.semcdb.2012.02.003 |
| [2] | Koppenol WH, Bounds PL, Dang CV. Otto Warburg's contributions to current concepts of cancer metabolism[J]. Nat Rev Cancer, 2011, 11: 325–337. DOI:10.1038/nrc3038 |
| [3] | Netanya Y, Spencer MD, Robert C, et al. The Warburg effect, lactate, and nearly a century of trying to cure cancer[J]. Semin Nephrol, 2019, 39: 380–393. DOI:10.1016/j.semnephrol.2019.04.007 |
| [4] | Hsu PP, Sabatini DM. Cancer cell metabolism: Warburg and beyond[J]. Cell, 2008, 134: 703–707. DOI:10.1016/j.cell.2008.08.021 |
| [5] | Cairns RA, Harris IS, Mak TW. Regulation of cancer cell metabolism[J]. Nat Rev Cancer, 2011, 11: 85–95. DOI:10.1038/nrc2981 |
| [6] | Martinez-Outschoorn UE, Peiris-Pagés M, Pestell RG, et al. Cancer metabolism: a therapeutic perspective[J]. Nat Rev Clin Oncol, 2017, 14: 11–31. DOI:10.1038/nrclinonc.2016.60 |
| [7] | Carracedo A, Cantley LC, Pandolfi PP, et al. Cancer metabolism: fatty acid oxidation in the limelight[J]. Nat Rev Cancer, 2013, 13: 227–232. DOI:10.1038/nrc3483 |
| [8] | Sotgia F, Ozsvari B, Fiorillo M, et al. A mitochondrial based oncology platform for targeting cancer stem cells (CSCs): MITO-ONC-RX[J]. Cell Cycle, 2018, 17: 2091–2100. DOI:10.1080/15384101.2018.1515551 |
| [9] | Martinez-Outschoorn UE, Lin Z, Whitaker-Menezes D, et al. Ketone body utilization drives tumor growth and metastasis[J]. Cell Cycle, 2012, 11: 3964–3971. DOI:10.4161/cc.22137 |
| [10] | Bonuccelli G, Tsirigos A, Whitaker-Menezes D, et al. Ketones and lactate "fuel" tumor growth and metastasis[J]. Cell Cycle, 2010, 9: 3506–3514. DOI:10.4161/cc.9.17.12731 |
| [11] | Puchalska P, Crawford, Peter A. Multi-dimensional roles of ketone bodies in fuel metabolism, signaling, and therapeutics[J]. Cell Metab, 2017, 25: 262–284. DOI:10.1016/j.cmet.2016.12.022 |
| [12] | Newman JC, Verdin E. Ketone bodies as signaling metabolites[J]. Trends Endocrin Met, 2014, 25: 42–52. DOI:10.1016/j.tem.2013.09.002 |
| [13] | Williamson DH, Bates MW, Page MA, et al. Activities of enzymes involved in acetoacetate utilization in adult mammalian tissues[J]. Biochem J, 1971, 121: 41–47. DOI:10.1042/bj1210041 |
| [14] | Hori T, Yamaguchi S, Shinkaku H, et al. Inborn errors of ketone body utilization[J]. Pediatr Int, 2015, 57: 41–48. DOI:10.1111/ped.12585 |
| [15] | Zhang S, Xie CF. The role of OXCT1 in the pathogenesis of cancer as a rate-limiting enzyme of ketone body metabolism[J]. Life Sci, 2017, 183: 110–115. DOI:10.1016/j.lfs.2017.07.003 |
| [16] | Fukao T, Song XQ, Mitchell GA, et al. Enzymes of ketone body utilization in human tissues: protein and messenger RNA levels of succinyl-coenzyme A (CoA): 3-ketoacid CoA transferase and mitochondrial and cytosolic acetoacetyl-CoA thiolases[J]. Pediatr Res, 1997, 42: 498–502. DOI:10.1203/00006450-199710000-00013 |
| [17] | Shi L, Long JG, Liu JK. Ketone bodies metabolism and Alzheimer's disease[J]. Prog Biochem Biophys (生物化学与生物物理进展), 2015, 42: 323–328. |
| [18] | Cui WM. The Research on Inhibiting Effect of Key Genes of Ketone Metabolism on the Proliferation and Metastasis of Renal Clear Cell Carcinoma (酮体代谢关键基因抑制肾透明细胞癌增殖和转移的研究)[D]. Nanning: Guangxi Medical University, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10598-1019143723.htm |
| [19] | Fukao T, Mitchell GA, Song XQ, et al. Succinyl-CoA: 3-ketoacid CoA transferase (SCOT): cloning of the human SCOT gene, tertiary structural modeling of the human SCOT monomer, and characterization of three pathogenic mutations[J]. Genomics, 2000, 68: 144–151. DOI:10.1006/geno.2000.6282 |
| [20] | Kassovska-Bratinova S, Fukao T, Song XQ, et al. Succinyl CoA: 3-oxoacid CoA transferase (SCOT): human cDNA cloning, human chromosomal mapping to 5pl3, and mutation detection in a SCOT-deficient patient[J]. Am J Hum Genet, 1996, 59: 519–528. |
| [21] | Shafqat N, Kavanagh KL, Sass JO, et al. A structural mapping of mutations causing succinyl-CoA:3-ketoacid CoA transferase (SCOT) deficiency[J]. J Inherit Metab Dis, 2013, 36: 983–987. DOI:10.1007/s10545-013-9589-z |
| [22] | Orii KE, Fukao T, Song XQ, et al. Liver-specific silencing of the human gene encoding succinyl-CoA: 3-ketoacid CoA transferase[J]. Tohoku J Exp Med, 2008, 215: 227–236. DOI:10.1620/tjem.215.227 |
| [23] | Jacinto E, Facchinetti V, Liu D, et al. SIN1/MIP1 maintains rictor-mTOR complex integrity and regulates Akt phosphorylation and substrate specificity[J]. Cell, 2006, 127: 125–137. DOI:10.1016/j.cell.2006.08.033 |
| [24] | Martinez-Outschoorn UE, Lin Z, Whitaker-Menezes D, et al. Ketone bodies and two-compartment tumor metabolism: stromal ketone production fuels mitochondrial biogenesis in epithelial cancer cells[J]. Cell Cycle, 2012, 11: 3956–3963. DOI:10.4161/cc.22136 |
| [25] | Zhang S. OXCT1 Promotes Proliferation and Migration of Non-small Lung Cancer Cell Migration via Activating NF-κB Pathway (OXCT1活化NF-κB通路促进非小细胞肺癌细胞的生长和迁移)[D]. Nanchang: Nanchang University, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10403-1018230852.htm |
| [26] | Pavlides S, Whitaker-Menezes D, Castello-Cros R, et al. The reverse Warburg effect: aerobic glycolysis in cancer associated fibroblasts and the tumor stroma[J]. Cell Cycle, 2009, 8: 3984–4001. DOI:10.4161/cc.8.23.10238 |
| [27] | Ozsvari B, Sotgia F, Simmons K, et al. Mitoketoscins: novel mitochondrial inhibitors for targeting ketone metabolism in cancer stem cells (CSCs)[J]. Oncotarget, 2017, 8: 78340–78350. |
| [28] | Levin VA, Panchabhai SC, Shen L, et al. Different changes in protein and phosphoprotein levels result from serum starvation of high-grade glioma and adenocarcinoma cell lines[J]. J Proteome Res, 2010, 9: 179–191. DOI:10.1021/pr900392b |
| [29] | Zhang CS, Jiang B, Li MQ, et al. The lysosomal v-ATPase-ragulator complex is a common activator for AMPK and mTORC1, acting as a switch between catabolism and anabolism[J]. Cell Metab, 2014, 20: 526–540. DOI:10.1016/j.cmet.2014.06.014 |
| [30] | Kim J, Kundu M, Viollet B, et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1[J]. Nat Cell Biol, 2011, 13: 132–141. DOI:10.1038/ncb2152 |
| [31] | Huang D, Li T, Wang L, et al. Hepatocellular carcinoma redirects to ketolysis for progression under nutrition deprivation stress[J]. Cell Res, 2016, 26: 1112–1130. DOI:10.1038/cr.2016.109 |
| [32] | Zhang J, Cong MH, Gao Y, et al. The sensitivity of the ketogenic metabolic therapy in cancer depends on the expression of ketolytic key enzymes[J]. Electron J Metab Nutr Cancer (肿瘤代谢与营养电子杂志), 2017, 4: 421–429. |
| [33] | Martinez-Outschoorn UE, Prisco M, Ertel A, et al. Ketones and lactate increase cancer cell "stemness, " driving recurrence, metastasis and poor clinical outcome in breast cancer[J]. Cell Cycle, 2011, 10: 1271–1286. DOI:10.4161/cc.10.8.15330 |
| [34] | Locke JA, Wasan KM, Nelson CC, et al. Androgen-mediated cholesterol metabolism in LNCaP and PC-3 cell lines is regulated through two different isoforms of acyl-coenzyme A: cholesterol acyltransferase (ACAT)[J]. Prostate, 2008, 68: 20–33. DOI:10.1002/pros.20674 |
| [35] | Saraon P, Cretu D, Musrap N, et al. Quantitative proteomics reveals that enzymes of the ketogenic pathway are associated with prostate cancer progression[J]. Mol Cell Proteomics, 2013, 12: 1589–1601. DOI:10.1074/mcp.M112.023887 |
| [36] | Guzmán M, Blázquez C. Ketone body synthesis in the brain: possible neuroprotective effects[J]. Prostaglandins Leukot Essent Fatty Acids, 2004, 70: 287–292. DOI:10.1016/j.plefa.2003.05.001 |
| [37] | Yang H, Shan W, Zhu F, et al. Ketone bodies in neurological diseases: focus on neuroprotection and underlying mechanisms[J]. Front Neurol, 2019, 10: 585. DOI:10.3389/fneur.2019.00585 |
| [38] | Wolfgang MK, Stefan W, Elke H, et al. Differential utilization of ketone bodies by neurons and glioma cell lines: a rationale for ketogenic diet as experimental glioma therapy[J]. BMC Cancer, 2011, 11: 315. DOI:10.1186/1471-2407-11-315 |
| [39] | Tisdale MJ, Brennan RA. Loss of acetoacetate coenzyme A transferase activity in tumours of peripheral tissues[J]. Br J Cancer, 1983, 47: 293–297. DOI:10.1038/bjc.1983.38 |
| [40] | Fredericks M, Ramsey RB. 3-Oxo acid coenzyme A transferase activity in brain and tumors of the nervous system[J]. J Neurochem, 1978, 31: 1529–1531. DOI:10.1111/j.1471-4159.1978.tb06581.x |
| [41] | Wheless JW. History of the ketogenic diet[J]. Epilepsia, 2010, 49: 3–5. |
| [42] | Kessler SK, Neal EG, Camfield CS, et al. Dietary therapies for epilepsy: future research[J]. Epilepsy Behav, 2011, 22: 17–22. DOI:10.1016/j.yebeh.2011.02.018 |
| [43] | Stafstrom CE, Rho JM. The ketogenic diet as a treatment paradigm for diverse neurological disorders[J]. Front Pharmacol, 2012, 3: 59. |
| [44] | Chang HT, Olson LK, Schwartz KA. Ketolytic and glycolytic enzymatic expression profiles in malignant gliomas: implication for ketogenic diet therapy[J]. Nutri Metab, 2013, 10: 47. DOI:10.1186/1743-7075-10-47 |
| [45] | Lu YX, Shi HP. Ketogenic diet and cancer treatment[J]. Electron J Metab Nutr Cancer (肿瘤代谢与营养电子杂志), 2015, 2: 61–66. |
 2019, Vol. 54
2019, Vol. 54


