脂肪酸β-氧化是脂肪酸分解的核心过程, 脂肪酸经活化生成脂酰CoA, 活化的脂酰CoA必须进入线粒体才能被氧化。Fritz、Yue[1]、McGarry和Foster等[2, 3]的开创性研究阐明了长链脂肪酸(long-chain fatty acids, LCFAs)进入线粒体基质的机制。肉毒碱棕榈酰转移酶1 (carnitine palmitoyltransferase 1, CPT1)存在于线粒体外膜上, 催化脂酰CoA与肉碱合成脂酰肉碱, 后者在位于线粒体内膜上的多种酶作用下转变为脂酰CoA并释放出肉碱。脂酰CoA进入线粒体是脂肪酸β-氧化的限速步骤, CPT1是脂肪酸β-氧化的限速酶。
近几年来, 随着肿瘤学、免疫学和代谢组学等相关学科和技术的发展与成熟, 很多研究者认为肿瘤是一种代谢性疾病, 与机体多种代谢通路有着密切关系。CPT1对肿瘤细胞和免疫细胞的代谢调控及其对肿瘤微环境的影响均能对肿瘤的发生发展产生影响, 为肿瘤免疫治疗提供了新的思路。随着对CPT1的认识和研究的深入, 其在肿瘤发生发展中的作用将得到进一步证实。
1 CPT1生物学功能脂代谢与生命活动和疾病的关系十分密切, 有关研究再次成为生命科学和医药学领域的热点。其中一个重要的环节是甘油三酯氧化分解产生大量ATP供机体需要。储存的脂肪从脂肪动员开始, 水解释放出游离的脂肪酸, 随后经过活化、转移至线粒体、β-氧化生成乙酰CoA、进入三羧酸循环彻底氧化产生大量ATP供能。其中β-氧化是脂肪酸分解的核心过程, CPT1是脂肪酸β-氧化的限速酶。短链和中链脂肪酸可自由进入线粒体, 而长链脂肪酸需要CPT1介导的转运过程。该家族目前发现有3种亚型, CPT1A、CPT1B和CPT1C[4-6], 其具有同源性。人类CPT1A和CPT1B具有63%的序列同源性, 活性位点的同源性明显更高(82%)[7]。第3个同工酶CPT1C是在2002年通过在表达序列标签(expressed sequence tag, EST)数据库搜索与人源CPT1A核苷酸序列具有同源性序列时发现的, 据报道编码了一个由798个氨基酸残基组成的蛋白质[8]。CPT1C蛋白编码区的主核苷酸序列与CPT1A和CPT1B的同源性分别为86%或85%[9]。A亚型分布在具有较高的脂肪酸合成速率的组织, 如肝、肾、结肠、十二指肠和小肠等。B亚型分布在具有较高脂肪酸氧化速率的组织, 如骨骼肌、心脏和睾丸等[10]。C亚型在正常组织只分布于脑中, 并且实验证实其仅存在于神经元中[8]。目前对CPT1A介导的脂肪酸β-氧化与免疫系统的关系研究吸引大家的关注, CPT1C是最后一个被发现的亚型, 在多种肿瘤组织中异常表达, 其在肿瘤细胞抵抗代谢压力中可能发挥着作用[11]。
2 CPT1C与肿瘤的关系肿瘤细胞的代谢需求与其他细胞相比明显增高, 在其生长过程中肿瘤细胞的能量代谢逐步适应了生长和增殖的需要。肿瘤细胞消耗的葡萄糖远远多于正常细胞, 更重要地是, 即使在有氧时, 肿瘤细胞中葡萄糖也不彻底氧化而是被分解生成乳酸, 葡萄糖摄取和糖酵解速率的增加补偿氧化磷酸化缺陷导致的ATP产生减少(Warburg效应)[12]。这种代谢方式使肿瘤细胞获得生存优势, 一是提供大量碳源, 用以合成蛋白质、脂类、核酸, 满足肿瘤快速生长的需要; 二是关闭有氧氧化通路, 避免产生自由基, 从而逃避细胞凋亡[9]。此外, 谷氨酰胺代谢的改变有利于支持核苷、氨基酸等生物合成途径, 也有利于氧化还原反应的平衡[13]。人们也发现癌细胞的脂质代谢发生改变, 一些细胞癌变后发生脂肪生成的表型, 增加脂肪酸的合成。脂肪酸是生产磷酸甘油所必需的, 它与其他复杂的脂质和胆固醇一起, 不仅可用于构建细胞膜, 还可参与信号通路的转导[14-17]。另一些癌细胞发生脂肪分解的表型, 通过脂肪酸氧化增加脂肪酸分解代谢, 作为其生长和增殖的主要能量来源。实际上, 这种类型的肿瘤, 包括前列腺肿瘤、白血病和大B细胞淋巴瘤等, 对脂肪酸氧化的依赖性增强, 成为它们增殖和生存的主要能量来源[18-20]。
CPT1C在癌细胞中的具体作用机制尚不十分清楚。由于该蛋白位于正常神经元细胞的内质网中, 且其肉碱酰基转移酶活性极低, 因此不认为其参与线粒体脂肪酸氧化的调控[21]。CPT1C首先被发现在乳腺癌和肺癌细胞中高表达[22], 随后一些研究发现在脑肿瘤, 如神经母细胞瘤和软组织肉瘤中过表达[23]。而在一些营养供应充足的肿瘤中, 如恶性血液肿瘤, 不会过表达CPT1C[23]。有研究表明, MCF-7乳腺癌细胞过表达CPT1C增加了脂肪酸氧化、ATP的产生和对葡萄糖缺乏或缺氧的抵抗力[22]。相反, CPT1特异性shRNA敲除CPT1C的MDA-MB-468细胞接种在裸鼠, 经过10周的观察, 与对照组相比, 肿瘤生长明显减缓, 提示CPT1C对实体瘤的生长具有显著促进作用[24]。这些研究结果表明, CPT1C可能是脂肪酸稳态的调节因子, 并可能参与在代谢压力下肿瘤细胞的生物能量代谢调节。
CPT1C是在ATP需求增加和代谢压力增加, 如葡萄糖缺乏和缺氧的条件下诱导产生的。CPT1C的表达可能是由腺苷酸激活蛋白激酶(AMPK)激活直接或间接影响所诱导的。在代谢压力下, ATP/AMP比值下降, 激活了AMPK。引起的直接作用有两条:一是AMPK可以抑制CPT1C mRNA开放阅读框使其表达增加[25]; 二是通过转录因子p53在体内外直接激活CPT1C的转录[24], p53通路是细胞增殖和存活的中心调控因子, AMPK被认为可以将葡萄糖的获取与p53通路联系起来[25]。AMPK激活后间接影响, 使转录增强因子CREB (cAMP response element-binding protein, CREB)磷酸化, 增强它的活性, 促进了PGC-1β和下游ERRα蛋白的表达, 从而增强了CPT1C、PPARα和其他一些与线粒体生物合成和FAO相关基因[26] (图 1)。
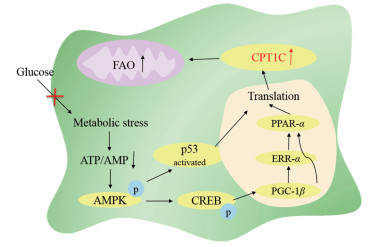
|
Figure 1 Regulation of carnitine palmitoyltransferase 1C (CPT1C) expression in cancer cells. Glucose deprivation induces metabolic stress and activation of AMPK. CPT1C expression may be increased via the AMPK/CREB/PGC-1β pathway and in a p53 dependent manner, which contributes to the increase of fatty acid oxidation. CPT1C: Palmitoyltransferase 1C; AMPK: Adenosine 5'-monophosphate (AMP)-activated protein kinase; CREB: cAMP response element-binding protein; PGC-1β: Peroxisome proliferator-activated receptor gamma, coactivator 1 beta; ERRα: Estrogen receptor-related receptor alpha; PPARα: Peroxisome proliferator-activated receptor alpha |
近年来, 随着肿瘤免疫治疗为攻克癌症带来了新的希望, 有研究者认为调控免疫系统的代谢能使其更好地发挥抗肿瘤作用[27]。现代技术的发展和广泛应用, 包括代谢组学和实时细胞外通量分析等技术, 有助于在实验确定的条件下表征和量化影响免疫细胞的代谢变化。
有关CPT1对免疫系统的影响主要集中在CPT1A对T淋巴细胞的调控作用。包括效应T细胞(effector T cells, Teff)、调节T细胞(regulatory T cells, Treg)和记忆T细胞(memory T cells, Tmem)在内的T细胞亚群不仅具有明确的免疫特性, 而且具有支持其生物合成和能量需求的特定代谢程序, 影响其分化和功能[28]。初始CD8+ T细胞(Tn)对能量的需求相对较低, 而效应T细胞(Teff)对能量和生物合成前体的需求增加, 以支持增殖和效应细胞的功能。此外, 记忆CD8+ T (Tmem)细胞需要生存很长一段时间, 同时维持体内平衡增殖和对继发性抗原刺激快速反应的能力。已有研究表明, 在Teff向Tmem转化过程中, CD8+ T细胞可特异性增加CPT1A的表达, 使其在初次免疫应答后采用氧化代谢方式, 且该表达与T细胞寿命和再次接受刺激后的代谢适应有关[29, 30]。研究者通过构建CPT1A和乙酰辅酶A羧化酶2 (acetyl-CoA carboxylase 2, ACC2)基因敲除鼠, 以及对长链和中链脂肪酸氧化缺陷的患者进行分析, 发现在Teff、Tmem或Treg细胞形成过程中, ACC2/CPT1A轴在很大程度上是不必要的, 且CPT1不可逆抑制剂乙莫克舍(etomoxir)对T细胞分化和功能的影响与CPT1A表达无关。在高浓度下, etomoxir对细胞代谢有脱靶作用[28]。
还有研究证明, 长链脂肪酸氧化在白细胞介素-4 (interleukin-4, IL-4)介导的巨噬细胞极化中起重要作用。然而, 这些结论中许多都是基于CPT1的抑制, 其中采用的高浓度的etomoxir远远超过抑制酶活性所需的浓度(EC90 < 3 mmol·L-1)。Divakaruni等[31]采用遗传学和药理学模型来证明长链脂肪酸氧化很大程度上对于IL-4驱动的极化是不必要的。出乎意料的是, 在没有CPT1或CPT2表达的情况下, 高浓度的etomoxir保留了破坏巨噬细胞极化的能力。极化阻滞可追溯到细胞内游离CoA的消耗, 这可能是由于前药etomoxir转化为活性的etomoxiryl CoA所致。这些研究有助于解释过量etomoxir对免疫细胞的影响, 并揭示了巨噬细胞极化中CoA代谢的作用。
此外, 有研究发现脂肪酸氧化过程在淋巴管生成中也起着调控作用, Wong等[32]发现在转基因小鼠模型中, 淋巴管内皮细胞特异性损失CPT1A会损害淋巴发育。淋巴管内皮细胞利用脂肪酸β-氧化为其增殖和分化期间淋巴细胞表面标记的表观遗传修饰提供能量。值得注意的是, 阻断CPT1可抑制损伤诱导的淋巴管生成, 这可能提示在某些疾病中, 通过降低脂肪酸氧化来抑制病理淋巴管生成可以作为一种潜在的治疗手段, 如在癌症中, 淋巴管过度生长促进肿瘤细胞转移, 抑制CPT1可以阻断其侵袭转移[33]。
4 CPT1抑制剂在大鼠肝脏和骨骼肌线粒体中有多种有关肉碱棕榈酰转移酶抑制剂的研究。其中丙二酸单酰辅酶A, 是脂肪酸合成的第一个限速步骤的产物, 是CPT1A和CPT1B的生理抑制剂, 它与CPT1的结合对脂肪酸氧化起着很强的通量控制作用[9]。CPT1A的N端调控域内的关键残基可作为对该代谢物敏感性的阳性或阴性决定因素[34-37], 该酶对malonyl-CoA敏感性的变化也与同质寡聚[38, 39]或与其他蛋白的异质结合有关[40], 其依赖于CPT1A所在膜的组成和弯曲程度[41, 42]。
药物化学家发现CPT1抑制剂仅有少数的结构类型, 多数可分为两类:环氧乙烷羧酸和肉碱衍生物。从作用机制上看, CPT抑制剂多在活性位点结合, 少数报道在丙二酸单酰辅酶A变构位点结合。环氧乙烷羧酸是一种不可逆抑制剂, 需要在生理条件下转化为CoA衍生物发挥作用[7]。肉碱衍生物和其他非共价结合抑制剂具有竞争性, 草酸衍生物是唯一报道的非竞争性CPT抑制剂[7]。
4.1 环氧乙烷羧酸及其酯类环氧羧酸是最早被广泛研究的肉碱依赖的脂肪酸氧化抑制剂之一, 代表了一个典型的结构类别, 是最有效的传统CPT1抑制剂。在1980~2000年间, 研究者为了探讨此类化合物的化学、生物学和生理学特性以及对CPT1的干预和作用原理, 在不同的环境中仅仅用略微不同的化合物多次进行同样的实验。Wolf和Eistetter等[43, 44]发现了此类化合物中较突出的一个脂肪酸跨线粒体膜转运抑制剂POCA。Bartlett等[45]证明其通过SCoA衍生物的中间体抑制CPT1A和CPT1B的活性。
经过化学家的结构修饰和改造, 形成了基于环氧乙烷羧酸结构单元最为著名的化合物——etomoxir[46]。这种化合物已经成为研究线粒体β-氧化使用最广泛的工具化合物, 并且作为多种适应症的潜在治疗药物引起人们的关注。其最早被开发的是一种抗生酮作用的降糖药, 用于治疗非胰岛素依赖性糖尿病。在结构上, etomoxir的(R)-对映体在体内外都比(S)-对映体具有更强的活性[42]。Etomoxir与CPT1催化部位不可逆结合, 抑制CPT1活性, 上调脂肪酸氧化酶活性, 增加葡萄糖的利用率, 促进氧化物酶体增殖[47]。经过etomoxir处理的小鼠在神经中枢系统中减少免疫细胞的浸润, 仅有少量巨噬细胞、活化的小神经胶质或T细胞存在, 同时减少炎症反应和脱髓鞘反应[48]。Etomoxir及其衍生物是PPARα激动剂, 有研究讨论了PPARα相关基因的诱导是对etomoxir的直接作用还是继发于CPT1的抑制, 普遍认为前者更可能[49, 50]。Etomoxir作为最常用的CPT1不可逆抑制剂被广泛应用于多种机制研究。
随后, 一些etomoxir的衍生物及经过结构修饰的化合物陆续被发现, 包括脱氯类似物、二硝基衍生物(DNP-Et)[51]、氟化衍生物[52]等。经过表观修饰的某些化合物显示出对CPT1A和CPT1B的选择性。
所有的环氧羧酸及其酯类不仅具有相似的化学类型, 而且具有非常相似的作用模式。这类药物都是前药, 需要在体内转化为活性形式发挥作用[7]。这种作用方式和抑制的不可逆性, 以及在不同种属间氧化速率和敏感性的差异使得对这类药物的评估复杂化。
4.2 肉碱衍生物及其类似物除了传统的酶底物研究, 很多注意力也投向了反应物肉碱, 以及类似反应过渡态产物的肉碱类似物。这类化合物与底物竞争性结合在酶的结合位点发挥作用, 属于可逆性抑制剂。(S)-Carnitine被报道在CPT酶水平上抑制脂肪酸氧化, 在动物实验中发现其有抗生酮作用[53]。McGarry课题组[54]证明(S)-acylcarnitines并不能影响CPT酶系统, 而是一种CACT抑制剂。基于同样的原理, 随后报道了天然来源的(R)-肉碱异构体硫酸盐衍生物的选择性是通过选择性靶向肝脏, 而不是内在的亚型选择性来实现的。
氨基肉碱及其衍生物是随后发现的一类典型的竞争性抑制剂。(R)-Aminocarnitine是一个体外分离线粒体强有力的抑制剂(IC50=3.2 μmol·L-1)[55]。氨基肉碱的长链酰基衍生物, 特别是棕榈酰氨基碳酸盐和肉豆蔻酰氨基碳酸盐, 是比氨基肉碱更有效的抑制剂[56, 57]。在前人研究基础上, 用脲基或磺酰胺取代酰胺键, Sigma Tau公司的科学家[58]描述了一系列化合物, 证明这些化合物比棕榈酰氨基肉碱对胃和肠中的条件更稳定。在相当长的历史上, 尽管氨基肉碱类被报道为CPT1抑制剂, 但实际上它们在体内和体外都是更强的CPT2抑制剂。经过不断的结构修饰和改造, ST2425引起人们的注意, 在抗生酮和降糖作用中有很多的效果[59]。在此基础上又进行结构修饰, 又出现上百种化合物, 将其中有较好IC50的药物在人类肿瘤细胞系中评估其增殖能力。
5 CPT1在肿瘤治疗中的潜在作用尽管多种从基因和药理作用角度设计的抗癌药物可以降低癌细胞的生存能力, 最近基于抑制脂肪酸氧化的新策略作为一种新的潜在的癌症治疗手段应运而生, 一些针对CPT1A和CPT1B抑制的药物开发项目已经开展[7], 这些抑制剂可降低肿瘤细胞的生存能力[19, 60]。然而, 考虑到组织的广泛性, 其主要缺点是抑制非肿瘤细胞的不良反应。相比之下, 抑制颅外肿瘤的CPT1C表达增加, 与其他CPT1亚型相比可能具有显著优势, 因为神经元细胞受到血脑屏障的保护。但迄今为止, 尚没有找到一种对不同的CPT1亚型表现出明显选择性的小分子CPT1抑制剂。已有明确的证据表明, CPT1C可能参与肿瘤细胞脂肪酸的稳态通路, 这有可能带来新的治疗机会。对这些机制的认识和理解, 将为今后利用CPT1C沉默来治疗颅外肿瘤的策略提供指导。
6 总结与展望脂肪酸氧化是最重要的细胞能量来源之一, 对这一过程的调控可能具有多种治疗应用价值。肿瘤的发生是由多种因素相互作用产生的, 治疗也应该从多种方面考虑。阐明肿瘤代谢和免疫代谢之间的关系, 将为肿瘤的治疗提供新的思路。CPT1作为机体代谢通路中关键的一个环节, 在调控肿瘤代谢方面也发挥着重要的作用, 特别是CPT1C在近些年已成为人们关注的热点, 其正常功能和在肿瘤发生发展中的作用机制有待探索, 开发其选择性抑制剂是具有较大潜力的抗肿瘤靶向治疗药物。CPT1C是CPT1蛋白质家族的最后一个被发现和克隆的成员, 也是该蛋白质家族中生物学功能最难阐明的一个:尽管其在一级结构上与CPT1A和CPT1B相似, 但它没有显示出良好的催化活性。由该蛋白质在细胞内质网上的定位, 可以预期它能够发挥广泛的作用与影响, 并可以结合不同的蛋白质。另外, 免疫细胞的代谢特点, 特别是记忆细胞依然没有完全阐明, 其中CPT1是否能通过调节免疫细胞起到杀伤肿瘤的作用还有待进一步证实。CPT1在免疫代谢与肿瘤代谢调控之间是否存在着联系尚有待深入探索。
由于该酶在体内分布广泛, 并且与多种生命活动存在着紧密联系, 针对其开发设计的抑制剂在产生药效的同时应尽可能避免不良反应。同时, 其与其他抗肿瘤药物联用发挥的作用也有待进一步研究, 为治疗提供新的策略。
| [1] | Fritz IB, Yue KT. Long-chain carnitine acyltransferase and the role of acylcarnitine derivatives in the catalytic increase of fatty acid oxidation induced by carnitine[J]. J Lipid Res, 1963, 4: 279–288. |
| [2] | McGarry J, Foster D. Regulation of hepatic fatty acid oxidation and ketone body production[J]. Annu Rev Biochem, 1980, 49: 395–420. DOI:10.1146/annurev.bi.49.070180.002143 |
| [3] | McGarry JD, Woeltje KF, Kuwajima M, et al. Regulation of ketogenesis and the renaissance of carnitine palmitoyltransferase[J]. Diabetes Metab Rev, 1989, 5: 271–284. DOI:10.1002/dmr.5610050305 |
| [4] | Jogl G, Tong L. Crystal structure of carnitine acetyltransferase and implications for the catalytic mechanism and fatty acid transport[J]. Cell, 2003, 112: 113–122. DOI:10.1016/S0092-8674(02)01228-X |
| [5] | Hada T, Yamamoto T, Yamamoto A, et al. Comparison of the catalytic activities of three isozymes of carnitine palmitoyltransferase 1 expressed in COS7 cells[J]. Applied Biochem Biotechnol, 2014, 172: 1486–1496. DOI:10.1007/s12010-013-0619-y |
| [6] | van der Leij FR, Huijkman NC, Boomsma C, et al. Genomics of the human carnitine acyltransferase genes[J]. Mol Genet Metab, 2000, 71: 139–153. DOI:10.1006/mgme.2000.3055 |
| [7] | Ceccarelli SM, Chomienne O, Gubler M, et al. Carnitine palmitoyltransferase (CPT) modulators: a medicinal chemistry perspective on 35 years of research[J]. J Med Chem, 2011, 54: 3109–3152. DOI:10.1021/jm100809g |
| [8] | Price NT, van der Leij FR, Jackson VN, et al. A novel brain-expressed protein related to carnitine palmitoyltransferase Ⅰ[J]. Genomics, 2002, 80: 433–442. DOI:10.1006/geno.2002.6845 |
| [9] | Casals N, Zammit V, Herrero L, et al. Carnitine palmitoyltransferase 1C: from cognition to cancer[J]. Prog Lipid Res, 2016, 61: 134–148. DOI:10.1016/j.plipres.2015.11.004 |
| [10] | McGarry JD, Brown NF. The mitochondrial carnitine palmitoyltransferase system—from concept to molecular analysis[J]. Eur J Biochem, 1997, 244: 1–14. DOI:10.1111/j.1432-1033.1997.00001.x |
| [11] | Wang Y, Chen Y, Guan L, et al. Carnitine palmitoyltransferase 1C regulates cancer cell senescence through mitochondria-associated metabolic reprograming[J]. Cell Death Diff, 2018, 25: 735–748. DOI:10.1038/s41418-017-0013-3 |
| [12] | Warburg O. On the origin of cancer cells[J]. Science, 1956, 123: 309–314. DOI:10.1126/science.123.3191.309 |
| [13] | Son J, Lyssiotis CA, Ying H, et al. Glutamine supports pancreatic cancer growth through a KRAS-regulated metabolic pathway[J]. Nature, 2013, 496: 101–105. DOI:10.1038/nature12040 |
| [14] | Swinnen JV, Brusselmans K, Verhoeven G. Increased lipogenesis in cancer cells: new players, novel targets[J]. Curr Opin Clin Nutr Metab Care, 2006, 9: 358–365. DOI:10.1097/01.mco.0000232894.28674.30 |
| [15] | Santos CR, Schulze A. Lipid metabolism in cancer[J]. FEBS J, 2012, 279: 2610–2623. DOI:10.1111/j.1742-4658.2012.08644.x |
| [16] | Currie E, Schulze A, Zechner R, et al. Cellular fatty acid metabolism and cancer[J]. Cell Metab, 2013, 18: 153–161. DOI:10.1016/j.cmet.2013.05.017 |
| [17] | Louie SM, Roberts LS, Mulvihill MM, et al. Cancer cells incorporate and remodel exogenous palmitate into structural and oncogenic signaling lipids[J]. Biochim Biophys Acta, 2013, 1831: 1566–1572. DOI:10.1016/j.bbalip.2013.07.008 |
| [18] | Zha S, Ferdinandusse S, Hicks JL, et al. Peroxisomal branched chain fatty acid β-oxidation pathway is upregulated in prostate cancer[J]. Prostate, 2005, 63: 316–323. DOI:10.1002/pros.20177 |
| [19] | Samudio I, Harmancey R, Fiegl M, et al. Pharmacologic inhibition of fatty acid oxidation sensitizes human leukemia cells to apoptosis induction[J]. J Clin Invest, 2010, 120: 142–156. DOI:10.1172/JCI38942 |
| [20] | Caro P, Kishan AU, Norberg E, et al. Metabolic signatures uncover distinct targets in molecular subsets of diffuse large B cell lymphoma[J]. Cancer Cell, 2012, 22: 547–560. DOI:10.1016/j.ccr.2012.08.014 |
| [21] | Sierra AY, Gratacós E, Carrasco P, et al. CPT1c is localized in endoplasmic reticulum of neurons and has carnitine palmitoyltransferase activity[J]. J Biol Chem, 2008, 283: 6878–6885. DOI:10.1074/jbc.M707965200 |
| [22] | Zaugg K, Yao Y, Reilly PT, et al. Carnitine palmitoyltransferase 1C promotes cell survival and tumor growth under conditions of metabolic stress[J]. Genes Dev, 2011, 25: 1041–1051. DOI:10.1101/gad.1987211 |
| [23] | Reilly PT, Mak TW. Molecular pathways: tumor cells Co-opt the brain-specific metabolism gene CPT1C to promote survival[J]. Clin Cancer Res, 2012, 18: 5850–5855. DOI:10.1158/1078-0432.CCR-11-3281 |
| [24] | Sanchez-Macedo N, Feng J, Faubert B, et al. Depletion of the novel p53-target gene carnitine palmitoyltransferase 1C delays tumor growth in the neurofibromatosis type Ⅰ tumor model[J]. Cell Death Diff, 2013, 20: 659–668. DOI:10.1038/cdd.2012.168 |
| [25] | Jones RG, Plas DR, Kubek S, et al. AMP-activated protein kinase induces a p53-dependent metabolic checkpoint[J]. Mol Cell, 2005, 18: 283–293. DOI:10.1016/j.molcel.2005.03.027 |
| [26] | Wu Y, Sarkissyan M, Mcghee E, et al. Combined inhibition of glycolysis and AMPK induces synergistic breast cancer cell killing[J]. Breast Cancer Res Treat, 2015, 151: 529–539. DOI:10.1007/s10549-015-3386-3 |
| [27] | Patel CH, Leone RD, Horton MR, et al. Targeting metabolism to regulate immune responses in autoimmunity and cancer[J]. Nat Rev Drug Discov, 2019, 18: 669–688. DOI:10.1038/s41573-019-0032-5 |
| [28] | Raud B, Roy DG, Divakaruni AS, et al. Etomoxir actions on regulatory and memory T cells are independent of CPT1A-mediated fatty acid oxidation[J]. Cell Metab, 2018, 28: 504–515.e507. DOI:10.1016/j.cmet.2018.06.002 |
| [29] | Pollizzi KN, Patel CH, Sun IH, et al. mTORC1 and mTORC2 selectively regulate CD8+ T cell differentiation[J]. J Clin Invest, 2015, 125: 2090–2108. DOI:10.1172/JCI77746 |
| [30] | van der Windt GJ, Everts B, Chang CH, et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development[J]. Immunity, 2012, 36: 68–78. DOI:10.1016/j.immuni.2011.12.007 |
| [31] | Divakaruni AS, Hsieh WY, Minarrieta L, et al. Etomoxir inhibits macrophage polarization by disrupting CoA homeostasis[J]. Cell Metab, 2018, 28: 490–503.e497. DOI:10.1016/j.cmet.2018.06.001 |
| [32] | Wong BW, Wang X, Zecchin A, et al. The role of fatty acid β-oxidation in lymphangiogenesis[J]. Nature, 2017, 542: 49–54. DOI:10.1038/nature21028 |
| [33] | Stacker SA, Williams SP, Karnezis T, et al. Lymphangiogenesis and lymphatic vessel remodelling in cancer[J]. Nat Rev Cancer, 2014, 14: 159–172. DOI:10.1038/nrc3677 |
| [34] | Cohen I, Kohl C, McGarry JD, et al. The N-terminal domain of rat liver carnitine palmitoyltransferase 1 mediates import into the outer mitochondrial membrane and is essential for activity and malonyl-CoA sensitivity[J]. J Biol Chem, 1998, 273: 29896–29904. DOI:10.1074/jbc.273.45.29896 |
| [35] | Jackson VN, Zammit VA, Price NT. Identification of positive and negative determinants of malonyl-CoA sensitivity and carnitine affinity within the amino termini of rat liver-and muscle-type carnitine palmitoyltransferase Ⅰ[J]. J Biol Chem, 2000, 275: 38410–38416. DOI:10.1074/jbc.M007722200 |
| [36] | Shi J, Zhu H, Arvidson DN, et al. A single amino acid change (substitution of glutamate 3 with alanine) in the N-terminal region of rat liver carnitine palmitoyltransferase Ⅰ abolishes malonyl-CoA inhibition and high affinity binding[J]. J Biol Chem, 1999, 274: 9421–9426. DOI:10.1074/jbc.274.14.9421 |
| [37] | Audrey F, Borthwick K, Esnous C, et al. Demonstration of N-and C-terminal domain intramolecular interactions in rat liver carnitine palmitoyltransferase 1 that determine its degree of malonyl-CoA sensitivity[J]. Biochem J, 2005, 387: 67–76. DOI:10.1042/BJ20041533 |
| [38] | Faye A, Esnous C, Price NT, et al. Rat liver carnitine palmitoyltransferase 1 forms an oligomeric complex within the outer mitochondrial membrane[J]. J Biol Chem, 2007, 282: 26908–26916. DOI:10.1074/jbc.M705418200 |
| [39] | Jenei ZA, Warren GZ, Hasan M, et al. Packing of transmembrane domain 2 of carnitine palmitoyltransferase-1A affects oligomerization and malonyl-CoA sensitivity of the mitochondrial outer membrane protein[J]. FASEB J, 2011, 25: 4522–4530. DOI:10.1096/fj.11-192005 |
| [40] | Brdiczka D. Contact sites between mitochondrial envelope membranes. Structure and function in energy-and protein-transfer[J]. Biochim Biophys Acta, 1991, 1071: 291–312. DOI:10.1016/0304-4157(91)90018-R |
| [41] | Rao JN, Warren GZ, Estolt-Povedano S, et al. An environment-dependent structural switch underlies the regulation of carnitine palmitoyltransferase 1A[J]. J Biol Chem, 2011, 286: 42545–42554. DOI:10.1074/jbc.M111.306951 |
| [42] | Zammit VA. Carnitine palmitoyltransferase 1: central to cell function[J]. IUBMB Life, 2008, 60: 347–354. DOI:10.1002/iub.78 |
| [43] | Wolf H, Eistetter K, Ludwig G. Phenylalkyloxirane carboxylic acids, a new class of hypoglycaemic substances: hypoglycaemic and hypoketonaemic effects of sodium 2-[5-(4-chlorophenyl)-pentyl]-oxirane-2-carboxylate (B 807-27) in fasted animals[J]. Diabetologia, 1982, 22: 456–463. DOI:10.1007/BF00282590 |
| [44] | Eistetter K, Wolf HP. Synthesis and hypoglycemic activity of phenylalkyloxiranecarboxylic acid derivatives[J]. J Med Chem, 1982, 25: 109–113. DOI:10.1021/jm00344a003 |
| [45] | Bartlett K, Sherratt HSA, Turnbull DM. Inhibition of hepatic and skeletal muscle carnitine palmitoyltransferase Ⅰ by 2[5(4-chlorophenyl)pentyl]-oxirane-2-carbonyl-CoA[C]//Biochemical Society Transcations. Portland Press Limited, 1984, 12: 688-689. |
| [46] | Selby PL, Sherratt HSA. Substituted 2-oxiranecarboxylic acids: a new group of candidate hypoglycaemic drugs[J]. Trends Pharmacol Sci, 1989, 10: 495–500. DOI:10.1016/0165-6147(89)90049-7 |
| [47] | Rupp H, Zarain-Herzberg A, Maisch B. The use of partial fatty acid oxidation inhibitors for metabolic therapy of angina pectoris and heart failure[J]. Herz, 2002, 27: 621–636. DOI:10.1007/s00059-002-2428-x |
| [48] | Shriver LP, Manchester M. Inhibition of fatty acid metabolism ameliorates disease activity in an animal model of multiple sclerosis[J]. Sci Rep, 2011, 1: 79. DOI:10.1038/srep00079 |
| [49] | Rupp H, Zarain-Herzberg A, Maisch B. Drug development based on functional genomics of overloaded cardiomyocytes: CPT 1 vs PPARα effects of etomoxir[M]// Dhalla NS, Chockalingam A, Berkowitz HI, et al. Frontiers in Cardiovascular Health, 2003, 9: 177-194. |
| [50] | Diéguez C, Frühbeck G, López M. Hypothalamic lipids and the regulation of energy homeostasis[J]. Obes Facts, 2009, 2: 126–135. |
| [51] | Declercq P, Falck J, Kuwajima M, et al. Characterization of the mitochondrial carnitine palmitoyltransferase enzyme system. Ⅰ. Use of inhibitors[J]. J Biol Chem, 1987, 262: 9812–9821. |
| [52] | Weis BC, Cowan AT, Brown N, et al. Use of a selective inhibitor of liver carnitine palmitoyltransferase Ⅰ (CPT Ⅰ) allows quantification of its contribution to total CPT Ⅰ activity in rat heart. Evidence that the dominant cardiac CPT Ⅰ isoform is identical to the skeletal muscle enzyme[J]. J Biol Chem, 1994, 269: 26443–26448. |
| [53] | McGarry JD, Foster DW. Acute reversal of experimental diabetic ketoacidosis in the rat with (+)-decanoylcarnitine[J]. J Clin Invest, 1973, 52: 877–884. DOI:10.1172/JCI107252 |
| [54] | Baillet L, Mullur RS, Esser V, et al. Elucidation of the mechanism by which (+)-acylcarnitines inhibit mitochondrial fatty acid transport[J]. J Biol Chem, 2000, 275: 36766–36768. DOI:10.1074/jbc.M008265200 |
| [55] | Kanamaru T, Shinagawa S, Asai M, et al. Emeriamine, an antidiabetic β-aminobetaine derived from a novel fungal metabolite[J]. Life Sci, 1985, 37: 217–223. DOI:10.1016/0024-3205(85)90647-2 |
| [56] | Jenkins DL, Griffith OW. Antiketogenic and hypoglycemic effects of aminocarnitine and acylaminocarnitines[J]. Proc Natl Acad Sci U S A, 1986, 83: 290–294. DOI:10.1073/pnas.83.2.290 |
| [57] | Shinagawa S, Kanamaru T, Harada S, et al. Chemistry and inhibitory activity of long chain fatty acid oxidation of emeriamine and its analogues[J]. J Med Chem, 1987, 30: 1458–1463. DOI:10.1021/jm00391a030 |
| [58] | Giannessi F, Chiodi P, Marzi M, et al. Reversible carnitine palmitoyltransferase inhibitors with broad chemical diversity as potential antidiabetic agents[J]. J Med Chem, 2001, 44: 2383–2386. DOI:10.1021/jm010889+ |
| [59] | Tassoni E, Conti R, Gallo G, et al. Aminocarnitine ureidic derivatives as inhibitors of carnitine palmitoyltransferase Ⅰ[J]. ChemMedChem, 2010, 5: 666–669. DOI:10.1002/cmdc.200900535 |
| [60] | Pike LS, Smift AL, Croteau NJ, et al. Inhibition of fatty acid oxidation by etomoxir impairs NADPH production and increases reactive oxygen species resulting in ATP depletion and cell death in human glioblastoma cells[J]. Biochim Biophys Acta, 2011, 1807: 726–734. DOI:10.1016/j.bbabio.2010.10.022 |
 2019, Vol. 54
2019, Vol. 54


