2. 内蒙古大学化学化工学院, 内蒙古 呼和浩特 010021
2. College of Chemistry and Chemical Engineering of Inner Mongolia University, Hohhot 010021, China
肿瘤的发生发展与机体免疫机制失调密切相关。一方面, 肿瘤细胞自身免疫原性较低, 可以逃避巨噬细胞(macrophage)和树突状细胞(dendritic cells, DCs)等抗原提呈细胞(antigen-presenting cell, APC)的免疫监视, 进而形成肿瘤病灶并发生侵袭转移; 另一方面, 肿瘤细胞通过上调程序性死亡蛋白-1配体(programmed death protein-1 ligand, PD-L1)[1]、细胞毒性T淋巴细胞相关抗原-4 (cytotoxic T lymphocyte associated antigen-4, CTLA-4)[2]和吲哚-2, 3双加氧酶1 (indoleamine 2, 3-dioxygenase 1, IDO-1)[3]等免疫抑制因子表达, 抑制T淋巴细胞活性, 逃避免疫系统杀伤作用, 从而产生免疫逃逸。针对上述肿瘤免疫治疗关键挑战, 研究人员采用了特异性激活抗肿瘤免疫效应的策略, 实现高效肿瘤免疫治疗, 主要手段包括: ①利用光疗、放疗和化疗等方法诱导肿瘤细胞免疫原性死亡, 增加肿瘤细胞免疫原性; ②通过筛选肿瘤相关抗原开发肿瘤疫苗, 激活免疫应答; ③利用CTLA-4的抗体或抑制剂如易普利姆玛单抗(ipilimumab)[4]、细胞生长因子如白介素-2 (interleukin-2, IL-2)[5]等启动和激活T细胞; ④利用嵌合抗原受体T细胞(chimeric antigen receptors T cells, CAR-T)[6]特异性识别肿瘤细胞和杀伤肿瘤细胞; ⑤利用靶向PD-1/PD-L1通路的单克隆抗体[7], 如帕博利珠单抗(pembrolizumab)、纳武单抗(nivolumab)阻断PD-1/PD-L1通路, 或利用小分子抑制剂抑制IDO-1的活性, 恢复T细胞对肿瘤细胞的杀伤作用[8]。肿瘤免疫治疗不仅可以直接摧毁原发肿瘤, 并且可以激活机体免疫系统, 从而追踪识别和杀伤原发肿瘤附近残留的及远端转移的肿瘤细胞, 显著延长肿瘤患者生存期, 为肿瘤临床治疗带来革命性突破, 其中肿瘤免疫检查点疗法已获得2018年诺贝尔医学或生理学奖[9-12]。然而, 由于肿瘤免疫微环境受到多种因素的影响, 单一的免疫调节手段不能达到理想的治疗效果[13]。因此, 肿瘤的免疫治疗需要递送多种免疫调节剂, 增加肿瘤细胞免疫原性的同时解除其免疫抑制, 从而提高肿瘤治疗效果。
常规纳米递药系统在药物递送方面具有明显优势, 利用增强渗透和保留(enhanced permeability and retention, EPR)效应, 实现其在肿瘤组织的有效蓄积[14-16]; 通过表面聚乙二醇(polyethylene glycol, PEG)化, 避免被机体的网状内皮系统清除[17, 18]; 表面修饰靶向肿瘤组织特有的生物标志物的靶向基团, 提高递送效率[19, 20]; 利用较大的比表面积可负载大量治疗药物, 相对减少药物在生物体内的降解[21]。尽管常规纳米递药系统有上述优势, 但仍存在较大的局限性, 比如药物的非特异性释放、肿瘤部位渗透性差和肿瘤细胞摄取率低等[22, 23]。肿瘤微环境和正常组织相比, 不仅肿瘤胞外微环境存在差异, 而且肿瘤胞内微环境也存在差异。肿瘤微环境保护着肿瘤细胞无限增殖、转移和侵袭[24], 同时也为肿瘤治疗提供了思路。酸激活药物释放是微环境刺激响应的常用策略。Sun等[25]报道了一种肿瘤细胞内酸刺激响应型纳米递药系统用于控制细胞内释放多柔比星(doxorubicin, DOX), DOX被封装在由单链脱氧核糖核酸(deoxyribonucleic acid, DNA)组成的线团状纳米胶囊中, 同时封装了酸响应聚合物包裹的脱氧核糖核酸酶Ⅰ (deoxyribonuclease Ⅰ, DNase Ⅰ)。在溶酶体中, 包裹DNase Ⅰ的聚合物外壳酸响应脱落, DNA纳米线团立即被降解, 快速释放DOX, 增强对肿瘤细胞的杀伤效果。另外, 肿瘤细胞过表达的金属基质蛋白酶(matrix metalloproteinases, MMPs)也是刺激响应释药策略的理想刺激信号; Xu等[26]运用MMPs可降解的明胶将DOX封装在介孔硅纳米粒中, 用于治疗MMP-9过表达的结肠癌(HT-29)。在MMP-9刺激下, 介孔硅中的DOX快速释放, 对HT-29细胞产生了比正常肝细胞更大的细胞毒性。此外, 肿瘤组织与正常组织相比, 由于氧的供应和消耗不平衡, 形成乏氧微环境[27]。肿瘤缺氧会促进肿瘤多种耐药性和恶性侵袭转移, 导致较差的肿瘤治疗效果和患者预后不良[28]。基于肿瘤乏氧微环境, Perche等[29]开发了一种由聚乙二醇、偶氮苯、聚乙烯亚胺(polyethyleneimine, PEI)和二油酰基磷脂酰乙醇胺(DOPE)组成的纳米递药系统, 用于递送小干扰核糖核酸(small interfering ribonucleic acid, siRNA)。在肿瘤乏氧微环境的刺激下, 该纳米粒脱掉PEG外壳, 从而增强细胞对siRNA的摄取, 在体内和体外均表现出乏氧刺激响应的基因沉默能力。
近年来, 本课题组结合纳米技术、材料科学及化学等学科技术, 针对肿瘤胞外微酸、过表达酶、胞内酸性和高浓度谷胱甘肽(glutathione, GSH)微环境特异性构建了一系列肿瘤微环境激活型多功能纳米递药系统, 共递送多种免疫调节剂。其可提高药物在肿瘤组织特异性蓄积, 改善药物的细胞摄取与释放行为, 调控肿瘤免疫抑制微环境, 从而实现免疫协同治疗, 显著提高肿瘤治疗效果并避免免疫调节剂脱靶释放造成的不良反应[30]。本文将根据微环境激活型纳米递药系统刺激响应的化学机制, 从肿瘤胞外激活、胞内激活以及胞内外协同激活3个方面介绍本课题组利用激活型纳米递药系统改善肿瘤免疫治疗效果的研究进展(图 1)。
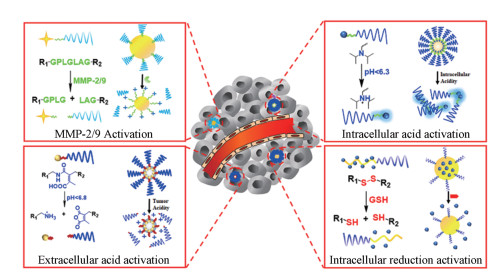
|
Figure 1 Mechanisms of tumor microenvironment-activatable nanosized drug delivery system |
PD-L1抗体靶向到肿瘤细胞表面PD-L1免疫检查点, 阻断PD-1/PD-L1免疫检查点通路, 解除肿瘤对细胞毒性T细胞(cytotoxic T lymphocyte, CTLs)的免疫抑制。在临床上, PD-L1抗体在部分患者中可产生显著疗效。但是, 由于部分正常组织细胞也表达PD-L1, 如肝细胞、血管内皮细胞和上皮细胞等, 从而导致PD-L1抗体会结合到正常组织细胞上, 引起严重的免疫相关毒副作用[31, 32]。
与正常组织相比, 实体肿瘤组织会过表达MMPs[33]。MMPs能够调控肿瘤微环境及多种肿瘤相关细胞的行为, 包括肿瘤细胞的生长、侵袭和转移等, 并且与肿瘤血管生成和免疫抑制密切相关[34]。为了提高免疫检查点抗体的治疗效果, 并避免抗体非肿瘤特异性分布导致的毒副作用, 作者[35]开发了肿瘤组织MMP-2激活型纳米递药系统, 共递送PD-L1抗体(ɑPD-L1)和光敏剂吲哚菁绿(indocyanine green, ICG, 图 2)。ICG在近红外激光照射下产生大量的活性氧, 促进肿瘤细胞释放肿瘤相关抗原, 增强肿瘤细胞免疫原性, 且促进细胞毒性T细胞在肿瘤组织中的浸润; 同时, ɑPD-L1能够阻断PD-1/PD-L1免疫检查点, 解除对CTLs的免疫抑制。
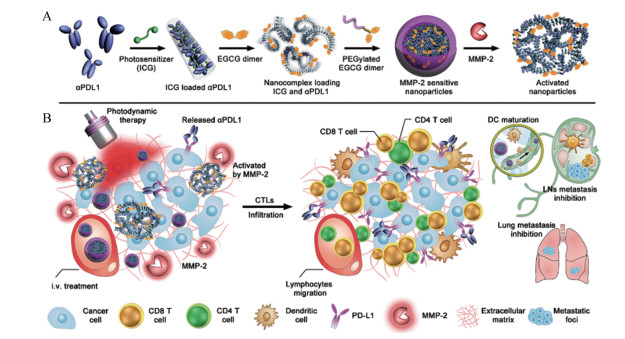
|
Figure 2 Matrix metalloproteinases 2 (MMP-2) activatable nanosized drug delivery system for improved immune check block (ICB) therapy by combating the immunologic tolerance of tumors[35]. A: Fabrication of MMP-2-liable nanoparticles; B: Schematic illustration of MMP-2 activatable nanoparticles-mediated combination ICB and photodynamic therapy (PDT) |
作者首先合成茶多酚二聚体, 利用MMP-2响应肽段将PEG和茶多酚二聚体偶联, 得到PEG化茶多酚二聚体, 然后利用共组装技术制备MMP-2激活型ɑPD-L1抗体药物递送系统。该纳米递药系统粒径为163.4 ± 6.6 nm, 在血液循环中保持良好的稳定性, 可避免ɑPD-L1结合到正常组织细胞。通过EPR效应大量蓄积到肿瘤组织部位后, 该纳米递药系统可在肿瘤组织过表达的MMP-2刺激下有效地释放出ɑPD-L1。以4T1三阴性乳腺癌的荷瘤小鼠为动物模型, 活体抑瘤实验表明, 给药24 h后MMP-2激活型纳米递药系统介导的ɑPD-L1在肿瘤组织的蓄积是游离ɑPD-L1的10.7倍。该纳米递药系统介导的光动力联合免疫检查点治疗有效地抑制了约85%肿瘤生长, 大约60%小鼠肿瘤完全消除, 80%小鼠生存期超过70天; 在相同的光功率条件下, 游离ɑPD-L1联合只负载ICG纳米递药系统的治疗仅抑制了约68%肿瘤生长, 并在50天时小鼠全部死亡。上述实验结果表明, MMP-2激活型纳米递药系统介导的光动力治疗(photodynamic therapy, PDT)联合PD-1/PD-L1免疫检查点治疗的策略, 有效改善了4T1肿瘤的免疫抑制微环境, 显著提高原位肿瘤治疗效果。
2 肿瘤胞外微酸环境激活型纳米递药系统德国生物化学家Otto Warburg发现, 肿瘤细胞的代谢获能途径区别于正常细胞。肿瘤细胞通过有氧糖酵解获取能量的同时产生大量的乳酸, 使得肿瘤微环境的pH值(6.0~7.2)低于正常组织(pH = 7.4)[36, 37]。大量研究表明, 表面带正电荷的纳米递药系统可有效促进其在肿瘤部位的渗透和肿瘤细胞摄取[38-40]。然而, 带正电荷的纳米递药系统在血液循环中易受到血液中蛋白的吸附和网状内皮系统的清除。虽然在纳米粒表面修饰PEG可有效解决这一问题, 但PEG修饰会阻碍正电荷的暴露, 降低了纳米粒的肿瘤渗透性和肿瘤细胞摄取率。
为了解决上述问题, 针对肿瘤酸性微环境特征, 作者[41]构建了肿瘤胞外微酸环境激活型前药纳米囊泡, 共递送奥沙利铂(oxaliplatin, OXA)前药和PEG化光敏剂(photosensitizer, PS), 突破肿瘤微环境生理屏障, 克服肿瘤免疫抑制(图 3)。该纳米囊泡粒径约为83.4 nm, 具有良好单分散性; 到达肿瘤部位后, 二甲基马来酸酐修饰的OXA前药在胞外微酸条件下发生酰胺键断裂, 酸酐脱落, 表面电荷由-10.1 ± 0.7 mV反转为7.0 ± 0.8 mV。同时, MMP-2响应的PEG化光敏剂在MMP-2的作用下发生PEG脱壳, 暴露大量氨基, 使纳米囊泡的表面电位提高到13.5 ± 1.2 mV, 进一步增加了前药纳米囊泡在肿瘤部位的蓄积渗透和肿瘤细胞摄取。

|
Figure 3 Tumor acidity and MMP-2 dual-activatable prodrug vesicles inducing immunogenic cell death of tumor[41]. A: Schematic design of the acidity and MMP-2 dual-responsive prodrug vesicles; B: Simplified mechanism of activatable prodrug vesicles-mediated combination chemoimmunotherapy and CD47 blockade |
活体分布和药物代谢动力学实验表明, 肿瘤胞外微环境双重激活型前药纳米囊泡介导的OXA在肿瘤部位的蓄积分别是单一激活型前药纳米囊泡和非激活型前药纳米囊泡的1.3倍和1.9倍。与游离OXA相比, 双重激活型前药纳米囊泡将OXA的血液清除半衰期和生物利用度分别提高了3倍和22.5倍。
焦脱镁叶绿酸a (pheophorbide a, PPa)介导的光动力效应和OXA会诱导肿瘤细胞发生免疫原性细胞死亡(immunogenic cell death, ICD), 钙网蛋白(calreticulin, CRT)外翻, 从而提高肿瘤细胞的免疫原性。双重激活型前药纳米囊泡在激光作用下, 显著诱导肿瘤细胞CRT外翻, 相较PBS组和游离OXA组分别提高了3.4倍和2.5倍, 是单一光敏剂组的3.0倍。上述实验结果表明, 具有肿瘤微酸环境引发表面电荷反转和MMP-2激活PEG脱壳暴露正电荷双重激活型前药纳米囊泡, 促进了药物在肿瘤部位的高效蓄积和渗透, 并可协同促发细胞免疫原性死亡, 提高肿瘤免疫原性, 激活机体免疫应答。肿瘤胞外微环境激活型前药纳米囊泡介导的肿瘤细胞ICD联合CD47抗体解除肿瘤免疫识别抑制信号, 进一步增强机体对肿瘤细胞的识别和杀伤。
3 肿瘤胞内酸环境激活型纳米递药系统细胞内亚细胞器如内涵体和溶酶体的pH值较细胞质偏低, 溶酶体内的pH值为4.0~5.0, 是控制纳米递药系统在肿瘤细胞内释放药物的理想刺激因素[42]。据此, 作者[43]设计了由酸敏感两嵌段高分子聚合物组装形成的肿瘤胞内酸环境激活性纳米递药系统, 用于递送siRNA并在肿瘤细胞内特异性激活释放。首先, 利用原子转移自由基聚合法合成聚乙二醇-聚甲基丙烯酸二异丙胺基乙酯两嵌段共聚物[PEG-b-poly(di-isopropyl amine ethyl methacrylate), PEG-b-PDPA], 进一步在高分子骨架上修饰PPa, 得到PDPA-PPa聚合物; 其次, 合成了油酸修饰聚乙烯亚胺阳离子聚合物(OEI-C14), 然后将两种聚合物混合制备得到复合胶束, 实现光敏剂PPa和siRNA的共递送(图 4)。在该工作中, 利用基因沉默技术, 阻断PD-1/PD-L1免疫检查点, 增强光动力介导的肿瘤免疫治疗效果。PDPA是一种pH超敏感的两嵌段共聚物, 其pKa大约为6.3。在中性条件下, PDPA-PPa和OEI-C14共组装成纳米胶束, 该胶束的粒径约为90 nm, 粒径均一。由于PPa分子聚集在胶束内核并发生分子间荧光共振能量转移, 其在血液循环中荧光淬灭, 从而降低PPa的暗毒性。当胶束进入内吞小泡的弱酸性微环境(pH = 5.0 ~ 6.0)后, PDPA的叔胺基团发生质子化, 胶束解离, PPa的荧光信号恢复, 实现肿瘤成像和光动力治疗。实验结果表明, 该胶束可以有效地将siRNA递送至肿瘤细胞, 实现siRNA的溶酶体逃逸, 从而促进siRNA发挥基因干扰作用, 抑制了B16-F10细胞中约55% PD-L1表达。通过阻断PD-L1免疫检查点, 解除肿瘤细胞经PD-1/PD-L1通路对CTLs的免疫抑制。该纳米胶束有效改善CTLs对肿瘤细胞的杀伤作用, 显著增强光动力介导的肿瘤免疫治疗效果。
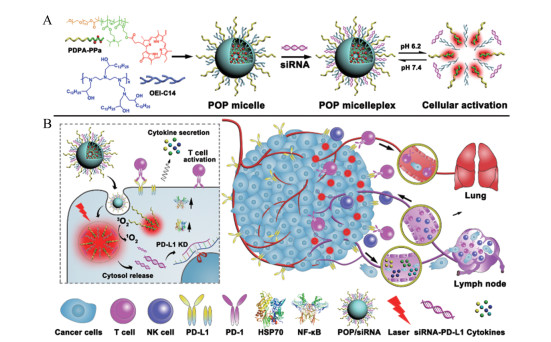
|
Figure 4 Acid-activatable micelleplexes for programmed death protein-1 ligand (PD-L1) blockade-enhanced photodynamic cancer immunotherapy[43]. A: Fabrication of acid-activatable micelleplexes; B: Schematic of the micelleplex mediated photodynamic cancer immunotherapy |
据文献[44-46]报道, 肿瘤细胞内谷胱甘肽(glutathione, GSH)浓度是正常细胞的10~100倍。肿瘤细胞和正常细胞之间GSH浓度的显著差异, 为实现肿瘤细胞内释药提供了契机。因此, 作者[47]开发了一种肿瘤细胞外微酸环境和肿瘤细胞内还原微环境双重激活型二元协同前药纳米递药系统(binary-cooperative prodrug nanoparticles, BCPN, 图 5)。BCPN可共递送OXA和NLG919至肿瘤细胞内, OXA可诱导肿瘤细胞ICD, 提高肿瘤免疫原性, 同时NLG919可抑制肿瘤细胞内IDO-1的活性, 克服肿瘤免疫抑制微环境。BCPN通过上述二元协同作用调控肿瘤免疫微环境, 可有效改善肿瘤免疫治疗效果。首先, 作者设计合成PEG化的OXA前体, 然后与用二硫键偶联的NLG919二聚体自组装制备得到纳米粒BCPN, 粒径约为125.2 nm。该纳米递药系统具有以下优势: ①较高的药物包封率和可调的载药比, NLG919和OXA的包封率分别为(96.1 ± 3.1) %和(85.1 ± 2.9) %, 载药量分别为(45.7 ± 1.2) %和(4.40 ± 1.5) %; ② PEG化OXA前药在酸性缓冲液(pH = 6.5~6.8)中具有较高的敏感性, 当BCPN到达肿瘤胞外微酸环境后, 酸敏感键断裂, 脱掉PEG外壳, 表面电位由负变正, 显著提高纳米粒在肿瘤组织的蓄积和渗透, 促进肿瘤细胞的摄取, 荷瘤小鼠尾静脉注射24 h后, 酸敏感组肿瘤内NLG919和OXA浓度分别较酸不敏感组提高4.2倍和2.7倍, 分别较游离NLG919和OXA组提高30倍和5.3倍; ③ OXA前药和NLG919二聚体均可在肿瘤细胞内GSH的刺激下特异性释放药物分子, 避免对正常组织产生不良影响。荷瘤小鼠模型的抑瘤实验结果显示, 该纳米递药系统对4T1原位肿瘤生长以及肺转移的抑制率分别是OXA和NLG919的2.1倍和2.0倍。BCPN纳米递药系统针对肿瘤胞外和胞内不同刺激信号的响应, 一方面, 增加了纳米递药系统在肿瘤部位的蓄积和渗透; 另一方面, 实现药物小分子在胞内集中释放, 调控肿瘤免疫微环境, 从而提高抑制乳腺癌和结直肠癌原发肿瘤的疗效, 有效预防乳腺癌肺转移和复发。

|
Figure 5 Tumor acidity and glutathione (GSH) dual‐activatable prodrug vesicles for immunotherapy by modulating the immune tumor microenvironment[47]. A: Self-assembly procedure and chemical structure of dual-activatable nanoparticles; B: Schematic illustration of the nanoparticles to elicit antitumor immunity and suppress regulatory T cells for improved immunotherapy |
纳米技术、材料科学和化学等多学科技术的迅速发展推动了纳米递药系统的智能化设计和应用, 有利于实现按时按需递药释药, 并在一个纳米递送平台中实现多种治疗药物的联合应用。将肿瘤胞外和胞内生理特征与纳米递药系统的设计相结合, 开发出一系列微环境激活型纳米递药系统, 如基于MMP-2激活型纳米递药系统用于抗体药物的瘤内递送和细胞外释放; 基于肿瘤胞内酸环境激活型纳米递药系统用于促进siRNA的溶酶体逃逸并阻断PD-L1通路。另外, 基于肿瘤胞外微酸环境和MMP-2双重激活型纳米递药系统用于共递送协同增效的小分子药物, 提高了肿瘤免疫治疗效果。针对纳米递药系统如何实现血液长循环、瘤内高蓄积和胞内药物易释放这些需求, 构建了同时对肿瘤胞外和胞内刺激信号双重响应的激活型纳米递药系统, 上述纳米递药系统可根据不同的刺激信号实现时空可控释药, 显著提高药物在荷瘤小鼠模型中的抗肿瘤免疫治疗效果。
尽管微环境激活型纳米递送系统的临床前研究取得了可喜进展, 但其向临床应用转化仍面临亟待克服的诸多难关。首先, 纳米递药系统的生物安全性需要进行全面评价。目前报道的大多数药物递送系统对载体材料的生物相容性和降解性的研究仍然不足, 阻碍了纳米递药系统的临床转化。因此, 后续研究应注重全面评估材料和纳米载体的安全性, 包括药物动力学、生物分布、代谢、排泄和长期毒性等方面; 其次, 虽然多种肿瘤生理信号可被用于实现纳米递药系统的肿瘤特异性激活和药物控制释放, 但是, 诸如酶环境、酸环境或氧化还原环境也并非肿瘤特有, 因此内源性信号激活型纳米递药系统仍然存在一定程度上的非特异性; 再者, 由于肿瘤异质性, 不同类型肿瘤、不同个体肿瘤中的生理特性也存在差异, 限制了微环境激活型纳米递药系统的应用范围。此外, 如何实现刺激响应纳米递药系统工业化制备的质量控制也是实现其临床转化的重大挑战。
虽然面临诸多难关, 但通过将外部刺激信号如光、电、磁、温度等与肿瘤组织内部刺激信号相结合, 开发多重刺激信号激活型纳米递药系统, 实现免疫治疗药物的靶向递送和可控释放, 有望进一步提高纳米递药系统的肿瘤特异性响应。并且, 随着研究的深入和技术进步, 研究者们有望设计开发出肿瘤特异性更高、毒副作用更小和质量更加可控的纳米递药系统, 改善肿瘤免疫治疗效果。
| [1] | Gopalakrishnan V, Spencer CN, Nezi L, et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients[J]. Science, 2018, 359: 97–103. DOI:10.1126/science.aan4236 |
| [2] | Littman DR. Releasing the brakes on cancer immunotherapy[J]. Cell, 2015, 162: 1186–1190. DOI:10.1016/j.cell.2015.08.038 |
| [3] | Prendergast GC, Smith C, Thomas S, et al. Indoleamine 2, 3‑ dioxygenase pathways of pathogenic inflammation and immune escape in cancer[J]. Cancer Immunol Immunother, 2014, 63: 721–735. DOI:10.1007/s00262-014-1549-4 |
| [4] | Tawbi HA, Forsyth PA, Algazi A, et al. Combined nivolumab and ipilimumab in melanoma metastatic to the brain[J]. N Engl J Med, 2018, 379: 722–730. DOI:10.1056/NEJMoa1805453 |
| [5] | Ross SH, Cantrell DA. Signaling and function of interleukin-2 in T lymphocytes[J]. Annu Rev Immunol, 2018, 36: 411–433. DOI:10.1146/annurev-immunol-042617-053352 |
| [6] | Neelapu SS, Tummala S, Kebriaei P, et al. Chimeric antigen receptor T-cell therapy-assessment and management of toxicities[J]. Nat Rev Clin Oncol, 2018, 15: 47–62. DOI:10.1038/nrclinonc.2017.148 |
| [7] | Brahmer JR, Tykodi SS, Chow LQM, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer[J]. N Engl J Med, 2012, 366: 2455–2465. DOI:10.1056/NEJMoa1200694 |
| [8] | Liu XD, Shin N, Koblish HK, et al. Selective inhibition of IDO1 effectively regulates mediators of antitumor immunity[J]. Blood, 2010, 115: 3520–3530. DOI:10.1182/blood-2009-09-246124 |
| [9] | Gajewski TF, Schreiber H, Fu YX. Innate and adaptive immune cells in the tumor microenvironment[J]. Nat Immunol, 2013, 14: 1014–1022. DOI:10.1038/ni.2703 |
| [10] | Woo SR, Turnis ME, Goldberg MV, et al. Immune inhibitory molecules LAG-3 and PD-1 synergistically regulate T-cell function to promote tumoral immune escape[J]. Cancer Res, 2012, 72: 917–927. DOI:10.1158/0008-5472.CAN-11-1620 |
| [11] | Curran MA, Montalvo W, Yagita H, et al. PD-1 and CTLA-4 combination blockade expands infiltrating T cells and reduces regulatory T and myeloid cells within B16 melanoma tumors[J]. Proc Natl Acad Sci U S A, 2012, 107: 4275–4280. |
| [12] | Tumeh PC, Harview CL, Yearley JH, et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance[J]. Nature, 2014, 515: 568–571. DOI:10.1038/nature13954 |
| [13] | Liu YY, Qiao LN, Zhang SP, et al. Dual pH-responsive multifunctional nanoparticles for targeted treatment of breast cancer by combining immunotherapy and chemotherapy[J]. Acta Biomater, 2018, 66: 310–324. DOI:10.1016/j.actbio.2017.11.010 |
| [14] | Torchilin V. Tumor delivery of macromolecular drugs based on the EPR effect[J]. Adv Drug Deliv Rev, 2011, 63: 131–135. DOI:10.1016/j.addr.2010.03.011 |
| [15] | Prabhakar U, Maeda H, Jain RK, et al. Challenges and key considerations of the enhanced permeability and retention effect for nanomedicine drug delivery in oncology[J]. Cancer Res, 2013, 73: 2412–2417. DOI:10.1158/0008-5472.CAN-12-4561 |
| [16] | Perry JL, Reuter KG, Luft JC, et al. Mediating passive tumor accumulation through particle size, tumor type, and location[J]. Nano Lett, 2017, 17: 2879–2886. DOI:10.1021/acs.nanolett.7b00021 |
| [17] | Bertrand N, Wu J, Xu X, et al. Cancer nanotechnology: the impact of passive and active targeting in the era of modern cancer biology[J]. Adv Drug Deliv Rev, 2014, 66: 2–25. DOI:10.1016/j.addr.2013.11.009 |
| [18] | Stone OA, El-Brolosy M, Wilhelm K, et al. Loss of pyruvate kinase M2 limits growth and triggers innate immune signaling in endothelial cells[J]. Nat Commun, 2018, 9: 4077–4089. DOI:10.1038/s41467-018-06406-8 |
| [19] | Chen F, Cai W. Tumor vasculature targeting: a generally applicable approach for functionalized nanomaterials[J]. Small, 2014, 10: 1887–1893. DOI:10.1002/smll.201303627 |
| [20] | Sato N, Chen XB, Kohi S, et al. Targeting hyaluronan for the treatment of pancreatic ductal adenocarcinoma[J]. Acta Pharm Sin B, 2016, 6: 101–105. DOI:10.1016/j.apsb.2016.01.002 |
| [21] | Biju V. Chemical modifications and bioconjugate reactions of nanomaterials for sensing, imaging, drug delivery and therapy[J]. Chem Soc Rev, 2014, 43: 744–764. DOI:10.1039/C3CS60273G |
| [22] | Maeda H, Wu J, Sawa T, et al. Tumor vascular permeability and the EPR effect in macromolecular therapeutics: a review[J]. J Control Release, 2000, 65: 271–284. DOI:10.1016/S0168-3659(99)00248-5 |
| [23] | Tanaka T, Shiramoto S, Miyashita M, et al. Tumor targeting based on the effect of enhanced permeability and retention (EPR) and the mechanism of receptor-mediated endocytosis (RME)[J]. Int J Pharmaceut, 2004, 277: 39–61. DOI:10.1016/j.ijpharm.2003.09.050 |
| [24] | Quail DF, Joyce JA. Microenvironmental regulation of tumor progression and metastasis[J]. Nat Med, 2013, 11: 1423–1437. |
| [25] | Sun WJ, Jiang TY, Lu Y, et al. Cocoon-like self-degradable DNA nanoclew for anticancer drug delivery[J]. J Am Chem Soc, 2014, 42: 14722–14725. |
| [26] | Xu JH, Gao FP, Li LL, et al. Gelatin-mesoporous silica nanoparticles as matrix metalloproteinases-degradable drug delivery systems in vivo[J]. Micropor Mesopor Mat, 2013, 182: 165–172. DOI:10.1016/j.micromeso.2013.08.050 |
| [27] | Zheng X, Wang X, Mao H, et al. Hypoxia-specific ultrasensitive detection of tumours and cancer cells in vivo[J]. Nat Commun, 2015, 6: 5834–5846. DOI:10.1038/ncomms6834 |
| [28] | Hockel M, Vaupel P. Tumor hypoxia: definitions and current clinical, biologic, and molecular aspects[J]. J Natl Cancer Ins, 2001, 93: 266–276. DOI:10.1093/jnci/93.4.266 |
| [29] | Perche F, Biswas S, Wang T, et al. Hypoxia-targeted siRNA delivery[J]. Angew Chem Int Ed, 2014, 53: 3362–3366. DOI:10.1002/anie.201308368 |
| [30] | Mura S, Nicolas J, Couvreur P. Stimuli-responsive nanocarriers for drug delivery[J]. Nat Mater, 2013, 12: 991–1003. DOI:10.1038/nmat3776 |
| [31] | Sharpe AH, Wherry EJ, Ahmed R, et al. The function of programmed cell death 1 and its ligands in regulating autoimmunity and infection[J]. Nat Immunol, 2007, 8: 239–245. DOI:10.1038/ni1443 |
| [32] | Naidoo J, Page DB, Li BT, et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies[J]. Ann Oncol, 2015, 26: 2375–2391. |
| [33] | Jones JL, Walker RA. Control of matrix metalloproteinase activity in cancer[J]. J Pathol, 1997, 183: 377–379. DOI:10.1002/(SICI)1096-9896(199712)183:4<377::AID-PATH951>3.0.CO;2-R |
| [34] | Conlon GA, Murray GI. Recent advances in understanding the roles of matrix metalloproteinases in tumour invasion and metastasis[J]. J Pathol, 2019, 247: 629–640. DOI:10.1002/path.5225 |
| [35] | Wang DG, Wang TT, Yu HJ, et al. Engineering nanoparticles to locally activate T cells in the tumor microenvironment[J]. Sci Immunol, 2019, 37: 6584–6597. |
| [36] | Tao YC, Liu SW, Zhang Y, et al. A pH-responsive polymer based on dynamic imine bonds as a drug delivery material with pseudo target release behavior[J]. Polym Chem, 2018, 9: 878–884. DOI:10.1039/C7PY02108A |
| [37] | Allen AE, Locasale JW. Glucose metabolism in cancer: the saga of pyruvate kinase continues[J]. Cancer Cell, 2018, 33: 337–339. DOI:10.1016/j.ccell.2018.02.008 |
| [38] | Chen XL, Liu LS, Jiang C, et al. Charge-reversal nanoparticles: novel targeted drug delivery carriers[J]. Acta Pharm Sin B, 2016, 6: 261–267. DOI:10.1016/j.apsb.2016.05.011 |
| [39] | Xue XD, Huang Y, Bo RN, et al. Trojan horse nanotheranostics with dual transformability and multifunctionality for highly effective cancer treatment[J]. Nat Commun, 2018, 9: 3653–3668. DOI:10.1038/s41467-018-06093-5 |
| [40] | Du BJ, Yu MX, Zheng J. Transport and interactions of nanoparticles in the kidneys[J]. Nat Rev Mater, 2018, 3: 358–374. DOI:10.1038/s41578-018-0038-3 |
| [41] | Zhou FY, Feng B, Yu HJ, et al. Tumor microenvironment-activatable prodrug vesicles for nanoenabled cancer chemoimmunotherapy combining immunogenic cell death induction and CD47 blockade[J]. Adv Mater, 2019, 31: 1805888–1805899. DOI:10.1002/adma.201805888 |
| [42] | Wang TT, Wang DG, Yu HJ, et al. Intracellularly acid switchable multifunctional micelles for combinational photo/chemotherapy of the drug resistant tumor[J]. ACS Nano, 2016, 10: 3496–3508. DOI:10.1021/acsnano.5b07706 |
| [43] | Wang DG, Wang TT, Liu JP, et al. Acid-activatable versatile micelleplexes for PD-L1 blockade-enhanced cancer photodynamic immunotherapy[J]. Nano Lett, 2016, 16: 5503–5513. DOI:10.1021/acs.nanolett.6b01994 |
| [44] | Saito G, Swanson JA, Lee KD. Drug delivery strategy utilizing conjugation via reversible disulfide linkages: role and site of cellular reducing activities[J]. Adv Drug Deliv Rev, 2003, 2: 199–215. |
| [45] | Huo M, Yuan JY, Tao L, et al. Redox-responsive polymers for drug delivery: from molecular design to applications[J]. Polym Chem, 2014, 5: 1519–1528. DOI:10.1039/C3PY01192E |
| [46] | Ling X, Tu JS, Wang JQ, et al. Glutathione-responsive prodrug nanoparticles for effective drug delivery and cancer therapy[J]. ACS Nano, 2019, 13: 357–370. DOI:10.1021/acsnano.8b06400 |
| [47] | Feng B, Zhou FY, Hou B, et al. Binary cooperative prodrug nanoparticles improve immunotherapy by synergistically modulating immune tumor microenvironment[J]. Adv Mater, 2018, 30: 1803001–1803011. DOI:10.1002/adma.201803001 |
 2019, Vol. 54
2019, Vol. 54


