2. 中国科学院大学, 北京 100009
2. University of Chinese Academy of Sciences, Beijing 100009, China
肿瘤细胞的代谢重塑(metabolic remodeling)可满足其快速增殖对能量和生物大分子物质的需求, 是肿瘤发生发展过程中显著特征之一。肿瘤代谢重塑的过程, 除了满足了肿瘤细胞能量供给、生物合成和氧化还原平衡等的代谢需求, 往往还伴随着肿瘤细胞中特定代谢物的累积。近年来, 随着肿瘤代谢研究的日益深入, 对于代谢物功能的认识也得到了不断拓展。肿瘤相关代谢物, 如糖代谢产物、脂代谢产物和氨基酸等, 可以通过对表观遗传调控酶的竞争性抑制或对蛋白进行翻译后修饰等机制调控肿瘤相关信号通路[1, 2], 进而影响肿瘤的发生发展。此外, 除了肿瘤细胞自身产生的代谢物之外, 近年来, 越来越多的研究也开始关注肿瘤微环境中的其他来源的代谢物对肿瘤的调控[3]。揭示肿瘤相关代谢物调控肿瘤相关信号通路的机制, 是认识代谢异常在肿瘤发生发展中的作用的重要内容, 有望对肿瘤代谢调控形成更加全面的认识, 同时也有助于发现新的肿瘤治疗靶标。本文将聚焦代谢物对肿瘤相关信号通路的调控机制, 分别从肿瘤自身产生的代谢物以及肿瘤微环境中其他来源的代谢物两个角度, 阐述代谢物调控肿瘤发生发展相关信号通路研究的最新进展。
1 肿瘤自身来源的代谢物肿瘤自身产生的异常的代谢物主要来自于糖代谢、脂代谢和氨基酸代谢过程的重塑。这些代谢过程的转变主要受肿瘤驱动基因的调控或者由代谢酶的突变/缺失/扩增导致, 同时还受环境因素的影响, 如氧气浓度和营养物质的可利用度。肿瘤代谢重塑导致的肿瘤代谢产物的异常不仅改变了肿瘤的能量和物质供给状态, 还参与了肿瘤相关信号通路的调控, 在肿瘤细胞的存活、增殖及侵袭转移中发挥了重要的作用。
1.1 乳酸乳酸(lactate)作为代谢通路中最受关注的代谢物之一, 对其关注最早缘于肿瘤细胞的有氧糖酵解效应。在氧气充足的情况下, 正常细胞通过线粒体代谢将葡萄糖充分氧化成CO2; 而肿瘤细胞即使在有氧条件下也更倾向于利用葡萄糖生成乳酸, 肿瘤细胞这一代谢特征被称为有氧糖酵解, 由著名生物化学家Warburg于1924年首次提出, 也被称为“瓦博格效应”(Warburg effect), 是最早被揭示的肿瘤的代谢特征。肿瘤细胞有氧糖酵解会在细胞质产生大量乳酸并被分泌到细胞外。乳酸在细胞内外的转运主要依赖于质子偶联单羧酸转运体1/4 (monocarboxylate transporters 1/4, MCT1/4)。MCT1/4是跨细胞膜的双向偶联质子的单羧酸转运体[4]。其中MCT4与乳酸的亲和力较低(Km=22~28 mmol·L-1)[4], 但由于其具有较高的翻转速率[5], 易于将糖酵解细胞产生的乳酸排出细胞外, 对于维持细胞内pH值稳态至关重要[6, 7]; MCT1与乳酸亲和力相对较高(Km=3.5~10 mmol·L-1)[4], 乳酸可以通过MCT1实现细胞内外的双向穿梭。在大多数正常组织中, MCT1负责将乳酸排出细胞外[8], 然而在糖酵解肿瘤细胞和某些特定组织, 如白色肌肉组织和星状细胞中, MCT4为乳酸分泌的主要通道[8]。
一直以来, 乳酸被认为是有氧糖酵解的代谢副产物。近年来, 乳酸的供能作用被逐步揭示, 乳酸作为重要的能量物质的作用引起广泛重视。研究表明, 细胞质内累积的乳酸能被乳酸脱氢酶(lactate dehydrogenase, LDH)氧化生成丙酮酸, 后者进一步进入三羧酸循环(tricarboxylic acid cycle, TCA cycle)。采用13C标记节食小鼠血液中的葡萄糖、谷氨酰胺和乳酸, 追踪代谢物去向比较代谢物的利用情况, 发现乳酸的利用度要比葡萄糖高2.5倍; 在除脑之外的所有组织中, 乳酸转化为TCA循环中间产物的效率最高。这些结果说明, 乳酸可以作为TCA循环的碳源及主要的能量来源[9]。另外, 由于LDH催化乳酸转变为丙酮酸的反应偶联烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)向还原型烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide adenine dinucleotide, NADH)的转变, 乳酸对于维持细胞质中NADH/NAD+的平衡也至关重要。新近有研究发现, 线粒体膜上表达MCT1[10]且线粒体中存在LDH[11], 提示乳酸向丙酮酸的转化可发生在线粒体中, 可能贡献于线粒体中NAD+的清除过程[11]。
除了上述代谢方面的功能, 近年来, 越来越多的研究发现, 乳酸可作为一种信号分子调控肿瘤相关信号通路促进肿瘤的发生发展。肿瘤内乳酸的含量与肿瘤的转移以及肿瘤患者预后密切相关[12], 已被认为是一类“癌代谢物” (onco-metabolite)。
1.1.1 调控细胞内HIF-1α的蛋白水平除红细胞以外的正常细胞中, 乳酸的产生是缺氧的标志, 乳酸可通过促进血管新生, 来缓解缺氧的压力。目前认为, 乳酸促进血管新生的作用主要通过对缺氧相关信号通路的调控实现。肿瘤细胞糖酵解的转变可以激活缺氧诱导因子1 (hypoxia-inducible factor 1, HIF-1) (图 1a)。HIF-1是α, β二聚体复合物, 其活化的调控主要依赖HIF-1α亚基的翻译后修饰的稳定性[13]。HIF-1α的翻译后修饰由依赖亚铁离子(Fe2+)和α-酮戊二酸(α-KG)的双加氧酶脯氨酰羟化酶2 (prolylhydroxylase 2, PHD2)负责, 它是一类氧感应器[14]。在正常氧条件下, PHD2将2个羟基转移至HIF-1α氧依赖结构域的402和564位的脯氨酸残基, 之后招募逢希伯-林道蛋白复合体(Von Hippel-Lindau, VHL)进行泛素化修饰进而导致HIF-1α被蛋白酶体降解; 在缺氧情况下, PHD2活性降低, HIF-1α的降解受到抑制, 其可进入细胞核内与HIF-1β以及其他辅因子结合形成转录活化复合物[15]。研究表明, 乳酸可通过抑制PHD2的功能, 维持HIF-1α的稳定性, 且这一作用不依赖于缺氧条件[16]。

|
Figure 1 Competitive inhibition effect of metabolites. a: Metabolites inhibit the degradation of HIF-1α by competitively binding to PHD2; b: Metabolites competitively bind to KDMs and inhibit the methylation of histones; c: Metabolites competitively bind to TETs to inhibit DNA methylation; d: High concentrations of butyrate competitively bind to HDACs to inhibit acetylation of histones; e: Itaconate competitively binds to SDH to inhibit the production of inflammatory cytokines. PHD2: Prolyl hydroxylase domain-containing protein 2; HIF-1α: Hypoxia inducible factor 1 subunit alpha; VHL: Von Hippel-Lindau tumor suppressor; (R)-2HG: (R)-2-Hydroxyglutarate; α-KG: α-Ketoglutarate; Ub: Ubiquitin; KDMs: Lysine demethylases; TETs: Ten-eleven translocation enzymes; SDH: Succinate dehydrogenase; ROS: Reactive oxygen species; HATs: Histone acetyltransferases; HDACs: Histone deacetylase; Ac: Acetyl |
乳酸抑制PHD2的分子机制仍需进一步探究。目前认为一种可能的机制是乳酸在细胞内可以被LDH催化形成丙酮酸, 丙酮酸由于与PHD2的底物α-KG结构类似, 可竞争性与PHD2结合而抑制其对HIF-1α羟化作用, 从而维持HIF-1α的稳定[17, 18]。HIF-1α可刺激血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达进而促进血管新生, 同时其还可以通过上调与肿瘤糖酵解、抗凋亡及侵袭转移相关的信号分子的转录来促进肿瘤的进展[19]。有意思的是, 乳酸的这些效应不发生在Warburg代谢特征的肿瘤细胞, 而是发生在进行氧化代谢的肿瘤细胞中。一种可能的解释是尽管肿瘤进行Warburg效应产生乳酸, 但是它们可以通过MCT4介导的外流移除乳酸, 反之呈现氧化代谢的肿瘤细胞更倾向于通过MCT1利用乳酸, 因而增加了细胞内乳酸的积累[16]。
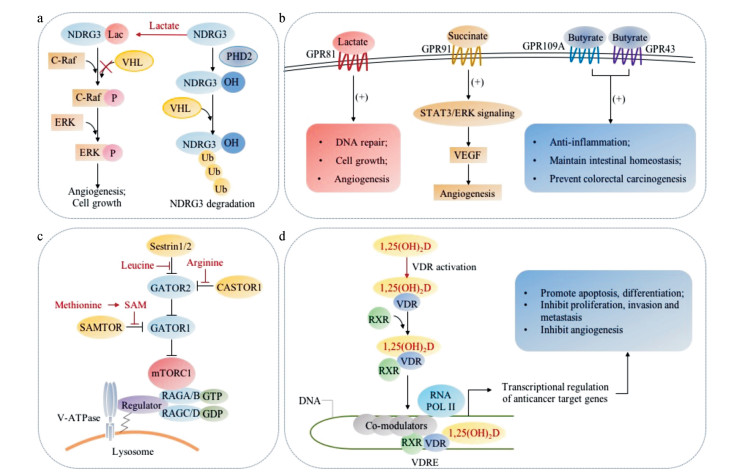
1.1.2 直接与NDRG3结合维持其稳定性除了HIF-1α, PHD2的其他靶蛋白如N-Myc下游调控基因3 (N-Myc downstream-regulated gene 3, NDRG3)也同样能够被PHD2进行羟化修饰, 进而招募VHL蛋白复合体进行泛素化修饰并降解[20]。NDRG3可通过结合丝苏氨酸蛋白激酶c-Raf激活Raf-ERK信号通路促进血管新生和细胞增殖。最近的研究表明, 在缺氧条件下, 乳酸可以直接与NDRG3结合使其免受PHD2的羟化作用进而维持NDRG3的稳定性, 这一过程不依赖于HIF-1α[20] (图 2a)。另一方面, 乳酸本身也可抑制PHD2的活性[16]。由此, 乳酸可以通过两种不相关的机制增加细胞内肿瘤驱动分子NDRG3的细胞内水平。
|
Figure 2 Metabolites bind directly to corresponding receptors. a: Direct binding of lactate to NDRG3 inhibits its degradation by PHD2/VHL; b: Metabolites directly bind to GPCR receptors to activate downstream signaling pathways; c: Amino acids directly bind to the corresponding receptors to activate the mTOR signaling pathway; d: Vitamin D derivative 1, 25(OH)2D binds to VDR to regulate the transcription. Lac: Lactate; NDRG3: N-Myc downstream-regulated gene 3; ERK: Extracellular signal-regulated kinase; STAT3: Signal transducer and activator of transcription 3; VEGF: Vascular endothelial growth factor; GPR: G-protein coupled receptor; GATOR: Gap activity toward Rags; CASTOR1: Cellular arginine sensor for mTORC1; mTORC1: Mammalian target of rapamycin complex 1; RAG: Ras related GTP binding protein; SAMTOR: S-Adenosylmethionine sensor upstream of mTORC1; VDR: Vitamin D receptor; RXR: Retinoid X receptor |
乳酸受体GPR81的发现为乳酸可作为信号分子提供了重要证据。GPR81也叫羟羧酸受体1 (hydroxycarboxylic acid receptor 1, HCAR1), 最早发现于脂肪细胞中, 参与乳酸对脂代谢的调控[21]。GPR81是一类抑制性G蛋白偶联受体[22], 可通过结合并激活Giα亚基抑制腺苷酸环化酶并抑制胰岛素诱导的脂质分解[23, 24]。最近几年这一受体在肿瘤中的作用引发了关注(图 2b)。GPR81在包括胰腺癌、结肠癌、肝癌、乳腺癌、肺癌和宫颈癌等多种肿瘤中的表达都有上调[25-27], 在其中大多数肿瘤中, GPR81的表达水平与肿瘤的生长和转移相关。乳酸活化GPR81可促进肿瘤细胞生长, 干扰GPR81表达能特异性导致依赖乳酸作为能量来源的肿瘤细胞的死亡[25]。乳酸激活的GPR81还是肿瘤细胞一类重要的生存信号, 对于肿瘤细胞有多方面的影响。在宫颈癌细胞中, 乳酸激活GPR81受体可促进DNA修复、介导化疗药耐药[26]; GPR81的活化还可通过增加促血管形成因子双调蛋白(amphiregulin)的分泌促进血管新生, 这一过程与细胞内PI3K/AKT信号通路相关[27]。此外, GPR81可以调控乳酸转运体MCT1和MCT4的表达, 促进乳酸在细胞内外的穿梭, 提示存在乳酸激活的正反馈作用[25]。
1.2 琥珀酸琥珀酸(succinate)是TCA循环的中间代谢物, 由α-KG经琥珀酰辅酶A转变为琥珀酸后, 被琥珀酸脱氢酶(succinate dehydrogenase, SDH)进一步转化为延胡索酸。琥珀酸在肿瘤中的功能引起关注, 主要是因为在肿瘤中发现了SDH失活突变, 能导致肿瘤细胞内琥珀酸的累积。
1.2.1 竞争性抑制双加氧酶目前, 在副神经节瘤、肾癌和胃肠道间质瘤等多种肿瘤中均发现了SDH基因的失活突变。SDH失活能引起肿瘤组织中琥珀酸水平异常升高。琥珀酸直接促肿瘤的作用已经有相当多的研究证据, 但是作用机制的认识还比较有限。现有的认识主要是通过影响一系列依赖Fe2+和α-KG的双加氧酶的功能实现的。琥珀酸与α-KG结构相似, 可通过与α-KG竞争, 抑制α-KG依赖的酶活[28]。目前证实受到影响的双加氧酶除了上文提到的PHD2 (图 1a), 还包括含有Jumonji C结构域的组蛋白去甲基化酶(lysine demethylases, KDMs) (图 1b)以及DNA去甲基化酶TET (ten-eleven translocation enzymes) (图 1c)。这些酶功能的改变, 能引起一系列促肿瘤的信号通路改变。如前文所述抑制PHD2能增强HIF-1α的蛋白稳定性, 造成一种假缺氧效应[29, 30]; 抑制TET和KDMs则能分别影响DNA和组蛋白赖氨酸残基的甲基化修饰, 引起基因转录改变[31, 32]。
1.2.2 激活细胞膜受体GPR91琥珀酸还可与细胞膜上特异性受体相结合发挥功能。同乳酸的细胞膜受体类似, 琥珀酸的受体GPR91 (也被称为succinate receptor 1, SUCNR)也是一类G蛋白偶联受体, 它的活化能激发细胞内钙离子的释放, 抑制环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的产生[33]。在小鼠中, GPR91主要表达在肾、肝、脾和小肠等组织中[33]。关于GPR91在肿瘤中的功能研究较少, 主要的研究聚焦于肿瘤微环境。研究发现, 琥珀酸可通过GPR91介导血管内皮细胞信号转导及转录激活因子3 (signal transducer and activator of transcription 3, STAT3)和细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)信号通路的活化, 上调VEGF的表达进而促进血管新生[34] (图 2b)。另外, GPR91在树突状细胞(dendritic cells, DCs)中也有表达。琥珀酸可以通过刺激GPR91促进DC细胞迁移, 并且协同Toll样受体(Toll-like receptors, TLRs)配体诱导细胞因子的表达。敲除GPR91的小鼠中, 琥珀酸激活的上述效应均能被逆转, 证实了GPR91对于琥珀酸发挥功能的重要性[35]。
1.2.3 琥珀酰化修饰琥珀酸的累积还参与了一种蛋白翻译后修饰(post-translational modifications, PTM)过程, 即赖氨酸残基的琥珀酰化修饰(succinylation)。琥珀酸可与乙酰辅酶A在琥珀酰辅酶A合成酶(succinyl-coenzyme A synthetase, SCS)催化下生成琥珀酰辅酶A, 后者可将琥珀酰基团添加到蛋白质的赖氨酸残基上进行琥珀酰化修饰[36] (图 3a)。有研究表明, 用SDH抑制剂3-硝基丙酸处理小鼠成纤维细胞可导致琥珀酰化修饰增加, 证实了琥珀酰化修饰与琥珀酸的增加有关[37]。蛋白的琥珀酰化修饰广泛存在于细胞质和细胞核蛋白中, 已经在包括组蛋白在内的多种蛋白质上发现了琥珀酰化修饰[38]。目前关于琥珀酰化修饰功能的认识还十分局限, 研究较多的是其可能参与全局性的细胞代谢调控, 因为很多细胞代谢酶都存在琥珀酰化修饰[37]。然而关于琥珀酰化修饰对肿瘤相关信号通路调控的功能知之甚少。最近的研究发现, α-KG脱氢酶复合物偶联组蛋白乙酰基转移酶2A (lysine acetyltransferase 2A, KAT2A)能够介导组蛋白H3K79位点琥珀酰化, 参与多个肿瘤生长相关信号分子的转录并促进肿瘤的生长[39], 但该研究中介导琥珀酰化修饰的琥珀酰辅酶A主要来自于α-KG, 琥珀酸的累积导致的琥珀酰化修饰的增加是否同样参与该过程尚不清楚。

|
Figure 3 Metabolite-mediated post-translational modifications. a: Succinate regulates downstream signaling pathways viasuccinylation; b: Fumarate succinates KEAP1 and glutathione to regulate redox-related signaling pathways; c: Itaconate modulates redox-related signaling pathways by the alkylation of KEAP1 and glutathione. KEAP1: Kelch-like ECH associated protein 1; NRF2: Nuclear factor erythroid 2-related factor 2; GSH: Glutathione; ATF3: Activating transcription factor 3; IκΒζ: Inhibitor of nuclear factor kappa B kinase subunit epsilon |
延胡索酸(fumarate)也是线粒体TCA循环的中间代谢物, 由琥珀酸脱氢酶催化氧化琥珀酸产生。生成的延胡索酸被延胡索酸水合酶(fumarate hydratase, FH)催化生成苹果酸。FH的突变失活, 可导致细胞内延胡索酸的累积, 与肿瘤的发生发展密切相关。研究表明, 遗传性平滑肌瘤病肾癌即是由FH的突变失活诱发[40]。近来, 对于延胡索酸促肿瘤的机制, 也有一定的认识。
1.3.1 竞争性抑制双加氧酶延胡索酸由于与琥珀酸结构类似, 也可与α-KG竞争, 抑制多种双加氧酶的活性, 从而影响表观修饰调控以及缺氧信号通路[32]。与上述机制一致, FH缺陷的肿瘤中常伴随DNA甲基化和组蛋白甲基化的升高以及HIF-1α的活化。关于HIF-1α活化的机制, 主要认为是与延胡索酸对PHD2的竞争性抑制相关(图 1a); 也有研究认为, 延胡索酸的累积与琥珀酸酯化修饰有关(见下节), 这一作用可能参与了FH缺陷的肿瘤中活性氧(reactive oxygen species, ROS)升高, 进一步增加HIF-1α的稳定性[41]。
1.3.2 琥珀酸酯化修饰延胡索酸是一类α, β-不饱和羰基化合物, 能够自发地与蛋白质的半胱氨酸残基的巯基发生迈克尔加成反应, 生成S-(2-琥珀酰)-半胱氨酸, 这一反应被称为琥珀酸酯化修饰(succination)[42, 43]。当前, 对琥珀酸酯化修饰的蛋白的免疫组化检测, 已经作为肾细胞癌和子宫肌瘤的诊断检查内容, 直接用于指征FH的突变情况[44, 45]。
琥珀酸酯化修饰能直接影响蛋白分子的功能, 其中研究最为广泛的是kelch样ECH相关蛋白1 (kelch-like ECH-associated protein 1, KEAP1)。KEAP1能负调控转录因子NRF2 (nuclear factor erythroid 2-related factor 2), 参与维持细胞内的氧化还原平衡[46]。在正常的生理条件下, KEAP1能够与NRF2相互作用, 促进NRF2的泛素化修饰及蛋白酶体降解; 而在氧化应激或者亲电基团存在的情况下, KEAP1-NRF2的相互作用被破坏, 导致NRF2的核转位, 促进抗氧化相关基因的转录。在FH缺陷的肿瘤中, KEAP1的155和288位的半胱氨酸残基能被琥珀酸酯化修饰, 阻碍其与NRF2相互作用, 导致NRF2下游抗氧化靶基因的转录激活[47, 48] (图 3b)。
然而, 与上述认识相悖的是, 肿瘤细胞中累积的延胡索酸也能使谷胱甘肽进行琥珀酯化修饰, 形成琥珀酸酯化谷胱甘肽(GSH+Fum, GSF) (图 3b)。GSF失去对ROS的清除作用, 导致ROS增加; 同时, GSF还可以与谷胱甘肽还原酶相互作用, 消耗还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced form of nicotinamide adenine dinucleotide phosphate, NADPH), 降低对ROS的清除能力。通过上述机制, 延胡索酸增加了线粒体内ROS的水平及HIF-1α的稳定性[41]。
延胡索酸介导的琥珀酸酯化既导致了ROS的增加, 也刺激了NRF2抗氧化信号通路的活化, 这两种看似矛盾的效应其实也不难理解。肿瘤细胞需要一定水平的线粒体ROS用于细胞增殖和压力应激, 而NRF2抗氧化途径的激活, 则避免ROS积累到更高的水平, 导致ROS相关的损伤。与上述认识一致, 下调NRF2的水平能够进一步增加细胞ROS水平, 抑制肿瘤细胞增殖[41, 49]。已有多项研究表明, NRF2介导的抗氧化信号通路可促进肿瘤恶性化[50, 51]。这些认识也提示, FH缺陷的肿瘤细胞在面对氧化应激压力时产生了一种内源性适应机制。
除此之外, 最近的一项研究利用一种能与延胡索酸竞争性结合半胱氨酸残基的化学探针, 对延胡索酸敏感的半胱氨酸残基进行了全蛋白质组范围内的分析, 发现酸性pH能促进延胡索酸对半胱氨酸残基的琥珀酸酯化修饰, 同时还发现了酵母交换型转换/蔗糖不发酵(yeast switch in mating type/sucrose non-fermentation, SWI/SNF)染色质重塑复合体中SWI/SNF相关的基质相关的肌动蛋白依赖的染色质亚家族C成员1的调节子(SWI/SNF related, matrix associated, actin dependent regulator of chromatin subfamily C member 1, SMARCC1)亚基的琥珀酸酯化修饰对于其和SNF5亚基发挥抑癌作用是必需的[52]。
1.4 (R)-2-羟基戊二酸异柠檬酸脱氢酶1/2 (isocitrate dehydrogenase 1/2, IDH1/2)是分别位于细胞质和线粒体的代谢酶, 均以同源二聚体方式存在, 以磷酸酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide phosphate, NADP+)依赖的方式, 催化异柠檬酸向α-KG转变的可逆反应。目前, 在包括脑胶质瘤、神经母细胞瘤、软骨肉瘤、胆管癌以及急性髓细胞白血病(acute myeloid leukemia, AML)在内的多种肿瘤中发现了IDH1和IDH2的突变[53-58]。IDH最常见的突变发生在其催化口袋的精氨酸残基上, 即IDH1 (R132)和IDH2 (R172或R140)[55, 58, 59]。突变的IDH1/2能够与野生型IDH结合形成异源二聚体, 产生新的酶活功能, 在NADPH存在的情况下, 进一步催化α-KG产生(R)-2-羟基戊二酸(2-hydroxyglutarate, 2-HG)。
由于2-HG与α-KG结构类似, 所以与上述提到的机制一样, 可以对依赖α-KG的多种双加氧酶产生竞争性抑制作用(图 1a~c)。其中, 已经被证实的酶包括TET家族中5-甲基胞嘧啶水解酶以及Jumonji家族的组蛋白去甲基化酶, 它们分别调控DNA和组蛋白的甲基化修饰, 进而影响基因的表达[60]。除了对DNA和组蛋白表观修饰的调控, 最近的研究发现, 2-HG可以竞争性地抑制依赖α-KG的RNA去甲基化酶——脂肪量和肥胖相关蛋白(fat mass and obesity associated, FTO)。在FTO高表达的白血病和胶质瘤细胞中, 2-HG抑制FTO酶活功能, 导致mRNA的N6-甲基腺嘌呤(m6A)修饰水平的增加, 降低MYC和CREBP转录产物的稳定性, 诱导了周期阻滞以及细胞凋亡, 显著抑制了肿瘤生长, 延长了移植瘤小鼠的生存期[61]。同时, 研究还发现, MYC信号通路高度活化的AML肿瘤对2-HG的敏感性降低, 这种肿瘤的异质性可能能够解释2-HG促进和抑制肿瘤的两种矛盾的作用。在敏感性的肿瘤细胞中, 体内外实验显示R-2HG协同化疗抑制肿瘤的生长[61]。
另外, 2-HG还可以通过非表观修饰的机制调控肿瘤相关信号通路。研究发现, 2-HG可通过抑制赖氨酸特异的组蛋白去甲基化酶4A (lysine demethylase 4A, KDM4A)促进哺乳动物雷帕霉素受体蛋白(mammalian target of rapamycin, mTOR)的活化。KDM4A是依赖α-KG的赖氨酸去甲基化酶Jumonji家族的成员, 其能特异地与mTOR1/2的负调控子含DEP结构域的mTOR相互作用蛋白(DEP domain containing mTOR interacting protein, DEPTOR)结合, KDM4A的删除或失活导致DEPTOR急剧减少, 而过表达KDM4A则降低E3连接酶诱导的DEPTOR泛素化。2-HG介导的KDM4A的抑制直接影响DEPTOR的稳定性, 导致mTOR以不依赖于PI3K/AKT/TSC1-2通路的方式活化[62]。
与琥珀酸和延胡索酸类似, 2-HG也可竞争性结合双加氧酶PHD2抑制其活性来维持HIF-1α的蛋白稳定性[60], 进而促进包括细胞增殖和存活基因、血管新生基因以及糖酵解相关基因在内的HIF关键转录靶标的转录, 促进肿瘤的发生发展。
1.5 氨基酸肿瘤细胞需要利用大量氨基酸用于生物大分子的合成, 氨基酸代谢异常也是肿瘤代谢重编程的重要内容, 主要表现为肿瘤细胞对特定非必需氨基酸的摄取增多, 转运体表达上调以及氨基酸合成或分解过程代谢酶的表达增强。
目前关于肿瘤细胞氨基酸代谢研究较多的是以谷氨酰胺(glutamine)、丝氨酸(serine)、精氨酸(arginine)为代表的非必需氨基酸和以甲硫氨酸(methionine)和亮氨酸(leucine)为主的必需氨基酸。这些氨基酸除了参与蛋白质的合成, 还有其他重要的代谢功能。如谷氨酰胺作为血液中含量最丰富的循环氨基酸[63], 可以进入三羧酸循环用于供给细胞能量并提供碳源, 为核苷和其他非必需氨基酸的合成提供氮源, 同时谷氨酰胺还可生成谷胱甘肽用于维持氧化平衡。包括胰腺癌、卵巢癌和乳腺癌在内的许多肿瘤都需要消耗大量的谷氨酰胺来维持生长[64-66]。临床研究也发现, 不同肿瘤患者血浆中谷氨酰胺的含量显著低于正常人群[67, 68], 提示谷氨酰胺对于维持肿瘤生长具有重要作用。另外, 其他氨基酸如丝氨酸作为一碳循环的中间产物可以参与形成核苷酸, 同时此过程可以生成NADPH用于维持氧化还原平衡。精氨酸则通过参与尿素循环有助于降低体内血氨浓度。
除了代谢功能之外, 这些氨基酸还参与信号通路的调控来促进肿瘤的生长。下面将对氨基酸调控信号通路的分子机制进行阐述。
1.5.1 直接结合胞内受体激活mTOR信号通路亮氨酸和精氨酸能够直接与它们各自的受体Sestrin 1/2[69, 70]、细胞内mTORC1的精氨酸感受器(cellular arginine sensor for mTORC1, CARTOR1)[71]分别结合, 破坏受体与复合物GATOR2 (Gap activity toward Rags 2)的相互作用, GATOR2释放出来与mTOR的负调控子复合物GATOR1 (Gap activity toward Rags 1)结合, 阻碍复合物GATOR1水解Ras相关GTP结合蛋白A/B (Ras related GTP binding A/B, RAGA/B)中的GTP。通过这一机制, mTOR得以被招募并激活, 促进蛋白质合成(图 2c)。
谷氨酰胺能够通过双向逆转运体L型氨基酸转运体1 (L-type amino acid transporter 1, LAT1)外流出细胞进而协助亮氨酸的摄入。另外, 亮氨酸能够直接结合谷氨酸脱氢酶(glutamate dehydrogenase, GDH), 促进谷氨酰胺分解。谷氨酰胺的分解能促进GTP与RAGA/B结合, 进而促进mTOR的招募与激活[72]。
与亮氨酸与精氨酸类似, 甲硫氨酸经甲硫氨酸腺苷转移酶催化生成的衍生物S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)能够与它的受体mTORC1上游的SAM感受器(S-adenosylmethionine sensor upstream of mTORC1, SAMTOR)直接结合, 进而解除GATOR1对mTOR的抑制作用, 发挥其促进蛋白质合成的功能(图 2c)[73]。
1.5.2 参与甲基化修饰甲硫氨酸衍生物SAM可以为核酸和组蛋白的甲基化修饰提供甲基供体, 进而调控肿瘤细胞癌基因与抑癌基因的表达; 丝氨酸通过参与嘌呤合成途径和甲硫氨酸循环途径支持SAM的合成[74]。研究表明, 丝氨酸缺乏能导致SAM水平下降[75]。在KRAS突变的肿瘤中敲除掉肝激酶B1 (liver kinase B1, LKB1)可导致丝氨酸合成增加, 进而导致细胞对DNA甲基转移酶抑制剂敏感, 这提示了依赖丝氨酸/SAM的甲基化修饰对肿瘤细胞的存活具有重要意义[76]。
1.6 乙酰辅酶A乙酰辅酶A是多条代谢通路的中心代谢产物, 它可以通过多种途径生成, 包括糖酵解产物丙酮酸的氧化脱羧, 长链脂肪酸的氧化或者某些氨基酸的氧化分解等。产生的乙酰辅酶A进入TCA循环与草酰乙酸缩合形成柠檬酸, 经线粒体穿梭进入细胞质, 再通过ATP-柠檬酸裂解酶(ATP citrate lyase, ACLY)生成乙酰辅酶A。细胞质中的乙酰辅酶A可以参与脂质的合成。研究表明, 抑制ACLY能够抑制肿瘤的生长[77], 提示了乙酰辅酶A对于肿瘤发生发展的重要作用。
除了代谢功能, 乙酰辅酶A还为蛋白质的乙酰化修饰提供乙酰基供体。有研究表明, 乙酰辅酶A的丰度与组蛋白乙酰化修饰的总体水平相关[78]。缺糖刺激可降低脑胶质瘤细胞中乙酰辅酶A水平及组蛋白乙酰化修饰水平; 而补充外源醋酸盐通过乙酰辅酶A合成酶催化生成乙酰辅酶A, 则可恢复组蛋白乙酰化修饰水平[79, 80]。乙酰辅酶A可通过影响组蛋白乙酰化修饰调控的基因转录, 影响细胞黏附、骨架重排和细胞外基质相互作用等[81]。
1.7 胆固醇脂质合成增加是肿瘤细胞代谢重编程的特征之一, 导致肿瘤细胞内胆固醇(cholesterol)水平的累积[82]。胆固醇的合成首先是由乙酰辅酶A通过甲羟戊酸途径合成羊毛醇, 再由羊毛醇经过Bolch途径生成胆固醇; 胆固醇合成过程中的限速酶是3-羟基3-甲基戊二酰辅酶A (3-hydroxy-3-methylglutaryl-coenzyme A, HMG-CoA)还原酶, 它催化HMG-CoA生成甲羟戊酸的过程。研究表明, 肿瘤细胞的HMG-CoA还原酶表达升高以及低密度脂蛋白受体表达增强, 导致胆固醇水平累积以及胆固醇消耗水平升高[82]。
胆固醇是雌激素和雄激素的前体物质。雌激素和雄激素能够分别与雌激素受体和雄激素受体结合, 激活下游3-磷酸肌醇激酶(phosphoinostitide-3-kinase, PI3K)、丝裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)等信号通路, 促进乳腺癌和前列腺癌的发生发展[83, 84]; 另外, 最近的研究发现, 在一些乳腺癌的动物模型中胆固醇代谢物27-羟胆固醇(27-hydroxycholesterol, 27HC)能够直接与雌激素受体结合促进肿瘤生长[85, 86]。27HC也可以通过与一种转录因子——肝X受体结合促进乳腺癌转移[85]。抑制小鼠模型的27HC产生时, 胆固醇对肿瘤生长的促进作用减弱[85]。这些研究结果提示, 胆固醇的代谢产物是雌激素受体阳性乳腺癌的驱动因素之一。
1.8 前列腺素E2前列腺素E2 (prostaglandin E2, PGE2)是前列腺素家族的一员。同其他前列腺素家族成员一样, PGE2的合成来源于花生四烯酸。PGE2的合成需要多种酶的参与, 其中环加氧酶2 (cyclooxygenase 2, COX2)与微粒体前列腺素E2合酶1 (microsomal prostaglandin E2 synthase 1, mPGES1)分别催化了PGE2合成反应的第一步与最后一步, 是合成通路的关键限速酶。同时, 15-羟基前列腺素脱氢酶(15-hydroxyprostaglandin dehydrogenase, 15-PGDH)可以催化PGE2转变为无活性的15-酮基前列腺素E2 (15-keto-PGE2), 介导前列腺素失活[87]。有研究发现, 在肿瘤组织中COX2及mPGES1的表达上调, 而15-PGDH的表达下调, 可能导致PGE2在肿瘤组织中的累积[88]。如在前列腺癌中常常发现COX2的表达上调, 且其表达与前列腺癌的侵袭转移呈正相关[89]。同时, 在多种肿瘤中发现了PGE2的上调, 并且PGE2的水平与患者的生存率呈负相关[90], PGE2可以促进肿瘤细胞的增殖与侵袭转移[91]。下面将对PGE2的作用机制进行介绍。
前列腺素受体(prostaglandin receptor, EP)家族包含4个成员, 即EP1、EP2、EP3与EP4, 均是G蛋白偶联受体。每种EP都可以与特异的G蛋白结合从而激活特定下游信号通路, 发挥不同的生物学功能。EP1的激活可以上调细胞内的钙离子浓度; EP2与EP4可以形成异源二聚体从而促进二级信使环化腺苷酸(cyclic adenosine monophosphate, cAMP)的合成; EP3可以通过与G蛋白结合的途径上调cAMP的水平, 发挥多种功能[92]。通过与EP结合, PGE2可以激活多种下游信号通路, 如蛋白激酶C (protein kinase C, PKC)[93]、SRC[94]、核因子受体kappa B (nuclear factor-kappa B, NF-κB)[94]、PI3K[91]、MAPK[94]信号通路等, 促进肿瘤细胞的增殖与侵袭转移等一系列恶性化表型。
1.9 腺苷酸腺苷酸(adenosine)是一类嘌呤核苷酸, 在多种病理过程中发挥重要功能。研究表明, 在缺氧和缺血压力刺激下, 肿瘤微环境中腺苷酸的含量会升高[95, 96]; 细胞外腺苷酸的产生主要由细胞外ATP经两种外核苷酸酶CD39和CD73分解生成, 目前已发现在不同类型肿瘤中均有CD73的高表达, 并且CD73的高表达也发现与预后差、转移率高具有相关性[97]。这些研究提示, 腺苷酸的产生与肿瘤的发生发展密切相关。
腺苷酸能够与4种G蛋白偶联受体亚型(A1、A2A、A2B和A3)直接结合激活下游信号通路。其中A1腺苷酸受体偶联Go蛋白, Go蛋白的活化能激活磷脂酶Cβ, 产生二级信使1, 4, 5-三磷酸肌醇(inositol-1, 4, 5-trisphosphate, IP3)和甘油二酯(diacylglycerol, DAG), 导致PKC活化; A2A和A2B腺苷酸受体偶联Gs/Golf蛋白, Gs/Golf蛋白的活化能够激活腺苷酸环化酶进而导致cAMP的累积, cAMP作为二级信使介导信号传导; A2B腺苷酸受体还能够与Gq蛋白偶联, 后者能够通过磷脂酶C依赖与不依赖的途径介导c-Jun N末端激酶(c-Jun N-terminal kinases, JNK)和丝裂原激活蛋白激酶P38 (mitogen-activated protein kinase P38, P38)的活化[98]; A3腺苷酸受体与Gq/11蛋白偶联, Gq/11蛋白的活化可通过激活磷脂酶Cγ增加PKC的活性[99]。
2 肿瘤微环境来源的代谢物除了肿瘤自身来源的代谢物, 肿瘤微环境中还浸润着多种其他来源的代谢物。这些代谢物也可参与肿瘤细胞的代谢过程并且调控肿瘤相关信号通路, 进而影响肿瘤的发生发展[100]。本文主要对肿瘤微环境中其他来源的代谢物对肿瘤信号通路的调控进行介绍。
2.1 短链脂肪酸短链脂肪酸由乙酸、丙酸和丁酸组成, 主要存在于结肠中, 在结肠腔内经微生物分解膳食纤维后产生, 总浓度高达50~100 mmol·L-1。结肠腔中的短链脂肪酸在保护结肠和肿瘤预防方面发挥了重要作用[101, 102]。关于短链脂肪酸如何影响脂代谢已经有了一定的认识。如乙酸和丙酸可以参与肝脏的脂质合成。乙酸可转化成为乙酰辅酶A, 作为脂肪酸合酶的底物而合成脂肪酸; 丙酸则可通过下调脂肪酸合酶来抑制脂质合成[101]。乙酸和丙酸的平衡是结肠中维持脂质及胆固醇平衡的重要因素。
短链脂肪酸在肿瘤中的研究集中于丁酸(butyrate)。丁酸主要由厚壁菌门细菌产生, 是肠道黏膜的重要能量物质之一。丁酸是一类抑癌代谢物, 有研究发现, 结肠癌患者体内产生丁酸的菌群相比正常人要少。菌群失调导致的丁酸的减少被认为可能是结肠癌发生发展的关键机制之一[103]。丁酸发挥抑癌作用主要通过对肿瘤相关信号通路的调控实现[104], 其调控的机制主要有两种, 一是通过调控组蛋白乙酰化修饰, 进而影响肿瘤增殖或凋亡相关的基因表达[103] (图 1d); 二是直接激活其细胞膜受体GPR109A及下游信号通路发挥抑肿瘤作用(图 2b)。
2.1.1 调控组蛋白乙酰化修饰丁酸对组蛋白乙酰化修饰的调控比较复杂, 与其浓度密切相关。以往研究表明, 低浓度的丁酸能够促进细胞增殖, 而高浓度的丁酸则诱导细胞的凋亡, 这种差异可能与丁酸对组蛋白乙酰化修饰影响的机制不同有关。一般情况下, 较低浓度丁酸(0.5 mmol·L-1)能够进入线粒体内进行β-氧化, 产生的乙酰辅酶A可以与草酰乙酸缩合形成柠檬酸, 后者通过线粒体穿梭, 在细胞质和细胞核中被ATP-柠檬酸裂解酶分解产生乙酰辅酶A。乙酰辅酶A是组蛋白乙酰转移酶(histone acetyltransferases, HATs)的重要辅因子, 为组蛋白乙酰化修饰提供乙酰基[105], 因而低浓度的丁酸可以增强HAT的功能[106]。当丁酸浓度超过5 mmol·L-1时, 由于细胞已经达到了氧化代谢丁酸能力的上限(1~2 mmol·L-1), 丁酸无法在线粒体内被代谢掉, 导致在细胞内积累。累积的丁酸可竞争性抑制组蛋白去乙酰化酶(histone deacetylases, HDACs)的活性[106]。由于HAT与HDAC对基因调控的偏好性不同, HAT更易调控增殖相关基因, 而HDAC偏向于调控凋亡相关基因, 导致了高低浓度下丁酸导致的细胞效应的差异。事实上, 上述机制在正常组织更新和稳态维持中也发挥重要作用。在正常肠道组织中, 随着黏液由腺窝基底部流向肠腔, 菌群产生的丁酸在肠腔内累积, 可诱导该部位结肠细胞的凋亡, 脱落至肠腔; 而在腺窝基底部丁酸浓度则较低, 促进细胞的增殖。丁酸通过这两种机制共同作用进行结肠上皮组织的更新, 维持肠道稳态[107]。
在结肠癌细胞中, 由于糖酵解增强, 丁酸的氧化代谢功能受损。无论微环境中丁酸浓度高低, 丁酸均能够在肿瘤细胞内积累发挥HDAC抑制剂的活性促进多个促凋亡基因, 如周期素依赖的激酶抑制因子1A (cyclin dependent kinase inhibitor 1A, CDKN1A)、BCL2相关X蛋白(BCL2 associated X, BAX)和细胞表面死亡受体FAS (Fas cell surface death receptor, FAS)基因的转录进而诱导肿瘤细胞的凋亡[103, 108]。此外, 也有报道提示, 活化的免疫细胞也能发生糖酵解的代谢转变[109], 因而丁酸对肿瘤微环境中的免疫系统也具有抑制HDAC活性的作用。研究发现, 丁酸可以影响T细胞的分化, 尤其是调节性T细胞(Treg)的分化。在这一过程中, 丁酸通过抑制蛋白去乙酰化酶, 导致Treg细胞的激活分子叉头框蛋白P3 (forkhead box P3, Foxp3)启动子区组蛋白乙酰化修饰的升高, 进而表达上调, 导致Treg的分化增加, 抑制了T细胞依赖的肠炎的发生[110]。通过对肿瘤自身和免疫系统信号通路的调控, 丁酸在抑制肿瘤的发生发展中发挥了重要作用。
2.1.2 激活细胞膜G蛋白偶联受体据报道, 丁酸还可以直接激活细胞膜G蛋白偶联受体GPR109A发挥抑癌作用。GPR109Α是一类G蛋白偶联受体, 通过cAMP和磷脂酰肌醇信号通路发挥作用。GPR109Α是一种抑癌基因, 其在正常结肠上皮细胞中表达较高, 而在结肠癌中表达较低[111]。另外在抗原呈递细胞, 如巨噬细胞、树突状细胞中, 该受体也有表达[112]。研究表明, 丁酸可以通过激活肿瘤和免疫细胞膜上的GPR109A受体, 发挥抗炎作用并且抑制结肠癌的发生发展[111, 112]。
除GPR109A之外, GPR41和GPR43也是包括丁酸在内的短链脂肪酸的受体。GPR41的激活可以诱导瘦素和肽YY (peptide YY)的产生, 参与饮食行为的调节[113]; 而GPR43 (图 2b)则与GPR109A类似, 被认为是一类肿瘤抑癌基因, 在结肠癌细胞中表达下调[114]。研究表明, 短链脂肪酸激活肠道上皮细胞膜上的GPR43和GPR109A受体可以刺激钾离子的外流以及细胞膜的超级化, 导致NOD样受体3 (NOD like receptor 3, NLRP3)炎性小体的激活[115], 炎性小体的激活能促使肠道上皮细胞进行修复, 维持细胞存活, 抵御肠炎刺激物的压力, 维持肠道稳态[115-117]; 另外GPR43在免疫细胞中也有表达, 短链脂肪酸通过对结肠Treg细胞膜受体GPR43的激活来调节Treg群的大小和功能, 进而发挥抗炎功能[118]。
2.2 衣康酸衣康酸(itaconate)是巨噬细胞活化时产生的代谢物[119]。当巨噬细胞受到炎性刺激物如脂多糖(lipopolysaccharide, LPS)刺激时, 代谢酶免疫应答基因1 (immunoresponsive gene 1, IRG1)的表达会升高, IRG1能催化三羧酸循环中间产物顺乌头酸生成衣康酸[119]。直到2016年, 衣康酸对巨噬细胞的免疫调节功能才开始被报道。研究发现, 衣康酸是一类重要的抗炎代谢物, 能够负调控炎症效应以及炎性因子的产生[119-121], 是一种巨噬细胞激活的负反馈机制。有证据提示, IRG1基因敲除的小鼠的巨噬细胞不能产生衣康酸, 当其被LPS刺激活化时, 其分泌炎性因子显著高于野生型小鼠[119]。衣康酸可以分泌到巨噬细胞外, 但是目前尚未发现衣康酸对肿瘤细胞的直接调控作用, 其主要是通过调节巨噬细胞的免疫功能来影响肿瘤的发生发展。
2.2.1 抑制琥珀酸脱氢酶衣康酸发挥抗炎效应的机制之一是通过底物竞争机制抑制SDH发挥作用[119] (图 1e)。已有报道发现, 在活化的巨噬细胞中, SDH可氧化琥珀酸, 产生ROS, 进而稳定HIF-1α。HIF-1α水平的升高可以进一步促进包括白介素1β (interleukin-1β, IL-1β)、白介素18 (interleukin-18, IL-18)等炎性因子的表达, 诱发炎症效应[122]。分子与细胞水平的实验均证实, 衣康酸能抑制SDH的活性, 提示SDH可能是衣康酸发挥抗炎效应的机制。
2.2.2 烷基化修饰半胱氨酸残基值得注意的是, 衣康酸对SDH的结合能力相对较弱, 其对SDH的抑制活性远低于经典的SDH抑制剂丙二酸[120, 123, 124], 而丙二酸的抗炎活性却远不如衣康酸, 提示衣康酸极有可能通过其他机制发挥抗炎效应。目前研究发现, 衣康酸可以通过蛋白的翻译后修饰机制调控炎症相关信号通路, 进而发挥抗炎作用。由于衣康酸是一类α, β-不饱和羧酸, 与延胡索酸类似, 它可以与蛋白分子的半胱氨酸残基发生迈克尔加成反应生成2, 3-二羧丙基加成物。Mills与其同事[120]发现, IRG1催化生成的衣康酸可以通过线粒体内膜上的二羧酸、柠檬酸和氧化戊二酸载体由线粒体基质转运到细胞质, 细胞质中的衣康酸可以对NRF2的负调控子KEAP1进行烷基化修饰抑制其介导的NRF2的降解作用, NRF2得以累积并进入细胞核内, 激活抗氧化和抗炎相关基因的转录(图 3c)。同年, 另外一个研究发现, 衣康酸以及其具有膜渗透能力的衍生物衣康酸二甲酯还可以对谷胱甘肽进行烷基化修饰, 使其失去清除ROS的能力, 进而诱导NRF2的活化, 发挥抗炎效应; 同时, 该研究也发现, 衣康酸造成的亲电压力也可以通过激活活化转录因子3 (activating transcription factor 3, ATF3)抑制核因子kappa B激酶抑制剂ζ亚基(inhibitor of nuclear factor kappa B kinase subunit epsilon, IκΒζ)的转录活性, 进而选择性地抑制炎性因子白介素6 (interleukin-6, IL-6)的释放, 而对肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)则无影响[121] (图 3c)。
目前关于衣康酸的研究主要聚焦于其对巨噬细胞免疫功能调控的机制。最近的一项研究发现, 在腹膜肿瘤(B16黑色素瘤和ID8卵巢癌)中, 肿瘤浸润的巨噬细胞能够通过释放衣康酸来促进肿瘤的生长[125]。肿瘤组织浸润的巨噬细胞的IRG1表达升高, 导致衣康酸产生增加。衣康酸可以增强肿瘤浸润巨噬细胞的脂肪酸氧化代谢, 增加线粒体ROS的产生; 肿瘤浸润巨噬细胞产生的ROS可以导致肿瘤细胞MAPK信号通路的活化, 促进肿瘤的发展[125]。更多关于衣康酸对肿瘤发生发展影响的研究还需进一步深入。
2.3 维生素维生素(vitamins)是人类生存必需的营养物质。近年来, 越来越多的研究表明维生素在肿瘤的预防和治疗中具有重要作用。维生素主要分为脂溶性(A、D、E和K)和水溶性(C和维生素B复合物)两大类, 其中在肿瘤信号通路调控领域研究较多的是维生素A和D。
维生素A主要从食物中获得, 其代谢产物维甲酸(retinoic acid)对抑制肿瘤的发生发展具有重要作用。有研究表明, 维甲酸在体内外都能显著诱导部分肿瘤细胞系的生长阻滞、凋亡和去分化。在包括血液病、乳腺癌、皮肤癌、前列腺癌等多种肿瘤中, 维生素A与维甲酸的稳态都发生了改变。在乳腺癌和卵巢癌中均发现维生素A到维甲酸的代谢通路受损, 提示维生素A代谢的异常可能促进了肿瘤的发生发展[126, 127]。维甲酸对肿瘤的作用主要通过两种核受体——维甲酸受体(retinoic acid receptors, RARs)和维甲酸X受体(retinoid X receptors, RXRs)介导。研究发现, 在部分癌种的癌前以及癌组织中, RAR-β的表达水平低于正常组织, 而外源加入其配体13-顺-维甲酸则能上调RAR-β的表达水平, 因而维甲酸被认为能够预防和抑制肿瘤的发生发展[128], 目前, 全反式维甲酸(一类天然维甲酸)已被FDA批准用于治疗急性早幼粒细胞白血病[128]。尽管维甲酸对于肿瘤的治疗已见成效, 但对于维甲酸的作用机制目前认识仍十分局限。已有研究认为维甲酸激活维甲酸受体可以促进多种凋亡相关基因的上调, 如BAX、CDKN1A等[129], 但未来针对这一问题仍需更深入的研究。
维生素D能够通过食物和紫外线(阳光)照射获得, 是一类脂溶性化合物, 主要参与骨骼的发育。流行病学研究提示, 维生素D缺乏增加肿瘤发生几率以及降低预后效果, 但这一结论仍需更多实验证实[130]。维生素D需要通过代谢才能发挥功能, 它首先在肝脏中被羟化生成25-羟维生素D [25-hydroxyvitamin D, 25(OH)D], 之后在肾脏被1-α-羟化酶催化生成1α, 25-二羟维生素D [1α, 25-dihydroxyvitamin D, 1, 25(OH)2D]。1, 25(OH)2D是维生素D的活化形式, 主要通过结合维生素D受体(vitamin D receptors, VDRs)发挥功能, 参与肿瘤增殖、凋亡、分化、侵袭转移、血管新生等多条信号通路的调控。VDRs是一类转录因子, 当1, 25(OH)2D与VDR结合后, 可刺激VDR和RXR形成二聚体, 进而与靶基因的启动子和增强子区域的维生素D效应元件(vitamin D response elements, VDREs)结合, 招募共活化子或共负调控子调控靶基因的转录[130]。VDR参与多个肿瘤相关基因转录的调控, 可上调CDKN1A、细胞周期蛋白依赖性蛋白激酶抑制因子1B (cyclin dependent kinase inhibitor 1B, P27)、BAX等抑癌基因, 下调CDKs、cyclins、MYC、BCL-2、VEGF等促癌基因, 发挥抗肿瘤活性(图 2d)。
2.4 微量元素微量元素也是一类从食物中获得的人类所必不可少的营养物质, 近年来, 越来越多的研究表明, 微量元素也参与肿瘤的发生发展, 这里针对研究较为广泛的钙离子(calcium)和铁离子(iron)进行阐述。
钙离子可以结合钙离子结合蛋白(calcium-binding proteins, CBPs), 促进CBPs与p53及细胞骨架蛋白形成复合物, 诱导细胞外基质的降解[131], 促进肿瘤发生发展。在多种肿瘤中都发现了CBPs的上调[132], 提示干预钙离子与CBPs的结合具有肿瘤治疗潜力, 目前相关临床试验正在开展(ClinicalTrials.gov, NCT03123978)。进一步研究发现, 钙离子不仅发挥促进肿瘤生长的作用, 钙离子还可以与钙离子受体(calcium-sensing receptors, CaSRs)结合, 发挥抑制肿瘤生长的作用[133]。在结肠组织中, CaSRs被钙离子激活后通过激活下游信号通路诱导结肠细胞的分化, 抑制细胞增殖, 从而发挥抑癌基因的功能[134]。与之类似的是, 在乳腺癌中钙离子可以激活CaSRs诱导乳腺癌细胞的分化与死亡。另外, 有研究表明激活CaSRs还可以增敏化疗[135]。由于钙离子功能的复杂性, 对其进行更深入的研究将有助于相关靶向药物的研发及临床患者的治疗。
除了钙离子, 铁离子在肿瘤的生长中也扮演了重要的作用。在多种类型的肿瘤中都发现有铁离子外排转运体(ferroportin, FPN)的表达下调[136, 137], 同时伴有转铁蛋白受体1 (transferrin receptor 1, TFR1)的表达升高[138], 导致铁离子在肿瘤细胞内的累积。有研究发现, 铁离子的累积可以促进肿瘤生长, 通过饮食或使用铁离子的螯合剂剥夺铁离子则会抑制肿瘤的生长[139]。相关的作用机制目前认识还比较有限, 铁离子通过影响铁离子依赖的核糖核苷酸还原酶, 影响脱氧核糖核苷酸的合成, 是重要作用机制之一[140]。与上述机制一致, 细胞内高浓度的铁离子是DNA复制及细胞的增殖必需的, 使用铁离子螯合剂可以显著地通过降低细胞增殖速率而抑制肿瘤生长; 在缺乏铁离子的状态下, 肿瘤细胞会产生G1/G0期细胞周期阻滞。
3 展望对于肿瘤细胞中代谢异常的认识, 最早可以追溯到上世纪20年代。2011年, 细胞杂志发表的“肿瘤的新十大特征(Hallmarks of Cancer: The Next Generation)”一文, 正式将肿瘤细胞代谢异常列为肿瘤十大特征之一。自此, 肿瘤细胞的代谢改变在肿瘤发生发展中的作用的认识被提升到一个新的高度。随后, 越来越多的证据表明, 肿瘤代谢通路的异常几乎涵盖了代谢网络中的各个信号通路, 包括有氧糖酵解、线粒体代谢、脂肪酸代谢、氨基酸代谢、尿素循环、精氨酸代谢等。现有的研究主要集中在从代谢通路变化导致的能量和物质供给的角度, 揭示上述代谢变化如何贡献于肿瘤的发生发展和恶性化进程。
近来, 以2-HG为代表的癌代谢物的概念的提出, 针对肿瘤代谢物的肿瘤治疗潜力得到广泛关注。特别是随着对癌代谢作用机制的不断深入, 相关的研究也已经拓展到代谢通路本身之外更广阔的领域。代谢物除了是代谢网络中的一个环节, 是代谢流向和流动速率的反映, 还可以作为信号分子直接或间接地影响其他肿瘤信号通路中的关键分子。抑制癌代谢产物2-HG的产生, IDH2突变体抑制剂enasidenib对具有相应突变的急性髓性白血病展现出良好的治疗效果, 被美国FDA批准上市, 成为第一个针对癌代谢物的抗肿瘤药物。该药物的成功上市, 提示了靶向异常肿瘤代谢产物及其激活的信号通路具有巨大的治疗潜力。由于代谢通路自身往往具有繁多的代偿通路, 因而针对肿瘤异常代谢通路自身往往很难取得良好的疗效, 事实上许多靶向代谢通路的抑制剂都疗效欠佳。抑制癌代谢物引起的信号通路激活可能具有更显著的抗肿瘤作用。为此, 需要对代谢物引起的信号通路激活进行更为深入的研究, 明确代谢物激活信号通路的机制, 从而辅助靶点的选择与药物设计, 从肿瘤代谢异常的角度开发肿瘤治疗方案。
当前, 该领域的研究可以说才刚刚起步。从上文可见, 目前揭示的癌代谢物的功能主要集中在①代谢物的竞争性抑制作用; ②代谢物直接结合于“受体分子”; ③代谢物介导的翻译后修饰(图 4)。上述作用机制, 基本符合代谢物作为化学小分子的作用特点。可以预见, 会有越来越多的代谢物被发现具有上述作用。其中, 化学结构的相似性可能是重要的研究依据。此外, 代谢物特异结合蛋白, 即所谓的“代谢物受体”是否是普遍现象, 也是非常值得关注的方向。目前已经发现了乳酸等代谢物的结合蛋白, 这些结合是否具有特异性, 是通过何种机制介导其结合, 是值得深入探讨的问题。对上述科学问题的回答, 或许可以借鉴以往对化学小分子的研究经验, 借助小分子探针结合转录、蛋白质组等组学手段以及结构生物学方法, 对代谢物的功能进行系统研究。另外, 在代谢物研究的过程中, 考虑到目前发现的代谢物在肿瘤中的主要差异体现在代谢物的累积, 因此, 应该在研究中高度关注代谢物的浓度, 即内源性代谢物的生理和病理浓度的差别。

|
Figure 4 A summary of the molecular mechanisms of metabolite-triggered oncogenic signaling in cancer. Accumulation of different metabolites triggers diverse oncogenic signaling via competitive inhibition, post-translational modifications and direct binding of the key molecules in the signaling pathway. M: Metabolites; GPR: G-protein coupled receptor; RAR: Retinoic acid receptor; CBP: Calcium-binding protein; CaSR: Calcium-sensing receptor; ECM: Extracellular matrix; CAF: Cancer-associated fibroblasts |
总之, 肿瘤相关代谢物及其相关信号通路的发现为认识代谢异常在肿瘤发生发展中的作用开辟了新的视野和更旷阔的研究空间。未来在该领域的探索可能为认识肿瘤代谢并探索其在肿瘤治疗中的机制提供重要的信息。
| [1] | Thompson CB. Metabolic enzymes as oncogenes or tumor suppressors[J]. N Engl J Med, 2009, 360: 813–815. DOI:10.1056/NEJMe0810213 |
| [2] | Yang M, Soga T, Pollard PJ. Oncometabolites: linking altered metabolism with cancer[J]. J Clin Invest, 2013, 123: 3652–3658. DOI:10.1172/JCI67228 |
| [3] | Bultman SJ, Jobin C. Microbial-derived butyrate: an oncometabolite or tumor-suppressive metabolite?[J]. Cell Host Microbe, 2014, 16: 143–145. DOI:10.1016/j.chom.2014.07.011 |
| [4] | Perez-Escuredo J, Van Hee VF, Sboarina M, et al. Monocarboxylate transporters in the brain and in cancer[J]. Biochim Biophys Acta, 2016, 1863: 2481–2497. DOI:10.1016/j.bbamcr.2016.03.013 |
| [5] | Dimmer KS, Friedrich B, Lang F, et al. The low-affinity monocarboxylate transporter MCT4 is adapted to the export of lactate in highly glycolytic cells[J]. Biochem J, 2000, 350 Pt 1: 219–227. |
| [6] | Chiche J, Le Fur Y, Vilmen C, et al. In vivo pH in metabolic-defective Ras-transformed fibroblast tumors: key role of the monocarboxylate transporter, MCT4, for inducing an alkaline intracellular pH[J]. Int J Cancer, 2012, 130: 1511–1520. DOI:10.1002/ijc.26125 |
| [7] | Manning Fox JE, Meredith D, Halestrap AP. Characterisation of human monocarboxylate transporter 4 substantiates its role in lactic acid efflux from skeletal muscle[J]. J Physiol, 2000, 529 Pt 2: 2285–293. |
| [8] | Ullah MS, Davies AJ, Halestrap AP. The plasma membrane lactate transporter MCT4, but not MCT1, is up-regulated by hypoxia through a HIF-1α-dependent mechanism[J]. J Biol Chem, 2006, 281: 9030–9037. DOI:10.1074/jbc.M511397200 |
| [9] | Hui S, Ghergurovich JM, Morscher RJ, et al. Glucose feeds the TCA cycle via circulating lactate[J]. Nature, 2017, 551: 115–118. DOI:10.1038/nature24057 |
| [10] | Hashimoto T, Hussien R, Brooks GA. Colocalization of MCT1, CD147, and LDH in mitochondrial inner membrane of L6 muscle cells: evidence of a mitochondrial lactate oxidation complex[J]. Am J Physiol Endocrinol Metab, 2006, 290: E1237–E1244. DOI:10.1152/ajpendo.00594.2005 |
| [11] | Passarella S, Paventi G, Pizzuto R. The mitochondrial L-lactate dehydrogenase affair[J]. Front Neurosci, 2014, 8: 407. |
| [12] | Brizel DM, Schroeder T, Scher RL, et al. Elevated tumor lactate concentrations predict for an increased risk of metastases in head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys, 2001, 51: 349–353. |
| [13] | Pugh CW, Ratcliffe PJ. Regulation of angiogenesis by hypoxia: role of the HIF system[J]. Nat Med, 2003, 9: 677–684. DOI:10.1038/nm0603-677 |
| [14] | Berra E, Benizri E, Ginouves A, et al. HIF prolyl-hydroxylase 2 is the key oxygen sensor setting low steady-state levels of HIF-1α in normoxia[J]. EMBO J, 2003, 22: 4082–4090. DOI:10.1093/emboj/cdg392 |
| [15] | Maxwell PH, Wiesener MS, Chang GW, et al. The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis[J]. Nature, 1999, 399: 271–275. DOI:10.1038/20459 |
| [16] | De Saedeleer CJ, Copetti T, Porporato PE, et al. Lactate activates HIF-1 in oxidative but not in Warburg-phenotype human tumor cells[J]. PLoS One, 2012, 7: e46571. DOI:10.1371/journal.pone.0046571 |
| [17] | Lu H, Forbes RA, Verma A. Hypoxia-inducible factor 1 activation by aerobic glycolysis implicates the Warburg effect in carcinogenesis[J]. J Biol Chem, 2002, 277: 23111–23115. DOI:10.1074/jbc.M202487200 |
| [18] | Lu H, Dalgard CL, Mohyeldin A, et al. Reversible inactivation of HIF-1 prolyl hydroxylases allows cell metabolism to control basal HIF-1[J]. J Biol Chem, 2005, 280: 41928–41939. DOI:10.1074/jbc.M508718200 |
| [19] | Semenza GL. Targeting HIF-1 for cancer therapy[J]. Nat Rev Cancer, 2003, 3: 721–732. DOI:10.1038/nrc1187 |
| [20] | Lee DC, Sohn HA, Park ZY, et al. A lactate-induced response to hypoxia[J]. Cell, 2015, 161: 595–609. DOI:10.1016/j.cell.2015.03.011 |
| [21] | Lee DK, Nguyen T, Lynch KR, et al. Discovery and mapping of ten novel G protein-coupled receptor genes[J]. Gene, 2001, 275: 83–91. DOI:10.1016/S0378-1119(01)00651-5 |
| [22] | Ge H, Weiszmann J, Reagan JD, et al. Elucidation of signaling and functional activities of an orphan GPCR, GPR81[J]. J Lipid Res, 2008, 49: 797–803. DOI:10.1194/jlr.M700513-JLR200 |
| [23] | Liu C, Wu J, Zhu J, et al. Lactate inhibits lipolysis in fat cells through activation of an orphan G-protein-coupled receptor, GPR81[J]. J Biol Chem, 2009, 284: 2811–2822. DOI:10.1074/jbc.M806409200 |
| [24] | Ahmed K, Tunaru S, Tang C, et al. An autocrine lactate loop mediates insulin-dependent inhibition of lipolysis through GPR81[J]. Cell Metab, 2010, 11: 311–319. DOI:10.1016/j.cmet.2010.02.012 |
| [25] | Roland CL, Arumugam T, Deng D, et al. Cell surface lactate receptor GPR81 is crucial for cancer cell survival[J]. Cancer Res, 2014, 74: 5301–5310. DOI:10.1158/0008-5472.CAN-14-0319 |
| [26] | Wagner W, Ciszewski WM, Kania KD. L- and D-lactate enhance DNA repair and modulate the resistance of cervical carcinoma cells to anticancer drugs via histone deacetylase inhibition and hydroxycarboxylic acid receptor 1 activation[J]. Cell Commun Signal, 2015, 13: 36. DOI:10.1186/s12964-015-0114-x |
| [27] | Lee YJ, Shin KJ, Park SA, et al. G-protein-coupled receptor 81 promotes a malignant phenotype in breast cancer through angiogenic factor secretion[J]. Oncotarget, 2016, 7: 70898–70911. |
| [28] | Yuan HX, Xiong Y, Guan KL. Nutrient sensing, metabolism, and cell growth control[J]. Mol Cell, 2013, 49: 379–387. DOI:10.1016/j.molcel.2013.01.019 |
| [29] | Selak MA, Armour SM, Mackenzie ED, et al. Succinate links TCA cycle dysfunction to oncogenesis by inhibiting HIF-alpha prolyl hydroxylase[J]. Cancer Cell, 2005, 7: 77–85. DOI:10.1016/j.ccr.2004.11.022 |
| [30] | Koivunen P, Hirsila M, Remes AM, et al. Inhibition of hypoxia-inducible factor (HIF) hydroxylases by citric acid cycle intermediates: possible links between cell metabolism and stabilization of HIF[J]. J Biol Chem, 2007, 282: 4524–4532. DOI:10.1074/jbc.M610415200 |
| [31] | Laukka T, Mariani CJ, Ihantola T, et al. Fumarate and succinate regulate expression of hypoxia-inducible genes via TET enzymes[J]. J Biol Chem, 2016, 291: 4256–4265. DOI:10.1074/jbc.M115.688762 |
| [32] | Xiao M, Yang H, Xu W, et al. Inhibition of α-KG-dependent histone and DNA demethylases by fumarate and succinate that are accumulated in mutations of FH and SDH tumor suppressors[J]. Genes Dev, 2012, 26: 1326–1338. DOI:10.1101/gad.191056.112 |
| [33] | He W, Miao FJ, Lin DC, et al. Citric acid cycle intermediates as ligands for orphan G-protein-coupled receptors[J]. Nature, 2004, 429: 188–193. DOI:10.1038/nature02488 |
| [34] | Mu X, Zhao T, Xu C, et al. Oncometabolite succinate promotes angiogenesis by upregulating VEGF expression through GPR91-mediated STAT3 and ERK activation[J]. Oncotarget, 2017, 8: 13174–13185. |
| [35] | Rubic T, Lametschwandtner G, Jost S, et al. Triggering the succinate receptor GPR91 on dendritic cells enhances immunity[J]. Nat Immunol, 2008, 9: 1261–1269. DOI:10.1038/ni.1657 |
| [36] | Zhang Z, Tan M, Xie Z, et al. Identification of lysine succinylation as a new post-translational modification[J]. Nat Chem Biol, 2011, 7: 58–63. DOI:10.1038/nchembio.495 |
| [37] | Park J, Chen Y, Tishkoff DX, et al. SIRT5-mediated lysine desuccinylation impacts diverse metabolic pathways[J]. Mol Cell, 2013, 50: 919–930. DOI:10.1016/j.molcel.2013.06.001 |
| [38] | Weinert BT, Scholz C, Wagner SA, et al. Lysine succinylation is a frequently occurring modification in prokaryotes and eukaryotes and extensively overlaps with acetylation[J]. Cell Rep, 2013, 4: 842–851. DOI:10.1016/j.celrep.2013.07.024 |
| [39] | Wang Y, Guo YR, Liu K, et al. KAT2A coupled with the α-KGDH complex acts as a histone H3 succinyltransferase[J]. Nature, 2017, 552: 273–277. DOI:10.1038/nature25003 |
| [40] | Menko FH, Maher ER, Schmidt LS, et al. Hereditary leiomyomatosis and renal cell cancer (HLRCC): renal cancer risk, surveillance and treatment[J]. Fam Cancer, 2014, 13: 637–644. DOI:10.1007/s10689-014-9735-2 |
| [41] | Sullivan LB, Martinez-Garcia E, Nguyen H, et al. The proto-oncometabolite fumarate binds glutathione to amplify ROS-dependent signaling[J]. Mol Cell, 2013, 51: 236–248. DOI:10.1016/j.molcel.2013.05.003 |
| [42] | Nagai R, Brock JW, Blatnik M, et al. Succination of protein thiols during adipocyte maturation: a biomarker of mitochondrial stress[J]. J Biol Chem, 2007, 282: 34219–34228. DOI:10.1074/jbc.M703551200 |
| [43] | Alderson NL, Wang Y, Blatnik M, et al. S-(2-Succinyl)cysteine: a novel chemical modification of tissue proteins by a Krebs cycle intermediate[J]. Arch Biochem Biophys, 2006, 450: 1–8. DOI:10.1016/j.abb.2006.03.005 |
| [44] | Bardella C, El-Bahrawy M, Frizzell N, et al. Aberrant succination of proteins in fumarate hydratase-deficient mice and HLRCC patients is a robust biomarker of mutation status[J]. J Pathol, 2011, 225: 4–11. DOI:10.1002/path.2932 |
| [45] | Joseph NM, Solomon DA, Frizzell N, et al. Morphology and immunohistochemistry for 2SC and FH aid in detection of fumarate hydratase gene aberrations in uterine leiomyomas from young patients[J]. Am J Surg Pathol, 2015, 39: 1529–1539. DOI:10.1097/PAS.0000000000000520 |
| [46] | Sun Z, Zhang S, Chan JY, et al. Keap1 controls postinduction repression of the Nrf2-mediated antioxidant response by escorting nuclear export of Nrf2[J]. Mol Cell Biol, 2007, 27: 6334–6349. DOI:10.1128/MCB.00630-07 |
| [47] | Adam J, Hatipoglu E, O'flaherty L, et al. Renal cyst formation in FH1-deficient mice is independent of the HIF/PHD pathway: roles for fumarate in KEAP1 succination and Nrf2 signaling[J]. Cancer Cell, 2011, 20: 524–537. DOI:10.1016/j.ccr.2011.09.006 |
| [48] | Ooi A, Wong JC, Petillo D, et al. An antioxidant response phenotype shared between hereditary and sporadic type 2 papillary renal cell carcinoma[J]. Cancer Cell, 2011, 20: 511–523. DOI:10.1016/j.ccr.2011.08.024 |
| [49] | Sourbier C, Ricketts CJ, Matsumoto S, et al. Targeting ABL1-mediated oxidative stress adaptation in fumarate hydratase-deficient cancer[J]. Cancer Cell, 2014, 26: 840–850. DOI:10.1016/j.ccell.2014.10.005 |
| [50] | Denicola GM, Karreth FA, Humpton TJ, et al. Oncogene-induced Nrf2 transcription promotes ROS detoxification and tumorigenesis[J]. Nature, 2011, 475: 106–109. DOI:10.1038/nature10189 |
| [51] | Mitsuishi Y, Taguchi K, Kawatani Y, et al. Nrf2 redirects glucose and glutamine into anabolic pathways in metabolic reprogramming[J]. Cancer Cell, 2012, 22: 66–79. DOI:10.1016/j.ccr.2012.05.016 |
| [52] | Kulkarni RA, Bak DW, Wei D, et al. A chemoproteomic portrait of the oncometabolite fumarate[J]. Nat Chem Biol, 2019, 15: 391–400. DOI:10.1038/s41589-018-0217-y |
| [53] | Paschka P, Schlenk RF, Gaidzik VI, et al. IDH1 and IDH2 mutations are frequent genetic alterations in acute myeloid leukemia and confer adverse prognosis in cytogenetically normal acute myeloid leukemia with NPM1 mutation without FLT3 internal tandem duplication[J]. J Clin Oncol, 2010, 28: 3636–3643. DOI:10.1200/JCO.2010.28.3762 |
| [54] | Abbas S, Lugthart S, Kavelaars FG, et al. Acquired mutations in the genes encoding IDH1 and IDH2 both are recurrent aberrations in acute myeloid leukemia: prevalence and prognostic value[J]. Blood, 2010, 116: 2122–2126. |
| [55] | Yan H, Parsons DW, Jin G, et al. IDH1 and IDH2 mutations in gliomas[J]. N Engl J Med, 2009, 360: 765–773. DOI:10.1056/NEJMoa0808710 |
| [56] | Amary MF, Bacsi K, Maggiani F, et al. IDH1 and IDH2 mutations are frequent events in central chondrosarcoma and central and periosteal chondromas but not in other mesenchymal tumours[J]. J Pathol, 2011, 224: 334–343. DOI:10.1002/path.2913 |
| [57] | Borger DR, Tanabe KK, Fan KC, et al. Frequent mutation of isocitrate dehydrogenase (IDH) 1 and IDH2 in cholangiocarcinoma identified through broad-based tumor genotyping[J]. Oncologist, 2012, 17: 72–79. DOI:10.1634/theoncologist.2011-0386 |
| [58] | Mardis ER, Ding L, Dooling DJ, et al. Recurring mutations found by sequencing an acute myeloid leukemia genome[J]. N Engl J Med, 2009, 361: 1058–1066. DOI:10.1056/NEJMoa0903840 |
| [59] | Parsons DW, Jones S, Zhang X, et al. An integrated genomic analysis of human glioblastoma multiforme[J]. Science, 2008, 321: 1807–1812. DOI:10.1126/science.1164382 |
| [60] | Kaelin WG Jr. Cancer and altered metabolism: potential importance of hypoxia-inducible factor and 2-oxoglutarate-dependent dioxygenases[J]. Cold Spring Harb Symp Quant Biol, 2011, 76: 335–345. DOI:10.1101/sqb.2011.76.010975 |
| [61] | Su R, Dong L, Li C, et al. R-2HG exhibits anti-tumor activity by targeting FTO/m6A/MYC/CEBPA signaling[J]. Cell, 2018, 172: 90–105. DOI:10.1016/j.cell.2017.11.031 |
| [62] | Carbonneau M, Gagné LM, Lalonde ME, et al. The oncometabolite 2-hydroxyglutarate activates the mTOR signalling pathway[J]. Nat Commun, 2016, 7: 12700. DOI:10.1038/ncomms12700 |
| [63] | Mayers JR, Vander Heiden MG. Famine versus feast: understanding the metabolism of tumors in vivo[J]. Trends Biochem Sci, 2015, 40: 130–140. DOI:10.1016/j.tibs.2015.01.004 |
| [64] | Fan J, Kamphorst JJ, Mathew R, et al. Glutamine-driven oxidative phosphorylation is a major ATP source in transformed mammalian cells in both normoxia and hypoxia[J]. Mol Syst Biol, 2013, 9: 712. DOI:10.1038/msb.2013.65 |
| [65] | Yang L, Moss T, Mangala LS, et al. Metabolic shifts toward glutamine regulate tumor growth, invasion and bioenergetics in ovarian cancer[J]. Mol Syst Biol, 2014, 10: 728. DOI:10.1002/msb.20134892 |
| [66] | Van Geldermalsen M, Wang Q, Nagarajah R, et al. ASCT2/SLC1A5 controls glutamine uptake and tumour growth in triple-negative basal-like breast cancer[J]. Oncogene, 2016, 35: 3201–3208. DOI:10.1038/onc.2015.381 |
| [67] | Hamberger A, Nystrom B, Larsson S, et al. Amino acids in the neuronal microenvironment of focal human epileptic lesions[J]. Epilepsy Res, 1991, 9: 32–43. DOI:10.1016/0920-1211(91)90044-G |
| [68] | Bode BP, Souba WW. Glutamine transport and human hepatocellular transformation[J]. JPEN J Parenter Enteral Nutr, 1999, 23: S33–S37. DOI:10.1177/014860719902300509 |
| [69] | Wolfson RL, Chantranupong L, Saxton RA, et al. Sestrin2 is a leucine sensor for the mTORC1 pathway[J]. Science, 2016, 351: 43–48. DOI:10.1126/science.aab2674 |
| [70] | Saxton RA, Knockenhauer KE, Wolfson RL, et al. Structural basis for leucine sensing by the Sestrin2-mTORC1 pathway[J]. Science, 2016, 351: 53–58. DOI:10.1126/science.aad2087 |
| [71] | Chantranupong L, Scaria SM, Saxton RA, et al. The CASTOR proteins are arginine sensors for the mTORC1 pathway[J]. Cell, 2016, 165: 153–164. DOI:10.1016/j.cell.2016.02.035 |
| [72] | Duran RV, Oppliger W, Robitaille AM, et al. Glutaminolysis activates Rag-mTORC1 signaling[J]. Mol Cell, 2012, 47: 349–358. DOI:10.1016/j.molcel.2012.05.043 |
| [73] | Gu X, Orozco JM, Saxton RA, et al. SAMTOR is an S-adenosylmethionine sensor for the mTORC1 pathway[J]. Science, 2017, 358: 813–818. DOI:10.1126/science.aao3265 |
| [74] | Newman AC, Maddocks ODK. Serine and functional metabolites in cancer[J]. Trends Cell Biol, 2017, 27: 645–657. DOI:10.1016/j.tcb.2017.05.001 |
| [75] | Maddocks OD, Labuschagne CF, Adams PD, et al. Serine metabolism supports the methionine cycle and DNA/RNA methylation through de novo ATP synthesis in cancer cells[J]. Mol Cell, 2016, 61: 210–221. DOI:10.1016/j.molcel.2015.12.014 |
| [76] | Kottakis F, Nicolay BN, Roumane A, et al. LKB1 loss links serine metabolism to DNA methylation and tumorigenesis[J]. Nature, 2016, 539: 390–395. DOI:10.1038/nature20132 |
| [77] | Hatzivassiliou G, Zhao F, Bauer DE, et al. ATP citrate lyase inhibition can suppress tumor cell growth[J]. Cancer Cell, 2005, 8: 311–321. DOI:10.1016/j.ccr.2005.09.008 |
| [78] | Mcdonnell E, Crown SB, Fox DB, et al. Lipids reprogram metabolism to become a major carbon source for histone acetylation[J]. Cell Rep, 2016, 17: 1463–1472. DOI:10.1016/j.celrep.2016.10.012 |
| [79] | Lee JV, Carrer A, Shah S, et al. Akt-dependent metabolic reprogramming regulates tumor cell histone acetylation[J]. Cell Metab, 2014, 20: 306–319. DOI:10.1016/j.cmet.2014.06.004 |
| [80] | Zhao S, Torres A, Henry RA, et al. ATP-citrate lyase controls a glucose-to-acetate metabolic switch[J]. Cell Rep, 2016, 17: 1037–1052. DOI:10.1016/j.celrep.2016.09.069 |
| [81] | Martinez-Reyes I, Chandel NS. Acetyl-CoA-directed gene transcription in cancer cells[J]. Genes Dev, 2018, 32: 463–465. DOI:10.1101/gad.315168.118 |
| [82] | Murai T. Cholesterol lowering: role in cancer prevention and treatment[J]. Biol Chem, 2015, 396: 1–11. DOI:10.1515/hsz-2014-0194 |
| [83] | Yager JD, Davidson NE. Estrogen carcinogenesis in breast cancer[J]. N Engl J Med, 2006, 354: 270–282. DOI:10.1056/NEJMra050776 |
| [84] | Locke JA, Guns ES, Lubik AA, et al. Androgen levels increase by intratumoral de novo steroidogenesis during progression of castration-resistant prostate cancer[J]. Cancer Res, 2008, 68: 6407–6415. DOI:10.1158/0008-5472.CAN-07-5997 |
| [85] | Nelson ER, Wardell SE, Jasper JS, et al. 27-Hydroxycholesterol links hypercholesterolemia and breast cancer pathophysiology[J]. Science, 2013, 342: 1094–1098. DOI:10.1126/science.1241908 |
| [86] | Wu Q, Ishikawa T, Sirianni R, et al. 27-Hydroxycholesterol promotes cell-autonomous, ER-positive breast cancer growth[J]. Cell Rep, 2013, 5: 637–645. DOI:10.1016/j.celrep.2013.10.006 |
| [87] | Mehdawi LM, Satapathy SR, Gustafsson A, et al. A potential anti-tumor effect of leukotriene C4 through the induction of 15-hydroxyprostaglandin dehydrogenase expression in colon cancer cells[J]. Oncotarget, 2017, 8: 35033–35047. |
| [88] | Zhao J, Wen S, Wang X, et al. Helicobacter pylori modulates cyclooxygenase-2 and 15-hydroxy prostaglandin dehydrogenase in gastric cancer[J]. Oncol Lett, 2017, 14: 5519–5525. |
| [89] | Ko CJ, Lan SW, Lu YC, et al. Inhibition of cyclooxygenase-2-mediated matriptase activation contributes to the suppression of prostate cancer cell motility and metastasis[J]. Oncogene, 2017, 36: 4597–4609. DOI:10.1038/onc.2017.82 |
| [90] | Asting AG, Iresjo BM, Nilsberth C, et al. Host knockout of E-prostanoid 2 receptors reduces tumor growth and causes major alterations of gene expression in prostaglandin E2-producing tumors[J]. Oncol Lett, 2017, 13: 476–482. DOI:10.3892/ol.2016.5448 |
| [91] | Du M, Shi F, Zhang H, et al. Prostaglandin E2 promotes human cholangiocarcinoma cell proliferation, migration and invasion through the upregulation of β-catenin expression via EP3-4 receptor[J]. Oncol Rep, 2015, 34: 715–726. DOI:10.3892/or.2015.4043 |
| [92] | Sugimoto Y, Narumiya S. Prostaglandin E receptors[J]. J Biol Chem, 2007, 282: 11613–11617. DOI:10.1074/jbc.R600038200 |
| [93] | Pan J, Yang Q, Shao J, et al. Cyclooxygenase-2 induced β1-integrin expression in NSCLC and promoted cell invasion via the EP1/MAPK/E2F-1/FoxC2 signal pathway[J]. Sci Rep, 2016, 6: 33823. DOI:10.1038/srep33823 |
| [94] | Lian S, Xia Y, Ung TT, et al. Prostaglandin E2 stimulates urokinase-type plasminogen activator receptor via EP2 receptor-dependent signaling pathways in human AGS gastric cancer cells[J]. Mol Carcinog, 2017, 56: 664–680. DOI:10.1002/mc.22524 |
| [95] | Stagg J, Smyth MJ. Extracellular adenosine triphosphate and adenosine in cancer[J]. Oncogene, 2010, 29: 5346–5358. DOI:10.1038/onc.2010.292 |
| [96] | Young A, Mittal D, Stagg J, et al. Targeting cancer-derived adenosine: new therapeutic approaches[J]. Cancer Discov, 2014, 4: 879–888. DOI:10.1158/2159-8290.CD-14-0341 |
| [97] | Leth-Larsen R, Lund R, Hansen HV, et al. Metastasis-related plasma membrane proteins of human breast cancer cells identified by comparative quantitative mass spectrometry[J]. Mol Cell Proteomics, 2009, 8: 1436–1449. DOI:10.1074/mcp.M800061-MCP200 |
| [98] | Vaque JP, Dorsam RT, Feng X, et al. A genome-wide RNAi screen reveals a Trio-regulated Rho GTPase circuitry transducing mitogenic signals initiated by G protein-coupled receptors[J]. Mol Cell, 2013, 49: 94–108. DOI:10.1016/j.molcel.2012.10.018 |
| [99] | Bahreyni A, Samani SS, Rahmani F, et al. Role of adenosine signaling in the pathogenesis of breast cancer[J]. J Cell Physiol, 2018, 233: 1836–1843. DOI:10.1002/jcp.25944 |
| [100] | Lyssiotis CA, Kimmelman AC. Metabolic interactions in the tumor microenvironment[J]. Trends Cell Biol, 2017, 27: 863–875. DOI:10.1016/j.tcb.2017.06.003 |
| [101] | Favier ML, Moundras C, Demigne C, et al. Fermentable carbohydrates exert a more potent cholesterol-lowering effect than cholestyramine[J]. Biochim Biophys Acta, 1995, 1258: 115–121. DOI:10.1016/0005-2760(95)00107-N |
| [102] | Rios-Covian D, Ruas-Madiedo P, Margolles A, et al. Intestinal short chain fatty acids and their link with diet and human health[J]. Front Microbiol, 2016, 7: 185. |
| [103] | Bultman SJ. Molecular pathways: gene-environment interactions regulating dietary fiber induction of proliferation and apoptosis via butyrate for cancer prevention[J]. Clin Cancer Res, 2014, 20: 799–803. DOI:10.1158/1078-0432.CCR-13-2483 |
| [104] | Fung KY, Cosgrove L, Lockett T, et al. A review of the potential mechanisms for the lowering of colorectal oncogenesis by butyrate[J]. Br J Nutr, 2012, 108: 820–831. DOI:10.1017/S0007114512001948 |
| [105] | Wellen KE, Hatzivassiliou G, Sachdeva UM, et al. ATP-citrate lyase links cellular metabolism to histone acetylation[J]. Science, 2009, 324: 1076–1080. DOI:10.1126/science.1164097 |
| [106] | Donohoe DR, Curry KP, Bultman SJ. Microbial oncotarget: bacterial-produced butyrate, chemoprevention and Warburg effect[J]. Oncotarget, 2013, 4: 182–183. |
| [107] | Donohoe DR, Collins LB, Wali A, et al. The Warburg effect dictates the mechanism of butyrate-mediated histone acetylation and cell proliferation[J]. Mol Cell, 2012, 48: 612–626. DOI:10.1016/j.molcel.2012.08.033 |
| [108] | Beyer-Sehlmeyer G, Glei M, Hartmann E, et al. Butyrate is only one of several growth inhibitors produced during gut flora-mediated fermentation of dietary fibre sources[J]. Br J Nutr, 2003, 90: 1057–1070. DOI:10.1079/BJN20031003 |
| [109] | Macintyre AN, Rathmell JC. Activated lymphocytes as a metabolic model for carcinogenesis[J]. Cancer Metab, 2013, 1: 5. DOI:10.1186/2049-3002-1-5 |
| [110] | Furusawa Y, Obata Y, Fukuda S, et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells[J]. Nature, 2013, 504: 446–450. DOI:10.1038/nature12721 |
| [111] | Thangaraju M, Cresci GA, Liu K, et al. GPR109A is a G-protein-coupled receptor for the bacterial fermentation product butyrate and functions as a tumor suppressor in colon[J]. Cancer Res, 2009, 69: 2826–2832. DOI:10.1158/0008-5472.CAN-08-4466 |
| [112] | Singh N, Gurav A, Sivaprakasam S, et al. Activation of GPR109A, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis[J]. Immunity, 2014, 40: 128–139. DOI:10.1016/j.immuni.2013.12.007 |
| [113] | Samuel BS, Shaito A, Motoike T, et al. Effects of the gut microbiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor, GPR41[J]. Proc Natl Acad Sci U S A, 2008, 105: 16767–16772. DOI:10.1073/pnas.0808567105 |
| [114] | Tang Y, Chen Y, Jiang H, et al. G-protein-coupled receptor for short-chain fatty acids suppresses colon cancer[J]. Int J Cancer, 2011, 128: 847–856. DOI:10.1002/ijc.25638 |
| [115] | Macia L, Tan J, Vieira AT, et al. Metabolite-sensing receptors GPR43 and GPR109A facilitate dietary fibre-induced gut homeostasis through regulation of the inflammasome[J]. Nat Commun, 2015, 6: 6734. DOI:10.1038/ncomms7734 |
| [116] | Dupaul-Chicoine J, Yeretssian G, Doiron K, et al. Control of intestinal homeostasis, colitis, and colitis-associated colorectal cancer by the inflammatory caspases[J]. Immunity, 2010, 32: 367–378. DOI:10.1016/j.immuni.2010.02.012 |
| [117] | Zaki MH, Boyd KL, Vogel P, et al. The NLRP3 inflammasome protects against loss of epithelial integrity and mortality during experimental colitis[J]. Immunity, 2010, 32: 379–391. DOI:10.1016/j.immuni.2010.03.003 |
| [118] | Smith PM, Howitt MR, Panikov N, et al. The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis[J]. Science, 2013, 341: 569–573. DOI:10.1126/science.1241165 |
| [119] | Lampropoulou V, Sergushichev A, Bambouskova M, et al. Itaconate links inhibition of succinate dehydrogenase with macrophage metabolic remodeling and regulation of inflammation[J]. Cell Metab, 2016, 24: 158–166. DOI:10.1016/j.cmet.2016.06.004 |
| [120] | Mills EL, Ryan DG, Prag HA, et al. Itaconate is an anti-inflammatory metabolite that activates Nrf2 via alkylation of KEAP1[J]. Nature, 2018, 556: 113–117. DOI:10.1038/nature25986 |
| [121] | Bambouskova M, Gorvel L, Lampropoulou V, et al. Electrophilic properties of itaconate and derivatives regulate the IκBzeta-ATF3 inflammatory axis[J]. Nature, 2018, 556: 501–504. DOI:10.1038/s41586-018-0052-z |
| [122] | Mills EL, Kelly B, Logan A, et al. Succinate dehydrogenase supports metabolic repurposing of mitochondria to drive inflammatory macrophages[J]. Cell, 2016, 167: 457–470. DOI:10.1016/j.cell.2016.08.064 |
| [123] | Meiser J, Kramer L, Sapcariu SC, et al. Pro-inflammatory macrophages sustain pyruvate oxidation through pyruvate dehydrogenase for the synthesis of itaconate and to enable cytokine expression[J]. J Biol Chem, 2016, 291: 3932–3946. DOI:10.1074/jbc.M115.676817 |
| [124] | Cordes T, Wallace M, Michelucci A, et al. Immunoresponsive gene 1 and itaconate inhibit succinate dehydrogenase to modulate intracellular succinate levels[J]. J Biol Chem, 2016, 291: 14274–14284. DOI:10.1074/jbc.M115.685792 |
| [125] | Weiss JM, Davies LC, Karwan M, et al. Itaconic acid mediates crosstalk between macrophage metabolism and peritoneal tumors[J]. J Clin Invest, 2018, 128: 3794–3805. DOI:10.1172/JCI99169 |
| [126] | Mira YLR, Zheng WL, Kuppumbatti YS, et al. Retinol conversion to retinoic acid is impaired in breast cancer cell lines relative to normal cells[J]. J Cell Physiol, 2000, 185: 302–309. DOI:10.1002/1097-4652(200011)185:2<302::AID-JCP15>3.0.CO;2-# |
| [127] | Williams SJ, Cvetkovic D, Hamilton TC. Vitamin A metabolism is impaired in human ovarian cancer[J]. Gynecol Oncol, 2009, 112: 637–645. DOI:10.1016/j.ygyno.2008.11.015 |
| [128] | Mamede AC, Tavares SD, Abrantes AM, et al. The role of vitamins in cancer: a review[J]. Nutr Cancer, 2011, 63: 479–494. DOI:10.1080/01635581.2011.539315 |
| [129] | Smith W, Saba N. Retinoids as chemoprevention for head and neck cancer: where do we go from here?[J]. Crit Rev Oncol Hematol, 2005, 55: 143–152. DOI:10.1016/j.critrevonc.2005.02.003 |
| [130] | Feldman D, Krishnan AV, Swami S, et al. The role of vitamin D in reducing cancer risk and progression[J]. Nat Rev Cancer, 2014, 14: 342–357. DOI:10.1038/nrc3691 |
| [131] | Mishra SK, Siddique HR, Saleem M. S100A4 calcium-binding protein is key player in tumor progression and metastasis: preclinical and clinical evidence[J]. Cancer Metastasis Rev, 2012, 31: 163–172. DOI:10.1007/s10555-011-9338-4 |
| [132] | Bresnick AR, Weber DJ, Zimmer DB. S100 proteins in cancer[J]. Nat Rev Cancer, 2015, 15: 96–109. DOI:10.1038/nrc3893 |
| [133] | Tennakoon S, Aggarwal A, Kallay E. The calcium-sensing receptor and the hallmarks of cancer[J]. Biochim Biophys Acta, 2016, 1863: 1398–1407. DOI:10.1016/j.bbamcr.2015.11.017 |
| [134] | Lipkin M. Preclinical and early human studies of calcium and colon cancer prevention[J]. Ann N Y Acad Sci, 1999, 889: 120–127. DOI:10.1111/j.1749-6632.1999.tb08729.x |
| [135] | Liu G, Hu X, Chakrabarty S. Calcium sensing receptor down-regulates malignant cell behavior and promotes chemosensitivity in human breast cancer cells[J]. Cell Calcium, 2009, 45: 216–225. DOI:10.1016/j.ceca.2008.10.004 |
| [136] | Pinnix ZK, Miller LD, Wang W, et al. Ferroportin and iron regulation in breast cancer progression and prognosis[J]. Sci Transl Med, 2010, 2: 43ra56. |
| [137] | Tesfay L, Clausen KA, Kim JW, et al. Hepcidin regulation in prostate and its disruption in prostate cancer[J]. Cancer Res, 2015, 75: 2254–2263. DOI:10.1158/0008-5472.CAN-14-2465 |
| [138] | Basuli D, Tesfay L, Deng Z, et al. Iron addiction: a novel therapeutic target in ovarian cancer[J]. Oncogene, 2017, 36: 4089–4099. DOI:10.1038/onc.2017.11 |
| [139] | Hann HW, Stahlhut MW, Menduke H. Iron enhances tumor growth. Observation on spontaneous mammary tumors in mice[J]. Cancer, 1991, 68: 2407–2410. DOI:10.1002/1097-0142(19911201)68:11<2407::AID-CNCR2820681113>3.0.CO;2-N |
| [140] | Torti SV, Torti FM. Iron and cancer: more ore to be mined[J]. Nat Rev Cancer, 2013, 13: 342–355. DOI:10.1038/nrc3495 |
 2019, Vol. 54
2019, Vol. 54


