2. 中国科学院大学, 北京 100009
2. University of Chinese Academy of Sciences, Beijing 100009, China
化疗药(chemotherapeutic agents)又称细胞毒类药物(cytotoxic drugs), 自上世纪40年代起应用于抗肿瘤治疗, 其临床应用历史悠久、适应症广, 在肿瘤药物治疗中占有重要地位。化疗药的作用机制各异, 但均是通过作用于肿瘤细胞增殖和存活所必需的关键细胞生物学事件, 实现其抗肿瘤作用。根据其作用机制不同, 化疗药可分为: ①影响DNA化学结构的药物, 如环磷酰胺、顺铂等; ②抑制核酸合成的药物, 如甲氨蝶呤、5-氟尿嘧啶等; ③作用于核酸转录的药物, 如多柔比星; ④作用于DNA复制的药物, 如喜树碱类的伊立替康、拓扑替康等; ⑤干扰有丝分裂期(mitosis)微管蛋白合成的药物, 如紫杉醇、多西他赛等。从上述作用机制可以看出, 化疗药干预的作用靶点, 通常对正常细胞也至关重要, 特别是快速分裂的正常细胞, 如小肠上皮细胞、骨髓干细胞和毛囊细胞等。这也决定了化疗药不可避免地对机体产生毒副作用, 如胃肠道毒性、血液系统毒性、脱发等。
上世纪90年代以来, 分子靶向药物的蓬勃发展, 革新了肿瘤药物治疗的理念, 开辟了肿瘤治疗的新时代。分子靶向药物的发展, 推动了特异针对肿瘤自身异常特别是癌驱动基因这一治疗策略的逐步成熟。与此同时, 分子靶向药物也超越化疗药, 成为新药研发的主流方向, 化疗药的研究陷入了相对低落的局面。新近, 肿瘤免疫疗法特别是免疫检查点抑制剂在肿瘤治疗中大放异彩, 展现出适应症广泛、获益时间长甚至治愈肿瘤等独特的优势, 掀起了肿瘤药物治疗的新一轮变革。肿瘤免疫治疗的成功提示, 针对免疫应答各个环节激活抗肿瘤免疫应答(antitumor immune response)可能带来新的治疗契机。根据以往认识, 化疗药杀伤肿瘤细胞的同时, 能释放新抗原, 激活肿瘤免疫应答, 因此掀起了化疗药与肿瘤免疫治疗联合用药的研究热潮。与此同时, 越来越多的研究提示, 化疗药对免疫系统的影响并不仅局限于上述机制, 涉及免疫应答多个环节, 作用广泛、机制复杂。化疗药与肿瘤免疫联合治疗亟需深入的机制认识。探索化疗药对免疫应答的影响, 有望拓展这类传统治疗药物的应用空间, 带来化疗药物发展的新契机。
本综述将依据免疫治疗与化疗药联用的研究现状, 重点从对免疫细胞的直接作用及肿瘤细胞免疫原性重塑两方面探讨化疗药调节肿瘤免疫应答的机制, 旨在能够加深化疗药免疫调控作用的理解, 为探索免疫治疗中化疗药的治疗空间提供理论指导。
1 化疗联合肿瘤免疫治疗研究现状对于免疫系统功能与肿瘤发生发展关系的认识由来已久, 最早可以追溯到100多年前[1]。当前, 人们对肿瘤的免疫逃逸机制已经形成了系统认识[2, 3]。肿瘤细胞可以通过释放如白细胞介素10 (interleukin-10, IL-10)、转化生长因子β (transforming growth factor β, TGF-β)及血管内皮生长因子(vascular endothelial growth factor, VEGF)等细胞因子及生长因子抑制免疫细胞功能[4, 5]或招募免疫抑制性的细胞如调节性T细胞(regulatory T cell, Treg)、骨髓来源抑制细胞(myeloid-derived suppressor cells, MDSC)等来保护自己免受免疫系统的攻击[6, 7]。近年来, 免疫检查点(immune checkpoint)在免疫逃逸中的作用受到广泛关注。免疫检查点是免疫系统的调控元件, 主要指表达于细胞表面的一系列受体, 包括细胞毒性T淋巴细胞相关蛋白4 (cytotoxic T-lymphocyte-associated protein 4, CTLA-4)、程序性细胞死亡蛋白1 (programmed death 1, PD-1)等。如表达于T细胞表面的PD-1, 可与肿瘤细胞表面表达的细胞程序性死亡配体1 (programmed cell death 1 ligand 1, PD-L1)结合, 进而抑制T细胞的激活, 阻碍细胞毒性T细胞(cytotoxic T lymphocyte, CTL)对肿瘤细胞的杀伤作用。肿瘤细胞表面可高表达PD-L1, 通过结合PD-1实现免疫逃逸。基于以上机制, 抑制免疫检查点被认为有望解锁肿瘤细胞对免疫系统的抑制作用, 激活免疫应答, 实现抗肿瘤作用。目前, 免疫检查点抑制剂主要是靶向PD-1、PD-L1和CTLA4等的各种治疗性抗体, 成为临床上肿瘤免疫治疗最成功的策略。自2011年美国FDA批准抗CTLA-4抗体伊匹单抗(ipilimumab)上市以来, 陆续有多个抗PD-1抗体, 如派姆单抗(pembrolizumab)、纳武单抗(nivolumab)及抗PD-L1抗体阿特珠单抗(atezolizumab)等相继上市, 应用于十余种肿瘤的治疗。2013年美国《科学》杂志将检查点抑制剂评为当年十大科学进展之首。
免疫检查点抑制剂获得临床成功的同时, 其临床响应率低的问题却尤为突出。目前, 在大多数肿瘤类型中, 免疫检查点抑制剂的临床响应率只有20%左右, 提示大约有80%的患者使用免疫检查点抑制剂后并不能获益[8]。为此, 通过联合用药增强免疫应答, 提高免疫治疗的响应率成为免疫治疗最重要的研究内容之一。化疗药因为人们熟知的直接杀伤肿瘤细胞的功能, 通常被认为可促进新抗原(neoantigen)的释放、促进肿瘤免疫应答, 成为与免疫检查点联用的重要组成。当前, 已有至少200项化疗药与免疫治疗联用的临床研究正在进行。值得注意的是, 目前已经完成的临床试验中, 免疫检查点抑制剂与化疗药联合用药的治疗优势并不一致, 提示了化疗与免疫治疗联用的复杂性。如在一项针对非小细胞肺癌的研究中, PD-1抗体联合卡铂、培美曲塞的响应率为91%, 显著高于PD-1抗体联用CTLA-4抗体的响应率67% (ClinicalTrials.gov, NCT02039674), 提示化疗可以增加免疫治疗的效应率。与之相对的是, 在一项包括759例患者的大规模Ⅲ期临床试验中, 非小细胞肺癌患者使用卡铂、紫杉醇联合CTLA-4抗体治疗, 联用组1年生存率为54%, 与相对单用化疗患者(53%)相比并无明显提高, 且治疗响应率(47% vs 44%)亦无明显的改善[9]。令情况变得更加复杂的是, 一项研究比较了不同剂量的PD-1抗体与卡铂、紫杉醇联用的效果, 发现与高剂量PD-1抗体联用相比, 低剂量PD-1抗体联用时患者的无进展生存期、总生存期均更长。其中, 低剂量联用组2年生存率为62%, 较高剂量组的27%有了显著的提高, 其背后的原因尚不清楚[10]。上述数据提示, 针对化疗药物与免疫抑制剂的联用, 情形可能比研究者想象的更加复杂, 需要更多的基于机制研究的理论支持和指引。
2 化疗药对免疫细胞的直接作用化疗药对免疫细胞的直接作用是化疗药调节免疫应答的重要途径。如前所述, 化疗药通过靶向细胞快速分裂所必需的生物学事件如DNA复制、纺锤体合成等发挥抗肿瘤作用。除了肿瘤细胞外, 其他快速分裂的正常细胞也会被化疗药杀伤。T细胞等多种类型免疫细胞在发挥功能时因具有快速增殖的特点, 也会成为化疗药的杀伤对象。以往研究表明, 化疗药对具有抗肿瘤作用的免疫细胞和介导肿瘤免疫逃逸的免疫抑制细胞均有作用, 这种双向调节的特点决定了化疗药引起的最终免疫应答效应可能是两方面因素平衡的结果, 而且不同化疗药的效应可能有很大差别(图 1)。以下将详细阐述化疗药对免疫细胞的直接作用。
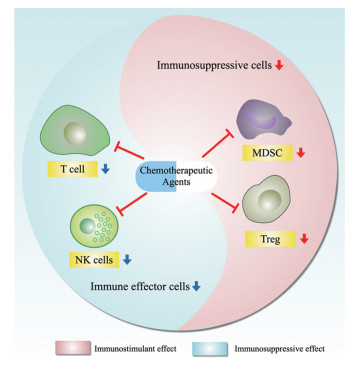
|
Figure 1 Direct effects of chemotherapeutic agents on immune cells. Chemotherapeutic agents can directly kill immune cells with anti-tumor effects such as T cells and NK cells, as well as immunosuppressive cells such as MDSC, Treg, etc. NK cells: Natural killer cells; Treg: Regulatory T cells; MDSC: Myeloid-derived suppressor cells |
许多发挥抗肿瘤作用的免疫细胞如T细胞等具有快速增殖的属性, 因而也会成为化疗药作用的对象。有研究发现, 在接受环磷酰胺化疗后, 肿瘤患者外周血中的T淋巴细胞数量降低程度可高达75%, 提示化疗药对T细胞强大的杀伤作用[11]。除了T细胞, 接受环磷酰胺与顺铂的联合化疗后骨髓和脾脏中的B细胞含量也会显著下降, 并伴随有IgG抗体产生能力的下降[12]。另有报道发现, 5-氟尿嘧啶、环磷酰胺与多柔比星联用能抑制乳腺癌患者自然杀伤(natural killer, NK)细胞的功能, 但NK细胞的数量不会发生显著的改变[13]。值得关注的是, 骨髓干细胞作为多种类型免疫细胞的来源, 也具有快速增殖的能力。有研究发现, 接受环磷酰胺、多柔比星、长春新碱的联合化疗后患者外周血中骨髓来源的中性粒细胞显著下降, 患者发生感染的几率显著上升[14]。事实上, 中性粒细胞减少是多种化疗药物的毒副作用之一[15, 16]。卵巢癌患者接受伊立替康为主的化疗后, 由于其骨髓抑制导致的白细胞减少的发生率超过40%[17]。然而, 目前化疗药引起的骨髓毒性对肿瘤免疫微环境的深入研究还少有报道。
2.2 杀伤免疫抑制细胞肿瘤细胞重塑免疫抑制微环境的机制之一是通过细胞因子释放, 诱导抑制型免疫细胞如Treg和MDSC向肿瘤组织的浸润。相对于其他免疫细胞而言, 免疫抑制细胞通常具有快速增殖的能力, 因而对化疗药物更敏感, 是化疗药激活免疫应答的机制之一。有研究发现, 吉西他滨能抑制MDSC活性, 同时会上调肿瘤细胞表面的人白细胞抗原(human leukocyte antigen, HLA), 从而促进细胞毒性T细胞的杀伤作用[18]。与之类似的是, 顺铂可以清除膀胱癌组织中的MDSC, 从而解除对CD8+ T细胞的抑制, 增强免疫应答[19]。对环磷酰胺的研究发现, 该药可在远低于细胞毒作用的起效剂量时, 就能下调抑制性免疫应答的功能[20]。此外, 低剂量的环磷酰胺可以增强患者临床获益并延长生存期[21], 这可能与环磷酰胺对Treg细胞的抑制作用有关[22]。化疗药在相对较低剂量时具有对免疫抑制性细胞的杀伤作用, 对其作用机制的认识还相对较少。
3 重塑肿瘤细胞免疫原性除了直接作用于免疫细胞外, 化疗药物对免疫细胞的影响更多是通过对肿瘤细胞的间接作用实现的。免疫细胞对肿瘤细胞的杀伤作用是一个多个环节、涉及多种免疫细胞和肿瘤细胞互动的过程。简单来讲, 抗原呈递细胞(antigen presenting cell, APC)如巨噬细胞(macrophage)或树突状细胞(dendritic cells, DC)等识别肿瘤特异性抗原, 对抗原进行加工后呈递给效应细胞如T细胞, T细胞识别并杀伤含有对应抗原的肿瘤细胞。在此过程中, 肿瘤抗原被APC识别发挥了至关重要的作用。近期的研究发现, 化疗药可影响肿瘤细胞的免疫原性, 涉及的机制较为复杂, 包括影响抗原释放、诱导免疫原性细胞死亡等(图 2)。以下就化疗药如何重塑肿瘤细胞的免疫原性进行详尽介绍。
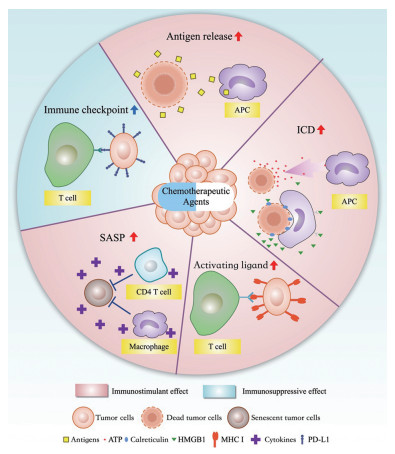
|
Figure 2 Chemotherapeutic agents reshape the immunogenicity of tumor cells. ① Inducing tumor cell death to release antigens; ② inducing ICD; ③ upregulating of MHC I; ④ inducing SASP and cytokines release; ⑤ upregulating immune checkpoint expression. APC: Antigen-presenting cell; ICD: Immunogenic cell death; SASP: Senescence-associated secretory phenotype; HMGB1: High mobility group box 1; MHC I: Major histocompatibility complex class I; PD-L1: Programmed cell death 1 ligand 1 |
化疗药诱导肿瘤细胞死亡后会释放出原本定位于肿瘤细胞内的具有免疫原性的物质, 从而激活APC介导的抗原呈递过程, 导致抗肿瘤免疫应答。如吉西他滨可以诱导肿瘤细胞的凋亡, 导致肿瘤细胞内的抗原被APC识别, 并呈递给CD8+ T细胞, 最终导致抗肿瘤效应增强[23]。在一项关于顺铂抗肿瘤机制的研究中, 应用基于质谱的蛋白质组学技术检测了顺铂给药前后肿瘤细胞培液上清中的蛋白质含量。总计鉴定到的2 239种蛋白质中, 有526种在顺铂处理后上调超过3倍, 其中包含有肿瘤驱动基因如NRAS等、热休克蛋白、代谢酶等多种类型的蛋白。经过这些上清中的抗原性物质刺激的APC可以显著增强CD8+ T细胞的增殖能力及功能水平, 提示化疗药诱导的抗原释放能通过抗原呈递系统显著激活抗肿瘤免疫应答[24]。
3.2 诱导免疫原性细胞死亡细胞死亡过程往往伴随着对免疫系统的激活, 这是当前固有免疫(innate immune system)研究领域的重要科学命题, 在近年来取得了较大进展[25]。细胞死亡曾被简单地分为两类: ①生理性的、精确调控的、无免疫原性的凋亡; ②病理性的、失控的、具有免疫原性的坏死[26]。目前的研究表明, 上述对死亡类型的分类过于简单化。细胞可能经过一系列精确的分子机制调控表现出坏死的表型; 反之, 凋亡细胞也有可能表现出明显的免疫原性[26]。这些认识提示依据细胞死亡时的形态学特征判断是否具有免疫原性, 存在片面性。能否在免疫健全小鼠中引起免疫效应是判断免疫原性的金标准。在上述认识的基础上, 人们发现化疗药能够诱导肿瘤细胞发生免疫原性细胞死亡(immunogenic cell death, ICD)。ICD过程具有显著的特征, 包括“导航”信号ATP释放、“吃我”信号钙网蛋白膜转位以及激活信号高迁移率族蛋白B1 (high mobility group box 1, HMGB1)的释放等。在这些因素的共同作用下, 固有免疫细胞被激活, 识别死亡肿瘤细胞的抗原, 交叉递呈给效应T细胞并最终增强抗肿瘤免疫应答的功能。
3.2.1 “导航”信号——ATP释放ATP作为一种强极性的小分子物质, 无法自由穿过细胞膜, 因而在细胞外维持在相对低的浓度。然而, 当细胞进入死亡进程后, 由于细胞膜通透性的改变, ATP会释放到细胞外。死亡细胞释放到细胞外的ATP在ICD介导的免疫应答中发挥了重要的作用。免疫细胞表面的P2Y2受体识别胞外的ATP, 促进DC细胞的活化, 诱导CD40、CD80、CD86等的表达[27, 28], 并以此作为导航信号诱导抗原呈递细胞向死亡细胞的位置进行迁移[29]。同时, ATP可以激活DC进而活化Ⅰ型辅助性T细胞(T helper cells, Th1 cells)与CD8+ T细胞, 从而增强抗肿瘤免疫[30]。采用siRNA干扰阻断化疗药处理细胞的ATP释放, 可减弱化疗药物的抗肿瘤作用[31]。
值得注意的是, 释放到细胞外的ATP可在核苷酸酶(CD39和CD73)的作用下脱去磷酸基团, 转变为腺苷。与ATP的作用相反, ATP的代谢产物腺苷能作用于免疫细胞表面的腺苷受体, 抑制炎性细胞因子如IL-12和TNF-α的分泌, 减弱对T细胞的激活能力, 发挥抑制免疫细胞的功能[32]。ATP与腺苷这种相反的免疫调节作用, 体现了一种精确的免疫调节机制, 以防止免疫细胞在迁移过程中过度激活[33, 34]。ATP和腺苷的共同作用维持了免疫细胞的稳态, 并诱导免疫细胞顺ATP浓度梯度进行迁移, 最终与细胞表面表达钙网蛋白的肿瘤细胞接触, 实现最终的活化。
3.2.2 “吃我”信号——钙网蛋白膜转位钙网蛋白(calreticulin)是一类内质网中高度保守的分子伴侣, 参与多种细胞过程, 其主要功能是防止错误折叠的蛋白质转运出内质网[35]以及调控细胞钙稳态[36]。当钙网蛋白转位到细胞表面时, 则作为吞噬信号分子发挥作用[37]。多项研究均提示, 钙网蛋白会刺激吞噬细胞对肿瘤细胞尤其是凋亡肿瘤细胞的吞噬作用[38-40]。有研究发现, 奥沙利铂处理细胞后会导致内质网应激, 造成内质网中的钙网蛋白转移到细胞膜表面[41], 顺铂也有类似的效应[42]。钙网蛋白的膜转位会招募DC细胞并激活其吞噬功能, 从而激活抗原呈递过程。使用siRNA干扰钙网蛋白的表达, 可抑制蒽环类药物诱导的DC细胞对肿瘤细胞的吞噬作用, 并显著降低由此引起的免疫原性[39]。研究发现, 细胞表面的钙网蛋白作为一种“吃我”信号对于免疫细胞吞噬死亡细胞是必需的, 而且这种作用可以被CD47的抗吞噬作用所拮抗[38]。
转位到细胞表面的钙网蛋白会作用于固有免疫细胞表面的多种受体, 包括模式识别受体如Toll样受体(toll-like receptors, TLRs)、胞吞受体如CD91、嘌呤受体如P2Y2R及NOD样受体(nod-like receptors, NLRs)[43]。其中, 钙网蛋白对CD91的激活介导了其促吞噬作用。钙网蛋白结合CD91后能激活免疫细胞内的Rac-1信号通路进而驱动免疫细胞对死亡细胞的吞噬。shRNA干扰CD91的表达或采用CD91的中和性抗体阻断CD91功能, 能降低化疗后的肿瘤细胞的免疫原性[44], 抑制肿瘤细胞对DC细胞的激活[45]。
3.2.3 激活信号——HMGB1释放肿瘤细胞死亡后释放多种物质, 其中有一类具有激活固有免疫系统能力的内源性分子被称为损伤相关分子模式(damage associated molecular patterns, DAMPs)。DAMPs释放后会激活众多免疫细胞信号通路, 包括NALP3炎症小体[46]、RAGE[47]以及TLR4[48]等。在众多DAMPs中, HMGB1被认为与ICD关系密切, 在抗原呈递细胞的活化中发挥了重要的作用。
在正常状态下, HMGB1定位于细胞核中, 不依赖于组蛋白结合于DNA上, 作为骨架支持其他核蛋白复合物的组装。细胞进入死亡进程时, HMGB1从细胞核中解离进而释放到细胞外[49]。有研究发现, 接受化疗的乳腺癌患者肿瘤组织的HMGB1发生上调[50]。释放出的HMGB1具有细胞因子的活性, 可以激活巨噬细胞和DC细胞的TLR4受体[51]及RAGE受体[52], 进而活化APC的免疫应答, 诱导TNF-α的释放[49]。早期的研究认为, HMGB1只能在细胞发生坏死时释放, 因为它结合于染色质中, 在凋亡过程中无法被释放[49]。然而近年来的研究也发现细胞发生凋亡后也伴随有HMGB1的释放[53], 提示化疗药诱导的凋亡过程也可能伴随着免疫应答。
3.3 上调肿瘤细胞表面免疫激活性配体除了上述提到的细胞死亡相关的免疫原性物质释放, 化疗药也能通过影响肿瘤细胞的蛋白表达, 重塑肿瘤细胞的免疫原性, 其中, 主要组织相容性复合物1 (major histocompatibility complex I, MHC I)的表达扮演了重要的角色。免疫系统攻击肿瘤细胞的基础是细胞毒性T细胞(cytotoxic T cell, CTL)识别肿瘤细胞表面的MHC I/多肽复合物, 从而激活CTL发挥杀伤肿瘤细胞的功能。肿瘤细胞可下调MHC I的表达来逃避CTL细胞的杀伤作用。有研究发现, 顺铂能上调头颈癌细胞表面的MHC I, 增强肿瘤抗原呈递, 促进CTL对肿瘤细胞的识别[54]及CD8+ T细胞的活化[55]。除此之外, 顺铂也能导致卵巢癌细胞的MHC I表达上调[42]。类似的结果在体内也得到了证实。将在体外进行顺铂预处理的肿瘤细胞进行皮下接种, 发现与对照组相比, 顺铂处理组的肿瘤细胞不易成瘤, 同时已长成肿瘤中MHC I的表达也更高[56]。在结肠癌细胞中也发现了类似的结果, 顺铂可以在体内外上调MHC I的表达[57]。也有研究发现, 除了肿瘤细胞外, 化疗药可上调APC的MHC I表达水平[58]。以上结果提示, 化疗药可以上调细胞表面的免疫激活性配体, 从而增强抗肿瘤免疫应答。
3.4 诱导衰老相关分泌表型细胞衰老发生于受损细胞, 当细胞损伤达到一定限度, 细胞停止增殖, 表现出衰老的表型, 是防止受损细胞增殖的重要机制[59]。尽管增殖已经停止, 衰老细胞却在基因转录水平非常活跃, 尤其是一系列炎性细胞因子的表达与分泌上调, 包括白细胞介素6 (interleukin 6, IL6)、白细胞介素1 (interleukin 1, IL1)等。这种现象称为衰老相关分泌表型(senescent-associated secretory phenotype, SASP)[60]。化疗药能通过激活p53造成肿瘤细胞衰老的认知可以追溯到20年前[61], 而近期的研究发现, 顺铂造成肿瘤细胞DNA损伤后引起的细胞衰老, 可进一步引发SASP, 诱导炎性因子释放[62]。
关于SASP增强抗肿瘤免疫的机制尚不十分清楚, 现有的研究主要集中在巨噬细胞对衰老细胞的吞噬上。有研究发现, SASP中的CCL2会直接招募巨噬细胞的浸润, 从而吞噬衰老肿瘤细胞[63]。此外, 清除CD4+ T细胞后巨噬细胞不具有吞噬衰老细胞的能力, 提示CD4+ T细胞在这一过程中可能是必需的[64]。除巨噬细胞外, 衰老肿瘤细胞可以通过CXCL16招募CD4+ T细胞以及同时表达T细胞受体与NK细胞受体的NKT细胞进而杀伤肿瘤细胞, 但具体的杀伤机制并不清楚[65]。
3.5 上调肿瘤细胞免疫检查点配体除了上述提到的增强肿瘤细胞免疫原性的机制, 化疗药也会通过上调肿瘤细胞表面的免疫检查点配体发挥抑制免疫系统的作用。如研究发现顺铂会上调头颈癌细胞表面的PD-L1表达, 从而抑制CD8+ T细胞功能。因而在顺铂给药基础上联合PD-L1显著激活CD8+ T细胞, 展现出协同效应[55]。与顺铂类似的是, 紫杉醇也可以通过激活卵巢癌细胞NF-κB信号通路诱导PD-L1的上调, 导致对免疫系统的抑制, 并且紫杉醇与PD-L1抗体联用也具有协同效应[66]。其他化疗药如5-氟尿嘧啶等都具有类似的效应[67], 提示这可能是多种化疗药所共有的作用。
4 展望对化疗药物的研究高峰集中于上世纪70年代, 之后随着靶向治疗的兴起, 对化疗药物的研究也逐渐衰落。近年来, 随着肿瘤免疫治疗取得重大进展, 人们开始逐渐认识到除了肿瘤细胞毒作用, 化疗药还具有强大的免疫调节作用。在全球肿瘤免疫治疗研究的浪潮中, 化疗药联合肿瘤免疫治疗也成为临床研究的重要阵地。与此同时, 与整个免疫治疗面临的问题类似, 化疗药的肿瘤免疫调节机制还不明确, 无法对临床研究进行指导。
现有的研究大多主要集中于化疗药诱导肿瘤细胞死亡后, 原本定位于肿瘤细胞中的物质释放到胞质中, 通过其免疫原性激活免疫应答; 同时, 也有研究发现化疗药可以上调免疫激活性配体并杀伤抑制性免疫细胞。然而, 值得注意的是, 化疗药同样也会杀伤快速增殖的抗肿瘤免疫细胞如CTL, 发挥免疫抑制作用。当前, 对化疗药的免疫抑制活性尚缺乏系统的研究, 对其机制尚没有更深入的认识。此外, 化疗药是否通过其他机制发挥免疫抑制功能, 能否通过改变用药剂量、频次和给药顺序的方式最大程度地避免免疫抑制效应, 也是非常值得关注的方向。事实上, 陆续有研究发现低剂量、高频次的化疗在小鼠移植瘤模型中展现出更好的抗肿瘤效应, 这也提示化疗药的免疫激活作用与免疫抑制作用间的平衡可能对最终疗效的发挥至关重要。如何在最大化免疫激活作用的同时, 减弱化疗药对免疫系统的抑制, 可能决定了化疗联合免疫治疗能否发挥出最大的效果。
总之, 化疗药作为一个传统的治疗领域, 过去几十年忽略了其对免疫系统的调控作用。当前肿瘤免疫治疗的蓬勃发展, 为化疗药的研究和临床应用开辟了新的视野和更广阔的空间, 有望带来化疗药研究的新突破。
| [1] | Lesterhuis WJ, Haanen JB, Punt CJ. Cancer immunotherapy-revisited[J]. Nat Rev Drug Discov, 2011, 10: 591–600. DOI:10.1038/nrd3500 |
| [2] | Heriot AG, Marriott JB, Cookson S, et al. Reduction in cytokine production in colorectal cancer patients: association with stage and reversal by resection[J]. Br J Cancer, 2000, 82: 1009–1012. DOI:10.1054/bjoc.1999.1034 |
| [3] | Evans C, Morrison I, Heriot AG, et al. The correlation between colorectal cancer rates of proliferation and apoptosis and systemic cytokine levels; plus their influence upon survival[J]. Br J Cancer, 2006, 94: 1412–1419. DOI:10.1038/sj.bjc.6603104 |
| [4] | Evans C, Dalgleish AG, Kumar D. Review article: immune suppression and colorectal cancer[J]. Aliment Pharmacol Ther, 2006, 24: 1163–1177. DOI:10.1111/j.1365-2036.2006.03075.x |
| [5] | Qiu B, Zhang D, Wang C, et al. IL-10 and TGF-β2 are overexpressed in tumor spheres cultured from human gliomas[J]. Mol Biol Rep, 2011, 38: 3585–3591. DOI:10.1007/s11033-010-0469-4 |
| [6] | Valzasina B, Piconese S, Guiducci C, et al. Tumor-induced expansion of regulatory T cells by conversion of CD4+CD25- lymphocytes is thymus and proliferation independent[J]. Cancer Res, 2006, 66: 4488–4495. DOI:10.1158/0008-5472.CAN-05-4217 |
| [7] | Talmadge JE, Gabrilovich DI. History of myeloid-derived suppressor cells[J]. Nat Rev Cancer, 2013, 13: 739–752. DOI:10.1038/nrc3581 |
| [8] | Siu LL, Ivy SP, Dixon EL, et al. Challenges and opportunities in adapting clinical trial design for immunotherapies[J]. Clin Cancer Res, 2017, 23: 4950–4958. DOI:10.1158/1078-0432.CCR-16-3079 |
| [9] | Govindan R, Szczesna A, Ahn MJ, et al. Phase Ⅲ trial of ipilimumab combined with paclitaxel and carboplatin in advanced squamous non-small-cell lung cancer[J]. J Clin Oncol, 2017, 35: 3449–3457. DOI:10.1200/JCO.2016.71.7629 |
| [10] | Rizvi NA, Hellmann MD, Brahmer JR, et al. Nivolumab in combination with platinum-based doublet chemotherapy for first-line treatment of advanced non-small-cell lung cancer[J]. J Clin Oncol, 2016, 34: 2969–2979. DOI:10.1200/JCO.2016.66.9861 |
| [11] | Harris J, Sengar D, Stewart T, et al. The effect of immunosuppressive chemotherapy on immune function in patients with malignant disease[J]. Cancer, 1976, 37: 1058–1069. DOI:10.1002/1097-0142(197602)37:2+<1058::AID-CNCR2820370813>3.0.CO;2-O |
| [12] | Zandvoort A, Lodewijk ME, Klok PA, et al. Effects of multidose combination chemotherapy on the humoral immune system[J]. Clin Immunol, 2003, 107: 20–29. DOI:10.1016/S1521-6616(03)00005-6 |
| [13] | Beitsch P, Lotzova E, Hortobagyi G, et al. Natural immunity in breast cancer patients during neoadjuvant chemotherapy and after surgery[J]. Surg Oncol, 1994, 3: 211–219. DOI:10.1016/0960-7404(94)90036-1 |
| [14] | Bodey GP, Hersh EM, Valdivieso M, et al. Effects of cytotoxic and immunosuppressive agents on the immune system[J]. Postgrad Med, 1975, 58: 67–74. |
| [15] | Horn L, Mansfield AS, Szczesna A, et al. First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer[J]. N Eng J Med, 2018, 379: 2220–2229. DOI:10.1056/NEJMoa1809064 |
| [16] | Loven D, Hasnis E, Bertolini F, et al. Low-dose metronomic chemotherapy: from past experience to new paradigms in the treatment of cancer[J]. Drug Discov Today, 2013, 18: 193–201. DOI:10.1016/j.drudis.2012.07.015 |
| [17] | Shiozawa T, Tadokoro J, Fujiki T, et al. Risk factors for severe adverse effects and treatment-related deaths in Japanese patients treated with irinotecan-based chemotherapy: a postmarketing survey[J]. Jpn J Clin Oncol, 2013, 43: 483–491. DOI:10.1093/jjco/hyt040 |
| [18] | Le HK, Graham L, Cha E, et al. Gemcitabine directly inhibits myeloid derived suppressor cells in BALB/c mice bearing 4T1 mammary carcinoma and augments expansion of T cells from tumor-bearing mice[J]. Int Immunopharmacol, 2009, 9: 900–909. DOI:10.1016/j.intimp.2009.03.015 |
| [19] | Wu K, Tan MY, Jiang JT, et al. Cisplatin inhibits the progression of bladder cancer by selectively depleting G-MDSCs: a novel chemoimmunomodulating strategy[J]. Clin Immunol, 2018, 193: 60–69. DOI:10.1016/j.clim.2018.01.012 |
| [20] | Lien K, Georgsdottir S, Sivanathan L, et al. Low-dose metronomic chemotherapy: a systematic literature analysis[J]. Eur J Cancer, 2013, 49: 3387–3395. DOI:10.1016/j.ejca.2013.06.038 |
| [21] | Penel N, Clisant S, Dansin E, et al. Megestrol acetate versus metronomic cyclophosphamide in patients having exhausted all effective therapies under standard care[J]. Br J Cancer, 2010, 102: 1207–1212. DOI:10.1038/sj.bjc.6605623 |
| [22] | Dalgleish AG. Rationale for combining immunotherapy with chemotherapy[J]. Immunotherapy, 2015, 7: 309–316. DOI:10.2217/imt.14.111 |
| [23] | Nowak AK, Lake RA, Marzo AL, et al. Induction of tumor cell apoptosis in vivo increases tumor antigen cross-presentation, cross-priming rather than cross-tolerizing host tumor-specific CD8 T cells[J]. J Immunol, 2003, 170: 4905–4913. DOI:10.4049/jimmunol.170.10.4905 |
| [24] | Beyranvand Nejad E, Van Der Sluis TC, Van Duikeren S, et al. Tumor eradication by cisplatin is sustained by CD80/86-mediated costimulation of CD8+ T cells[J]. Cancer Res, 2016, 76: 6017–6029. DOI:10.1158/0008-5472.CAN-16-0881 |
| [25] | Jorgensen I, Rayamajhi M, Miao EA. Programmed cell death as a defence against infection[J]. Nat Rev Immunol, 2017, 17: 151–164. DOI:10.1038/nri.2016.147 |
| [26] | Galluzzi L, Bravo-San Pedro JM, Vitale I, et al. Essential versus accessory aspects of cell death: recommendations of the NCCD 2015[J]. Cell Death Differ, 2015, 22: 58–73. DOI:10.1038/cdd.2014.137 |
| [27] | Idzko M, Hammad H, Van Nimwegen M, et al. Extracellular ATP triggers and maintains asthmatic airway inflammation by activating dendritic cells[J]. Nat Med, 2007, 13: 913–919. DOI:10.1038/nm1617 |
| [28] | Granstein RD, Ding W, Huang J, et al. Augmentation of cutaneous immune responses by ATP gamma S: purinergic agonists define a novel class of immunologic adjuvants[J]. J Immunol, 2005, 174: 7725–7731. DOI:10.4049/jimmunol.174.12.7725 |
| [29] | Elliott MR, Chekeni FB, Trampont PC, et al. Nucleotides released by apoptotic cells act as a find-me signal to promote phagocytic clearance[J]. Nature, 2009, 461: 282–286. DOI:10.1038/nature08296 |
| [30] | Di Virgilio F, Sarti AC, Falzoni S, et al. Extracellular ATP and P2 purinergic signalling in the tumour microenvironment[J]. Nat Rev Cancer, 2018, 18: 601–618. DOI:10.1038/s41568-018-0037-0 |
| [31] | Michaud M, Martins I, Sukkurwala AQ, et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice[J]. Science, 2011, 334: 1573–1577. DOI:10.1126/science.1208347 |
| [32] | Borea PA, Gessi S, Merighi S, et al. Adenosine as a multi-signalling guardian angel in human diseases: when, where and how does it exert its protective effects?[J]. Trends Pharmacol Sci, 2016, 37: 419–434. DOI:10.1016/j.tips.2016.02.006 |
| [33] | Schrier DJ, Imre KM. The effects of adenosine agonists on human neutrophil function[J]. J Immunol, 1986, 137: 3284–3289. |
| [34] | Bao Y, Chen Y, Ledderose C, et al. Pannexin 1 channels link chemoattractant receptor signaling to local excitation and global inhibition responses at the front and back of polarized neutrophils[J]. J Biol Chem, 2013, 288: 22650–22657. DOI:10.1074/jbc.M113.476283 |
| [35] | Michalak M, Corbett EF, Mesaeli N, et al. Calreticulin: one protein, one gene, many functions[J]. Biochem J, 1999, 344 Pt 2: 281–292. |
| [36] | Pozzan T, Rizzuto R, Volpe P, et al. Molecular and cellular physiology of intracellular calcium stores[J]. Physiol Rev, 1994, 74: 595–636. DOI:10.1152/physrev.1994.74.3.595 |
| [37] | Raghavan M, Wijeyesakere SJ, Peters LR, et al. Calreticulin in the immune system: ins and outs[J]. Trends Immunol, 2013, 34: 13–21. DOI:10.1016/j.it.2012.08.002 |
| [38] | Gardai SJ, Mcphillips KA, Frasch SC, et al. Cell-surface calreticulin initiates clearance of viable or apoptotic cells through trans-activation of LRP on the phagocyte[J]. Cell, 2005, 123: 321–334. DOI:10.1016/j.cell.2005.08.032 |
| [39] | Obeid M, Tesniere A, Ghiringhelli F, et al. Calreticulin exposure dictates the immunogenicity of cancer cell death[J]. Nat Med, 2007, 13: 54–61. DOI:10.1038/nm1523 |
| [40] | Chao MP, Jaiswal S, Weissman-Tsukamoto R, et al. Calreticulin is the dominant pro-phagocytic signal on multiple human cancers and is counterbalanced by CD47[J]. Sci Transl Med, 2010, 2: 63ra94. |
| [41] | Panaretakis T, Kepp O, Brockmeier U, et al. Mechanisms of pre-apoptotic calreticulin exposure in immunogenic cell death[J]. EMBO J, 2009, 28: 578–590. DOI:10.1038/emboj.2009.1 |
| [42] | Grabosch S, Bulatovic M, Zeng F, et al. Cisplatin-induced immune modulation in ovarian cancer mouse models with distinct inflammation profiles[J]. Oncogene, 2019, 38: 2380–2393. DOI:10.1038/s41388-018-0581-9 |
| [43] | Gold LI, Eggleton P, Sweetwyne MT, et al. Calreticulin: non-endoplasmic reticulum functions in physiology and disease[J]. FASEB J, 2010, 24: 665–683. DOI:10.1096/fj.09-145482 |
| [44] | Garg AD, Krysko DV, Verfaillie T, et al. A novel pathway combining calreticulin exposure and ATP secretion in immunogenic cancer cell death[J]. EMBO J, 2012, 31: 1062–1079. DOI:10.1038/emboj.2011.497 |
| [45] | Cirone M, Di Renzo L, Lotti LV, et al. Primary effusion lymphoma cell death induced by bortezomib and AG 490 activates dendritic cells through CD91[J]. PLoS One, 2012, 7: e31732. DOI:10.1371/journal.pone.0031732 |
| [46] | Halle A, Hornung V, Petzold GC, et al. The NALP3 inflammasome is involved in the innate immune response to amyloid-beta[J]. Nat Immunol, 2008, 9: 857–865. DOI:10.1038/ni.1636 |
| [47] | Yan SF, Ramasamy R, Schmidt AM. Mechanisms of disease: advanced glycation end-products and their receptor in inflammation and diabetes complications[J]. Nat Clin Pract Endocrinol Metab, 2008, 4: 285–293. DOI:10.1038/ncpendmet0786 |
| [48] | Taylor KR, Yamasaki K, Radek KA, et al. Recognition of hyaluronan released in sterile injury involves a unique receptor complex dependent on Toll-like receptor 4, CD44, and MD-2[J]. J Biol Chem, 2007, 282: 18265–18275. DOI:10.1074/jbc.M606352200 |
| [49] | Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J]. Nature, 2002, 418: 191–195. DOI:10.1038/nature00858 |
| [50] | Aoto K, Mimura K, Okayama H, et al. Immunogenic tumor cell death induced by chemotherapy in patients with breast cancer and esophageal squamous cell carcinoma[J]. Oncol Rep, 2018, 39: 151–159. |
| [51] | Apetoh L, Ghiringhelli F, Tesniere A, et al. Toll-like receptor 4-dependent contribution of the immune system to anticancer chemotherapy and radiotherapy[J]. Nat Med, 2007, 13: 1050–1059. DOI:10.1038/nm1622 |
| [52] | Sims GP, Rowe DC, Rietdijk ST, et al. HMGB1 and RAGE in inflammation and cancer[J]. Annu Rev Immunol, 2010, 28: 367–388. DOI:10.1146/annurev.immunol.021908.132603 |
| [53] | Bell CW, Jiang W, Reich CF 3rd, et al. The extracellular release of HMGB1 during apoptotic cell death[J]. Am J Physiol Cell Physiol, 2006, 291: C1318–C1325. DOI:10.1152/ajpcell.00616.2005 |
| [54] | Gameiro SR, Caballero JA, Hodge JW. Defining the molecular signature of chemotherapy-mediated lung tumor phenotype modulation and increased susceptibility to T-cell killing[J]. Cancer Biother Radiopharm, 2012, 27: 23–35. DOI:10.1089/cbr.2012.1203 |
| [55] | Tran L, Allen CT, Xiao R, et al. Cisplatin alters antitumor immunity and synergizes with PD-1/PD-L1 inhibition in head and neck squamous cell carcinoma[J]. Cancer Immunol Res, 2017, 5: 1141–1151. DOI:10.1158/2326-6066.CIR-17-0235 |
| [56] | Nio Y, Hirahara N, Minari Y, et al. Induction of tumor-specific antitumor immunity after chemotherapy with cisplatin in mice bearing MOPC-104E plasmacytoma by modulation of MHC expression on tumor surface[J]. Anticancer Res, 2000, 20: 3293–3299. |
| [57] | Ohtsukasa S, Okabe S, Yamashita H, et al. Increased expression of CEA and MHC class I in colorectal cancer cell lines exposed to chemotherapy drugs[J]. J Cancer Res Clin Oncol, 2003, 129: 719–726. DOI:10.1007/s00432-003-0492-0 |
| [58] | Jackaman C, Majewski D, Fox SA, et al. Chemotherapy broadens the range of tumor antigens seen by cytotoxic CD8+ T cells in vivo[J]. Cancer Immunol Immunother, 2012, 61: 2343–2356. DOI:10.1007/s00262-012-1307-4 |
| [59] | Sieben CJ, Sturmlechner I, Van De Sluis B, et al. Two-step senescence-focused cancer therapies[J]. Trends Cell Biol, 2018, 28: 723–737. DOI:10.1016/j.tcb.2018.04.006 |
| [60] | Capece D, Verzella D, Tessitore A, et al. Cancer secretome and inflammation: the bright and the dark sides of NF-kappaB[J]. Semin Cell Dev Biol, 2018, 78: 51–61. DOI:10.1016/j.semcdb.2017.08.004 |
| [61] | Chang BD, Xuan Y, Broude EV, et al. Role of p53 and p21waf1/cip1 in senescence-like terminal proliferation arrest induced in human tumor cells by chemotherapeutic drugs[J]. Oncogene, 1999, 18: 4808–4818. DOI:10.1038/sj.onc.1203078 |
| [62] | Sun X, Shi B, Zheng H, et al. Senescence-associated secretory factors induced by cisplatin in melanoma cells promote non-senescent melanoma cell growth through activation of the ERK1/2-RSK1 pathway[J]. Cell Death Dis, 2018, 9: 260. DOI:10.1038/s41419-018-0303-9 |
| [63] | Eggert T, Wolter K, Ji J, et al. Distinct functions of senescence-associated immune responses in liver tumor surveillance and tumor progression[J]. Cancer Cell, 2016, 30: 533–547. DOI:10.1016/j.ccell.2016.09.003 |
| [64] | Kang TW, Yevsa T, Woller N, et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development[J]. Nature, 2011, 479: 547–551. DOI:10.1038/nature10599 |
| [65] | Mossanen JC, Kohlhepp M, Wehr A, et al. CXCR6 inhibits hepatocarcinogenesis by promoting natural killer T- and CD4+ T-cell-dependent control of senescence[J]. Gastroenterology, 2019, 156: 1877–1889.e4. DOI:10.1053/j.gastro.2019.01.247 |
| [66] | Peng J, Hamanishi J, Matsumura N, et al. Chemotherapy induces programmed cell death-ligand 1 overexpression via the nuclear factor-κB to foster an immunosuppressive tumor microenvironment in ovarian cancer[J]. Cancer Res, 2015, 75: 5034–5045. DOI:10.1158/0008-5472.CAN-14-3098 |
| [67] | Van Der Kraak L, Goel G, Ramanan K, et al. 5-Fluorouracil upregulates cell surface B7-H1 (PD-L1) expression in gastrointestinal cancers[J]. J Immunother Cancer, 2016, 4: 65. DOI:10.1186/s40425-016-0163-8 |
 2019, Vol. 54
2019, Vol. 54


