程序性死亡受体1 (programmed cell death protein 1, PD-1, 又称CD297)是由Pdcd1编码的Ⅰ型跨膜蛋白, 是CD28免疫球蛋白超家族的一员。在多种免疫细胞中均有表达, 包括T细胞、B细胞和髓细胞, 可抑制T细胞的激活、调节CD8+ T细胞的效应性[1]。细胞程序性死亡-配体1 (programmed cell death 1 ligand 1, PD-L1, 又称CD274、B7-H1)是B7家族中一个负性T细胞共刺激分子, 由人9号染色体上基因编码, 广泛表达于树突状细胞等抗原提呈细胞表面。PD-L1主要由INF-γ诱导产生, 通过与PD-1结合抑制CD8+ T细胞的增殖和活化。有研究表明, PD-1及其同源配体主要抑制炎症反应时周围组织T细胞的活性, 并通过诱导活化的T细胞凋亡、促进T细胞衰竭、增强调节性T细胞的免疫抑制功能、抑制T细胞的增殖与活化和产生白介素2 (interleukin-2, IL-2)等方式调控自身免疫, 同时也介导了肿瘤的免疫逃逸[2, 3]。
PD-1表达于多种肿瘤组织中的肿瘤浸润型淋巴细胞, 包括头颈部癌[4]、黑色素瘤[5]和非小细胞肺癌(non-small-cell lung cancer, NSCLC)[6]; PD-L1也在多种恶性肿瘤中高表达, 如NSCLC等。通过靶向PD-1和PD-L1的免疫治疗可以克服肿瘤环境的免疫抑制、重新激活患者自身的免疫细胞来杀伤肿瘤, 进而治疗多种癌症。目前, 美国食品药品监督管理局(FDA)批准的免疫检查点抑制剂包括: PD-1单抗nivolumab (BMS)、pembrolizumab (Merck), PD-L1单抗atezolizumab (Genentech)、avelumab (Emd Serono)、durvalumab (Astrazeneca)。尽管肿瘤免疫治疗在一些患者身上取得了显著且持久的疗效, 但PD-1或PD-L1治疗的患者响应率只有20%~30%。一方面, 预测反应率的生物标志物研究的不足限制了临床患者治疗策略的有效性的提高; 另一方面, 由于机体免疫调节信号通路错综复杂, 耐药成为免疫治疗发展的一大难题和挑战。因此, 发现更有效的预测生物标志物以及探究免疫治疗的内在机制和耐药机制是解决当前免疫治疗难题的重要任务。
1 临床试验与生物标志物两项有关nivolumab治疗癌症进展的耐药NSCLC患者的Ⅲ期临床试验(CheckMate017, CheckMate057)表明, 鳞状或非鳞状非小细胞肺癌患者的总生存(overall survival, OS)和无进展生存期(progression-free survival, PFS)在接受nivolumab治疗后都有所提高[7]。而有关pembrolizumab的临床研究(Keynote010)发现, PD-L1表达大于1%的患者使用该单抗作为二线药物相较于化疗药的OS更高[8]; 尤其是PD-L1表达大于50%的肝癌转移的继发性肺癌患者(患者无EGFR激活或ALK突变且未接受治疗), 使用单抗药物治疗的OS、PFS和生存率远高于化疗组(Keynote024)[9]。此外, durvalumab治疗Ⅲ期非转移性NSCLC的临床试验也显示出良好的效果[10]。
随着FDA批准nivolumab等抗体作为肿瘤的一、二线治疗药物, 寻找具有预测治疗反应意义的生物标志物已成为临床研究需要迫切解决的课题。最近的两项Meta分析表明, 肿瘤PD-L1表达与客观缓解率(objective response rate, ORR)和PD-1/PD-L1抑制因子之间存在相关性, 提示研究者PD-L1有可能成为有效的生物标志物。Passiglia等[11]分析了7项共914例患者的研究发现PD-L1阳性NSCLC (免疫组化 > 1%染色)患者的ORR明显高于PD-L1阴性的患者(OR: 2.44; 95%置信区间: 1.61~3.68)。Abdel-Rahman等[12]的Meta分析包括了12项研究共3 790名患者, 发现在PD-1/PD-L1抑制剂治疗的患者中, 当NSCLC患者PD-L1表达超过1%时, ORR比表达低于1%时有所改善(OR: 2.18; 95%置信区间: 1.45~3.29; P=0.000 2)。这些数据表明, 当使用PD-1/PD-L1抑制剂治疗NSCLC时, 具有超过1%的PD-L1表达的患者对NSCLC治疗的敏感性更高。但是, 目前尚不清楚肿瘤PD-L1的表达基线是否与临床治疗反应时间有关。PD-L1是一种可诱导的动态的生物标志物, 因此与EGFR和ALK突变等更易于检测的肿瘤预测生物标志物有所不同; 如果PD-L1表达因先天免疫抵抗而不是抗肿瘤免疫反应而短暂升高, 那么阻断该抑制途径来对抗肿瘤可能是无效的。另外, 由于PD-L1的表达是动态的, 受空间(原发灶或转移灶)和时间(活检和后续治疗之间的间隔)的影响, 其表达水平也可能会发生变化, 而活检样本只是肿瘤的快照, 不能反映整个肿瘤微环境, 因此通过组织学分析单个患者的数据将有助于确定PD-L1表达在NSCLC的预测作用。
目前PD-L1作为有效临床治疗生物标志物的研究还在完善中。另一方面, 免疫相关反应标准(immune-related response criteria, ir-RC)已被证明更适合用于免疫治疗药物的反应评价。另外, McGranahan等[13]发现, 新抗原的异质性将影响整体新抗原负担进而影响PD-1/PD-L1抑制剂的治疗结果。Rizvi等[14]研究也发现pembrolizumab的疗效与新抗原负荷即较高的非同义突变率相关——pembrolizumab持久疗效的患者的候选新抗原负担明显高于无持久疗效的患者, 而高候选新抗原负担与无进展生存期(PFS)改善相关(14.5个月vs 3.5个月, P=0.002)。该研究还揭示了肿瘤突变负担与PD-L1表达之间的一些相关性。这说明肿瘤PD-L1表达水平与其他免疫生物标志物相结合的组合预测有望在未来进一步提高临床反应预测的准确性。
此外, 一些新的潜在预测生物标志物也在研究中, 如干扰素基因信号[15]、Ⅱ类主要组织相容性抗原[16]的表达、微生物组[17, 18]和肿瘤浸润淋巴细胞[5]等。未来, 无论是根据目前已有预测生物标志物进行组合预测, 还是发现更多新的潜在生物标志物, 都有待更多的临床研究来确证。
2 PD-1/PD-L1抑制T细胞激活的机制PD-1介导免疫抑制的机制与多个细胞信号通路交叉相关。PD-1在持续抗原刺激, 如持续感染或在肿瘤环境中呈高表达, 抑制自体免疫功能。PD-L1与PD-1结合后, 通过募集磷酸酶如SHP2作用于PD-1蛋白结构域基于免疫受体酪氨酸的转换基序(immunoreceptor tyrosine-based switch motif, ITSM)磷酸化酪氨酸残基, 使激酶去磷酸化, 进而拮抗T细胞受体(T cell receptor, TCR)与CD28发出的阳性信号, 影响下游的PI3K-AKT、RAS、ERK等通路来抑制T细胞的激活[19]。抗PD-L1治疗解救耗竭的CD8+ T细胞是依赖于CD28信号传导, 即TCR的参与[20]。PD-1通过抑制ZAP70、PKCθ、PI3K-AKT和RAS通路, 使得激活型T细胞相关转录因子如AP-1 (activator protein 1)、NFAT (nuclear factor of activated T cell)、NF-κB (nuclear factor-κB)受到抑制; 另外, 还通过增加BATF (basic leucine zipper transcription factor ATF-like)的表达, 抑制T细胞功能[21] (图 1)。
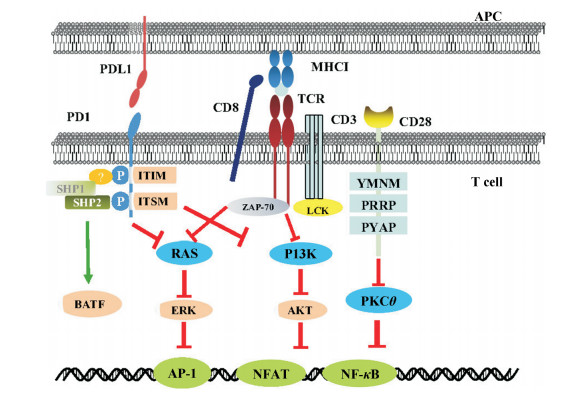
|
Figure 1 The mechanism of programmed cell death protein 1 (PD-1) mediated immunosuppression is cross-related with multiple cell signaling pathways. After the combination of programmed cell death 1 ligand 1 (PD-L1) and PD-1, phosphatases such as SHP2 are recruited to act on the phosphorylated tyrosine residues in the structural domain of PD-1 protein to dephosphorylate the kinase, thereby antagonizing the positive signals from TCR and CD28 and affecting the downstream PI3K-AKT, RAS, ERK and other pathways to inhibit the activation of T cells. Anti-PD-L1 therapy saves depleted CD8+ T cells by relying on CD28 signaling, i.e., the involvement of TCR[20]. PD-1 inhibited transcriptional factors associated with activated T cells such as AP-1 and NFAT\NF-κB (nuclear factor-κB) by inhibiting ZAP70, PI3K-AKT and RAS. In addition, the expression of basic leucine zipper transcription factor ATF-like (BATF) can also be increased to inhibit the function of T cells. YMNM and PYAP mediated pathways are also involved in T cell regulation. The red arrow indicates inhibition, while the green arrow points downstream in the figure above |
PD-1也可以抑制调节细胞的作用。研究发现, T滤泡辅助细胞(Tfr)中的PD-1缺失可以增加其数量和抑制能力[22], 另外PD-1表达也会调控调节性T细胞(regulatory cells, Treg)的作用。Treg细胞是重要的免疫抑制性调节细胞, 也是免疫抑制解除机制研究的热点[23], 其标志性分子之一Foxp3是一个转录调控因子, 可以通过直接调控多种基因来调节Treg的活性。研究表明, CD4+FOXP3+CXCR5- Treg细胞上有PD-1表达, 且PD-1调控Foxp3的稳定性, 即PD-1通过下调天冬酰胺酰基内肽酶, 维持Foxp3蛋白的表达水平来抑制淋巴细胞的活性。
另外, 抗PD-L1单抗还可能通过抑制肿瘤的代谢途径起效。在一项PD-L1抗体的研究中[24], 肿瘤细胞的糖酵解酶水平、AKT磷酸化水平和葡萄糖摄取在治疗后明显降低, 提示肿瘤代谢可能是免疫检查点抑制剂的重要机制之一。有关免疫检查点抑制剂对肿瘤代谢的研究仍在开展中, 有待新进展和新发现的报道。
3 耐药机制 3.1 肿瘤新抗原负荷随着免疫检查点抑制剂的广泛应用, 耐药成为免疫治疗发展的重大阻碍, 如何克服患者的耐药成为亟待解决的问题。Rizvi等[14]对经过免疫治疗的NSCLC患者进行研究, 发现其新抗原负荷与疗效明显相关, 提示新抗原负荷可能是理解耐药机制和克服耐药的关键。在这项研究中, 对pembrolizumab有持久疗效的NSCLC患者体内的新抗原负荷明显高于无持久疗效的患者, 且高新抗原负荷与PFS改善相关。另外, McGranahan等[13]也发现新抗原的异质性可能影响整体的新抗原负荷水平, 进而影响PD-1/PD-L1单抗的治疗效果。有关新抗原负荷与PD-1耐药机制的关系还需更进一步的研究。
3.2 肿瘤免疫与代谢研究发现, 在肾癌(renal cell carcinoma, RCC)中适应缺氧的因子水平显著上调, 且葡萄糖醛酸化、营养物质转运相关分子过度表达, 这可能是RCC对抗PD-1治疗出现耐药的一种以满足细胞快速增殖的能量需求的代谢转变。其中, 以促进细胞清除毒素和外源性亲脂性化学物质为主要作用的UGT1A6是与抗PD-1治疗耐药相关的单一高表达分子, 且其他的UGT1A家族成员及构成化学防御的溶质载体的表达也上调, 这可能导致以UGT1A6为代表的分子对肿瘤细胞毒素的清除能力增强, 使其更有利于与免疫系统的竞争[25]。抗PD-1治疗耐药的RCC中代谢基因的过度表达反映了肿瘤通过竞争肿瘤微环境(tumor microenvironment, TME)内的葡萄糖等重要营养物质来限制肿瘤特异性浸润T细胞的反应性, 介导耐药的发生。
PD-1能通过影响肿瘤浸润T细胞代谢、改变相关代谢信号通路基因的表达, 进而诱导耐药的发生, 提示可能在肿瘤代谢通路的研究中发现新的靶点, 与抗PD-1单抗联用将起到逆转耐药的治疗效果。
3.3 肿瘤微环境 3.3.1 肿瘤内在因子临床研究表明, 只有存在浸润性T细胞(即一定CD8+ T细胞浸润数量)的患者, 才对PD-1抗体治疗响应。因此, 针对浸润性T细胞的相关研究可能会对如何提高患者的治疗响应率有所启发。有研究发现, 细胞内在因子和致癌信号是影响浸润性T细胞水平的重要因素之一。WNT信号转导通路是动物中主要的生长调控途径, WNT通路下游的T细胞因子(TCF)与β-连环蛋白结合直接介导基因表达, 促进细胞生长增殖。该研究表明, WNT通路中β-连环蛋白的过度表达与黑色素瘤中肿瘤特异性T细胞的浸润减少密切相关[26]——β-连环蛋白基因的突变导致β-连环蛋白异常的稳定, 从而持续与核内受体TCF结合促使一些基因的大量表达; CCL4细胞因子表达的缺失导致了APC细胞特别是树突状细胞的缺失, 进而抑制了肿瘤相关抗原激活T细胞的过程的发生。
3.3.2 炎症环境转移性黑色素瘤的病变分析结果显示, 间充质和抑制性炎症转录表型与PD-1抑制剂耐药相关。CD8+ T细胞在侵袭性肿瘤边缘的存在以及肿瘤中PD-L1高表达与治疗反应率正相关, 说明存在持续的炎症反应, 但也并不尽然[27], 有待进一步确证。
3.4 表观遗传—DNA甲基化DNA甲基化和表观遗传因子组蛋白-赖氨酸N-甲基转移酶(enhancer of zeste homolog 2, EZH2)可能是介导黑色素瘤免疫治疗耐药的重要机制: DNA甲基化阻碍了IFN的转录, 而E2H2的激活影响了RAS、PI3K、DNA修复等信号通路进而增加DNA甲基化水平。CpG位点的DNA甲基化是癌症中最常见和最稳定的表观遗传变化。高甲基化通过抑制识别癌细胞所需的内源性干扰素反应来限制免疫检查点阻断免疫治疗; 而整体低甲基化也会导致PD-L1和抑制性细胞因子IL-6、VEGF的表达增加, 并伴有上皮-间质变化, 可导致免疫抑制[28]。目前, 对这些相互对照的甲基化状态的驱动因素尚不清楚。此外, DNA甲基化在细胞毒性T细胞(cytotoxic T cells)耗竭中也起着关键作用, 而这种耗竭与肿瘤进展有关。因此, 表观遗传药物与免疫检查点抑制剂的联合使用为突破耐药带来新的可能。
4 联合用药 4.1 联合靶向原癌基因RAS基因家族参与细胞内的信号传递, 与肿瘤的发生密切相关, 主要包括H-RAS、K-RAS和N-RAS等。当K-RAS基因突变时, 该基因永久活化, 不能产生正常的RAS蛋白, 使得细胞内信号传导紊乱, 细胞增殖失控而癌变。在肿瘤临床治疗中发现, K-RAS的突变会增加肿瘤细胞的异质性, 进而提高免疫检查点抑制剂的响应率, 其机制为通过IRF2-CXCL3-CXCR2通路介导T细胞的数量增加, MDSC细胞数量减少且Treg细胞数量的减少。这提示, 可以通过上调IRF2表达或抑制CXCR2的表达克服PD-1药物耐药的问题。CXCR1/2的抑制剂SX-682的最新研究进展为联合用药增添了新的可能[29]。
原癌基因RAS的促癌机制研究发现, 其可以通过稳定PD-L1 mRNA的稳定性—3'UTR区的AU增加, 促进癌症发生。因此, 下调RAS基因下游的MEK表达进而降低PD-L1 mRNA的表达, 也可能是减少肿瘤抑制、促进肿瘤免疫的一种策略[30]。
在pembrolizumab治疗后黑色素瘤复发的患者研究中发现, 患者JAK1和JAK2的基因缺失和突变以及B2M突变会导致抗原呈递障碍、β-2-微球蛋白的缺失和HLA的障碍, 进而导致CD8浸润的T细胞丢失MHC I且对IFN-γ的敏感性降低[31]。上述研究提示, 可以通过靶向JAK1、JAK2以及B2M的突变逆转免疫检查点抑制剂的耐药。
在NSCLC的PD-1调控机制研究中, 一个重要假设是先天免疫通过肿瘤细胞内的组成型致癌信号通路介导PD-1表达上调, 其可能的机制为异常的ALK信号通过STAT3通路增加PD-1的表达[32]。另外, 表皮生长因子受体(EGFR)通路及其突变的激活也与NSCLC患者的PD-L1表达上调相关[33], 说明采用免疫治疗与相关靶向药物的组合策略, 如ALK或EGFR的靶向药物与抗PD-1药物联用可能会取得较好的抗癌效果。但也有临床研究表明, EGFR或ALK易位突变的患者对抗PD-1治疗的响应率较低[34]。因此, 促癌基因与PD-1表达的调控组合策略能否增强抗癌效果取得临床治疗的突破还有待进一步的研究。
4.2 联合靶向Treg细胞靶向负性调节细胞Treg的癌症免疫治疗也是近年来关注的重点, 但是Treg的干预存在潜在的致命风险。因此, 增加靶向癌症细胞的选择性、减少正常组织自身免疫性疾病及炎症的发生是亟需攻克的难点。
Treg细胞是抗肿瘤免疫的阻碍之一, Neuropilin-1 (Nrp1)是维持肿瘤内Treg稳定和功能必不可少的一部分, 因此Treg限制性的Nrp1的缺失可能与肿瘤耐药的改善相关。这提示确定Nrp1依赖性的基础和Treg关键调控因素将有助于改善癌症的免疫治疗。研究发现, 一方面, Nrp1-表型的增加会诱导肿瘤内IFN-γ的生成, 使Treg细胞的脆弱性增加, 肿瘤免疫抑制减弱, 抗肿瘤免疫增强, 这与黑色素瘤和头颈鳞状细胞癌的预后相关; 另一方面, IFN-γ诱导的Treg细胞脆弱性是抗PD-1治疗的可能机制, 即抗PD-1药物诱导大量IFN-γ产生。在肿瘤缺氧酸性微环境中, Hif1α表达的增加也会提高Treg细胞抑制的选择性, 使得外周Treg细胞耐受, 是另一个打破耐药的潜在靶点[35]。
4.3 联合靶向DNA损伤修复基因研究表明, DNA损伤修复基因BRCA2高突变的患者对PD-1抑制剂有较好的响应, 生存率较高。另外, 错配修复缺陷(mismatch repair deficiency, dMMR)型实体瘤对PD-1单抗pembrolizumab有较好的响应[36]。
ATR蛋白是一种编码修复紫外线损伤的激酶, 其缺失会导致细胞异常增殖; 编码ATR蛋白基因的突变会改变肿瘤微环境从而诱发促炎环境、减少T细胞募集, 进而促进黑色素瘤的生长[37]。因此, 联合靶向DNA损伤修复基因, 可能会改善耐药患者的情况。
从另一方面来说, 累计更多突变也可能提高免疫治疗的响应率。因为一般来说, 实体瘤的突变程度与免疫治疗的响应率密切相关, 这可能是由于高突变的肿瘤细胞可以产生更多的新抗原, 因此更容易被免疫系统识别“非己”身份, 提高免疫系统的攻击性。
4.4 联合表观遗传和转录调控在DNA甲基化抑制剂治疗的黑色素瘤患者中发现, 低甲基化水平与PD-L1表达相关, 提示表观遗传疗法和免疫疗法结合可能是克服耐药的有效途径[38]。EZH2的调控可调节DNA甲基化水平。因此, 可能采用的新策略为通过增强EZH2、HDAC、NDMT的相关调控实现对肿瘤的控制, 如组蛋白去甲基化酶(LSD1)的敲除, 可减少重复元件的表达(转录), 包括内源性逆转录病毒元件(ERV)[39]。
转录因子YY1会上调免疫检查点受体的表达水平, 并下调长期激活且耗竭的T细胞中I型细胞因子[40]。PD-1、TIM3和LAG3的上调以及IL-2 (与组蛋白甲基转移酶EZH2协同)和IFN-γ的下调的双信号重复持续刺激会使YY1上调, T细胞耗竭增加, 降低细胞毒性作用和减少T细胞增殖。另外, 调节效应CD4+ T细胞分化的转录因子(BACH2)和编码淋巴细胞迁移相关的基因(CCL3)的高表达也可能与PD-L1的治疗耐受相关。上述研究为耐药新靶点的发现提供新的可能。
4.5 多免疫靶点联合调控研究发现, 肿瘤突变导致的新抗原的丢失可能是抗PD-1耐药的关键。有研究者提出, 针对耐药肿瘤出现的新抗原可以用于开发特定的疫苗和过继性T细胞治疗中T细胞受体的设计[41]。Koyama等[42]使用两种完全免疫的肺腺癌小鼠模型, 观察到PD-1抗体结合T细胞后Tim-3的上调, 并且在PD-1阻断失败后, 用Tim-3阻断抗体治疗的小鼠具有明显提高的生存率, 研究者们分析了来自人类患者的肿瘤标本证实这一发现——在抗PD-1治疗失败时, Tim-3在阻断抗体结合T细胞方面也有类似的上调。这提示假设在活检时测量多个免疫检查点就可以提供特定和个性化的免疫治疗策略, 以更好地弥补免疫检查点表达的动态和多样性带来的治疗困难。
5 潜在肿瘤标记物与肿瘤疗效预测Rab27蛋白是Ras家族中小GTP酶Rab家族一员, 在囊泡的形成、运输、融合等过程中发挥着重要的作用, 而在肿瘤的发生发展过程中, 囊泡的运输及其胞吐作用起着非常重要的作用。有研究表明, Rab27A、Rab27B与肿瘤转移相关的临床特征关系密切, 可以作为潜在的肿瘤标记物来判断预后; 且Rab27与肿瘤转移密切相关, 有望成为潜在的肿瘤标记物[43]。
6 总结与展望免疫治疗为癌症治疗带来了根本性的改变, 其中, 免疫检查点抑制剂凭借不良反应少、应用范围广的特点, 为患者带了新的希望, 发展前景广阔。但仅有小部分患者能从治疗中受益的现状和耐药的发生为免疫治疗带来新的挑战。目前, 对于PD-1/PD-L1的作用机制和耐药机制依然不清晰, 潜在肿瘤标记物与肿瘤疗效预测还有待进一步的研究。在突破免疫治疗耐药的瓶颈方面, 研究者们致力于新靶点的发现和联合治疗的探索, 但临床上尚未得到令人满意的结果。因此, 未来研究对进一步优化免疫治疗策略、更加精准筛选出免疫治疗响应率高的患者以及耐药机制等问题的阐明都有待研究者们作进一步的努力。
| [1] | Liang SC, Latchman YE, Buhlmann JE, et al. Regulation of PD-1, PD-L1, and PD-L2 expression during normal and autoimmune responses[J]. Eur J Immunol, 2003, 33: 2706–2716. DOI:10.1002/eji.200324228 |
| [2] | Keir ME, Liang SC, Guleria I, et al. Tissue expression of PD-L1 mediates peripheral T cell tolerance[J]. J Exp Med, 2006, 203: 883–895. DOI:10.1084/jem.20051776 |
| [3] | He J, Hu Y, Hu M, et al. Development of PD-1/PD-L1 pathway in tumor immune microenvironment and treatment for non-small cell lung cancer[J]. Sci Rep, 2015, 5: 13110. DOI:10.1038/srep13110 |
| [4] | Montler R, Bell RB, Thalhofer C, et al. OX40, PD-1 and CTLA-4 are selectively expressed on tumor-infiltrating T cells in head and neck cancer[J]. Clin Transl Immunol, 2016, 5: e70. DOI:10.1038/cti.2016.16 |
| [5] | Ahmadzadeh M, Johnson LA, Heemskerk B, et al. Tumor antigen-specific CD8 T cells infiltrating the tumor express high levels of PD-1 and are functionally impaired[J]. Blood, 2009, 114: 1537–1544. |
| [6] | Konishi J, Yamazaki K, Azuma M, et al. B7-H1 expression on non-small cell lung cancer cells and its relationship with tumor-infiltrating lymphocytes and their PD-1 expression[J]. Clin Cancer Res, 2004, 10: 5094–5100. DOI:10.1158/1078-0432.CCR-04-0428 |
| [7] | Vokes EE, Ready N, Felip E, et al. Nivolumab versus docetaxel in previously treated advanced non-small-cell lung cancer (CheckMate 017 and CheckMate 057): 3-year update and outcomes in patients with liver metastases[J]. Ann Oncol, 2018, 29: 959–965. DOI:10.1093/annonc/mdy041 |
| [8] | Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial[J]. Lancet, 2016, 387: 1540–1550. DOI:10.1016/S0140-6736(15)01281-7 |
| [9] | Reck M, Rodriguez-Abreu D, Robinson AG, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer[J]. N Engl J Med, 2016, 375: 1823–1833. DOI:10.1056/NEJMoa1606774 |
| [10] | Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after chemoradiotherapy in stage Ⅲ non-small-cell lung cancer[J]. N Engl J Med, 2017, 377: 1919–1929. DOI:10.1056/NEJMoa1709937 |
| [11] | Passiglia F, Bronte G, Bazan V, et al. PD-L1 expression as predictive biomarker in patients with NSCLC: a pooled analysis[J]. Oncotarget, 2016, 7: 19738–19747. |
| [12] | Abdel-Rahman O. Correlation between PD-L1 expression and outcome of NSCLC patients treated with anti-PD-1/PD-L1 agents: a meta-analysis[J]. Crit Rev Oncol Hematol, 2016, 101: 75–85. DOI:10.1016/j.critrevonc.2016.03.007 |
| [13] | McGranahan N, Furness AJS, Rosenthal R, et al. Clonal neo-antigens elicit T cell immunoreactivity and sensitivity to immune checkpoint blockade[J]. Science, 2016, 351: 1463–1469. DOI:10.1126/science.aaf1490 |
| [14] | Rizvi NA, Hellmann MD, Snyder A, et al. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer[J]. Science, 2015, 348: 124–128. DOI:10.1126/science.aaa1348 |
| [15] | Ayers M, Lunceford J, Nebozhyn M, et al. IFN-γ-related mRNA profile predicts clinical response to PD-1 blockade[J]. J Clin Invest, 2017, 127: 2930–2940. DOI:10.1172/JCI91190 |
| [16] | Johnson DB, Estrada MV, Salgado R, et al. Melanoma-specific MHC-Ⅱ expression represents a tumour-autonomous phenotype and predicts response to anti-PD-1/PD-L1 therapy[J]. Nat Commun, 2016, 7: 10582. DOI:10.1038/ncomms10582 |
| [17] | Routy B, Le Chatelier E, Derosa L, et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors[J]. Science, 2018, 359: 91–97. DOI:10.1126/science.aan3706 |
| [18] | Gopalakrishnan V, Spencer CN, Nezi L, et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients[J]. Science, 2018, 359: 97–103. DOI:10.1126/science.aan4236 |
| [19] | Zhao MX, Guo WJ, Wu YY, et al. SHP2 inhibition triggers anti-tumor immunity and synergizes with PD-1 blockade[J]. Acta Pharm Sin B, 2019, 9: 304–315. DOI:10.1016/j.apsb.2018.08.009 |
| [20] | Herbst RS, Soria JC, Kowanetz M, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients[J]. Nature, 2014, 515: 563–567. DOI:10.1038/nature14011 |
| [21] | Sharpe AH, Pauken KE. The diverse functions of the PD1 inhibitory pathway[J]. Nat Rev Immunol, 2017, 18: 153–167. |
| [22] | Sage PT, Francisco LM, Carman CV, et al. The receptor PD-1 controls follicular regulatory T cells in the lymph nodes and blood[J]. Nat Immunol, 2013, 14: 152–161. DOI:10.1038/ni.2496 |
| [23] | Stathopoulou C, Gangaplara A, Mallett G, et al. PD-1 inhibitory receptor downregulates asparaginyl endopeptidase and maintains Foxp3 transcription factor stability in induced regulatory T cells[J]. Immunity, 2018, 49: 247–263.e7. DOI:10.1016/j.immuni.2018.05.006 |
| [24] | Chang CH, Qiu J, O'Sullivan D, et al. Metabolic competition in the tumor microenvironment is a driver of cancer progression[J]. Cell, 2015, 162: 1229–1241. DOI:10.1016/j.cell.2015.08.016 |
| [25] | Ascierto ML, McMiller TL, Berger AE, et al. The intratumoral balance between metabolic and immunologic gene expression is associated with anti-PD-1 response in patients with renal cell carcinoma[J]. Cancer Immunol Res, 2016, 4: 726–733. DOI:10.1158/2326-6066.CIR-16-0072 |
| [26] | Spranger S, Bao R, Gajewski TF. Melanoma-intrinsic β-catenin signalling prevents anti-tumour immunity[J]. Nature, 2015, 523: 231–235. DOI:10.1038/nature14404 |
| [27] | Hölzel M, Tüting T. Inflammation-induced plasticity in melanoma therapy and metastasis[J]. Trends Immunol, 2016, 37: 364–374. DOI:10.1016/j.it.2016.03.009 |
| [28] | Emran AA, Chatterjee A, Rodger EJ, et al. Targeting DNA methylation and EZH2 activity to overcome melanoma resistance to immunotherapy[J]. Trends Immunol, 2019, 40: 328–344. DOI:10.1016/j.it.2019.02.004 |
| [29] | Liao WT, Overman MJ, Boutin AT, et al. KRAS-IRF2 axis drives immune suppression and immune therapy resistance in colorectal cancer[J]. Cancer Cell, 2019, 35: 559–572. DOI:10.1016/j.ccell.2019.02.008 |
| [30] | Coelho MA, de Carné Trécesson S, Rana S, et al. Oncogenic RAS signaling promotes tumor immunoresistance by stabilizing PD-L1 mRNA[J]. Immunity, 2017, 47: 1083–1099. DOI:10.1016/j.immuni.2017.11.016 |
| [31] | Zaretsky JM, Garcia-Diaz A, Shin DS, et al. Mutations associated with acquired resistance to PD-1 blockade in melanoma[J]. N Engl J Med, 2016, 375: 819–829. DOI:10.1056/NEJMoa1604958 |
| [32] | Ota K, Azuma K, Kawahara A, et al. Induction of PD-L1expression by the EML4-ALK oncoprotein and downstream signaling pathways in non-small cell lung cancer[J]. Clin Cancer Res, 2015, 21: 4014–4021. DOI:10.1158/1078-0432.CCR-15-0016 |
| [33] | Li J, Chen Y, Shi X, et al. A systematic and genome-wide correlation meta-analysis of PD-L1 expression and targetable NSCLC driver genes[J]. J Thorac Dis, 2017, 9: 2560–2571. DOI:10.21037/jtd.2017.07.117 |
| [34] | Gainor JF, Shaw AT, Sequist LV, et al. EGFR mutations and ALK rearrangements are associated with low response rates to PD-1 pathway blockade in non-small cell lung cancer: a retrospective analysis[J]. Clin Cancer Res, 2016, 22: 4585–4593. DOI:10.1158/1078-0432.CCR-15-3101 |
| [35] | Overacre-Delgoffe AE, Chikina M, Dadey RE, et al. Interferon-γ drives Treg fragility to promote anti-tumor immunity[J]. Cell, 2017, 169: 1130–1141. DOI:10.1016/j.cell.2017.05.005 |
| [36] | Hugo W, Zaretsky JM, Sun L, et al. Genomic and transcriptomic features of response to anti-PD-1 therapy in metastatic melanoma[J]. Cell, 2016, 165: 35–44. DOI:10.1016/j.cell.2016.02.065 |
| [37] | Chen CF, Ruiz-Vega R, Vasudeva P, et al. ATR mutations promote the growth of melanoma tumors by modulating the immune microenvironment[J]. Cell Rep, 2017, 18: 2331–2342. DOI:10.1016/j.celrep.2017.02.040 |
| [38] | Chatterjee A, Rodger EJ, Ahn A, et al. Marked global DNA hypomethylation is associated with constitutive PD-L1 expression in melanoma[J]. iScience, 2018, 4: 312–325. DOI:10.1016/j.isci.2018.05.021 |
| [39] | Sheng WQ, LaFleur MW, Nguyen TH, et al. LSD1 ablation stimulates anti-tumor immunity and enables checkpoint blockade[J]. Cell, 2018, 174: 549–563. DOI:10.1016/j.cell.2018.05.052 |
| [40] | Balkhi MY, Wittmann G, Xiong F, et al. YY1 upregulates checkpoint receptors and downregulates type I cytokines in exhausted, chronically stimulated human T cells[J]. iScience, 2018, 2: 105–122. DOI:10.1016/j.isci.2018.03.009 |
| [41] | Anagnostou V, Smith KN, Forde PM, et al. Evolution of neo-antigen landscape during immune checkpoint blockade in non-small cell lung cancer[J]. Cancer Discov, 2017, 7: 264–276. DOI:10.1158/2159-8290.CD-16-0828 |
| [42] | Koyama S, Akbay EA, Li YY, et al. Adaptive resistance to therapeutic PD-1 blockade is associated with upregulation of alternative immune checkpoints[J]. Nat Commun, 2016, 7: 10501. DOI:10.1038/ncomms10501 |
| [43] | Poggio M, Hu TY, Pai CC, et al. Suppression of exosomal PD-L1 induces systemic anti-tumor immunity and memory[J]. Cell, 2019, 177: 414–427. DOI:10.1016/j.cell.2019.02.016 |
 2019, Vol. 54
2019, Vol. 54


