肿瘤已成为严重影响人类健康的重大问题。目前对肿瘤发生发展机制认识尚不明了, 对肿瘤的治疗并不理想。近年来, 越来越多的研究显示肿瘤微环境在肿瘤的发生发展中起着重要的作用。针对肿瘤微环境中肿瘤免疫和肿瘤代谢的治疗是目前肿瘤治疗研究的热点, 肿瘤免疫和肿瘤代谢的靶点研究对肿瘤药物的研发具有重要意义。本文对近年来肿瘤免疫代谢的药物靶点研究进展及药物开发进展进行综述。
1 肿瘤微环境肿瘤微环境(tumor microenvironment, TME), 即肿瘤细胞产生和生活的内环境。早在1889年, 英国外科医生Stephen Paget等[1, 2]就提出著名的“种子与土壤”学说, 即肿瘤细胞“种子”的生长, 需要合适的肿瘤微环境的“土壤”。然而, 这一假说在当时并未受到足够的重视, 肿瘤治疗仅仅局限于杀死肿瘤细胞。直到近些年来, 越来越多的研究阐明肿瘤微环境的构成, 并发现肿瘤微环境对肿瘤的发生、发展起重要作用。肿瘤微环境是一个动态网络, 其中不仅包括了肿瘤细胞本身, 还包括存在于肿瘤细胞周围基质中的肿瘤相关成纤维细胞、内皮细胞、周细胞、脂肪细胞、间充质干细胞、B淋巴细胞、T淋巴细胞、髓源性细胞、单核细胞、肿瘤相关巨噬细胞以及血管、淋巴管、细胞外基质等。肿瘤微环境中的基质细胞和肿瘤细胞通过旁分泌或细胞-细胞间的直接作用, 抑制免疫细胞的免疫识别监视功能, 改变各类细胞的代谢, 促进肿瘤组织内的慢性炎症样反应, 影响肿瘤内血管形成, 促进肿瘤的生长与转移[3-5]。
1.1 肿瘤免疫微环境肿瘤免疫治疗自19世纪末被提出后, 逐渐引起人们的关注。免疫逃逸是肿瘤的十大特征之一[6]。肿瘤免疫治疗逐渐引起科学家的重视。肿瘤免疫治疗是通过激活人体本身的免疫系统从而起到杀灭肿瘤细胞[7]。近10年来, 肿瘤免疫治疗取得了显著的进展。2013年, Science杂志将肿瘤免疫治疗列于十大科学突破之首。2018年, 诺贝尔生理学或医学奖授予美国的James Allison与日本的Tasuku Honjo, 以表彰他们在肿瘤免疫疗法的贡献。目前, 肿瘤免疫疗法已在多种肿瘤如黑色素瘤、肺癌、前列腺癌和肾癌等多种实体瘤的治疗中展示了良好的治疗效果[8-11]。
虽然肿瘤免疫治疗取得了巨大的成功, 但临床上仍有一部分患者对免疫疗法没有反应。随着对肿瘤免疫的进一步研究, 人们逐渐了解到肿瘤免疫微环境的复杂性和多样性是影响免疫治疗效果的关键因素。免疫微环境的改变, 可能会使原本并不响应免疫治疗的患者, 变为响应治疗。目前, 如何改变免疫微环境使其响应免疫治疗, 是扩展免疫治疗应用范围、提高免疫治疗效率的重要研究方向。
在肿瘤微环境中, 单核细胞、髓源性抑制细胞可以在趋化因子配体2 (C-C motif chemokine ligand 2, CCL2)、趋化因子配体5 (C-C motif chemokine ligand 5, CCL5)和集落刺激因子1 (colony stimulating factor 1, CSF-1)等趋化因子的诱导下被招募到肿瘤中, 并进一步分化为肿瘤相关巨噬细胞。肿瘤相关巨噬细胞主要分为两类, 即促炎M1型和免疫抑制M2型。肿瘤微环境中白介素4 (interleukin 4, IL-4)和白介素13 (interleukin 13, IL-13)等M2极化因子含量丰富, 因此肿瘤相关巨噬细胞大多类似M2巨噬细胞。肿瘤相关巨噬细胞能够分泌表皮生长因子(epidermal growth factor, EGF)和趋化因子配体18 (C-C motif chemokine ligand 18, CCL18)等因子促进肿瘤生长; 通过释放基质金属蛋白酶(matrix metallopeptidase, MMP)和尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator, uPA)等因子促进肿瘤细胞浸润和转移; 通过表达血管内皮生长因子(vascular endothelial growth factor, VEGF)促进肿瘤血管新生从而参与到一系列肿瘤进程中[12, 13]。另外, 在不同类型的肿瘤微环境中还发现有调节性T细胞(Treg细胞)浸润。Treg细胞是一类可以调节多种免疫细胞功能的T细胞亚群, 主要通过抑制T细胞的活化, 发挥免疫调节及诱导免疫耐受作用。Treg细胞也是免疫抑制性肿瘤微环境的主要组成成分, 其在肿瘤局部微环境中, 对抗肿瘤免疫应答过程, 发挥免疫抑制作用, 并协助肿瘤细胞参与免疫逃逸, 进而影响肿瘤的恶性演进过程[14]。
肿瘤免疫微环境的复杂性与异质性增加了肿瘤免疫疗法的难度, 也影响了免疫疗法的效率。免疫微环境已成为近年来肿瘤免疫治疗新的研究方向, 与常规肿瘤疗法联合应用可以很大程度上提高肿瘤治疗的效果。
1.2 肿瘤代谢微环境肿瘤细胞代谢相对于正常细胞具有较高的异质性。为了维持其快速的生长和增殖, 肿瘤细胞必须拥有相较于正常细胞更高的代谢速率。1924年, 德国化学家Otto Warburg提出肿瘤细胞为了适应其快速生长对营养物质的需求, 选择进行有氧糖酵解而不进行三羧酸循环获取能量, 这就是著名的瓦伯格效应(Warburg effect)[15], 他因此获得1931年的诺贝尔奖。肿瘤中能量代谢途径出现异常, 因此肿瘤也被认为是一种代谢性疾病。2011年, Hanahan和Weinberg[6]将肿瘤代谢异常列为肿瘤的十大特征之一。由此可见, 肿瘤代谢异常在肿瘤的发生发展中起着重要的作用。
肿瘤细胞不仅通过有氧糖酵解为自身生长提供能量, 也可以通过丝氨酸代谢等途径为细胞复制提供生物大分子, 同时也会大量利用谷氨酰胺、脂类物质等促进自身增殖。肿瘤细胞的代谢方式是复杂多样的, 它会根据自身所处环境的变化而选择适合自己的代谢方式来满足自身增殖, 这种通过改变肿瘤能量代谢方式的适应性称为能量代谢重编程[16]。肿瘤微环境会诱发肿瘤细胞代谢发生重编程, 此过程会导致肿瘤细胞与宿主免疫细胞竞争利用营养物质。研究表明, 肿瘤细胞可以竞争性摄取葡萄糖, 从而影响T细胞的代谢模式, 抑制T细胞的哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)活性、糖酵解能力和干扰素γ (interferon-γ, INF-γ)的产生[17]。不仅如此, 肿瘤细胞来源的代谢产物可通过多种方式影响免疫细胞的激活及效应功能的发挥。肿瘤细胞分泌的乳酸、前列腺素E2 (prostaglandin E2, PEG2), 可以促进巨噬细胞从M1抑癌型向M2促癌型的转换, 最终达到促使肿瘤细胞存活及增殖的目的[18, 19]。因此, 靶向肿瘤代谢对肿瘤免疫和肿瘤治疗具有重要的意义。
2 肿瘤免疫药物靶点及相关药物研究进展目前, 肿瘤免疫治疗蓬勃发展。纽约癌症研究所(Cancer Research Institute, CRI)于2018年10月公布的《全球肿瘤免疫治疗发展趋势》调查报告, 报告显示全球有417个处于临床研究阶段的靶点。相比2017年, 2018年肿瘤免疫治疗全球项目数增加67%, 靶点数增加50%, 有临床开发项目的企业与机构数增加42%。另外, 全球50%的研究项目集中在最热门的48个靶点上[20], 图 1列出了最热门的15个肿瘤免疫相关靶点及其项目数。目前, 靶向免疫调节的靶点主要分3类: T细胞免疫检查点、肿瘤组织免疫检查点和免疫环境调控靶点。
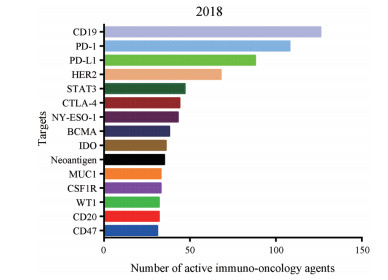
|
Figure 1 The top 15 of immuno-oncology targets |
正常生理情况下, T细胞依赖抗原提呈细胞提呈的外源或内源性抗原与T细胞表面受体结合以及额外的共刺激信号来充分激活, 然后通过其他效应细胞对表达相关抗原的细胞进行杀伤。在肿瘤微环境中, T细胞的激活与抑制处于异常模式。靶向T细胞免疫检查点治疗是采用共抑制分子或配体的单克隆抗体来阻断信号, 从而活化T细胞, 增强其杀伤肿瘤细胞的能力[21]。细胞毒T淋巴细胞相关抗原4 (cytotoxic T lymphocyte-associated antigen-4, CTLA-4)和程序性细胞死亡受体1 (programmed cell death protein 1, PD-1)是最为经典的、临床上最常用的T细胞免疫检查点, 针对它们开发的抗体药物已在黑色素瘤和肺癌等患者的临床治疗中表现出很好的治疗效果。
CTLA-4, 又名CD152, 是由CTLA-4基因编码的一种跨膜蛋白质, 表达于活化的CD4+和CD8+ T细胞, 是免疫系统中一个至关重要的“刹车”。1995年, Sharpe和Mak两课题组[22, 23]分别利用CTLA-4基因敲除小鼠模型发现了CTLA-4基因负调控T细胞活化的功能。Allison课题组等[24]发现开发出抗体阻断CTLA-4功能, 可以增强CD8+ T细胞对肿瘤的杀伤力。CTLA-4还参与了其他免疫控制途径。Treg细胞在肿瘤中大量存在, 并高度表达CTLA-4。在CTLA-4敲除小鼠模型中, Treg细胞控制效应T细胞的功能被削弱, 说明CTLA-4对Treg细胞功能也很重要。所以, CTLA-4抗体可能通过去除调节性T细胞而增强肿瘤免疫[25-27]。目前获批上市的CTLA-4抗体只有伊匹单抗(ipilimumab)[28]。2011年, 美国食品药品监督管理局(FDA)批准伊匹单抗用于治疗晚期黑色素瘤。2018年, 伊匹单抗被批准用于一线治疗中高危晚期肾细胞癌的联合用药(表 1)。
| Table 1 Tumor immune related therapeutic drugs. CTLA-4: Cytotoxic T lymphocyte- associated antigen-4; PD-1: Programmed cell death protein 1; PD-L1: Programmed death ligand 1 |
PD-1是表达在T细胞表面的另一种重要的免疫抑制跨膜蛋白, 为T细胞特异性表面糖蛋白CD28超家族成员。PD-1是最早由日本科学家本庶佑[29]在1992年发现的, 它在B和T淋巴细胞都表达, 通过与其配体程序性死亡配体1 (programmed death ligand 1, PD-L1)和程序性死亡配体2 (programmed death ligand 2, PD-L2)结合来调节T细胞活化。PD-1与PD-L1相互作用, 可以导致肿瘤抗原特异性T细胞凋亡, 抑制IFN-γ、肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)和白介素2 (interleukin 2, IL-2)等细胞因子的分泌, 使肿瘤细胞逃脱机体免疫监控[30, 31]。目前FDA批准上市的PD-1抑制剂有帕姆单抗(pembrolizumab)、纳武单抗(nivolumab)和cemiplimab。其中, 帕姆单抗和纳武单抗都于2014年获得FDA批准, 用于不可切除的或转移性晚期黑色素瘤和晚期非小细胞肺癌的治疗。目前, 这两种药物已经在中国获批上市。Cemiplimab于2018年9月获批, 用于转移性、局部晚期皮肤鳞状细胞癌的治疗。除此之外, 国内上市的还有我国自主研发的3个PD-1单抗药物, 分别为特瑞普利单抗、信迪利单抗和卡瑞利珠单抗(表 1)。目前还没有靶向于PD-1的小分子抑制剂上市。
此外, 还有一些其他的T细胞免疫检查点如淋巴细胞激活基因3 (lymphocyte activation gene 3, LAG-3)、T细胞免疫球蛋白黏蛋白3 (T-cell immunoglobulin mucin 3, TIM-3)、T细胞活化的免疫球蛋白V结构域抑制剂(V-domain Ig suppressor of T cell activation, VISTA)等[32, 33]。LAG-3和CD4是同源蛋白, 主要表达在活化的T淋巴细胞、B淋巴细胞、自然杀伤细胞(natural killer cell, NK)和浆细胞样树突状细胞(plasma cytoid dendritic cells, pDCs), 并负调控T细胞功能[34]。TIM-3是TIM家族的一个受体蛋白, 在T细胞、Treg细胞和先天免疫细胞(树突细胞、自然杀伤细胞、单核细胞)表面表达。与其他免疫检查点分子不同的是, TIM-3并非在所有T细胞激活后得以上调, 仅在CD4+ T细胞和CD8+ T细胞中上调, 参与协同抑制作用[35]。VISTA又叫血小板受体Gi24、PD-1同源蛋白(PD-1H), 属于免疫球蛋白家族, 胞外结构域和PD-L1同源。人源的VISTA主要表达在CD4+ T细胞、CD8+ T细胞、CD11b+亚群的单核细胞、淋巴细胞、骨髓细胞、树突细胞亚群和中性粒细胞[36]。目前VISTA的细胞表面受体尚不清楚。靶向于这3个靶点的药物研发仍处于临床试验阶段, 尚没有上市药物。
2.2 肿瘤组织免疫检查点肿瘤组织免疫检查点中最经典的为PD-L1, 又称CD274和B7-H1, 是华人科学家陈列平教授课题组[37]首次发现的。在许多肿瘤组织中均可以检测到PD-L1蛋白的表达, 肿瘤微环境可诱导肿瘤细胞上PD-L1的表达, 表达的PD-L1有利于肿瘤的发生和生长, 诱导抗肿瘤T细胞的失活。PD-L1是PD-1的配体, 它与PD-1的结合会导致PD-1的胞内结构域的酪氨酸磷酸化, 并招募酪氨酸磷酸酶SHP-2, 从而减少T细胞受体(T cell receptor, TCR)信号通路的磷酸化, 降低了TCR通路下游的激活信号以及T细胞的激活和细胞因子的生成。因此PD-1/PD-L1通路的抑制会加速和加强自身免疫[38, 39]。目前, 已上市的PD-L1抗体有3个。阿特珠单抗(atezolizumab)于2016年5月18日首次获得FDA批准, 是FDA批准的首个PD-L1抑制剂, 适用于膀胱癌和非小细胞肺癌。Avelumab被美国FDA认证为治疗默克尔细胞癌的孤儿药, 2017年获批用于治疗晚期或转移性尿路上皮癌。Durvalumab于2017年获批上市, 可用于尿路上皮癌(表 1)。
尽管目前免疫检查点治疗已逐步成为多种实体瘤的新的治疗标准, 但是在临床试验中也面临着许多问题, 包括治疗周期长和费用昂贵等。其中最为严重的问题是免疫疗法的总体有效率低, 并不是所有患者都对免疫疗法有响应。以PD-1/L1抑制剂为例, 其疗效与多种因素相关, 如PD-L1表达情况、微卫星不稳定性(microsatellite instability, MSI)和肿瘤突变负荷(tumor mutational burden, TMB)等。通常, PD-L1表达水平越高, 阻断后被免疫细胞识别的可能性就大大增加, 治疗有效率就越高。MSI是指由于DNA复制时插入或缺失突变引起的简单重复序列长度改变的现象, 通常由错配修复功能缺陷引起。研究表明, 在结直肠癌中, PD-1/L1抑制剂可显著提高出现错配基因修复缺失以及微卫星不稳定的患者的生存率[40]。TMB是指肿瘤细胞基因组中, 所评估基因的编码区发生置换和插入/缺失性突变(体细胞突变)的总数。一般检测到TMB大于20即为高负荷状态。研究发现TMB越大, PD-1/L1抑制剂有效率越高[41]。
临床发现, 免疫检测点抑制剂还有可能为患者带来一系列的毒副作用, 包括腹泻、结肠炎、肝炎、皮肤毒性和内分泌毒性, 如垂体炎和甲状腺功能障碍[42]。更有甚者, 免疫治疗可能会引起一些患者的病情加重, 这种现象被称为疾病超进展(hyperprogressive disease, HPD)现象。疾病超进展通常表现为治疗后肿瘤生长率是治疗前的2倍以上[43]。研究发现, 在406例接受了PD-1/L1抑制剂治疗的非小细胞肺癌患者中, 有13.8%的患者出现了HPD现象, 而在59例接受了常规单药化疗的非小细胞肺癌患者中, 仅有5.1%的患者出现HPD现象[44]。HPD的发生与多种因素相关。通常情况下, 老年患者(≥65岁) HPD发生率高于年龄 < 65岁的患者, 这可能与老年人特有的机体免疫特征相关[43]。在头颈部鳞状细胞癌中, 局部复发转移的患者HPD发生率高于未出现复发转移的患者[45]。目前, 超进展的发生机制仍在探索中。有研究发现, 发生超进展的肿瘤患者通常出现MDM2原癌基因(MDM2 proto-oncogene, MDM2)和MDM4原癌基因(MDM4 proto-oncogene, MDM4)基因扩增以及表皮生长因子受体(epidermal growth factor receptor, EGFR)突变, 但其具体机制尚不明确[46]。
2.3 免疫环境调控免疫环境调控是指对肿瘤微环境中的巨噬细胞、抗原呈递细胞、自然杀伤细胞等免疫细胞和IL-2、IL-10、转化生长因子β (transforming growth factor β, TGF-β)等免疫分子之间相互作用的调节, 从而激活抗肿瘤细胞免疫应答。免疫调控因子药物就是针对免疫环境进行调控的一类药物, 临床上多用于辅助用药, 如白介素(IL)。IL-2又名T细胞生长因子, 主要由活化的CD4+ T细胞和CD8+ T细胞产生, 是所有T细胞亚群的生长因子, 并可促进活化B细胞增殖, 故为调控免疫应答的重要因子, 也参与抗体反应、造血和肿瘤监视。高剂量IL-2是CTLA-4抗体ipilimumab被批准上市前唯一用来治疗黑色素瘤的非手术方法[7, 47]。
3 肿瘤代谢药物靶点及相关药物研究进展随着肿瘤的发展, 肿瘤细胞能够进行能量代谢重塑。葡萄糖代谢、脂代谢和氨基酸代谢等代谢途径的改变, 对肿瘤的发生、发展、转移起着非常重要的作用[48] (图 2)。靶向肿瘤代谢途径对肿瘤的治疗具有重要作用, 靶向肿瘤代谢途径的研究已成为近年来研究热点。
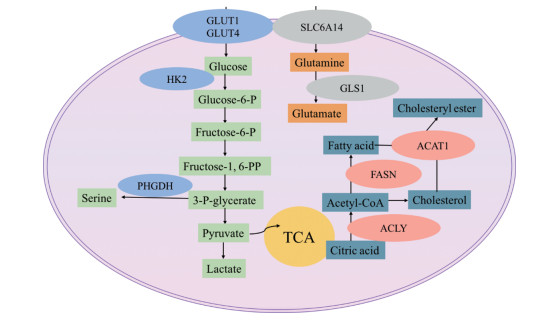
|
Figure 2 Tumor cell metabolic pathway. HK2: Hexokinase 2; GLUT1: Glucose transporter 1; PHGDH: Phosphoglycerate dehydrogenase; ACLY: ATP citrate lyase; FASN: Fatty acid synthase; ACAT1: Acetyl-CoA acetyltransferase 1; SLC6A14: Solute carrier family 6 member 14; GLS1: Glutaminase |
葡萄糖代谢异常是肿瘤代谢最突出的特点。肿瘤细胞有氧糖酵解能力是正常细胞的20~30倍。因此, 靶向糖酵解等异常环节的代谢酶是抗肿瘤治疗的重点(表 2)。在糖酵解过程中, 己糖激酶(hexokinase, HK)是第一个限速酶, 可催化葡萄糖转化为葡萄糖-6-磷酸, 这是葡萄糖代谢过程最为重要的反应。在肿瘤细胞中, 葡萄糖代谢的第一个限速步骤即发生异常, 相比正常细胞, 肿瘤细胞葡萄糖摄入量增加且HK2的表达显著上调[49]。HK2在正常细胞中几乎不表达, 因此可以靶向HK2从而靶向肿瘤细胞。研究表明, 抑制HK2可以安全有效地阻断肿瘤的生长[50]。3-溴丙酮酸(3-bromopyruvate, 3BrPA)是HK2的靶向抑制剂, 它可以通过降低HK2和ATP水平从而抑制多发性骨髓瘤细胞增殖, 起到抗肿瘤作用[51]。
| Table 2 Tumor metabolism related target therapeutic drugs. LDH: Lactate dehydrogenase |
肿瘤细胞糖酵解需要摄入大量葡萄糖, 因此, 阻断肿瘤生长还应着眼于切断葡萄糖转运途径, 即抑制葡萄糖转运酶活性[52]。葡萄糖转运体1 (glucose transporter 1, GLUT1)与葡萄糖高度亲和, 在胃癌、结直肠癌、肾癌及肺癌等多种肿瘤中高表达[53]。WZB117是GLUT1的抑制剂, 它可以抑制肺癌细胞A549和乳腺癌MCF7细胞的细胞增殖。葡萄糖转运体4 (glucose transporter 4, GLUT4)主要在多发性骨髓瘤表达, 负责维持足够的葡萄糖摄入。有文献报道, 人类免疫缺陷病毒(human immunodeficiency virus, HIV)蛋白酶抑制剂利托韦那可以靶向抑制GLUT4, 从而抑制多发性骨髓瘤的生长[54]。
磷酸甘油酸脱氢酶(phosphoglycerate dehydrogenase, PHGDH)是糖酵解通路的旁支——丝氨酸合成通路的第一个分支酶, 可以催化糖酵解中间产物3-磷酸甘油酸生成3-磷酸羟基丙酮酸, 将糖酵解中间产物引入丝氨酸生物合成途径, 是下游一系列反应的重要限速酶。近年来发现PHGDH与乳腺癌、胃癌、结肠癌、黑色素瘤等多种肿瘤的发生发展相关[55-57]。抑制PHGDH可以阻断丝氨酸生物合成, 从而抑制肿瘤的增殖[55]。研究发现, 小分子抑制剂CRB-5884可以抑制肿瘤细胞的丝氨酸合成, 并且特异性抑制具有高丝氨酸生物合成活性的黑色素瘤和乳腺癌细胞增殖[55]。
乳酸脱氢酶(lactate dehydrogenase, LDH)也是糖酵解的关键酶之一, 可以催化丙酮酸转换为乳酸和还原型辅酶(nicotinamide adenine dinucleotide, NADH), 氧化生成NAD+。LDH有A、B、C三种亚型, 其中, LDHA在多种肿瘤组织中高表达, 如乳腺癌、前列腺癌和胰腺癌等, 并与临床结果不佳有关[58-60]。仿制药二氯乙酸是一种可口服的小分子, 可以通过抑制LDHA从而增加丙酮酸进入线粒体的通量, 促进葡萄糖氧化, 诱导肿瘤中线粒体凋亡, 并抑制体外和体内肿瘤的生长[61, 62]。棓黄素(galloflavin, GF)也是一种LDHA抑制剂, 可以通过阻断糖酵解和ATP产生来抑制癌细胞的增殖[63]。
3.2 脂代谢肿瘤细胞中的脂代谢发生了特异性的变化, 这些改变影响了细胞生长、增殖、分化及迁移过程。最近的证据表明, 在某些类型的癌症如前列腺癌中, 细胞增殖的启动更依赖于脂质代谢而不是糖酵解[64]。靶向抑制脂肪酸合成可以削弱细胞增殖和存活的能力, 因为它限制了脂质膜的产生, 以及阻断线粒体中脂肪酸的β-氧化。目前, 针对于脂肪酸合成的靶点主要有ATP柠檬酸裂解酶(ATP citrate lyase, ACLY)和脂肪酸合成酶(fatty acid synthase, FASN) (表 2)。
ACLY是一种可催化柠檬酸盐生成乙酰辅酶A (acetyl CoA)的胞质酶。乙酰辅酶A是内源性脂肪酸和胆固醇生物合成的重要基础材料, 因此, 抑制ACLY有可能降低胆固醇和甘油三酯水平。目前, 已有文献报道, ACLY在多种肿瘤组织中高表达, 如肺癌、前列腺癌、膀胱癌、结直肠癌和乳腺癌等, 且ACLY高表达的患者预后较差[65-67]。ACLY高表达与肿瘤的淋巴结转移也密切相关[68]。ACLY作为脂质代谢的关键酶, 在肿瘤的发生发展中起着重要作用, 有可能成为肿瘤治疗的新靶点[65]。目前研究最多的ACLY抑制剂之一是柠檬酸的类似物。最早发现的ACLY抑制剂是羟基柠檬酸(hydroxycitric acid, HCA), HCA与α-硫辛酸(α-lipoic acid)联用可以抑制肿瘤生长, 且不显示任何毒性反应。SB-204990是另一种被证实的ACLY抑制剂, 它在生物体内和体外模型中都可以一定程度地抑制肿瘤的生长[69]。
FASN是重要的生物合成酶, 是肿瘤脂质生成的一种关键酶, 在催化脂肪酸合成的过程中发挥重要作用。FASN在代谢过程中主要负责内源性脂肪酸的合成, 并将乙酰CoA、丙二酰单酰CoA聚合成长链脂肪酸。FASN在乳腺癌、前列腺癌、黑色素瘤、膀胱癌、肺癌和卵巢癌等多种肿瘤中处于高表达水平, 且与患者的不良预后密切相连[70, 71]。因此, 抑制FASN表达可能成为一种新的治疗肿瘤手段。目前, 针对FASN的治疗手段有RNA干扰和FASN抑制剂浅蓝菌素和C75。浅蓝菌素是一种真菌的天然抗菌物, 为广谱的FASN抑制剂。浅蓝菌素能够抑制结直肠癌肝转移的发生, 并通过诱导凋亡来抑制小鼠结直肠癌细胞的生长, 是一种潜在的选择性抗肿瘤物质[72]。C75是人工合成的较稳定的化合物, 抑制FASN的酶活性进而抑制脂肪酸的合成。研究表明, 裸鼠皮下种植乳腺癌细胞后用C75治疗, 发现植入的肿瘤细胞的脂肪酸合成受到抑制并开始凋亡, 而且肿瘤的生长也受到了抑制, 但C75几乎不影响正常组织。因此, C75有可能成为一种抗肿瘤药物[73]。
除了靶向于脂肪酸合成外, 胆固醇代谢被认为在肿瘤的发生发展中起着重要作用。胆固醇酯化酶(acetyl-CoA acetyltransferase 1, ACAT1)是细胞内催化游离胆固醇和长链脂肪酸合成胆固醇酯的酶, 在体内胆固醇代谢平衡过程起到关键的调控作用(图 2)。ACAT1的抑制剂阿伐麦布被发现具有良好的抗肿瘤效果[74]。已有文献报道, 抑制胆固醇酯化能够增强CD8+ T细胞的抗肿瘤活性。阿伐麦布联合使用PD-1抗体具有良好的抗肿瘤效果[75]。阿伐麦布还可以抑制胰腺癌的生长, 减少胰腺癌转移到其他器官, 且表现出较好的安全性[76]。
3.3 氨基酸代谢蛋白质是细胞的重要组成物质之一, 而蛋白质是由氨基酸合成, 各类免疫细胞、因子的合成都有赖于氨基酸的合成、代谢, 因此, 氨基酸代谢可以改善肿瘤微环境。氨基酸代谢与肿瘤的产生、致癌基因的异常表达都有密切关系, 尤其是谷氨酰胺代谢。谷氨酰胺是人体内最为丰富的非必需氨基酸之一。在肿瘤中, 谷氨酰胺则是特定情况下的必需氨基酸[77]。因此, 通过靶向谷氨酰胺代谢, 可有效抑制肿瘤的生长。目前, 靶向于谷氨酰胺的药物主要有两类, 一类是抑制谷氨酰胺的摄入, 一类是抑制关键酶阻断谷氨酰胺代谢(表 2)。
在肿瘤中, 与谷氨酰胺转运相关蛋白表达水平发生上调, 利于肿瘤细胞摄入大量谷氨酰胺。溶质转运体家族6成员14 (solute carrier family 6 member 14, SLC6A14)是转运谷氨酰胺进入细胞的重要转运酶, 在结肠癌、宫颈癌、胰腺癌和乳腺癌中高表达, 在正常细胞中低表达。因此, 阻断SLC6A14可以抑制肿瘤中谷氨酰胺水平, 而对正常细胞无影响。已有文献报道, SLC6A14抑制剂α-MT可以抑制胰腺癌细胞的增殖、迁移和侵袭, 并且诱导细胞自噬[78]。α-MT在雌激素受体(estrogen receptor, ER)阳性乳腺癌中也起着肿瘤抑制作用。α-MT可以通过阻断mTOR信号通路激活ER阳性乳腺癌细胞自噬, 诱导细胞凋亡, 从而抑制细胞增殖。在裸鼠体内实验中, α-MT也具有显著的抗肿瘤效果[79, 80]。
在谷氨酰胺代谢中, 有一个重要的酶——谷氨酰胺酶(glutaminase, GLS)。在线粒体中, 谷氨酰胺经GLS催化脱氨基生成谷氨酸。研究发现, 淋巴瘤、神经胶质瘤、乳腺癌、胰腺癌、非小细胞肺癌和肾癌等肿瘤细胞均高表达GLS1[81-84]。上调的GLS1可以增强谷氨酰胺代谢, 促进肿瘤细胞增殖。因此, GLS1可以作为一个有效的抗肿瘤靶点。目前, 已发现不少针对GLS的抑制剂具有抗肿瘤活性。有文献报道, C-968可以以剂量依赖方式抑制肝细胞癌增殖[85]。在卵巢癌细胞中, C-968可以诱导细胞凋亡并将细胞周期阻滞在G1期, 还能增加细胞对紫杉醇的敏感性[86]。
4 总结与展望肿瘤免疫治疗已成为目前临床上治疗肿瘤的热门方向。与传统的放化疗和手术治疗相比, 免疫治疗的疗效更好, 不良反应更小, 尤其适用于不适合手术且有广泛转移风险的恶性肿瘤患者。肿瘤免疫微环境在肿瘤的发生发展中起着重要的作用, 靶向于肿瘤免疫中的重要检查点, 可以更好地提高患者对肿瘤免疫治疗的响应率, 从而获得更好的治疗效果。目前, PD-1、PD-L1、CTLA-4等免疫检查点的抑制剂已在临床上取得显著疗效, 拯救无数患者的生命。然而, 肿瘤免疫治疗也存在一些不足之处, 如个体差异性较大。提高患者对免疫治疗的响应性, 进一步扩展免疫治疗的应用范围, 是肿瘤免疫治疗的发展趋势。
肿瘤细胞代谢对肿瘤微环境产生了多方面的影响, 是促进肿瘤免疫抑制的重要原因之一。肿瘤代谢成为肿瘤治疗药物研发的热点。近年来, 临床上出现了许多以肿瘤代谢为靶点的抗肿瘤药物, 一些靶向于糖代谢、脂代谢、氨基酸代谢的抑制剂已取得显著的抗肿瘤疗效。目前在肿瘤代谢方面主要面对的问题是如何更好地提高这些抑制剂对肿瘤的特异性而不影响正常细胞代谢, 因此, 寻找更好地特异性靶向于肿瘤代谢的靶点, 是肿瘤代谢研究的主要方向。同时, 由于细胞代谢途径具有多样性, 存在众多的代谢旁路, 这些旁路的代偿也使得代谢抑制效果不佳。因此, 进一步深入研究肿瘤代谢途径, 了解肿瘤微环境中肿瘤代谢与肿瘤免疫的关系, 才能开发出更有效的代谢相关抗肿瘤药物。
本文总结了肿瘤免疫和肿瘤代谢过程中的一些重要作用靶点及其抑制剂, 包括已上市药物、临床研究阶段药物及一些在研药物。随着肿瘤研究的进一步深入, 将进一步了解肿瘤免疫和肿瘤代谢在肿瘤发生发展和侵袭转移中的作用, 有利于开发出更有效低毒的抗肿瘤药物。相信会有越来越多的靶向于肿瘤免疫和肿瘤代谢的药物进入临床, 为肿瘤治疗提供更多的选择。
| [1] | Paget S. The distribution of secondary growths in cancer of the breast. 1889[J]. Cancer Metastasis Rev, 1989, 8: 98–101. |
| [2] | Hoshino A, Costa-Silva B, Shen TL, et al. Tumour exosome integrins determine organotropic metastasis[J]. Nature, 2015, 527: 329–335. DOI:10.1038/nature15756 |
| [3] | Wu T, Dai Y. Tumor microenvironment and therapeutic response[J]. Cancer Lett, 2017, 387: 61–68. DOI:10.1016/j.canlet.2016.01.043 |
| [4] | Hanahan D, Coussens LM. Accessories to the crime: functions of cells recruited to the tumor microenvironment[J]. Cancer Cell, 2012, 21: 309–322. DOI:10.1016/j.ccr.2012.02.022 |
| [5] | Quail DF, Joyce JA. Microenvironmental regulation of tumor progression and metastasis[J]. Nat Med, 2013, 19: 1423–1437. DOI:10.1038/nm.3394 |
| [6] | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144: 646–674. DOI:10.1016/j.cell.2011.02.013 |
| [7] | Dougan M, Dougan SK. Targeting immunotherapy to the tumor microenvironment[J]. J Cell Biochem, 2017, 118: 3049–3054. DOI:10.1002/jcb.26005 |
| [8] | Rodriguez-Cerdeira C, Carnero Gregorio M, López-Barcenas A, et al. Advances in immunotherapy for melanoma: a comprehensive review[J]. Mediators Inflamm, 2017, 2017: 3264217. |
| [9] | Naylor EC, Desani JK, Chung PK. Targeted therapy and immunotherapy for lung cancer[J]. Surg Oncol Clin N Am, 2016, 25: 601–609. DOI:10.1016/j.soc.2016.02.011 |
| [10] | Bilusic M, Madan RA, Gulley JL. Immunotherapy of prostate cancer: facts and hopes[J]. Clin Cancer Res, 2017, 23: 6764–6770. DOI:10.1158/1078-0432.CCR-17-0019 |
| [11] | Cho YH, Kim MS, Chung HS, et al. Novel immunotherapy in metastatic renal cell carcinoma[J]. Investig Clin Urol, 2017, 58: 220–227. DOI:10.4111/icu.2017.58.4.220 |
| [12] | Sawa-Wejksza K, Kandefer-Szerszeń M. Tumor-associated macrophages as target for antitumor therapy[J]. Arch Immunol Ther Exp, 2018, 66: 97–111. DOI:10.1007/s00005-017-0480-8 |
| [13] | Mantovani A, Marchesi F, Malesci A, et al. Tumour-associated macrophages as treatment targets in oncology[J]. Nat Rev Clin Oncol, 2017, 14: 399–416. DOI:10.1038/nrclinonc.2016.217 |
| [14] | Watanabe MA, Oda JM, Amarante MK, et al. Regulatory T cells and breast cancer: implications for immunopathogenesis[J]. Cancer Metastasis Rev, 2010, 29: 569–579. DOI:10.1007/s10555-010-9247-y |
| [15] | Warburg O, Wind F, Negelein E. The metabolism of tumors in the body[J]. J Gen Physiol, 1927, 8: 519–530. DOI:10.1085/jgp.8.6.519 |
| [16] | Yoshida GJ. Metabolic reprogramming: the emerging concept and associated therapeutic strategies[J]. J Exp Clin Cancer Res, 2015, 34: 111. DOI:10.1186/s13046-015-0221-y |
| [17] | Chang CH, Qiu J, O'sullivan D, et al. Metabolic competition in the tumor microenvironment is a driver of cancer progression[J]. Cell, 2015, 162: 1229–1241. DOI:10.1016/j.cell.2015.08.016 |
| [18] | Pavlova NN, Thompson CB. The emerging hallmarks of cancer metabolism[J]. Cell Metab, 2016, 23: 27–47. DOI:10.1016/j.cmet.2015.12.006 |
| [19] | Luan B, Yoon YS, Le Lay J, et al. CREB pathway links PGE2 signaling with macrophage polarization[J]. Proc Natl Acad Sci U S A, 2015, 112: 15642–15647. |
| [20] | Tang J, Pearce L, O'donnell-Tormey J, et al. Trends in the global immuno-oncology landscape[J]. Nat Rev Drug Discov, 2018, 17: 922. |
| [21] | Sharma P, Allison JP. The future of immune checkpoint therapy[J]. Science, 2015, 348: 56–61. DOI:10.1126/science.aaa8172 |
| [22] | Tivol EA, Borriello F, Schweitzer AN, et al. Loss of CTLA-4 leads to massive lymphoproliferation and fatal multiorgan tissue destruction, revealing a critical negative regulatory role of CTLA-4[J]. Immunity, 1995, 3: 541–547. DOI:10.1016/1074-7613(95)90125-6 |
| [23] | Waterhouse P, Penninger JM, Timms E, et al. Lymphoproliferative disorders with early lethality in mice deficient in CTLA-4[J]. Science, 1995, 270: 985–988. DOI:10.1126/science.270.5238.985 |
| [24] | Leach DR, Krummel MF, Allison JP. Enhancement of antitumor immunity by CTLA-4 blockade[J]. Science, 1996, 271: 1734–1736. DOI:10.1126/science.271.5256.1734 |
| [25] | Piccirillo CA, Shevach EM. Naturally-occurring CD4+CD25+ immunoregulatory T cells: central players in the arena of peripheral tolerance[J]. Semin Immunol, 2004, 16: 81–88. DOI:10.1016/j.smim.2003.12.003 |
| [26] | Takahashi T, Tagami T, Yamazaki S, et al. Immunologic self-tolerance maintained by CD25+CD4+ regulatory T cells constitutively expressing cytotoxic T lymphocyte-associated antigen 4[J]. J Exp Med, 2000, 192: 303–310. DOI:10.1084/jem.192.2.303 |
| [27] | Wing K, Onishi Y, Prieto-Martin P, et al. CTLA-4 control over Foxp3+ regulatory T cell function[J]. Science, 2008, 322: 271–275. DOI:10.1126/science.1160062 |
| [28] | Hodi FS, O'day SJ, Mcdermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma[J]. N Engl J Med, 2010, 363: 711–723. DOI:10.1056/NEJMoa1003466 |
| [29] | Ishida Y, Agata Y, Shibahara K, et al. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death[J]. EMBO J, 1992, 11: 3887–3895. DOI:10.1002/j.1460-2075.1992.tb05481.x |
| [30] | Okazaki T, Honjo T. PD-1 and PD-1 ligands: from discovery to clinical application[J]. Int Immunol, 2007, 19: 813–824. DOI:10.1093/intimm/dxm057 |
| [31] | Chamoto K, Al-Habsi M, Honjo T. Role of PD-1 in immunity and diseases[J]. Curr Top Microbiol Immunol, 2017, 410: 75–97. |
| [32] | Joller N, Kuchroo VK. TIM-3, LAG-3, and TIGIT[J]. Curr Top Microbiol Immunol, 2017, 410: 127–156. |
| [33] | Le Mercier I, Chen W, Lines JL, et al. VISTA regulates the development of protective antitumor immunity[J]. Cancer Res, 2014, 74: 1933–1944. DOI:10.1158/0008-5472.CAN-13-1506 |
| [34] | Long L, Zhang X, Chen F, et al. The promising immune checkpoint LAG-3: from tumor microenvironment to cancer immunotherapy[J]. Genes Cancer, 2018, 9: 176–189. |
| [35] | Das M, Zhu C, Kuchroo VK. TIM-3 and its role in regulating anti-tumor immunity[J]. Immunol Rev, 2017, 276: 97–111. DOI:10.1111/imr.12520 |
| [36] | Xu W, Hieu T, Malarkannan S, et al. The structure, expression, and multifaceted role of immune-checkpoint protein VISTA as a critical regulator of anti-tumor immunity, autoimmunity, and inflammation[J]. Cell Mol Immunol, 2018, 15: 438–446. DOI:10.1038/cmi.2017.148 |
| [37] | Dong H, Zhu G, Tamada K, et al. B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion[J]. Nat Med, 1999, 5: 1365–1369. DOI:10.1038/70932 |
| [38] | Chen L, Han X. Anti-PD-1/PD-L1 therapy of human cancer: past, present, and future[J]. J Clin Invest, 2015, 125: 3384–3391. DOI:10.1172/JCI80011 |
| [39] | Zou W, Wolchok JD, Chen L. PD-L1 (B7-H1) and PD-1 pathway blockade for cancer therapy: mechanisms, response biomarkers, and combinations[J]. Sci Transl Med, 2016, 8: 328r. |
| [40] | Le DT, Uram JN, Wang H, et al. PD-1 blockade in tumors with mismatch-repair deficiency[J]. N Engl J Med, 2015, 372: 2509–2520. DOI:10.1056/NEJMoa1500596 |
| [41] | Goodman AM, Kato S, Bazhenova L, et al. Tumor mutational burden as an independent predictor of response to immunotherapy in diverse cancers[J]. Mol Cancer Ther, 2017, 16: 2598–2608. DOI:10.1158/1535-7163.MCT-17-0386 |
| [42] | Spain L, Diem S, Larkin J. Management of toxicities of immune checkpoint inhibitors[J]. Cancer Treat Rev, 2016, 44: 51–60. DOI:10.1016/j.ctrv.2016.02.001 |
| [43] | Champiat S, Dercle L, Ammari S, et al. Hyperprogressive disease is a new pattern of progression in cancer patients treated by anti-PD-1/PD-L1[J]. Clin Cancer Res, 2017, 23: 1920–1928. DOI:10.1158/1078-0432.CCR-16-1741 |
| [44] | Ferrara R, Mezquita L, Texier M, et al. Hyperprogressive disease in patients with advanced non-small cell lung cancer treated with PD-1/PD-L1 inhibitors or with single-agent chemotherapy[J]. JAMA Oncol, 2018, 4: 1543–1552. DOI:10.1001/jamaoncol.2018.3676 |
| [45] | Saada-Bouzid E, Defaucheux C, Karabajakian A, et al. Hyperprogression during anti-PD-1/PD-L1 therapy in patients with recurrent and/or metastatic head and neck squamous cell carcinoma[J]. Ann Oncol, 2017, 28: 1605–1611. DOI:10.1093/annonc/mdx178 |
| [46] | Kato S, Goodman A, Walavalkar V, et al. Hyperprogressors after immunotherapy: analysis of genomic alterations associated with accelerated growth rate[J]. Clin Cancer Res, 2017, 23: 4242–4250. DOI:10.1158/1078-0432.CCR-16-3133 |
| [47] | West WH, Tauer KW, Yannelli JR, et al. Constant-infusion recombinant interleukin-2 in adoptive immunotherapy of advanced cancer[J]. N Engl J Med, 1987, 316: 898–905. DOI:10.1056/NEJM198704093161502 |
| [48] | Wu W, Zhao S. Metabolic changes in cancer: beyond the Warburg effect[J]. Acta Biochim Biophys Sin (Shanghai), 2013, 45: 18–26. DOI:10.1093/abbs/gms104 |
| [49] | Patra KC, Wang Q, Bhaskar PT, et al. Hexokinase 2 is required for tumor initiation and maintenance and its systemic deletion is therapeutic in mouse models of cancer[J]. Cancer Cell, 2013, 24: 213–228. DOI:10.1016/j.ccr.2013.06.014 |
| [50] | Wolf A, Agnihotri S, Micallef J, et al. Hexokinase 2 is a key mediator of aerobic glycolysis and promotes tumor growth in human glioblastoma multiforme[J]. J Exp Med, 2011, 208: 313–326. DOI:10.1084/jem.20101470 |
| [51] | Nakano A, Miki H, Nakamura S, et al. Up-regulation of hexokinase Ⅱ in myeloma cells: targeting myeloma cells with 3-bromopyruvate[J]. J Bioenerg Biomembr, 2012, 44: 31–38. DOI:10.1007/s10863-012-9412-9 |
| [52] | Chan DA, Sutphin PD, Nguyen P, et al. Targeting GLUT1 and the Warburg effect in renal cell carcinoma by chemical synthetic lethality[J]. Sci Transl Med, 2011, 3: 94ra70. |
| [53] | Yu M, Yongzhi H, Chen S, et al. The prognostic value of GLUT1 in cancers: a systematic review and meta-analysis[J]. Oncotarget, 2017, 8: 43356–43367. |
| [54] | Wei C, Bajpai R, Sharma H, et al. Development of GLUT4-selective antagonists for multiple myeloma therapy[J]. Eur J Med Chem, 2017, 139: 573–586. DOI:10.1016/j.ejmech.2017.08.029 |
| [55] | Possemato R, Marks KM, Shaul YD, et al. Functional genomics reveal that the serine synthesis pathway is essential in breast cancer[J]. Nature, 2011, 476: 346–350. DOI:10.1038/nature10350 |
| [56] | Xian Y, Zhang S, Wang X, et al. Phosphoglycerate dehydrogenase is a novel predictor for poor prognosis in gastric cancer[J]. Onco Targets Ther, 2016, 9: 5553–5560. DOI:10.2147/OTT.S105787 |
| [57] | Yoon S, Kim JG, Seo AN, et al. Clinical implication of serine metabolism-associated enzymes in colon cancer[J]. Oncology, 2015, 89: 351–359. DOI:10.1159/000439571 |
| [58] | Huang X, Li X, Xie X, et al. High expressions of LDHA and AMPK as prognostic biomarkers for breast cancer[J]. Breast, 2016, 30: 39–46. DOI:10.1016/j.breast.2016.08.014 |
| [59] | Xian ZY, Liu JM, Chen QK, et al. Inhibition of LDHA suppresses tumor progression in prostate cancer[J]. Tumour Biol, 2015, 36: 8093–8100. DOI:10.1007/s13277-015-3540-x |
| [60] | He TL, Zhang YJ, Jiang H, et al. The c-Myc-LDHA axis positively regulates aerobic glycolysis and promotes tumor progression in pancreatic cancer[J]. Med Oncol, 2015, 32: 187. DOI:10.1007/s12032-015-0633-8 |
| [61] | Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth[J]. Cancer Cell, 2007, 11: 37–51. DOI:10.1016/j.ccr.2006.10.020 |
| [62] | Michelakis ED, Webster L, Mackey JR. Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer[J]. Br J Cancer, 2008, 99: 989–994. DOI:10.1038/sj.bjc.6604554 |
| [63] | Farabegoli F, Vettraino M, Manerba M, et al. Galloflavin, a new lactate dehydrogenase inhibitor, induces the death of human breast cancer cells with different glycolytic attitude by affecting distinct signaling pathways[J]. Eur J Pharm Sci, 2012, 47: 729–738. DOI:10.1016/j.ejps.2012.08.012 |
| [64] | Ferro M, Terracciano D, Buonerba C, et al. The emerging role of obesity, diet and lipid metabolism in prostate cancer[J]. Future Oncol, 2017, 13: 285–293. DOI:10.2217/fon-2016-0217 |
| [65] | Khwairakpam AD, Shyamananda MS, Sailo BL, et al. ATP citrate lyase (ACLY): a promising target for cancer prevention and treatment[J]. Curr Drug Targets, 2015, 16: 156–163. DOI:10.2174/1389450115666141224125117 |
| [66] | Shah S, Carriveau WJ, Li J, et al. Targeting ACLY sensitizes castration-resistant prostate cancer cells to AR antagonism by impinging on an ACLY-AMPK-AR feedback mechanism[J]. Oncotarget, 2016, 7: 43713–43730. |
| [67] | Merino Salvador M, Gomez de Cedron M, Moreno Rubio J, et al. Lipid metabolism and lung cancer[J]. Crit Rev Oncol Hematol, 2017, 112: 31–40. DOI:10.1016/j.critrevonc.2017.02.001 |
| [68] | Qian X, Hu J, Zhao J, et al. ATP citrate lyase expression is associated with advanced stage and prognosis in gastric adenocarcinoma[J]. Int J Clin Exp Med, 2015, 8: 7855–7860. |
| [69] | Granchi C. ATP citrate lyase (ACLY) inhibitors: an anti-cancer strategy at the crossroads of glucose and lipid metabolism[J]. Eur J Med Chem, 2018, 157: 1276–1291. DOI:10.1016/j.ejmech.2018.09.001 |
| [70] | Li J, Dong L, Wei D, et al. Fatty acid synthase mediates the epithelial-mesenchymal transition of breast cancer cells[J]. Int J Biol Sci, 2014, 10: 171–180. DOI:10.7150/ijbs.7357 |
| [71] | Rossato FA, Zecchin KG, La Guardia PG, et al. Fatty acid synthase inhibitors induce apoptosis in non-tumorigenic melan-a cells associated with inhibition of mitochondrial respiration[J]. PLoS One, 2014, 9: e101060. DOI:10.1371/journal.pone.0101060 |
| [72] | Murata S, Yanagisawa K, Fukunaga K, et al. Fatty acid synthase inhibitor cerulenin suppresses liver metastasis of colon cancer in mice[J]. Cancer Sci, 2010, 101: 1861–1865. DOI:10.1111/j.1349-7006.2010.01596.x |
| [73] | Pizer ES, Chrest FJ, Digiuseppe JA, et al. Pharmacological inhibitors of mammalian fatty acid synthase suppress DNA replication and induce apoptosis in tumor cell lines[J]. Cancer Res, 1998, 58: 4611–4615. |
| [74] | Li J, Qu X, Tian J, et al. Cholesterol esterification inhibition and gemcitabine synergistically suppress pancreatic ductal adenocarcinoma proliferation[J]. PLoS One, 2018, 13: e0193318. DOI:10.1371/journal.pone.0193318 |
| [75] | Yang W, Bai Y, Xiong Y, et al. Potentiating the antitumour response of CD8+ T cells by modulating cholesterol metabolism[J]. Nature, 2016, 531: 651–655. DOI:10.1038/nature17412 |
| [76] | Li J, Gu D, Lee SS, et al. Abrogating cholesterol esterification suppresses growth and metastasis of pancreatic cancer[J]. Oncogene, 2016, 35: 6378–6388. DOI:10.1038/onc.2016.168 |
| [77] | Salamanca-Cardona L, Shah H, Poot AJ, et al. In vivo imaging of glutamine metabolism to the oncometabolite 2-hydroxyglutarate in IDH1/2 mutant tumors[J]. Cell Metab, 2017, 26: 830–841. DOI:10.1016/j.cmet.2017.10.001 |
| [78] | Coothankandaswamy V, Cao S, Xu Y, et al. Amino acid transporter SLC6A14 is a novel and effective drug target for pancreatic cancer[J]. Br J Pharmacol, 2016, 173: 3292–3306. DOI:10.1111/bph.13616 |
| [79] | Karunakaran S, Ramachandran S, Coothankandaswamy V, et al. SLC6A14 (ATB0, +) protein, a highly concentrative and broad specific amino acid transporter, is a novel and effective drug target for treatment of estrogen receptor-positive breast cancer[J]. J Biol Chem, 2011, 286: 31830–31838. DOI:10.1074/jbc.M111.229518 |
| [80] | Jiang HL, Jiang XL, Tang TZ, et al. A new strategy to intervene tumor metabolism: regulatory targets for amino acid metabolism and advances in drug research[J]. Acta Pharm Sin (药学学报), 2019, 54: 407–419. |
| [81] | Simpson NE, Tryndyak VP, Beland FA, et al. An in vitro investigation of metabolically sensitive biomarkers in breast cancer progression[J]. Breast Cancer Res Treat, 2012, 133: 959–968. DOI:10.1007/s10549-011-1871-x |
| [82] | Martin-Rufian M, Nascimento-Gomes R, Higuero A, et al. Both GLS silencing and GLS2 overexpression synergize with oxidative stress against proliferation of glioma cells[J]. J Mol Med (Berl), 2014, 92: 277–290. DOI:10.1007/s00109-013-1105-2 |
| [83] | Mohamed A, Deng X, Khuri FR, et al. Altered glutamine metabolism and therapeutic opportunities for lung cancer[J]. Clin Lung Cancer, 2014, 15: 7–15. DOI:10.1016/j.cllc.2013.09.001 |
| [84] | Simpson NE, Tryndyak VP, Pogribna M, et al. Modifying metabolically sensitive histone marks by inhibiting glutamine metabolism affects gene expression and alters cancer cell phenotype[J]. Epigenetics, 2012, 7: 1413–1420. DOI:10.4161/epi.22713 |
| [85] | Xi J, Sun Y, Zhang M, et al. GLS1 promotes proliferation in hepatocellular carcinoma cells via AKT/GSK3beta/cyclinD1 pathway[J]. Exp Cell Res, 2019, 381: 1–9. DOI:10.1016/j.yexcr.2019.04.005 |
| [86] | Yuan L, Sheng X, Clark LH, et al. Glutaminase inhibitor compound 968 inhibits cell proliferation and sensitizes paclitaxel in ovarian cancer[J]. Am J Transl Res, 2016, 8: 4265–4277. |
 2019, Vol. 54
2019, Vol. 54


