2. 江苏省中医药研究院, 中药组分与微生态研究中心, 江苏 南京 210028
2. Multi-component of Traditional Chinese Medicine and Microecology Research Center, Jiangsu Provincial Academy of Chinese Medicine, Nanjing 210028, China
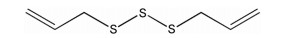
肿瘤转移是临床致死的重要原因, 目前尚无特别有效的治疗手段[1]。本课题组前期实验及相关文献均表明, 大蒜中的有效活性成分二烯丙基三硫化物(diallyl trisulfide, DATS, 图 1)具有良好的抗肿瘤转移作用[2, 3], 但如何将其递送到转移灶发挥抗肿瘤转移作用是亟待解决的关键问题。随着对生物来源载体的深入研究, 肿瘤细胞衍生的外泌体因其具有转移器官亲和力和荷载小分子药物的性能从而引起了研究人员的广泛关注[4, 5]。
|
Figure 1 The chemical structure of diallyl trisulfide (DATS) |
生物体中的所有细胞都分泌细胞外囊泡(extracellular vesicles, EVs), 这是一种异质的脂质双层膜封闭囊泡, 可以向受体细胞输送大量蛋白质和核酸, 从而在细胞通讯中发挥核心作用。细胞外泌体(exosome, Exo)是细胞分泌的经典EVs, 定义为30~100 nm直径的内吞来源的膜纳米囊泡。研究表明, 它们与纳微米粒子在大小、结构和载体功能方面相似, 可用作内源性天然载体以递送化学治疗药物[6]。此外, 特定供体细胞来源的外泌体具有一定的器官亲和性[7]。研究发现, 肺转移肿瘤细胞来源的外泌体因其所携带的特殊蛋白分子能够特异性地靶向肺组织而实现肿瘤转移灶的靶向[8]。本文将利用外泌体的载体性能和组织亲和性, 提取肺转移肿瘤细胞的外泌体用以包载DATS, 制备转移灶靶向的载药系统, 旨在提高DATS的抗肿瘤转移作用, 并为抗肿瘤转移载药系统的开发及抗肿瘤转移治疗策略提供新的思路。
材料与方法实验材料 小鼠黑色素瘤B16BL6细胞(和园生物有限公司); 高糖DMEM培养基、胰蛋白酶(上海源培生物科技股份有限公司); 胎牛血清(FBS, 以色列BI公司); 大蒜素DATS对照品, 批号100384-201403, 质量分数94%, 供含量测定用(中国食品药品检定研究院); 大蒜素DATS, 质量分数98% (上海菲越医药科技有限公司); PKH26试剂盒、高效RIPA组织/细胞裂解液(北京索莱宝科技有限公司); BCA试剂盒(赛默飞世尔科技有限公司); 四甲基偶氮唑盐(MTT, 江苏凯基生物技术股份有限公司); 二甲亚砜(DMSO, 美国Sigma公司); 结晶紫染色液(上海碧云天生物技术有限公司); 水为纯净水, 其他试剂均为分析纯。
实验动物 SPF级C57BL/6小鼠, 购于扬州大学比较医学中心, 雄性, 体重18~22 g, 动物实验获得南京中医药大学伦理委员会的同意。
细胞外泌体提取及DATS-Exo的制备 B16BL6细胞培养于DMEM完全培养基(含10% FBS、青-链霉素100 μg·mL-1), 37 ℃、5% CO2培养箱内培养。收集处于对数生长期的(外泌体分泌较多) B16BL6细胞上清液, 采用梯度-超速离心的方法提取外泌体, 即细胞培养上清液在4 ℃条件下分别300 ×g离心10 min、2 000 ×g离心15 min和12 000 ×g离心30 min, 去除漂浮的细胞和细胞碎片, 这些上清液随后用0.22 μm的无菌膜过滤以达到除菌的目的, 过滤后的上清在4 ℃条件下100 000 ×g离心2 h, 用磷酸盐缓冲液(PBS)洗涤, 最后外泌体用100 μL PBS重悬。
采用超声的方法制备DATS-Exo, 将纯化的外泌体与5 mg·mL-1 DATS在冰水浴下超声, 超声条件: 20%振幅, 4 s开, 2 s关, 2 min循环, 共循环6次。取出, 于37 ℃培养箱中恢复2 h, 然后在100 000 ×g离心70 min, 去除上清及未被外泌体包载的DATS, 用PBS洗涤, 得到DATS-Exo。
DATS-Exo的表征 取DATS-Exo 10 μL, 纯水稀释至1 mL, 用马尔文激光粒径仪测定DATS-Exo的平均粒径、多分散系数(PDI)及zeta电位。将载有Formvar支持膜的铜网置于蜡板上, 在膜上分别滴加1滴外泌体PBS重悬液。红外灯下照射5 min, 滴加1滴1%磷钨酸, 室温下风干10 min, 置于透射电镜下观察微乳的外观形态。
DATS-Exo的总蛋白浓度测定 采用BCA法测定DATS-Exo的总蛋白浓度。取DATS-Exo 10 μL, 加入高效RIPA裂解液15 μL, 共计25 μL, 涡旋混匀, 作为待测样品, 取BCA试剂盒, 按试剂A:试剂B = 50:1, 制备工作液, 取96孔板, 分别加入各个稀释浓度的蛋白质标准品(20~2 000 μg·mL-1)和待测样品各25 μL, 然后每孔加入200 μL工作液, 振荡器上震荡30 s, 37 ℃孵育30 min, 采用全波长酶标仪测定各孔562 nm处吸光度值, 制备标准曲线y = 1 128.5 x - 181.66, 计算DATS-Exo的总蛋白浓度。
Western blot检测外泌体特异性蛋白 取DATS-Exo的RIPA裂解液, 加入蛋白样品上样缓冲液(5×), 于100 ℃水浴锅中煮沸10 min变性, 取25 mg总蛋白量的蛋白样品进行电泳、转膜、洗涤封闭, 分别结合一抗(CD9、Flotillin 1、TSG101和α6的稀释倍数均为1:1 000)于4 ℃过夜, 洗涤, 室温下结合二抗(荧光二抗的稀释倍数为1:5 000) 2 h后, 洗涤, 于双色红外激光扫描成像系统(Odyssey)检测蛋白条带。
DATS-Exo载药量的测定 取DATS-Exo, 加入等体积的细胞裂解液裂解1 min, 再加25倍的甲醇溶解, 0.22 μm混合滤膜滤过, HPLC (Agilent 1260, 美国安捷伦公司)测定DATS含量, 计算载药量(LC)。LC (%) = CDATS/Cprotein×100%, 其中, CDATS为DATS总量; Cprotein为每微克蛋白外泌体。色谱条件: Agilent SB-C18色谱柱(150 mm×4.6 mm, 5 μm); 乙腈-水(73:27, v/v)流动相; 流速为1.0 mL·min-1; 25.0 ℃柱温; 进样量20 μL, 检测波长250 nm, 理论塔板数大于5 000。
B16BL6细胞对Exo的摄取情况 将Exo稀释成总蛋白质量浓度为800 μg·mL-1, 取Exo 0.1 mL, 重悬在0.5 mL Diluent C中, 记为A; 取2 μL PKH26加到0.5 mL Diluent C中, 记为B, 然后将A与B混合, 25 ℃孵育3 min, 加入等体积血清, 终止反应, Exo混合液在100 000 ×g离心70 min, 去上清, 重悬, 用PBS清洗3遍, 去除未结合染料; 取对数生长期B16BL6细胞, 制成细胞悬液, 用细胞计数仪计数, 接种于6孔板, 每孔加入5×106个细胞, 待细胞贴壁后, 加入Exo及PKH26-Exo, 孵育2 h后, 将各孔中培养基吸出, PBS洗3遍, 在荧光显微镜下观察各组细胞中摄取情况结果, 用流式细胞仪测定各组相对荧光值。
MTT实验评价DATS-Exo对B16BL6细胞增殖的影响 取对数生长期B16BL6细胞, 调整细胞数为每毫升1×104个, 接种于96孔板, 于5% CO2、37 ℃细胞培养箱中培养, 待细胞贴壁后给药, 实验分为4组:空白对照组、DATS 50 μmol·L-1组、Exo组和DATS-Exo组(按照蛋白浓度和载药量换算, 含等量DATS 50 μmol·L-1), DATS先用DMSO配成高浓度母液, 再用培养基配制成相应给药浓度, 以增加DATS的溶解度, 每组设6个复孔, 给药24 h后更换新鲜培养基, 并于每孔加入MTT溶液10 μL, 于5% CO2、37 ℃细胞培养箱中培养4 h, 弃上清液, 每孔加入二甲基亚砜100 μL, 置于微孔板振荡器避光震荡10 min, 使用酶标仪于570 nm处测定各孔吸光度(A)值, 计算细胞增殖抑制率(IR)。
| $ {\rm{IR }} ({\rm{\% }}) = (1 -A_{给药} / A_{对照}) × 100{\rm{\% }} $ | (1) |
划痕实验考察DATS-Exo对B16BL6细胞水平迁移的影响 B16BL6细胞用含10% FBS、1%青霉素-链霉素的双抗DMEM培养液于37 ℃、5% CO2条件下的细胞培养箱中培养。接种细胞之前在12孔板背面画横线标记。细胞消化后接种于12孔板, 待细胞铺满板底, 用10 μg·mL-1丝裂霉素C处理2 h后, 在12孔板底垂直于背面横线划痕, 吸去细胞培养液, 用PBS小心冲洗孔板3次, 洗去划痕产生的细胞和细胞碎片。分别加入DMEM培养液和大蒜素。实验分为4组:空白对照组、DATS 30 μmol·L-1组、Exo组和DATS-Exo组(按照蛋白浓度和载药量换算, 含等量的DATS 30 μmol·L-1)。大蒜素DATS先用DMSO配成高浓度母液, 以增加大蒜素DATS的溶解度, 放入37 ℃、5% CO2培养箱培养, 分别在0、24 h时观察划痕并拍照, 采用Olympus Cell Sens Standard1.18软件测量划痕面积, 计算迁移面积及迁移抑制率, 公式如下:
| $ 迁移面积 = 划痕面积 (0 \text{h}) - 划痕面积 (24 \text{h}) $ | (2) |
| $ 迁移抑制率 = [1 - 迁移面积 (24 \text{h}给药组) / 迁移面积 (24 \text{h}对照组)]×100{\rm{\% }} $ | (3) |
Exo体内分布情况 取PKH26标记的外泌体溶液, 通过尾静脉注射入C57BL6小鼠体内, 24 h后脱颈椎处死小鼠, 解剖, 取心、肝、脾、肺和肾脏制成冰冻切片, 于激光共聚焦显微镜下观察荧光分布的情况。
DATS-Exo体内抗肿瘤转移情况 建立小鼠黑色素瘤肺转移实验模型, 取对数生长期B16BL6细胞, 用灭菌的PBS溶液将细胞制成细胞悬液, 并将细胞数调整至每毫升5×105个, 迅速进行接种。每只C57BL/6小鼠尾静脉处注射0.2 mL新鲜制备、吹打均匀的B16BL6细胞悬液。小鼠接种肿瘤细胞后, 随机分为模型组、Exo组、DATS-Exo组及DATS组, 每组5只。23天后开始给药, 腹腔注射, DATS剂量为20 mg·kg-1, 隔天给药, 14天后脱颈椎处死小鼠, 解剖, 取小鼠肺组织, 记录肺结节数目, 并对剥离的肺组织进行H & E染色。
统计学分析 应用GraphPad 7.0软件进行统计分析。所有实验均独立重复3次, 计量资料以x ± s表示, 各组分别与对照组进行单因素方差分析。
结果 1 DATS-Exo的制备与表征从生长状态良好的肺转移小鼠黑色素瘤B16BL6细胞上清液中提取外泌体, 电镜下显示, 外泌体形态均匀, 具有茶托样的双层膜结构, 大小约在100 nm左右(图 2A)。经马尔文粒径仪检测粒径和电位, 结果显示, 所提取的外泌体平均粒径约为100.08 nm, 分散均匀, 呈负电荷(表 1)。BCA法检测外泌体的蛋白含量为1 312.33 ± 6.27 μg·mL-1。Western blot实验结果表明, 所提取的外泌体能够表达TSG101、Flotillin 1、CD9等外泌体标记性蛋白, 此外, 还表达肺亲和性蛋白α6 (图 2B)。采用超声载药的方法制备含药的DATS-Exo, 通过HPLC检测并计算载药量为0.33% ± 0.02% (以μg蛋白含量计)。电镜、Western blot及粒径、电位等检测结果显示, 载药后, 粒径略有变大, 但并不影响外泌体标记蛋白的表达。结果表明DATS-Exo成功制备。

|
Figure 2 Preparation and characterization of diallyl trisulfide-exosome (DATS-Exo). A: Morphology of exosome and DATS-Exo detected by transmission electron. Scale bar: 200 μm; B: Expressions of TSG101, Flotillin 1, CD9, α6 and glyceraldehyde-3-phosphate dehydrogenase (GAPDH) in exosome and DATS-Exo from B16BL6 cell line |
| Table 1 The particle size, polydispersity index (PDI) and potential of Exo and DATS-Exo. n = 3, x ± s |
肿瘤细胞的异常增殖和高迁移水平是恶性肿瘤细胞发生转移的重要特征。分别用含药外泌体DATS-Exo、空白外泌体Exo和DATS处理B16BL6细胞24 h后, 采用MTT方法检测细胞的增殖活性。结果显示, DATS-Exo与DATS都能有效抑制B16BL6细胞的增殖(图 3A), 且与DATS组相比, DATS-Exo的抑制作用更强, 统计学具有极显著差异(P < 0.01)。

|
Figure 3 The anti-proliferation and anti-migration effect of DATS-Exo in vitro. A: Cell proliferation was measured by MTT assay after exposure to DATS and DATS-Exo for 24 h. Results were expressed as a proliferation inhibition rate of blank, which was considered as 0%; B: Confluent B16BL6 cells were scratched and incubated with DATS-Exo and DATS. The area covered by migrating cells was recorded by phase-contrast microscopy connected to a digital camera at time 0 and 24 h; C: The wound closure area was calculated by measuring the diminution of the wound bed surface upon time. n = 3, x ± s. *P < 0.05, **P < 0.01 |
通过经典的划痕法考察含药外泌体DATS-Exo的抑制肿瘤细胞水平迁移能力, 结果以0和24 h两个时间点为例, 24 h后B16BL6细胞发生迁移行为, 而给予DATS-Exo及DATS都能显著抑制B16BL6细胞的水平迁移能力(P < 0.01), DATS-Exo组与DATS组相比具有更强的抑制效果(P < 0.05), 对于B16BL6细胞的迁移抑制率高达90%以上, 几乎完全抑制B16BL6细胞的水平迁移(图 3B、C)。实验结果表明, 将大蒜素DATS制备成外泌体载药系统可明显提高其体外抗肿瘤细胞转移的能力。
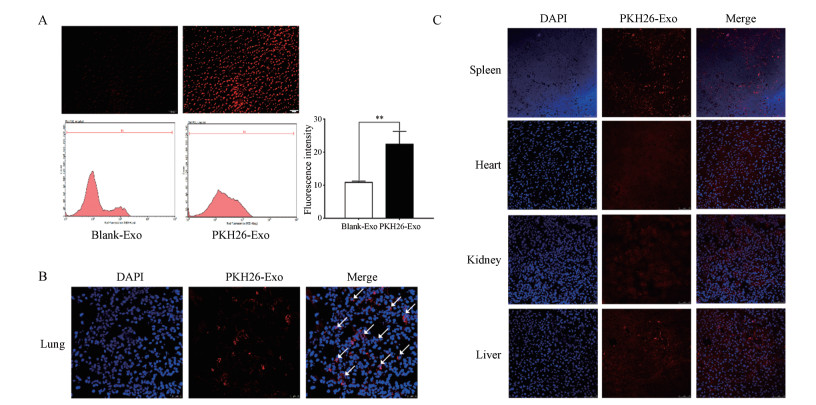
3 B16BL6细胞对Exo的摄取情况为了研究B16BL6肿瘤细胞对外泌体的摄取情况, 使用红色荧光膜染料PKH26标记外泌体, 并与B16BL6细胞共培养2 h后, 细胞置于荧光倒置显微镜下观察结果显示, 外泌体可以被B16BL6细胞成功摄取。大多数B16BL6细胞的细胞质中可以观察到均匀分布PKH26的红色荧光, 证实外泌体可以有效被受体细胞摄取(图 4A)。
|
Figure 4 Exo were uptaken by cells and tissues. A: PKH26-labed exosome (red) incubated with B16BL6 cell for 2 h and observed under a fluorescence microscope (100×). n = 3, x ± s. **P < 0.01; B and C: B16BL6 derived exosomes were labeled with PKH26 (red fluorescent) and were injected into mice via the lateral tail vein. Lung (B), spleen, heart, kidney and liver (C) tissue were separated after 24 h, and stained with Hoechst (blue fluorescent) and observed under a laser confocal microscopy (630×) |
特定细胞来源的外泌体具有一定的器官亲和性。有研究发现, 来源于肺转移细胞的外泌体更容易倾向到达肺组织, 其原因可能与其表面携带的相关整合素分子有关。前期实验证实B16BL6细胞的外泌体表达整合素α6, 用膜染料PKH26标记外泌体, 通过尾静脉注射入小鼠体内, 24 h后取出脏器, 激光共聚焦结果显示, 外泌体在肺部分布较多, 能够被肺组织细胞摄取。另外, 在肝脏及脾也有一定的分布, 在心脏和肾脏分布相对较少(图 4B、C)。
5 DATS-Exo体内抗肿瘤转移情况为了考察含药外泌体DATS-Exo的体内抑制肿瘤转移的情况, 将肺转移小鼠黑色素瘤肿瘤细胞通过尾静脉注射入C57BL/6小鼠体内, 建立实验性肺转移小鼠模型并通过腹腔注射给予DATS-Exo及DATS。结果显示, 造模后, H & E染色发现模型组小鼠与正常组相比, 肺部发生了严重的转移, 体现在模型组小鼠肺部出现了较多的肿瘤结节数目和较大的肿瘤体积。不论是DATS组还是含药外泌体DATS-Exo组均表现出一定的抑制肿瘤转移的效果, 而与DATS组相比, DATS-Exo组能更好地抑制肿瘤的肺转移, 减少肿瘤结节数目, 降低异常的肺重量, 具有更优的抗肿瘤转移作用(图 5)。

|
Figure 5 The anti-metastasis effect of DATS-Exo in vivo. B16BL6 experimental metastasis model was established to evaluate the anti-metastasis effect of DATS-Exo. A: H & E stain histological analysis of lung sections indicate experimental lung metastasis was inhibited by DATS-Exo. Scale bar: 5 000 μm in the figure above; 200 μm in the figure below; B and C: Lung metastasis was quantified as number of metastatic node in the lung (B) and lung weight (C) in different group. n = 3, x ± s. *P < 0.05, **P < 0.01, ****P < 0.000 1 |
大蒜素DATS是一种具有抗肿瘤转移潜力的抗肿瘤活性成分, 但如何提高其转移灶的靶向性从而进一步提高其抗肿瘤转移作用是研究者关注的问题。本研究利用肺转移肿瘤细胞衍生的外泌体既有转移灶的靶向性即肺亲和性, 又有载体性能可荷载小分子化合物的特性, 通过低温超声的方法制备了一种含药的外泌体DATS-Exo, 提高了其体内外的抗肿瘤转移作用。
对于DATS的靶向性研究, 已有一些纳米递药系统相关的靶向技术被用作DATS的剂型改造, 主要集中在如何提高其肿瘤靶向能力, 如聚氰基丙烯酸丁酯和聚乳酸(PLA)自组装成的DATS微球[9], 然而这种非天然来源的聚合物纳米粒体内的靶向性主要依赖于被动的高通透性和滞留效应(EPR), 缺乏专属高效的肿瘤特异性靶向能力, 更是缺乏提高其转移灶的靶向能力的制剂手段, 还存在某些有机辅料在体内降解速度缓慢、易蓄积、制备过程中有机溶剂残留等问题。本文选用来源于生物的天然药物载体细胞外泌体作为DATS的递送载体, 具有多种优势:首先, 外泌体可以来源于患者自身的细胞, 在药物传递过程中减少了免疫原性; 其次, 外泌体作为一种膜结构载体, 与脂质体结构类似, 能够通过其表面的膜蛋白与靶细胞膜融合, 将其负载的药物直接运送到受体细胞中, 避免了细胞吞噬-溶酶体途径带来的药物降解及细胞毒性等问题; 此外, 不同来源的外泌体因其供体细胞的差异性而呈现出不同的特性。本研究选用外泌体的供体细胞为肺转移肿瘤细胞B16BL6, 研究表明, 肿瘤细胞外泌体的产生和释放比正常细胞显著升高, 并带有宿主细胞独特的性质。本研究发现所提取的外泌体除了表达外泌体的标志性蛋白外, 还表达整合素α6, 且体内分布实验结果显示外泌体在肺部具有良好的聚集, 与Hoshino等[8]研究发现肺转移的肿瘤细胞分泌的外泌体因膜上表达整合素α6β1和α6β4会特定地到达肺部并黏附在肺部的组织细胞如内皮细胞上的结果相一致。
细胞外泌体的提取方法有差速超高速离心法、密度梯度离心法、试剂盒提取方法、磁珠免疫法等, 其中本研究中所采用的差速离心法是目前最经典的分离外泌体的方法, 被认为是外泌体提取分离的“金标准”[10], 整个操作过程简单, 所分离的外泌体在电镜下观察具有外泌体经典的茶托样结构, 且形态规则、大小较均匀。目前外泌体载有小分子药物的方法也有很多研究, 主要有被动孵育、超声、电穿孔及供体细胞载药等方法[11]。考虑到大蒜素DATS是一种易挥发的脂溶性成分, 被动孵育会加速其挥发而导致载药量过低, 而电穿孔法可能会对外泌体或药物的完整性造成影响[12]。因此, 本实验采用低温超声的方法, 最终测得含药外泌体的载药量为0.33% ± 0.02%, 载药量适中。
本研究建立了实验性转移动物模型考察含药外泌体的抗肿瘤转移能力, 证实含药外泌体具有更好的抗肿瘤转移效果。然而, 其抗肿瘤转移的作用机制尚不十分明确。有研究表明, 原位肿瘤细胞能够释放一些细胞因子到达局部组织, 调控局部组织宿主细胞释放炎性蛋白S100A8/A9、SAAs, 激活局部组织TLR4、TLR3等, 形成一种有利于肿瘤定植生长的炎性微环境[13, 14]。本研究将大蒜素DATS包载于外泌体中并将其递送到局部肺组织, 而大蒜素DATS具有抗炎、抗氧化等作用, 那么含药外泌体的抗肿瘤转移作用是否与干扰炎性微环境的形成有关?有待于进一步研究。本课题组后续将以炎性转移前微环境为切入点, 深入研究含药外泌体的抗肿瘤转移分子机制, 旨在为肿瘤转移的治疗提供和发现新的策略和思路。
| [1] | Fidler IJ, Kripke ML. The challenge of targeting metastasis[J]. Cancer Metastasis Rev, 2015, 34: 635–641. DOI:10.1007/s10555-015-9586-9 |
| [2] | Liu YP, Zhao Y, Wei ZH, et al. Targeting thioredoxin system with an organosulfur compound, diallyl trisulfide (DATS), attenuates progression and metastasis of triple-negative breast cancer (TNBC)[J]. Cell Physiol Biochem, 2018, 50: 1945–1963. DOI:10.1159/000494874 |
| [3] | Wei ZH, Shan YL, Tao L, et al. Diallyl trisulfides, a natural histone deacetylase inhibitor, attenuate HIF-1α synthesis, and decreases breast cancer metastasis[J]. Mol Carcinog, 2017, 56: 2317–2331. DOI:10.1002/mc.22686 |
| [4] | Wang XY, Zhang HY, Yang HO, et al. Cell-derived exosomes as promising carriers for drug delivery and targeted therapy[J]. Curr Cancer Drug Targets, 2018, 18: 347–354. DOI:10.2174/1568009617666170710120311 |
| [5] | Tai YL, Chu PY, Lee BH, et al. Basics and applications of tumor-derived extracellular vesicles[J]. J Biomed Sci, 2019, 26: 35. DOI:10.1186/s12929-019-0533-x |
| [6] | Ha D, Yang NN, Nadithe V. Exosomes as therapeutic drug carriers and delivery vehicles across biological membranes: current perspectives and future challenges[J]. Acta Pharm Sin B, 2016, 6: 287–296. DOI:10.1016/j.apsb.2016.02.001 |
| [7] | Busatto S, Pham A, Suh A, et al. Organotropic drug delivery: synthetic nanoparticles and extracellular vesicles[J]. Biomed Microdevices, 2019, 21: 46. DOI:10.1007/s10544-019-0396-7 |
| [8] | Hoshino A, Costa-Silva B, Shen TL, et al. Tumour exosome integrins determine organotropic metastasis[J]. Nature, 2015, 527: 329–335. DOI:10.1038/nature15756 |
| [9] | Zhang ZM, Yang XY, Deng SH, et al. Anti-tumor effects of polybutylcyanoacrylate nanoparticles of diallyl trisulfide on orthotopic transplantation tumor model of hepatocellular carcinoma in BALB/c nude mice[J]. Chin Med J, 2007, 120: 1336–1342. DOI:10.1097/00029330-200708010-00008 |
| [10] | Jeppesen DK, Fenix AM, Franklin JL, et al. Reassessment of exosome composition[J]. Cell, 2019, 177: 428–445, e418. DOI:10.1016/j.cell.2019.02.029 |
| [11] | Kim MS, Haney MJ, Zhao Y, et al. Development of exosome-encapsulated paclitaxel to overcome MDR in cancer cells[J]. Nanomed Nanotechnol Biol Med, 2016, 12: 655–664. DOI:10.1016/j.nano.2015.10.012 |
| [12] | Johnsen KB, Gudbergsson JM, Skov MN, et al. A comprehensive overview of exosomes as drug delivery vehicles - endogenous nanocarriers for targeted cancer therapy[J]. Biochim Biophys Acta, 2014, 1846: 75–87. |
| [13] | Liu Y, Gu Y, Han YM, et al. Tumor exosomal RNAs promote lung pre-metastatic niche formation by activating alveolar epithelial TLR3 to recruit neutrophils[J]. Cancer Cell, 2016, 30: 243–256. DOI:10.1016/j.ccell.2016.06.021 |
| [14] | Sakaguchi M. S100-SPECT uncovers cellular and molecular events of pre-metastatic niche formation and following organ-specific cancer metastasis[J]. Theranostics, 2017, 7: 2649–2651. DOI:10.7150/thno.19866 |
 2019, Vol. 54
2019, Vol. 54


