2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850;
3. 安徽医科大学, 安徽 合肥 230032
2. Beijing Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China;
3. Anhui Medical University, Hefei 230032, China
创伤后应激障碍(post-traumatic stress disorder, PTSD)是指个体目睹或经历重大威胁或创伤事件后, 所导致的个体延迟出现和持续存在的精神障碍[1], 使患者易产生抑郁、焦虑和恐惧等情绪[2]。PTSD主要涉及海马、前额叶、杏仁核及下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)轴, 但具体的发病机制尚不完全明确。对于PTSD的治疗, 目前首选五羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor, SSRI), 其中氟西汀、帕罗西汀和舍曲林疗效较好[3], 但是长期用药所带来的不良反应不容忽视, 常见的有恶心、头疼和失眠, 严重者还可引起血液及淋巴系统不适、免疫失调和性功能障碍等。
粉防己碱是由中药汉防己科植物粉防己的干燥根中提取的一种双苄基异喹啉类生物碱(结构式见图 1), 属于钙通道阻滞剂, 临床上主要用于心血管疾病、风湿病等治疗[4], 具有抗炎[5]、抗肿瘤[6]及免疫调节[7]等药理作用。
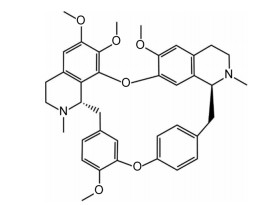
|
Figure 1 Structure of tetrandrine |
血脑屏障[8] (blood-brain barrier, BBB)是血中物质进入脑组织的生理性屏障, 通透性极低, 由于它的存在, 药物很难吸收入脑发挥治疗作用, 使得药物脑靶向成为一个难题[9]。而鼻腔给药后药物分子可通过鼻黏膜上皮细胞、三叉神经通路进入大脑[10], 仅有少量药物通过血液循环透过血脑屏障, 可实现药物直接通过鼻腔到达脑部[11], 提高药物生物利用度[12], 该给药途径适合脑部疾病治疗。
原位凝胶[13] (in situ gel)也称在体凝胶, 是一类以溶液状态给药后, 能在用药部位立即发生相转变, 由液态转化形成非化学交联半固体凝胶的制剂。根据发生相变的原理可将原位凝胶分为温度型原位凝胶[14]、pH型原位凝胶[15]和离子型原位凝胶[16]。其中温度敏感型凝胶通过对环境温度的响应发生相转变, 常温下为液体状态, 随着温度的升高, 达到相转变温度后, 在给药部位迅速形成半固体凝胶, 用药局部滞留时间长, 具有良好的药物缓控释性能[17], 因此特别适合通过鼻腔给药实现脑靶向。
本研究制备了粉防己碱鼻用温敏凝胶(intranasal tetrandrine temperature-sensitive gel, TTG), 建立PTSD小鼠模型; 用高架十字迷宫评价其焦虑状态; 条件恐惧箱评价其恐惧状态; 苏木精-伊红(H & E)病理切片及c-fos免疫组化进一步观察脑部海马区、前额叶皮层和杏仁核的病变情况, 以评价TTG对PTSD的治疗效果。
材料与方法药品与试剂 粉防己碱(批号: HXHFJJS20171012, 纯度: 99%, 西安昊轩生物科技有限公司); 泊洛沙姆407 (批号: WPTF533B, 北京凤礼精求商贸有限责任公司); 泊洛沙姆188 (批号: WPMG557C, 美国BASF公司); 盐酸(批号: 20180808)、无水乙醚(批号: 20170324) (国药集团化学试剂有限公司); Cy7 (批号: CYW00584, 北京泛博生物化学有限公司); 生理盐水(批号: 1903163982, 石家庄四药有限公司); 去氧胆酸钠(批号: 66-10-18, 上海化学试剂采购供应站); 异氟烷(批号: 045727, 鲁南贝特制药有限公司)。
仪器 高架十字迷宫(型号: DB015, 北京智鼠多宝生物科技有限责任公司); Xeye Aba动物行为视频分析系统(安徽正华生物仪器设备有限公司); 条件恐惧箱(上海吉量软件科技有限公司); 动物行为学视频分析系统主控器(上海吉量软件科技有限公司); 高级旋转流变仪(奥地利安东帕有限公司); 小动物活体成像(型号: IVIS Lumina Series Ⅲ, Perkin Elmer公司); 倒置荧光显微镜(型号: BDS200-FL, 重庆奥普医疗器械有限公司)。
实验动物 健康ICR小鼠18只, 健康C57BL/6N小鼠9只, SPF级, 体重为(20 ± 1) g, 购自北京维通利华实验动物技术有限公司, 许可证号: SCXK (京) 2016-0006。动物饲养环境: 21~25 ℃, 给予12 h光照/12 h黑暗, 自由进食饮水。健康中华大蟾蜍12只, 雌雄各半, 体重60~70 g, 购自苏北农产品店。所有动物实验经军事科学院军事医学研究院辐射医学研究所伦理委员会批准且实验均按照相关指导原则和规定进行。
TTG的制备 空白温敏凝胶的制备:精密称取2 g泊洛沙姆188, 12 g泊洛沙姆407于50 mL烧杯中, 加入超纯水40 mL混匀, 4 ℃放置24 h使其充分溶胀, 补充超纯水至50 mL, 4 ℃保存待用[18]。
精密称取粉防己碱0.2 g于10 mL离心管中, 加入0.1 mol·L-1盐酸(pH 1.46) 3 mL及空白温敏凝胶7 mL (C泊洛沙姆188 = 28 mg·mL-1; C泊洛沙姆407 = 168 mg·mL-1), 涡旋混合器充分混合均匀, 即得TTG (C粉防己碱 = 20 mg·mL-1, pH 5.50)。
胶凝温度及胶凝时间测定 将装有TTG的试管置于恒温水浴锅, 试管溶液面始终低于水浴面, 水浴温度由20 ℃缓慢升至40 ℃, 升温速度为1 ℃·min-1, 倒转试管, 观察液体流动情况, 液体不流动时的温度记为凝胶温度, 液体由溶液状态转变为凝固状态时间为胶凝时间。
流变学性质考察 采用安东帕高级旋转流变仪测定TTG的流变学性质, 考察在10~40 ℃温度内TTG储能模量(G')、损耗模量(G")及复合黏度(viscosity)的变化; 考察在32 ℃条件下, 0.1~100 s-1剪切频率(ω)内G'、G"及复合黏度的变化。
温敏凝胶鼻腔内滞留时间考察 称取10 mg Cy7加至5 mL上述空白温敏凝胶中(2 mg·mL-1), 同时制备相同浓度Cy7水溶液。ICR小鼠随机分为空白对照组、Cy7溶液组和Cy7温敏凝胶组。Cy7溶液组小鼠给予20 μL Cy7水溶液(2 mg·mL-1); Cy7温敏凝胶组小鼠给予等量Cy7温敏凝胶(2 mg·mL-1); 空白对照组不作任何处理。选择激发波长为745 nm, 分别于给药后0、0.5、1、2和4 h进行小动物荧光成像并观察。
TTG纤毛毒性考察 将12只中华大蟾蜍随机分为生理盐水组(阴性对照)、1%去氧胆酸钠组(阳性对照)、空白温敏凝胶组和TTG组, 每组3只[19]。蟾蜍处死后, 暴露上腭, 用眼科剪和镊子小心地分离上腭黏膜, 面积约为5 mm×5 mm, 生理盐水冲洗血块及组织。将上腭黏膜纤毛面朝上置于载玻片上, 分别滴加100 μL生理盐水、1%去氧胆酸钠、空白温敏凝胶和TTG, 轻轻盖上盖玻片, 于200倍光学显微镜下观察蟾蜍上腭黏膜纤毛摆动情况, 记录从给药开始到纤毛停止摆动所持续的时间, 即纤毛持续运动时间(persistent vibration duration, PVD)。以各给药组蟾蜍的PVD除以生理盐水的PVD即得纤毛持续运动百分率(percentage of persistent vibration, PPV)。PPV越高表示药物对纤毛的毒性越小, 反之越大。
小鼠单次延长应激(single prolonged stress, SPS)模型建立 所有小鼠适应性饲养3天后, 随机分为正常组、SPS模型组和TTG治疗组, 每组6只, 共18只。SPS模型[20]的建立共分为3个步骤: ①禁锢:将小鼠置于50 mL离心管(离心管穿孔以保证动物正常呼吸), 水平放置禁锢2 h; ②强迫游泳:将禁锢后的小鼠放到水深11 cm、水温(25 ± 1) ℃的2 L烧杯中强迫游泳20 min; ③乙醚麻醉:将强迫游泳后的小鼠放到饲养笼中恢复15 min后, 用无水乙醚将小鼠麻醉至意识丧失后, 将其置于通风处待其自然苏醒, 再正常饲养。
高架十字迷宫 小鼠高架十字迷宫(elevated plus maze, EPM)由长臂、短臂及中央区连接而成, 长臂长700 mm, 宽80 mm; 短臂长665 mm, 宽55 mm, 底部和四周均为黑色, 整体置于可升降的不绣钢支架上, 调节高架十字迷宫底座到地面的距离为80 cm。给药7天后进行EPM检测[21], 将小鼠头朝开臂方向由中央区域自由放下, 记录300 s内小鼠分别进入开放臂和闭合臂的次数和滞留时间, 以验证SPS模型是否建立成功, 评价TTG是否具有抗PTSD作用。每只小鼠实验结束后清理粪便, 用75%酒精擦拭小鼠活动区域, 擦干后再进行下一轮实验, 避免排泄物及气味对实验小鼠的影响。
小鼠条件恐惧模型建立 条件恐惧实验(不可逃避足底电击)中所有小鼠适应性饲养3天后, 随机分为正常组、条件恐惧模型组和TTG治疗组, 每组3只, 共9只。条件恐惧模型[22]建立是将小鼠放到幽闭电击箱中接受两个阶段的刺激: ①自发活动阶段:将小鼠放到幽闭电击箱中自由活动300 s, 不予以任何刺激; ②刺激阶段: 15次间断的、不可逃避的足底电击(电击参数: 0.8 mA, 持续10 s, 间隔10 s, 共300 s), 上述阶段持续两天。正常组置于幽闭电击箱, 但不给予电击, 共600 s。每只小鼠实验结束后清理粪便, 并用75%乙醇擦拭幽闭电击箱底部及侧面, 避免排泄物及气味对实验小鼠的影响。
小鼠僵住行为检测 给药7天后, 将小鼠置于电击箱中进行环境重现实验, 不给予任何刺激(每只动物放在与造模时同样的电击箱内), 采用视频分析软件检测小鼠在300 s内的不动时间。
给药方案 模型建立成功后第2天开始给药, TTG组单侧鼻孔给予20 mg·kg-1 TTG 20 μL, 每日1次, 连续7天, 正常组及模型组不给药。
H & E病理切片观察 条件恐惧模型小鼠在给药7天且僵住行为检测后麻醉, 取全脑组织置于4%多聚甲醛中保存固定、脱水、石蜡包埋、切成薄片, H & E染色, 200倍光学显微镜下观察脑组织形态学变化[23]。
免疫组化检测c-fos蛋白表达 不可逃避足底电击模型小鼠在给药7天且僵住行为检测后麻醉, 取全脑组织置于4%甲醛中保存, 切海马及前额叶皮层横切面, 200倍镜下观察c-fos蛋白的表达情况。
统计学方法 利用SPSS16.0分析软件, 多组间的数据采用单因素方差分析, 实验数据均以x ± s表示, P < 0.05表示有显著性差异。
结果 1 TTG胶凝温度及胶凝时间在4 ℃时, TTG外观为白色黏稠流动状液体(图 2A); 37 ℃时, 迅速转变成不流动凝胶态(图 2B)。通过试管倒转法测定TTG的胶凝温度低于32 ℃, 胶凝时间为1.32 min。

|
Figure 2 Tetrandrine temperature-sensitive gels (TTG) appearance. A: T < 32 ℃, B: T > 32 ℃ |
G'代表半固体状态, G"代表液体状态。23 ℃时, G'等于G", 此温度即为液体向半固体转变的临界温度。当温度低于23 ℃时, G"高于G', 液体的黏性特征占优势, 说明此时的温敏凝胶为流动的液体; 当温度高于23 ℃时, G'大于G", 固体的弹性特征占主导, 此时的凝胶状态为半固体; 当温度升高至35 ℃后, G'及G"均趋于稳定, 且G'大于G", 因此在鼻腔温度下, TTG以半固体状态黏附于鼻腔内, 增加在鼻腔内的滞留时间(图 3A)。
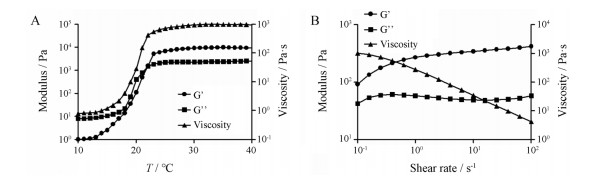
|
Figure 3 The storage modulus (G'), loss modulus (G") and viscosity curve of TTG. The change of modulus and viscosity of TTG at 10 ℃-40 ℃ with 1% shear rate (A) and with shear rates between 0.1 s-1 and 100 s-1 at 32 ℃ (B) |
温度为32 ℃、ω在0.1~100 s-1内时, G'大于G", TTG处于半固体状态, 表明鼻腔环境下, 制剂的固体性质始终强于液体性质, 凝胶结构稳定; 随着ω增加, 凝胶黏度变小, 存在剪切变稀现象(图 3B)。
3 TTG鼻腔滞留时间延长随着时间延长, Cy7溶液组和Cy7温敏凝胶组小鼠鼻腔中荧光强度均逐渐下降, 前者下降较快, 后者下降较慢。溶液流动性好, 易通过鼻内纤毛运动排出, 不能在鼻腔内滞留, 给药后很快通过鼻腔流到口腔内。而温敏凝胶具有生物黏附性, 给药后0、0.5、1、2和4 h鼻腔内荧光强度均高于Cy7生理盐水溶液(图 4)。说明以凝胶作为药物载体至少可在鼻腔内停留4 h, 延长药物在鼻腔内滞留时间, 减少鼻纤毛摆动引起的药物流失, 提高药物生物利用度。

|
Figure 4 In vivo imaging of mice to investigate the nasal retention time of Cy7 temperature-sensitive gels. Normal group, Cy7 saline group, Cy7 temperature-sensitive gels at 0 h (A), 0.5 h (B), 1 h (C), 2 h (D) and 4 h (E) after administration, respectively |
生理盐水组蟾蜍上腭黏膜纤毛结构排列整齐, 清晰可见, 运动活跃, 有规律地向同一方向呈麦浪式摆动, 且摆动频率较高(图 5A)。当给予1%去氧胆酸钠后, 黏膜表面排列杂乱无章, 纤毛结构被严重破坏, 在短时间内停止摆动, 部分脱落, 毒性最大(图 5B)。空白温敏凝胶组及TTG组, 纤毛结构较清晰完整, 运动较活跃, 未出现明显细胞脱落现象, 表明空白温敏凝胶和TTG对纤毛几乎没有毒性, 安全性较高, 可用于鼻腔给药(图 5C、D)。
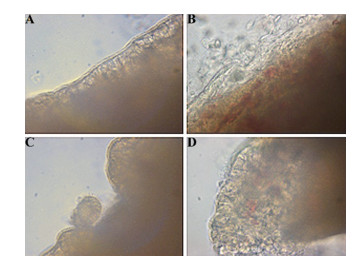
|
Figure 5 The effect of different formulations on cilia structure of toad. A: Normal saline group; B: Sodium deoxycholate group; C: Blank gel group; D: TTG group |
各给药组的PVD和PPV由高到低排列顺序依次为生理盐水组 > 空白温敏凝胶组 > TTG组 > 去氧胆酸钠组(表 1)。与生理盐水组相比, 去氧胆酸钠组的PVD和PPV显著降低(P < 0.001);与去氧胆酸钠组相比, 空白温敏凝胶及TTG组的PVD、PPV均显著升高(P < 0.001), 说明空白温敏凝胶和TTG安全性较高。
| Table 1 The effect of different formulations on the movement of toad cilia. PVD: Persistent vibration duration; PPV: Percentage of persistent vibration. n = 3, x ± s. ***P < 0.001 vs normal saline group; ###P < 0.001 vs sodium deoxycholate group |
从正常组、模型组和TTG组的路径分析, 与正常组相比, 模型组在开臂滞留的路径明显缩短(图 6A、B), 表明SPS模型建立成功。与模型组相比, TTG组在开臂滞留的路径明显延长, 表明TTG对PTSD具有良好的改善作用(图 6B、C)。与正常组相比, 模型组OE明显降低(P < 0.001), 尽管OL及OT指标均无统计学差异(P > 0.05), 但与正常组相比仍有焦虑行为发生。与模型组相比, TTG单侧鼻孔给药7天后OE、OT明显增高(P < 0.01, P < 0.05)。尽管OL无统计学差异(P > 0.05), 但TTG组与模型组相比仍有改善的趋势, 表明TTG具有良好的抗PTSD作用。
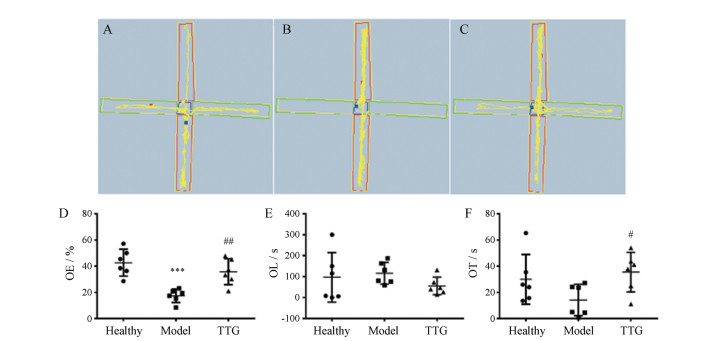
|
Figure 6 Anti-post-traumatic stress disorder (PTSD) effects of TTG in mice in the elevated plus maze (EPM) experiment. A: The EPM route of healthy mice; B: The EPM route of model mice; C: The EPM route of TTG mice; D: The percentages of number of open arm entries (OE) after intranasal administration; E: The latency of open arm entries (OL) after intranasal administration; F: The residence time of open arm entries (OT) after intranasal administration. n = 6, x ± s. ***P < 0.001 vs healthy group; #P < 0.05, ##P < 0.01 vs model group |
与正常组相比, 模型组不动时间明显增高(P < 0.01), 说明环境重现使小鼠产生恐惧记忆, 条件恐惧模型建立成功; 与模型组相比, TTG组的不动时间显著降低(P < 0.05), 表明TTG具有良好的抗PTSD的作用(图 7)。

|
Figure 7 Effects of TTG on freezing time in mice. n = 3, x ± s. **P < 0.01 vs healthy group; #P < 0.05 vs model group |
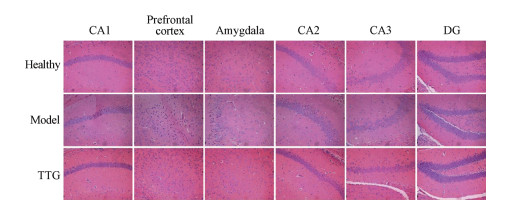
通过倒置荧光显微镜(×200)观察海马(CA1区、CA2区、CA3区、DG区)、前额叶皮层及杏仁核结构, 发现正常组海马、前额叶皮层及杏仁核部位均核型规整, 排列整齐。与正常组相比, 模型组CA1区、前额叶皮层及杏仁核部位核型不规整, 排列不整齐不均匀, 并且出现核固缩深染的现象, 表明不可逃避足底电击导致CA1区、前额叶皮层及杏仁核部位发生了病变。与模型组相比, TTG组核固缩深染现象消失, 且细胞核排列整齐, 说明TTG能缓解PTSD所致小鼠病理学改变。对于海马CA2区、CA3区和DG区, 正常组、模型组、TTG组并无差异, 因此初步判断PTSD病变部位主要在海马的CA1区、前额叶皮层及杏仁核部位[24] (图 8)。
|
Figure 8 H & E staining results of hippocampus (CA1, CA2, CA3, DG), prefrontal cortex and amygdala in mice (×200) |
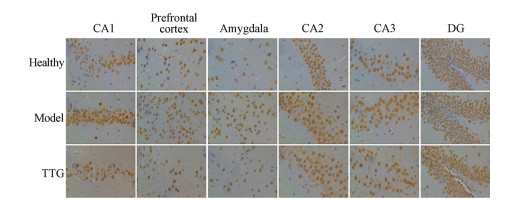
c-fos作为在原癌基因家族中的快速反应基因, 参与神经纤维对伤害性刺激的反应, 表明神经元的兴奋性[25]。倒置荧光显微镜(×200)观察海马(CA1区、CA2区、CA3区、DG区)、前额叶皮层及杏仁核结构, 蓝色为细胞核, 棕黄色为c-fos阳性信号。PTSD模型建立后, 海马CA1区、前额叶皮层及杏仁核部位c-fos的表达量显著增高, 而海马CA2、CA3、DG区未见明显差异。TTG给药7天后, 可降低海马CA1区、前额叶皮层及杏仁核部位c-fos的表达量, 表明TTG对足底电击导致的PTSD症状具有良好的改善作用, 且小鼠的病变部位主要在海马CA1区、前额叶皮层及杏仁核部位(图 9), 与H & E病理切片结果一致。
|
Figure 9 Immunohistochemistry results of hippocampus (CA1, CA2, CA3, DG), prefrontal cortex and amygdala in mice (×200) |
近年来, PTSD发病率越来越高[26], 但对于PTSD发病机制尚不明确, 大量文献表明主要集中于3个方面: ① HPA轴功能紊乱[27]: HPA轴为神经内分泌系统的重要组成部分, 参与并控制应激反应。从解剖学角度讲, 大脑海马及杏仁核与下丘脑之间存在着密切的联系, 这种联系使得大脑核团可以刺激HPA轴; ②炎性因子[28]:炎症反应可使相关蛋白的表达发生变化, 进一步引起氧化应激反应, 导致神经系统损伤; ③ 5-羟色胺(5-hydroxytryptamine, 5-HT)系统[29]: 5-HT在大脑皮层及神经突触内含量较高, 是一种抑制性神经递质。PTSD的发生与5-HT含量异常密切相关, 5-HT本身为一类抗抑郁药, 能产生使人愉悦的信使, 调节人的情绪, 这也为PTSD的治疗提供了可能。粉防己碱具有抗炎、抗氧化及免疫调节等药理作用[30], 本实验室前期实验也表明粉防己碱脑靶向制剂具有治疗微波脑损伤的作用。因此, 认为其可能具有治疗PTSD的作用。
由于血脑屏障的存在, 药物实现脑靶向治疗脑部疾病一直以来是重点也是难点, PTSD作为一种神经系统疾病也存在靶向递送效率低的问题, 因此, 本研究选用鼻腔给药的方式来实现脑靶向, 以可在鼻腔发生相转变的温敏凝胶作为粉防己碱载体, 不仅增加了药物在鼻腔内的滞留时间, 还具有良好的缓控释性能, 提高生物利用度。
本研究采用国际公认的SPS应激和不可逃避足底电击刺激法作为PTSD模型的制备方法。一个有效的动物学模型应当具有3个效度:表观有效性、结构有效性和预测有效性[31], SPS模型具有上述优点, 动物所表现出的行为反应与PTSD患者的某些临床症状相似, 并且可以模拟HPA轴负反馈抑制改变[32]; 而足底电击模型会使动物产生恐惧、抑郁等情绪, 发生神经化学变化[33]。因此, 本研究分别选用SPS及足底电击作为PTSD的模型, 使其产生焦虑及恐惧的情绪, 很好地模拟了PTSD的症状, 具有药理学及生物学意义。
通过高架十字迷宫进行行为学评价, 小鼠PTSD造模后, 开臂进入次数比例及开臂滞留时间明显比正常组减少, 开臂进入潜伏期比正常组高, 表明动物处于焦虑状态; TTG鼻腔给药7天后, 再次进行高架十字迷宫评价, 3个指标显示焦虑的情绪大有改观, 表明TTG能够改善小鼠焦虑的情绪, 产生抗PTSD的作用。僵住行为检测结果显示, 足底电击能使小鼠产生恐惧记忆, 延长不动时间, 而TTG则可缩短小鼠在幽闭恐惧箱内的不动时间, 进而产生抗PTSD的作用。H & E及c-fos免疫组化病理切片反映了PTSD的病变部位主要在海马CA1区、前额叶皮层及杏仁核。综上所述, 粉防己碱温敏凝胶作为一种中药单体脑靶向制剂, 鼻腔滞留时间长, 安全性高, 可显著改善PTSD症状, 为PTSD治疗提供一种新选择。但其作用机制尚不清楚, 还需进一步研究。
| [1] | Jerud A, Pruitt L, Zoellner L, et al. The effects of prolonged exposure and sertraline on emotion regulation in individuals with posttraumatic stress disorder[J]. Behav Res Ther, 2016, 77: 62–67. DOI:10.1016/j.brat.2015.12.002 |
| [2] | Georgopoulos AP, James LM, Christova P, et al. A two-hit model of the biological origin of posttraumatic stress disorder (PTSD)[J]. J Ment Health Clin Psychol, 2018, 2: 9–14. |
| [3] | Berke D, Kline N, Wachen J, et al. Predictors of attendance and dropout in three randomized controlled trials of PTSD treatment for active duty service members[J]. Behav Res Ther, 2019, 118: 7–17. DOI:10.1016/j.brat.2019.03.003 |
| [4] | Seo EJ, Fischer N, Efferth T. Phytochemicals as inhibitors of NF-kappaB for treatment of Alzheimer's disease[J]. Pharmacol Res, 2018, 129: 262–273. DOI:10.1016/j.phrs.2017.11.030 |
| [5] | Qin G, Gui B, Xie J, et al. Tetrandrine alleviates nociception in a rat model of migraine via suppressing S100B and p-ERK activation in satellite glial cells of the trigeminal ganglia[J]. J Mol Neurosci, 2018, 64: 29–38. DOI:10.1007/s12031-017-0999-5 |
| [6] | Que X, Su J, Guo P, et al. Study on preparation, characterization and multidrug resistance reversal of red blood cell membrane-camouflaged tetrandrine-loaded PLGA nanoparticles[J]. Drug Deliv, 2019, 26: 199–207. DOI:10.1080/10717544.2019.1573861 |
| [7] | Jiang Q, Liu WY, Feng W, et al. Effects of prenatal tetrandrine treatment on the expression of kruppel-like factor 5 and survivin in the lung of congenital diaphragmatic hernia rat model induced by nitrofen[J]. Natl Med J China (中华医学杂志), 2018, 98: 539–543. |
| [8] | Thurgur H, Pinteaux E. Microglia in the neurovascular unit: blood-brain barrier-microglia interactions after central nervous system disorders[J]. Neuroscience, 2019, 405: 55–67. DOI:10.1016/j.neuroscience.2018.06.046 |
| [9] | Kanazawa T, Kaneko M, Niide T, et al. Enhancement of nose-to-brain delivery of hydrophilic macromolecules with stearate- or polyethylene glycol-modified arginine-rich peptide[J]. Int J Pharm, 2017, 530: 195–200. DOI:10.1016/j.ijpharm.2017.07.077 |
| [10] | Lin T, Liu E, He H, et al. Nose-to-brain delivery of macromolecules mediated by cell-penetrating peptides[J]. Acta Pharm Sin B, 2016, 6: 352–358. DOI:10.1016/j.apsb.2016.04.001 |
| [11] | Sunena Singh S, Mishra D. Nose to brain delivery of galantamine loaded nanoparticles: in-vivo pharmacodynamic and biochemical study in mice[J]. Curr Drug Deliv, 2019, 16: 51–58. |
| [12] | Trotta V, Pavan B, Ferraro L, et al. Brain targeting of resveratrol by nasal administration of chitosan-coated lipid microparticles[J]. Eur J Pharm Biopharm, 2018, 127: 250–259. DOI:10.1016/j.ejpb.2018.02.010 |
| [13] | Hao J, Zhao J, Zhang S, et al. Fabrication of an ionic-sensitive in situ gel loaded with resveratrol nanosuspensions intended for direct nose-to-brain delivery[J]. Colloids Surf B Biointerfaces, 2016, 147: 376–386. DOI:10.1016/j.colsurfb.2016.08.011 |
| [14] | Soliman M, Elmowafy E, Casettari L, et al. Star-shaped poly(oligoethylene glycol) copolymer-based gels: thermo-responsive behaviour and bioapplicability for risedronate intranasal delivery[J]. Int J Pharm, 2018, 543: 224–233. DOI:10.1016/j.ijpharm.2018.03.053 |
| [15] | Kouchak M, Mahmoodzadeh M, Farrahi F. Designing of a pH-triggered carbopol(R)/HPMC in situ gel for ocular delivery of dorzolamide HCl: in vitro, in vivo, and ex vivo evaluation[J]. AAPS PharmSciTech, 2019. DOI:10.1208/s12249-019-1431-y |
| [16] | Hou W, Zhou Z, Zhang L, et al. Low-voltage-manipulating spin dynamics of flexible Fe3O4 films through ionic gel gating for wearable devices[J]. ACS Appl Mater Interfaces, 2019, 11: 21727–21733. DOI:10.1021/acsami.9b06505 |
| [17] | Huang J, Jiang X. Injectable and degradable pH-responsive hydrogels via spontaneous amino-yne click reaction[J]. ACS Appl Mater Interfaces, 2018, 10: 361–370. DOI:10.1021/acsami.7b18141 |
| [18] | Ci L, Huang Z, Liu Y, et al. Amino-functionalized poloxamer 407 with both mucoadhesive and thermosensitive properties: preparation, characterization and application in a vaginal drug delivery system[J]. Acta Pharm Sin B, 2017, 7: 593–602. DOI:10.1016/j.apsb.2017.03.002 |
| [19] | Cheng YK, Guo YW, Shang KX, et al. Selecting solvent and solubilizer for puerarin nasal drops by solubility and irritation[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 4335–4339. |
| [20] | Wan J, Liu D, Zhang J, et al. Single-prolonged stress induce different change in the cell organelle of the hippocampal cells: a study of ultrastructure[J]. Acta Histochem, 2016, 118: 10–19. DOI:10.1016/j.acthis.2015.11.003 |
| [21] | Alonso-Caraballo Y, Hodgson KJ, Morgan SA, et al. Enhanced anxiety-like behavior emerges with weight gain in male and female obesity-susceptible rats[J]. Behav Brain Res, 2019, 360: 81–93. DOI:10.1016/j.bbr.2018.12.002 |
| [22] | Brás S, Soares SC, Cruz T, et al. The feasibility of an augment reality system to study the psychophysiological correlates of fear-related responses[J]. Brain Behav, 2018, 8: e01084. DOI:10.1002/brb3.1084 |
| [23] | Sanjo N, Nose Y, Shishido-Hara Y, et al. A controlled inflammation and a regulatory immune system are associated with more favorable prognosis of progressive multifocal leukoencephalopathy[J]. J Neurol, 2019, 266: 369–377. DOI:10.1007/s00415-018-9140-0 |
| [24] | Song X, He R, Han W, et al. Protective effects of the ROCK inhibitor fasudil against cognitive dysfunction following status epilepticus in male rats[J]. J Neurosci Res, 2019, 97: 506–519. DOI:10.1002/jnr.24355 |
| [25] | Fung C, Koussoulas K, Unterweger P, et al. Cholinergic submucosal neurons display increased excitability following in vivo cholera toxin exposure in mouse ileum[J]. Front Physiol, 2018. DOI:10.3389/fphys.2018.00260 |
| [26] | Zhe X, Liu K, Mu Y, et al. Decreased regional cerebral perfusion at resting state in acute posttraumatic stress disorder resulting from a single, prolonged stress event[J]. Acad Radiol, 2016, 23: 1083–1090. DOI:10.1016/j.acra.2016.05.002 |
| [27] | Sabbagh J, Cordova R, Zheng D, et al. Targeting the FKBP51/GR/Hsp90 complex to identify functionally relevant treatments for depression and PTSD[J]. ACS Chem Biol, 2018, 13: 2288–2299. DOI:10.1021/acschembio.8b00454 |
| [28] | Lima B, Hammadah M, Wilmot K, et al. Posttraumatic stress disorder is associated with enhanced interleukin-6 response to mental stress in subjects with a recent myocardial infarction[J]. Brain Behav Immun, 2019, 75: 26–33. DOI:10.1016/j.bbi.2018.08.015 |
| [29] | Browne C, Falcon E, Robinson S, et al. Reversal of stress-induced social interaction deficits by buprenorphine[J]. Int J Neuropsychopharmacol, 2018, 21: 164–174. DOI:10.1093/ijnp/pyx079 |
| [30] | Xu W, Meng K, Tu Y, et al. Tetrandrine potentiates the glucocorticoid pharmacodynamics via inhibiting P-glycoprotein and mitogen-activated protein kinase in mitogen-activated human peripheral blood mononuclear cells[J]. Eur J Pharmacol, 2017, 807: 102–108. DOI:10.1016/j.ejphar.2017.04.007 |
| [31] | Maximino C, van der Staay FJ. Behavioral models in psychopathology: epistemic and semantic considerations[J]. Behav Brain Funct, 2019. DOI:10.1186/s12993-019-0152-4 |
| [32] | Piggott VM, Bosse KE, Lisieski MJ, et al. Single-prolonged stress impairs prefrontal cortex control of amygdala and striatum in rats[J]. Front Behav Neurosci, 2019. DOI:10.3389/fnbeh.2019.00018 |
| [33] | Abdullahi PR, Vafaei A, Ghanbari A, et al. Time-dependent protective effects of morphine against behavioral and morphological deficits in an animal model of posttraumatic stress disorder[J]. Behav Brain Res, 2019, 364: 19–28. DOI:10.1016/j.bbr.2019.01.058 |
 2019, Vol. 54
2019, Vol. 54


