近来, 有研究报道发现C48/80 (compound 48/80)等小分子化合物能够通过小鼠肥大细胞上的MrgprB2受体, 引发小鼠发生过敏样反应[1]。不同于IgE介导的Ι型过敏反应和补体途径的过敏反应[2], 这种过敏反应与给药速度和剂量直接相关, 并在首次用药后即可出现, 被称为类过敏反应。药物作用于MrgprB2受体后, 造成肥大细胞内钙离子浓度升高, 引起肥大细胞颗粒物质的释放, 促使类过敏反应的发生。同时还发现, MrgprB2受体与人肥大细胞膜上的MRGPRX2受体具有同源性, 是引发药物类过敏反应的关键受体, 小分子药物通过作用于MrgprB2受体造成野生型小鼠出现类过敏反应, 但当敲除MrgprB2受体后, 这种类过敏反应症状也不再出现, 并进一步证实了临床上经常发生过敏反应的四氢异喹啉类肌肉松弛药[2]、氟喹诺酮类抗菌药[3]等小分子药物就是通过MrgprB2活化肥大细胞而导致类过敏反应发生的, 明确了人肥大细胞膜上的G蛋白偶联受体MRGPRX2就是药物引发类过敏反应的关键靶受体。
中药及其制剂是临床上广泛使用的有效药物。近年来, 各类中药制剂尤其是中药注射剂引起过敏样反应的报道增多, 但作用靶点与分子机制尚无相关研究[4, 5]。倍半萜类物质广泛存在于多种药物制剂中[6], 其引发的过敏样反应是否是由于共同的异戊二烯单元引起的并不明确。并且, 此类物质致敏的分子机制尚无完整研究报道。因此, 有必要对其引发的过敏反应机制进行研究。环丙沙星作为MRGPRX2受体的激动剂, 能够导致肥大细胞释放β-氨基己糖苷酶和组胺等过敏介质而引发类过敏反应。在此基础上, 本研究探讨吉马酮是否通过MRGPRX2引发类过敏反应, 明确导致类过敏机制, 为药物安全性使用奠定实验基础。
材料与方法仪器与设备 RPL-10ZD装柱机(大连日普利科技仪器有限公司, 中国); HC-3018R高速冷冻离心机(科大创新股份有限公司中佳分公司, 中国); 高效液相色谱/质谱联用仪(HPLC/MS) (日本岛津公司, 日本), 包括: LC-20AD高效液相色谱泵3个, SIL-20A自动进样器, CTO-20A柱温箱, SPD-20A紫外检测器, SPD-M20A二极管阵列检测器, LCMS2010质谱仪, LCMS-Solution工作站; SW-CJ-1F超净工作台(苏州安泰空气技术有限公司, 中国); MCO-15AC CO2细胞培养箱(日本三洋电机株式会社, 日本); 尼康Ti-S倒置荧光显微镜(尼康株式会社, 日本); AUY-120精密天平(岛津公司, 日本)。
试剂 人参皂苷Re、人参皂苷Rb1、吉马酮(成都普非德, 中国); C48/80 (Sigma试剂公司, 美国)青霉素、链霉素(大连美罗制药厂, 中国); 氯化钠和氯化钾(天津市天力化学试剂有限公司, 中国); 氢氧化钠(天津市科密欧化学试剂有限公司, 中国); 七水合硫酸镁(成都化学试剂厂, 中国); 十二水合磷酸氢二钠(广东省化学试剂工程技术研究开发中心, 中国); 超纯水实验室自制。
细胞系 LAD2人肥大细胞株(NIH赠与), 培养基StemPro-34+10 mL·L-1 StemPro nutrient supplement (Invitrogen公司, 美国), 2 mmol·L-1 L-glutamine (R & D公司, 美国), 100 ng·mL-1人干细胞生长因子(human stem cell factor, SCF) (义翘神州科技有限公司, 中国), 于37 ℃、5%的CO2培养箱中培养。
细胞膜固定相制备 将细胞悬液于4 ℃条件下5 000 r∙min-1离心10 min, 去除上清的培养液, 沉淀即为细胞, 加入生理盐水重新混悬后于上述条件离心, 生理盐水清洗过程重复2次。向得到的细胞中加入预冷的Tris-HCl溶液5 mL, 置于超声仪内冰浴超声30 min破碎细胞, 以保证细胞膜的活性。同时称取0.02 g硅胶于具支试管中, 置于105 ℃烘箱中活化30 min。超声破碎细胞后, 用细胞破碎仪再次破碎, 程序为工作3 s, 间歇1 s, 6次。离心10 min (4 ℃, 1 500 ×g), 吸取上清液于另外一只离心管中, 离心10 min (4 ℃, 12 000 ×g), 得到沉淀即为细胞膜, 沉淀用生理盐水重悬, 再离心10 min (4 ℃, 12 000 ×g), 将得到的细胞膜清洗一次。沉淀用5 mL的生理盐水混悬, 吸入5 mL注射器中, 于真空涡旋振荡条件下与已经活化的硅胶混匀, 置于磁力搅拌器上于4 ℃条件搅拌30 min, 静置过夜, 得到细胞膜固定相悬液。
CMC柱的制备 将细胞膜固定相悬液涡旋混匀, 转移至10 mL离心管中, 4 ℃条件下2 000 r∙min-1离心10 min, 弃上清, 沉淀加入生理盐水约5 mL涡旋混匀, 重复上述操作2次, 去除多余的未包裹在硅胶上的细胞膜, 向沉淀中加入生理盐水约5 mL涡旋混匀, 倒入事先已经冲洗过的装柱机中, 流动相为水, 流速为2.0 mL·min-1, 装柱时的压力不超过10 MPa, 装柱时间5 min, 即可将细胞膜固定相装入柱芯中, 将装填好的细胞膜色谱柱装入液相色谱仪中使用。
色谱条件 细胞膜色谱条件1:超纯水为流动相, 流速0.2 mL·min-1, PDA检测器检测。细胞膜色谱条件2:流动相: 50 mmol·L-1 PBS缓冲盐; 流速: 0.2 mL·min-1; 柱温箱: 37 ℃; PDA检测。
制备LAD2/CMC色谱柱用于细胞膜色谱法分析, 色谱柱在使用前预平衡1 h。已知环丙沙星可以引起类过敏反应[1], 所以使用其作为阳性对照应用于二维在线检测可引起类过敏的试剂。LAD2/CMC细胞膜的重现性通过反复注射环丙沙星来检测。对于一根LAD2/CMC细胞膜色谱柱, 保留时间由5次重复注射致敏成分(5 μL, 0.1 mg·mL-1)来计算和确定。
钙成像 LAD2细胞以5 000个细胞每孔接种于96孔板中, 在37 ℃饱和湿度的细胞培养箱中培养过夜, 离心, 弃上清, 加入5 ng·mL-1 Fluo-3-AM的钙成像缓冲溶液(CIB: NaCl 125 mmol·L-1, KCl 3 mmol·L-1, CaCl2 2.5 mmol·L-1, MgCl2 0.6 mmol·L-1, HEPES 10 mmol·L-1, 葡萄糖20 mmol·L-1, NaHCO3 1.2 mmol·L-1, 蔗糖20 mmol·L-1, pH 7.4), 37 ℃培养箱孵育30 min。弃孵育液, 加入CIB清洗一遍后弃上清, 再次加入CIB, 每孔100 μL, 于荧光显微镜的蓝光下, 以C48/80为阳性对照, CIB为阴性对照, 给药组每孔依次加入400 μmol·L-1, 加药体积为100 μL的人参皂苷Re、人参皂苷Rb1和吉马酮后采集荧光变化突变, 曝光时间为200 ms, 每秒拍一张, 拍照时间为2 min。
β-氨基己糖苷酶释放率的测定 将LAD2细胞稀释为终浓度为每毫升1×105个细胞, 每孔100 μL接种于96孔板, 并设置4个复孔。在37 ℃饱和湿度的细胞培养箱中培养过夜。次日, 对于给药组细胞, 1 500 r·min-1室温离心5 min后, 弃上清, 以台式液配制浓度为100、200、400 μmol·L-1的吉马酮, 并依次加入孔板中, 30 μg·mL-1的C48/80为阳性对照, 单独的台式液为阴性对照, 37 ℃下培养30 min后, 1 500 r·min-1室温离心5 min, 得到给药组细胞培养基上清; 再用0.1% Triton X-100裂解空白组细胞5 min, 将裂解液吹打均匀, 在1 500 r·min-1室温离心5 min, 得到细胞裂解液。将给药组细胞培养基上清及细胞裂解液各50 μL分别加入空白96孔板, 每孔加入底物1 mmol·L-1的β-氨基己糖50 μL, 置于37 ℃培养箱内孵育90 min, 孵育完成后, 每孔加入0.1 μmol·L-1 Na2CO3/NaHCO3终止液150 μL终止反应。将96孔板置于室温摇床上摇晃混匀2 min, 在酶标仪上405 nm下检测吸光度值(OD)。β-氨基己糖苷酶释放率的计算方法: β-氨基己糖苷酶释放率(%) = [上清液吸光度/(上清液吸光度+细胞裂解液吸光度)]×100%。
组胺释放量的测定 将LAD2细胞稀释为终浓度为每毫升1×106个细胞, 每孔100 μL接种于96孔板, 在37 ℃饱和湿度的细胞培养箱中培养过夜。次日, 1 500 r·min-1室温离心5 min后, 弃上清, 加入台式液配制的浓度为100, 400 μmol·L-1吉马酮溶液, 30 μg·mL-1的C48/80为阳性对照, 阴性对照组加入台式液100 μL, 37 ℃下培养30 min后, 1 500 r·min-1室温离心5 min, 取上清50 μL, 加入含100 μL内标(氘代组胺, 美国Sigma公司)的新1.5 mL EP管中, 振荡10 s。10 000 r·min-1, 4 ℃离心10 min。离心后吸取上清50 μL于进样瓶中, 质谱检测。
siRNA干扰 MrgprX2 siRNA片段为forward: 5'‑ GUACAACAGUGAAUGGAAATT‑3'、reverse: 5'‑UUU CCAUUCACUGUUGUACTT‑3';无序的siRNA片段作为阴性对照forward: 5'‑UUCUCCGAACGUGUCACG UTT‑3'、reverse: 5'‑ACGUGACACGUUCGGAGAATT‑ 3'。分别稀释75 pmol MrgprX2 siRNA和Lipofectamine 2000稀释液7.5 µL至100 µL Opti-MEM培养基中, 静置2 min后, 将MrgprX2 siRNA加入到Lipofectamine 2000稀释液中, 轻柔混匀, 室温静置15 min。将LAD2细胞以每孔(0.25~1)×106个细胞接种于6孔板中, 加入MrgprX2 siRNA和Lipofectamine 2000的混合液, 轻柔混匀。转染48 h后用于后续实验。
竞争性结合实验 竞争性结合实验是通过使用6×10-8~9.6×10-7 mol·L-1不同浓度的吉马酮作为LAD2/CMC细胞膜色谱柱的流动相, 检测不同浓度环丙沙星的保留时间。再根据已知竞争性位移分析法考察药物的作用位点。
统计学方法 所有实验数据采用平均值±标准差(x ± s)表示, 用SPSS 18.0统计软件进行student's t-test分析, P < 0.05为具有统计学差异, P < 0.01为统计学差异较显著, P < 0.001为统计学差异极显著。
结果 1 吉马酮可引起LAD2细胞内钙离子浓度升高具有致敏作用的药物可激活肥大细胞钙动员, 引起肥大细胞内Ca2+浓度的升高, 胞内游离的Ca2+与荧光探针结合发出荧光, 可通过荧光强度表征胞内Ca2+的含量。在400 μmol·L-1吉马酮、人参皂苷Re或人参皂苷Rb1的作用下, 仅吉马酮可使人肥大细胞LAD2细胞内Ca2+浓度升高, 其他两种作用甚微(图 1)。
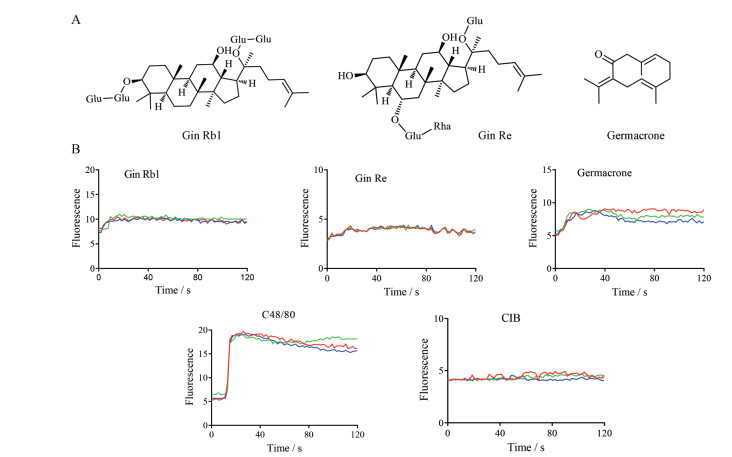
|
Figure 1 Germacrone increased Ca2+ concentration in LAD2 cells. A: Chemical structure of ginsenoside Rb1, ginsenoside Re and germacrone; B: Calcium image of ginsenoside Rb1, ginsenoside Re and germacrone (400 μmol·L-1) on LAD2 cells. C48/80: Compound 48/80. Experiments are repeated thrice, and each color line represents an individual cell |
肥大细胞激活后会发生脱颗粒反应释放颗粒物质, β-氨基己糖苷酶和组胺包含于肥大细胞释放的颗粒物质中, 可作为评价肥大细胞脱颗粒反应程度的标志物。吉马酮能够剂量依赖性的激活LAD2细胞, 释放β-氨基己糖苷酶和组胺。100 μmol·L-1不引起LAD2细胞激活, 而在200和400 μmol·L-1吉马酮的作用下, 可以引起人肥大细胞LAD2 β-氨基己糖苷酶的释放率分别为29.8% ± 1.9%和37.5% ± 0.7% (图 2A)。组胺是肥大细胞释放的重要致敏介质, 在200和400 μmol·L-1吉马酮的作用下, 组胺的释放量分别为(174.4 ± 8.9)和(231.8 ± 17.6) ng·mL-1 (图 2B)。与对照组相比, 具有统计学差异(P < 0.05)。
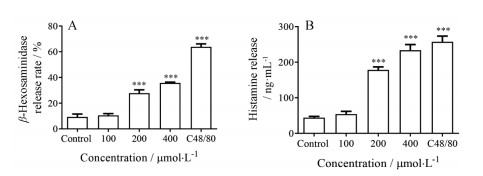
|
Figure 2 Germacrone induced LAD2 cells degranulation reaction. A: The release rate of β-hexosaminidase by germacrone on LAD2; B: The histamine release by germacrone on LAD2. n = 6, x ± s. ***P < 0.001 vs Control |
为了考察吉马酮致类过敏反应与MRGPRX2受体的关系, 采用siRNA干扰的方法敲低LAD2细胞中的MRGPRX2的表达。通过Control-siRNA与MrgprX2-siRNA干扰后, 吉马酮刺激LAD2细胞脱颗粒释放β-氨基己糖苷酶的作用明显降低(图 3A)。同时还发现与对照组相比, 使胞内钙离子浓度升高的作用也明显降低(图 3B)。
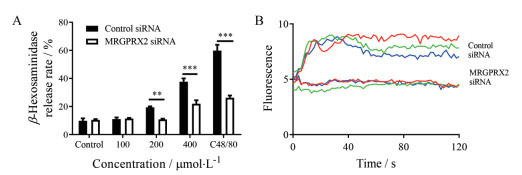
|
Figure 3 The allergic effect of germacrone on MrgprX2-knockdown LAD2 cells. A: The β-hexosaminidase release of germacrone on MrgprX2-knockdown LAD2 cells; B: Representative Fluo-3 fluorescence incubated of MrgprX2-knockdown LAD2 cells showing changes in Ca2+ induced by 400 μmol·L-1 Germacrone. Experiments are repeated thrice. n = 6, x ± s. and analyzed using two-tailed unpaired Student's t-test. **P < 0.01, ***P < 0.001. Each color line represents an individual cell |
分别采用6×10-8~9.6×10-7 mol·L-1不同浓度的吉马酮作为流动相, 色谱柱进样注射环丙沙星, 记录环丙沙星在不同流动相下的保留时间[7]。环丙沙星作为明确的MRGPRX2受体的激动剂, 其与吉马酮一样, 均在LAD2细胞膜色谱柱上具有保留作用(图 4A)。根据竞争剂环丙沙星的保留时间, 发现环丙沙星的保留时间随着流动相中吉马酮浓度的增加而降低(图 4B)。结果表明吉马酮与环丙沙星在LAD2/CMC细胞膜色谱柱上具有相同的结合位点。
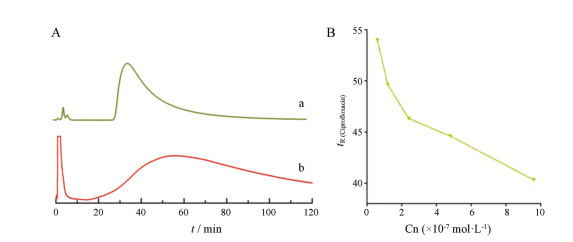
|
Figure 4 Germacrone and ciprofloxacin could competitive bind MRGPRX2. A: The LAD2/CMC chromatograms of germacrone and ciprofloxacin; B: Germacrone decreased reserve time of ciprofloxacin in a dose-manner |
小分子药物引发的类过敏反应可能是源于药物直接刺激肥大细胞或嗜碱性粒细胞, 导致肥大细胞脱颗粒释放组胺类活性递质而引发的[8]。药物类过敏反应在患者首次用药时即可能发生[9]。近年来, 临床观察发现中药注射剂可以引发类过敏反应[10, 11]。但由于中药组分众多, 相互作用复杂, 引发机制也不清楚。一般情况下, 过敏反应的发生机制分为3类: ①以不依赖IgE介导方式直接刺激肥大细胞, 通过G蛋白偶联受体造成肥大细胞内钙离子浓度升高[12]; ②通过补体受体激活肥大细胞[13]; ③抑制COX-1活性造成生物胺类成分合成及释放[14]。目前药物导致类过敏反应的作用机制报道较少[15]。
钙成像实验证实倍半萜类化合物吉马酮[9]、人参皂苷Re及人参皂苷Rb1[16]中只有吉马酮可激活LAD2细胞, 造成细胞内钙离子浓度升高(图 1)。与此同时, 由于胞内钙离子浓度升高, 激活肥大细胞脱颗粒[17]。因此, 吉马酮能剂量依赖性地引发β-氨基己糖苷酶及组胺(图 2)等颗粒物质的释放。但是, 吉马酮在MRGPRX2敲低的LAD2细胞的细胞内钙离子浓度及脱颗粒作用降低(图 3), 表明吉马酮导致肥大细胞脱颗粒通过MRGPRX2, 所以, 吉马酮引发的类过敏反应与MRGPRX2相关。进一步, 与环丙沙星的竞争性结合实验结果表明, 吉马酮是MRGPRX2的外源性小分子配体(图 4)。但是, 这种对MRGPRX2受体的激活作用, 可能和倍半萜类物质共有的3个异戊二烯单元并不相关。
本实验通过一系列体外实验发现, 200 μmol·L-1以上的吉马酮具有致类过敏作用, 这种类过敏反应具有剂量依赖性。同时对吉马酮与MRGPRX2相互作用特性进行了分析, 对其致敏机制进行研究, 为中药制剂的安全性奠定了实验基础。
| [1] | McNeil BD, Pundir P, Meeker S, et al. Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions[J]. Nature, 2015, 519: 237–241. DOI:10.1038/nature14022 |
| [2] | Feng CX, Xiu X, Tian W, et al. Establishment of in-vitro model of complement activation and its application[J]. Acta Pharm Sin (药学学报), 2017, 52: 722–728. |
| [3] | Blanca-Lopez N, Ariza A, Doña I, et al. Hypersensitivity reactions to fluoroquinolones: analysis of the factors involved[J]. Clin Exp Allergy, 2013, 43: 560–567. DOI:10.1111/cea.12099 |
| [4] | Xu YB, Dou DQ. Advance and prospect in studies on anaphylactoid reaction of traditional Chinese medicine injections[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 2765–2773. |
| [5] | Wang J, Wang T, Li Y S, et al. Allergic constitution theory of Chinese medicine and its assessment criterion and related studies[J]. Chin J Integr Med, 2015, 21: 716–720. DOI:10.1007/s11655-014-1996-y |
| [6] | Hu CQ, Xu MZ, Ma Y, et al. Determination of the allergic impurities in the parenteral injection of Chinese traditional medicines containing Salvia miltiorrhiza[J]. Acta Pharm Sin (药学学报), 2008, 43: 518–522. |
| [7] | Jiang X, Lv B, Li P, et al. Bioactivity-integrated UPLC/Q-TOF-MS of Danhong injection to identify NF-κB inhibitors and anti-inflammatory targets based on endothelial cell culture and network pharmacology[J]. J Ethnopharmacol, 2015, 174: 270–276. DOI:10.1016/j.jep.2015.08.026 |
| [8] | Moon P D, Choi I S, Go J H, et al. Inhibitory effects of BiRyuChe-bang on mast cell-mediated allergic reactions and inflammatory cytokines production[J]. Am J Chin Med, 2013, 41: 1267–1282. DOI:10.1142/S0192415X13500857 |
| [9] | Deng C, Ji J, Li N, et al. Fast determination of curcumol, curdione and germacrone in three species of Curcuma rhizomes by microwave-assisted extraction followed by headspace solid-phase microextraction and gas chromatography-mass spectrometry[J]. J Chromatogr A, 2006, 1117: 115–120. DOI:10.1016/j.chroma.2006.03.066 |
| [10] | Han S, Zhang T, Huang J, et al. New method of screening allergenic components from Shuanghuanglian injection: with RBL-2H3/CMC model online HPLC/MS system[J]. J Pharm Biomed Anal, 2014, 88: 602–608. DOI:10.1016/j.jpba.2013.10.006 |
| [11] | Braakman RB, Bezstarosti K, Sieuwerts AM, et al. Integrative analysis of genomics and proteomics data on clinical breast cancer tissue specimens extracted with acid guanidinium thiocyanate-phenol-chloroform[J]. J Proteome Res, 2015, 14: 1627–1636. DOI:10.1021/acs.jproteome.5b00046 |
| [12] | Ashmole I, Bradding P. Ion channels regulating mast cell biology[J]. Clin Exp Allergy, 2013, 43: 491–502. DOI:10.1111/cea.12043 |
| [13] | Szebeni J. Complement activation-related pseudoallergy: a stress reaction in blood triggered by nanomedicines and biologicals[J]. Mol Immunol, 2014, 61: 163–173. DOI:10.1016/j.molimm.2014.06.038 |
| [14] | Berkes EA. Anaphylactic and anaphylactoid reactions to aspirin and other NSAIDs[J]. Clin Rev Allergy Immunol, 2003, 24: 137–148. DOI:10.1385/CRIAI:24:2:137 |
| [15] | Farnam K, Chang C, Teuber S, et al. Nonallergic drug hypersensitivity reactions[J]. Int Arch Allergy Immunol, 2012, 159: 327–345. DOI:10.1159/000339690 |
| [16] | Qi LW, Wang CZ, Yuan CS. American ginseng: potential structure-function relationship in cancer chemoprevention[J]. Biochem Pharmacol, 2010, 80: 947–954. DOI:10.1016/j.bcp.2010.06.023 |
| [17] | Sibilano R, Frossi B, Pucillo CE. Mast cell activation: a complex interplay of positive and negative signaling pathways[J]. Eur J Immunol, 2014, 44: 2558–2566. DOI:10.1002/eji.201444546 |
 2019, Vol. 54
2019, Vol. 54


