2. 北京中医药大学北京市方剂与证候研究重点实验室, 北京 100029;
3. 北京中医药大学北京中医药研究院, 北京 100029
2. Beijing Key Laboratory of Syndrome Prescription Basic Research, Beijing University of Chinese Medicine, Beijing 100029, China;
3. Beijing Research Institute of Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
紫菀为菊科(Compositae)多年生草本植物紫菀(Aster tataricus L. f.)的干燥根及根茎, 性辛、苦, 温, 归肺经, 具有润肺下气, 消痰止咳的功效, 临床常用于治疗痰多咳喘、新久咳嗽、劳嗽咳血等症[1]。现代药理研究结果表明, 紫菀的药理功效十分广泛, 除传统的祛痰、止咳、平喘活性外[2-4], 紫菀提取物还可以显著的缓解由脂多糖所诱导的小鼠急性肺损伤[5]; 并可以通过控制糖尿病大鼠的血糖浓度及抑制血液中炎症因子的表达, 缓解糖尿病视网膜病变[6]; 不仅如此, 紫菀多糖还可以显著的诱导胃癌细胞SGC-7901的凋亡等[7]。
众所周知, 中药所包含的化学成分是中药发挥药效的物质基础, 且与药理活性密切相关。越来越多的学者逐渐认识到, 中药药效的发挥并不只是简单地依靠其中的某一种化学成分, 而是由多种成分协同作用所产生的效果[8]。因此建立系统的数据采集及相应的数据挖掘策略, 用于紫菀药材成分的全面表征, 对于系统阐释紫菀的药效物质基础及作用机制具有十分重要的意义。
超高效液相色谱-四级杆飞行时间串联质谱(UHPLC-Q-TOF-MS/MS)联用技术因其强大高效的成分解析能力, 常用于复杂体系成分解析[9]。在本研究中根据数据依赖性采集和数据非依赖性采集的互补性, 利用UHPLC-Q-TOF-MS/MS联用技术, 建立了一种组合的数据采集及相应的数据挖掘策略, 并用于紫菀中化学成分的高效分离及鉴定。
材料与方法仪器与试剂 Agilent 1290超高效液相色谱仪和Agilent 6550离子漏斗四级杆飞行时间串联质谱仪(型号: G6550A, 美国Agilent公司); Milli-Q超纯水制备仪(美国Millipore公司); 乙腈和甲醇(LC/MS级, 美国Fisher公司), 甲酸(LC/MS级, 美国Sigma公司), 其他试剂均为分析纯(北京华威锐科化工有限公司)。紫菀(Aster tataricus L. f.)购自北京同仁堂, 由北京中医药大学王学勇教授鉴定, 药材样本陈列于北京中医药大学中药分析与转化研究中心, 样本编号No.CMAT-AT-201604, 对照品购自中国食品药品检定研究院、成都瑞芬思生物科技有限公司及实验室自制(纯度≥98%)。
供试品溶液的制备 以2015版《中国药典》中紫菀样品的提取方法为依据:取紫菀样品粉末约1 g, 过3号筛, 精密称定, 置具塞锥形瓶中, 精密加入甲醇20 mL, 称定重量, 40 ℃温浸1 h后, 超声处理(功率250 W, 40 kHz) 1 h, 取出, 放冷, 再次称定重量, 并用甲醇补足失重, 摇匀, 过滤。重述上述操作, 合并两次续滤液, 离心(10 000 r·min-1) 10 min, 取上清液, N2吹干, 用50%甲醇溶液1 mL复溶, 过0.22 μm滤膜, 即得。
超高液相色谱条件 样品的分离采用Acquity UPLC HSS T3柱(100 mm×2.1 mm, 1.8 μm, Waters), 柱温箱设定为30 ℃, 检测波长设定为220、254、275、315和360 nm; 流动相由0.1%甲酸水(A)和乙腈(B)组成, 梯度洗脱: 0 min, 95% A; 1 min, 95% A; 5 min, 85% A; 15 min, 60% A; 20 min, 25% A; 25 min, 5% A, 进样体积为2 μL, 流速为0.4 mL·min-1。
质谱条件 电喷雾离子源(ESI), 扫描范围m/z为50~1 500, 正负离子模式检测, 毛细管电压分别为4 kV (ESI+)和3.5 kV (ESI-), 干燥气温度230 ℃, 干燥气流速15 L·min-1, 鞘气温度300 ℃, 鞘气流速12 L·min-1, 雾化气压力50 psig, 碰撞能量10~40 eV, 采样频率0.25 s。
样品分析流程 分别利用数据依赖性和数据非依赖性采集方法, 获取每个样品的高分辨质谱数据。同时, 为了提高检测的灵敏度, 减少碎片离子的遗漏, 采用碰撞能量传播(collision energy spread, CES)的方法, 在数据依赖性采集模式下CES的设置为0 (数据非依赖性采集模式下为15 eV), 当碰撞能量分别为10、20和40 eV时, 可以得到一个不断增强的产物离子色谱图。在数据依赖性采集模式下, 每一次全扫描中, 5个响应最强的离子(响应值大于10 000 counts), 被用于做TOF扫描及相应的产物离子扫描。
数据后处理及分析策略 ①靶向成分的发现。首先, 利用Personal Compound Database Library (PCDL) Manager软件(Agilent Technologies, USA, Version B.07.00)构建紫菀属成分数据库, 数据库中共包含273个紫菀属植物化学成分及其相关信息; 然后, 进一步利用该软件构建对照品成分数据库, 用于收集各对照品在不同碰撞能量下(10/20/40 eV)的高分辨率的特征离子碎片信息; 为确保测定的准确性, 同时还建立了适用于每个对照品的色谱检测方法。②非靶向成分发现。首先, 通过在线数据库对化合物进行实时监测; 然后, 利用MassHunter软件(Agilent Technologies, USA)峰发现集成算法, 生成化合物母离子的提取色谱图(Extracted Ion Chromatograms, EIC), 并对化合物进行识别; 最后, 将MS/MS谱图用于数据库检索, 与数据库匹配的化合物将进一步利用软件中的靶向二级质谱信息(Target MS/MS)进行核查, 以确认待核查化合物的名称及结构。③基于靶向的非靶向成分发现。以紫菀中4种具有代表性的化合物(芹菜素、异鼠李素、山柰酚和α-菠菜甾醇)作为次生代谢产物的模板, 结合Agilent Masshunter Metabolite ID软件, 通过推导其产生的碎片离子, 反向寻找模板衍生化合物, 并进行化合物的鉴定或表征。④化合物的辅助鉴定。关键产物离子(key product ions, KPIs)可用于化合物的快速检测和识别[10, 11]。本研究中主要包含4类化合物的KPIs, 分别为:肽类(106.064 9 m/z, positive, astin C), 酚酸类(191.055 6 m/z, negative, 4-caffeoylquinic acid), 黄酮类(153.018 0 m/z, Positive, 山柰酚)及三萜类(191.178 9 m/z, positive, 紫菀酮)。此外, 在研究的过程中还借助ChemBioDraw Ultra 14.0软件中的一个重要参数Clog P值, 用于预测化合物的同分异构体[12, 13]。
结果与讨论利用上述的全成分采集和挖掘策略, 共有132个化学成分, 包括18个肽类、22个有机酸类、31个黄酮类、43个萜类、9个香豆素类、3个甾体类、3个蒽醌类及3个醛类, 被鉴定或初步表征(图 1和表 1)。在这132个化合物中, 有120个化合物的质谱数据可以通过数据依赖性采集方法获得(占92%), 而所有的132个化合物的质谱数据都可通过数据非依赖性采集方法获得。对于某些化合物(如某些多肽和糖苷), 在数据依赖性采集模式下可以观察到相应的二级碎片离子数据信息, 但是在数据非依赖性采集模式下则无法观察到。矩阵效应是可能导致数据非依赖性采集模式下二级数据采集失败的主要原因[14]。同时, 所鉴定的化合物中, 有59个化合物通过与对照品的保留时间及质谱图进行比对而确认。所鉴定的化合物的误差范围均在±5 ppm以内。
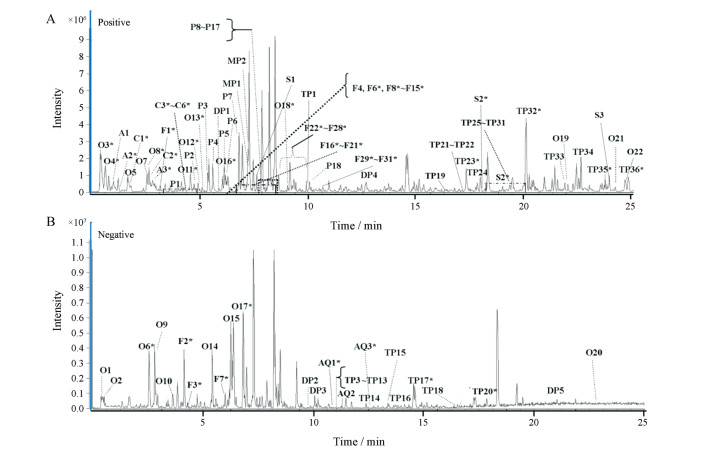
|
Figure 1 Representative base peak chromatograms of Aster tataricus samples both in positive ion mode (a) and negative ion mode (b). '*' in the figure are compounds which confirmed by reference standards; the numbers hereby are consistent with those in Table 1. A: Aldehydes; AQ: Anthraquinones; C: Coumarin; DP: Diterpenes; F: Flavonoids; MP: Monoterpenes; O: Organic acids; P: Peptides; S: Steroids; T: Triterpenens |
| Table 1 Compounds identified in Aster tataricus by UHPLC-Q-TOF-MS/MS. Key product ions are shown in bold. *Compared with standard substance; Aa: 6β-Hydroxy-7, 8-dehydroxy-bacchorticuneatin; Bb: 16β, 17-Dihydroxy(-)-kuarnan-19-oic acid; Cc: 2, 3, 24-Trihydroxyolean-12-en-28-oic acid; Dd: 3-O-(D-arabinopyranosyl-(1→6)-β-D-glucopyranosyl)-2, 3, 16-trihydroxyolean-12-en-28-oic acid; Ee: Shion-22(30)-en-3, 21-dione; Ff: α-Spinasteryl-3-O-β-D-glucoside |
肽类是紫菀中的主要特征性化学成分。在本研究中, 正离子模式下共鉴定了18种肽类化合物, 其关键产物离子为m/z 106.064 9。同时, 在研究的过程中还发现, 该类化合物的二级质谱图信息中通常可以清楚地观察到H20或CO的丢失, 进而得到[M+H-H2O]+或[M+H-CO]+的产物离子[15, 16]。在化合物解析的过程中发现P5与P3是同分异构体; 借助Clog P值可将P5指认为astin E, 因为P5 (astin E)的Clog P值(1.521)比P3 (astin H)的Clog P值(1.468)更大, 进而保留时间也更长。其他化合物, 如asterin B和asterin C, astin A和astin B等同分异构体的判定方法与此类同。
2 有机酸类化合物在本文中共鉴定了22种有机酸类化合物, 其中焦性没食子酸(O3)、原儿茶酸(O4)、绿原酸(O6)、咖啡酸(O8)、阿魏酸(O11)、苯甲酸(O12)、异阿魏酸(O14)、洋蓟素(O16)、咖啡酸甲酯(O17)和丹皮酚(O19)通过与对照品比对而确认。通过非靶向分析, 借助Chemspider在线数据库匹配, 进一步表征了琥珀酸(O1)、2, 2-二甲基琥珀酸(O2)、4-羟基苯甲酸(O5)和正十二烷酸(O21)。母离子为m/z 353.0878的化合物有3个, 其中通过与对照品比对可以确认绿原酸(O6), 对于另外两个化合物, 通过比对其DAD色谱图(波长315 nm), 色谱保留时间及二级碎片离子信息, 结合文献报道, 辅以Clog P值, 可得知另外两个化合物应分别为隐绿原酸(O9)和1-咖啡酰奎宁酸(O13)[22]。洋蓟素(O16)及其同分异构体[3, 4-二咖啡酰奎宁酸(O10)、4, 5-二咖啡酰奎宁酸(O15)和3, 5-二咖啡酰奎宁酸(O18)]的鉴定方法同理[23]。此外, 化合物O20和O22都具有m/z 181和m/z 163的特征碎片离子, 这种碎片离子经常在咖啡酸和咖啡酸酯中出现, 借助PCDL manager数据库初步确定O20和O22分别为十八烷基咖啡酸和二十二酯咖啡酸。
3 黄酮类化合物在本文中共有31种黄酮类成分被鉴定或初步表征, 其关键产物离子为m/z 153.018 3。通过与对照品的保留时间, 二级碎片离子信息进行比对, 共确认了其中的27个化合物。利用上述指定的次生代谢产物模板(芹菜素、异鼠李素和山柰酚), 结合Metabolite ID软件, 对模板化合物的糖基化的产物进行预测, 进一步表征了另外4种黄酮类化合物:芹菜素-5-异鼠李糖苷(F4)、异鼠李素-3-O-新橙皮苷(F11)、异鼠李素-3-O-葡萄糖苷(F14)和山柰酚-3-O-洋槐糖苷(F21)。为佐证所推断化合物的准确性, 可进一步利用多重质量亏损过滤(MMDF)技术对潜在代谢产物进行辅助筛选[25]。例如:化合物F25的准分子离子峰为[M+H]+ m/z 287.055 2 (0.8 ppm, C15H10O5, kaempferol), 化合物F13的准分子离子峰为[M+H]+ m/z 449.107 2 (-1.5 ppm, C21H20O11), 化合物F13的分子质量比F25多162 Da, 利用MMDF筛选推测F13可能是F25的葡萄糖苷的结合物; 进一步观察其碎片离子峰的信息, 化合物F13与F25在断裂的过程中, 均产生了黄酮类化合物的特征碎片离子m/z 153.017 3, 由此可以判定, F13即为F25的葡萄糖苷代谢产物。
4 萜类化合物萜类化合物是紫菀中最重要的指标性成分, 在本文中共鉴定了36个三萜、5个二萜及2个单萜, 其中三萜类化合物的关键产物离子为m/z 191.179 2。通过与对照品的保留时间及碎片离子信息比对, 明确了其中的7个成分, 分别为23-羟基白桦脂酸(TP17)、白桦脂酸(TP20)、齐墩果酸(TP23)、表木栓醇(TP26)、桦木醇(TP32)、木栓酮(TP35)、紫菀酮(TP36)。利用自建PCDL manager成分数据库结合文献比对, 除TP24、TP25、TP28、TP31、TP33和TP34之外, 其余的未知萜类化合物均被初步表征[26-34]。观察发现TP28、TP33、TP34、TP35 (木栓酮)和TP36 (紫菀酮)具有相同的母离子及相似的二级碎片离子信息, 为同分异构体。他们在色谱柱中的保留时间T28最小, 紫菀酮最大。根据它们的二级碎片离子信息, 初步推测TP28、TP33、TP34可能分别为β-香树精、蒲公英甾醇和astertarone A[31, 35, 36]。进一步对所推断化合物的Clog P值进行分析, 它们的Clog P值分别为10.144、10.663、10.675、10.745和10.825, 与它们在色谱柱的保留时间一致, 由此可知化合物的推断正确。同理TP24、TP25、TP31与TP32 (桦木醇)为同分异构体。通过查阅文献及数据库比对, 初步推测TP24、TP25和TP31分别为friedelan-3-ol、astertarone B和astatarone G[31, 37]; 且4个化合物的Clog P值分别为8.087 (TP24)、8.375 (TP25)、10.332 (TP31)和10.479 (TP32), 与其在色谱中的出峰先后顺序一致。
5 其他化合物除上述4种主要类型的化合物之外, 还从紫菀中鉴定或初步表征了18种其他类型的化合物, 其中包括9种香豆素类、3种蒽醌类、3种甾体类和3种醛类化合物。其中9种香豆素类成分(C1-C9)、2种蒽醌类化合物(AQ1、AQ3)、2种醛类化合物(A2、A3)和1种甾体类化合物(S2)通过与对照品比对而确认。利用PCDL manager进行快速识别, 并与文献比对, 可以判定化合物S3为豆甾醇[38]。通过非靶向分析, 结合Chemspider在线数据进行比对, 进一步表征了AQ2和A1分别为大黄素蒽酮和5-羟甲基-2-糠醛。同时, 根据次生代谢产物模板(菠菜甾醇), 利用MetaboliteID软件进行非靶向离线数据分析, 将化合物S1初步表征为菠菜甾醇-3-O-D-葡萄糖苷。
结论本文首次利用超高效液相色谱-四级杆飞行时间串联质谱联用技术(UHPLC-Q-TOF-MS/MS)对紫菀的化学成分进行了全面、高效地解析, 在25 min内, 对紫菀中的132个化合物进行了鉴定或初步表征, 其中有59个化合物通过与对照品比对而确认。同时, 本文还对紫菀中的2种特征性化学成分(多肽及萜类)、2种高含量、高活性成分(酚酸及黄酮类)及其他4种类型的化合物(香豆素、蒽醌、甾体、醛类)的二级质谱裂解规律进行了归纳和总结。利用本文所建立的化合物分析策略, 不仅可以全面的了解紫菀药材的物质基础, 同时也可以为其他类型中药材或中药复方的成分解析提供有效的指导。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of China(中国药典)[M]. Beijing: China Medical Science Press, 2015: 1341. |
| [2] | Wu T, Chen ZJ, Hu YJ, et al. Experimental study on expectorant effect of different processing methods of Aster tataricus decoction pieces[J]. J Shanghai Univ Tradit Chin Med (上海中医药大学学报), 2006, 20: 55–57. |
| [3] | Yu P, Cheng S, Xiang J, et al. Expectorant, antitussive, anti-inflammatory activities and compositional analysis of Aster tataricus[J]. J Ethnopharmacol, 2015, 164: 328–333. DOI:10.1016/j.jep.2015.02.036 |
| [4] | Chen LS, Zheng DS. Bioactive constituents from the rhizomes of Aster tataricus L. f. afford the treatment of asthma through activation of β2AR and inhibition of NF-κB[J]. Latin Am J Pharm, 2015, 34: 291–295. |
| [5] | Chen YJ, Dong JJ, Liu J, et al. Network pharmacology-based investigation of protective mechanism of Aster tataricus on lipopolysaccharide-induced acute lung injury[J]. Int J Mol Sci, 2019, 20: 543–557. DOI:10.3390/ijms20030543 |
| [6] | Du H, Zhang M, Yao KJ, et al. Protective effect of Aster tataricus extract on retinal damage on the virtue of its antioxidant and anti-inflammatory effect in diabetic rat[J]. Biomed Pharmacother, 2017, 89: 617–622. DOI:10.1016/j.biopha.2017.01.179 |
| [7] | Zhang YX, Wang QS, Wang T, et al. Inhibition of human gastric carcinoma cell growth in vitro by a polysaccharide from Aster tataricus[J]. Int J Biol Macromol, 2012, 51: 509–513. DOI:10.1016/j.ijbiomac.2012.06.019 |
| [8] | Liu P, Yang H, Long F, et al. Bioactive equivalence of combinatorial components identified in screening of an herbal medicine[J]. Pharmacol Res, 2014, 31: 1788–1800. DOI:10.1007/s11095-013-1283-1 |
| [9] | Liu J, Xiao HB. Advances in basic research on pharmacodynamic substances of traditional Chinese medicine based on chromatography[J]. Acta Pharm Sin (药学学报), 2019, 54: 73–81. |
| [10] | Chen JF, Song YL, Guo XY, et al. Characterization of the herb-derived components in rats following oral administration of Carthamus tinctorius extract by extracting diagnostic fragment ions (DFIs) in the MSn chromatograms[J]. Analyst, 2014, 139: 6474–6485. DOI:10.1039/C4AN01707B |
| [11] | Han J, Sheng LS, Yang ZY, et al. High performance liquid chromatography/electrospray ionization mass spectrometric characterization of recombinant L-asparaginase Ⅱ[J]. Acta Pharm Sin (药学学报), 2001, 36: 46–50. |
| [12] | Liang J, Xu F, Zhang YZ, et al. The profiling and identification of the absorbed constituents and metabolites of Paeoniae Radix Rubra decoction in rat plasma and urine by the HPLC-DAD-ESI-IT-TOF-MS (n) technique: a novel strategy for the systematic screening and identification of absorbed[J]. J Pharm Biomed Anal, 2013, 83: 108. DOI:10.1016/j.jpba.2013.04.029 |
| [13] | Zhang CY, Li J, Gao JM, et al. The impurity profiling of paclitaxel and its injection by UPLC-MS/MS[J]. Acta Pharm Sin (药学学报), 2016, 51: 965–971. |
| [14] | Scheidweiler KB, Jarvis MJ, Huestis MA. Nontargeted SWATH acquisition for identifying 47 synthetic cannabinoid metabolites in human urine by liquid chromatography-high-resolution tandem mass spectrometry[J]. Anal Bioanal Chem, 2015, 407: 883–897. DOI:10.1007/s00216-014-8118-8 |
| [15] | Zhao DX, Hu BQ, Zhang M, et al. Simultaneous separation and determination of phenolic acids pentapeptides, and triterpenoid saponins in the root of Aster tataricus by high-performance liquid chromatography coupled with electrospray ionization quadrupole time-of-flight mass spectrometry[J]. J Sep Sci, 2015, 38: 571–575. DOI:10.1002/jssc.201401008 |
| [16] | Xu HM, Zheng GZ, Zhou WB, et al. Astins, six new chlorinated cyclopentapeptides from Aster tataricus[J]. Tetrahedron, 2013, 69: 7964–7969. DOI:10.1016/j.tet.2013.07.006 |
| [17] | Xu HM, Zeng GZ, Zhou WB, et al. Astins K-P, six new chlorinated cyclopentapeptides from Aster tataricus[J]. Tetrahedron, 2013, 69: 7964–7969. DOI:10.1016/j.tet.2013.07.006 |
| [18] | Kosemura S, Ogawa T, Totsuka K. Isolation and structure of asterin, a new halogenated cyclic penta-peptide from Aster tataricus[J]. Tetrahedron Lett, 1993, 34: 1291–1294. DOI:10.1016/S0040-4039(00)91777-5 |
| [19] | Hiroshi M, Koichi T. Bioactive cyclic peptides from higher plants[J]. Heterocycles, 2010, 80: 739–764. DOI:10.3987/REV-09-SR(S)7 |
| [20] | Zhu XC, Lu Y, Zhang CF, et al. Advances on peptides from Aster tataricus L.[J]. Chin Wild Plant Resour (中国野生植物资源), 2014, 33: 32–36. |
| [21] | Morita H, Nagashima S, Takeya K, et al. Cyclic peptides from higher plants. 12. structure of a new peptides, astin-J, from Aster tataricus[J]. Chem Pharm Bull, 1995, 43: 271–273. DOI:10.1248/cpb.43.271 |
| [22] | Wang JJ, Zhang L, Guo Q, et al. Quantitative analysis of seven phenolic acids in eight Yinqiao Jiedu serial preparations by quantitative analysis of multi-components with single-marker[J]. Acta Pharm Sin (药学学报), 2015, 50: 480–485. |
| [23] | Li J, Li J, Jia JP, et al. Comparison of flower buds and leaves of Tussilago farfara L. by UHPLC-Q Extractive Hybrid Quadrupole Orbitrap Ms[J]. Acta Pharm Sin (药学学报), 2018, 53: 444–452. |
| [24] | Diaz JG, Carmona AJ, Torres F, et al. Cytotoxic activities of flavonoid glycoside acetates from Consolida oliveriana[J]. Planta Med, 2008, 74: 171–174. DOI:10.1055/s-2008-1034278 |
| [25] | Qiao S, Xu HS, Shi XW, et al. Identification of major bioactive components and their metabolites in rat plasma oral administration of Zhikebao tablet by UHPLC-QTOF-MS[J]. Acta Pharm Sin (药学学报), 2018, 53: 1536–1544. |
| [26] | Shao Y, Wang MF, Ho CT, et al. Wagner, lingulatusin, two epimers of an unusual linear diterpene form Aster lingulatus[J]. Phytochemistry, 1998, 49: 609–612. DOI:10.1016/S0031-9422(98)00141-1 |
| [27] | Cheng DL, Cao XP, Wei HX, et al. Kaurane diterpenoids from Aster ageratoides[J]. Phytochemistry, 1993, 33: 1181–1183. DOI:10.1016/0031-9422(93)85045-S |
| [28] | Li EW, Gao X, Gao K, et al. Labdane diterpenoid glycosides from Aster veitchianus[J]. Chem Biodiv, 2007, 4: 531–538. DOI:10.1002/cbdv.200790046 |
| [29] | Schöpke T, Al-Tawaha C, Wray V, et al. Triterpenoid saponins from Aster bellidiastrum[J]. Phytochemistry, 1997, 45: 125–132. DOI:10.1016/S0031-9422(96)00776-5 |
| [30] | Yu P, Cheng S, Xiang J, et al. Expectorant, antitussive, anti-inflammatory activities and compositional analysis of Aster tataricus[J]. J Ethnopharmacol, 2015, 164: 328–333. DOI:10.1016/j.jep.2015.02.036 |
| [31] | Sun YP, Li L, Liao M, et al. A systematic data acquisition and mining strategy for chemical profiling of Aster tataricus rhizome (Ziwan) by UHPLC-Q-TOF-MS and the corresponding anti-depressive activity screening[J]. J Pharm Biomed Anal, 2018, 154: 216–226. DOI:10.1016/j.jpba.2018.03.022 |
| [32] | Zhou WB, Zeng GZ, Xu HM, et al. Astershionones A-F, six new anti-HBV shionane-type triterpenes from Aster tataricus[J]. Fitoterapia, 2014, 93: 98–104. DOI:10.1016/j.fitote.2013.12.021 |
| [33] | Sung CK, Kim SM, Oh CJ, et al. Taraxerone enhances alcohol oxidation via increases of alcohol dehyderogenase (ADH) and acetaldehyde dehydrogenase (ALDH) activities and gene expressions[J]. Food Chem Toxicol, 2012, 21: 485–489. |
| [34] | Mo EK, Han BH, Kim SM, et al. Identification of d-friedoolean-13-en-3-one (Taraxerone) as an antioxidant compound from sedom (Sedum sarmentosum)[J]. Food Sci Biotechnol, 2012, 21: 485–489. DOI:10.1007/s10068-012-0061-x |
| [35] | Akihisa T, Kimura Y, Koike K, et al. Astertarone A: a triterpenoid ketone isolated from the roots of Aster tataricus L.[J]. Chem Pharm Bull, 1998, 46: 1824–1826. DOI:10.1248/cpb.46.1824 |
| [36] | Zhang N, Pang L, Dong N, et al. Quantification of taraxasterol in rat plasma by LC/MS/MS: application to a pharmacokinetic study[J]. Biomed Chromatogr, 2015, 29: 1643. DOI:10.1002/bmc.3473 |
| [37] | Akihisa T, Kimura Y, Tai T, et al. Astertarone, a hydroxy-triterpenoid ketone from the roots of Aster tataricus L.[J]. Chem Pharm Bull, 1999, 47: 1161–1163. DOI:10.1248/cpb.47.1161 |
| [38] | Kemmo S, Ollilainen V, Lampi AM, et al. Determination of stigmasterol and cholesterol oxides using atmospheric pressure chemical ionization liquid chromatography/mass spectrometry[J]. Food Chem, 2007, 101: 1438–1445. DOI:10.1016/j.foodchem.2006.03.052 |
 2019, Vol. 54
2019, Vol. 54


