金黄葡球菌(Staphylococcus aureus)已成为继HⅣ之后第二大威胁人类生命的病原微生物, 其导致的感染可遍及全身并有高发病率及高死亡率特点, 被认为是21世纪十大最致命的感染性疾病之一[1-4]。耐甲氧西林金黄葡球菌(methicillin-resistant S. aureus, MRSA)因对常用抗生素多重耐药, 已成为院内获得性感染首要致病菌[5-11]。仅在美国, 每年大约有两百万人感染MRSA, 23 000余人死于MRSA感染[12]。为应对耐药菌威胁, 我国启动了《遏制细菌耐药国家行动计划(2016~2020年)》, 2016年全国细菌耐药的检测报告显示:全国MRSA平均检出率仍高达34.4%。随着人类对抗生素的大量使用甚至滥用, 被认为是抵御MRSA的“最后一道防线”的万古霉素(vancomycin)的中介耐万古霉素金黄葡球菌(vancomycin intermediate-resistant S. aureus, VISA)菌株也在不断被报道[13-15]。遗憾的是抗生素研发却是投入强度最低的常见病药物之一, 过去30年无新骨架上市。因此, 新型抗菌药的研发成为各国政府及从事药物研究的科学家特别关注的聚焦问题。
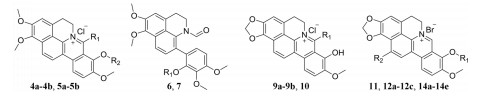
本课题组首先发现一类由生物碱天然产物小檗碱(berberine)衍生、具有全新结构骨架的环化小檗碱(CBBR)衍生物具有较好的抗MRSA活性, 虽然CBBR本身没有抗菌活性, 但在其7-、8-位或13-位引入适当取代基, 均可在不同程度上对MSSA/MRSA、以及对耐万古霉素肠球菌(vancomycin resistant Enterococcus, VRE)显示较好抑制活性, 最小抑菌浓度(minimal inhibitory concentration, MIC)介于0.25~16 μg·mL-1之间[16-21]。提示CBBR衍生物的化学骨架和作用机制与临床使用抗菌药物完全不同, 值得进一步研究。为丰富与发展该类衍生物的抗菌构效关系(structure-activity relationship, SAR), 以期同时获得抗菌活性更好、抗菌谱更广的候选物, 本文以前期工作为基础, 将7、8、或者13-位的活性基团进行组合, 设计合成了一系列未经报道的7, 8-位和8, 13-位双取代环化小檗碱衍生物(图 1), 并对代表性化合物开展了体外代谢稳定性评价与初步机制研究。

|
Figure 1 Chemical structure of CBBR, and its structure modification strategy |
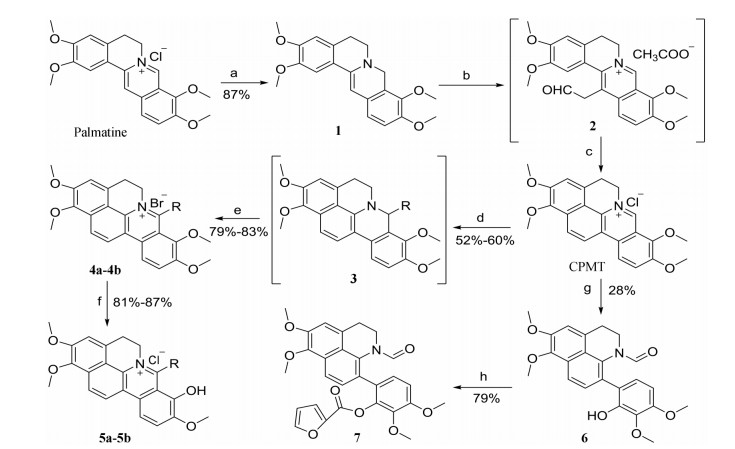
首先, 以市售盐酸巴马亭(palmatine)为原料, 经还原、取代、环化等反应, 以64%的产率得到关键中间体环化巴马亭(CPMT), 随后与相应的格氏试剂反应得到中间体3, 经溴素氧化得到7-取代CPMT 4a、4b, 高温负压条件下, 选择性脱除甲基得到化合物5a、5b。CPMT经间氯过氧苯甲酸氧化开环得到目标物6, 然后6在三乙胺作用下, 与2-呋喃甲酰氯反应得到目标物7[21-23] (合成路线1)。
|
Scheme 1 Synthetic route of target compounds. Reagents and conditions: (a) NaBH4, 5% NaOH, K2CO3, CH3OH, r.t., 3 h; (b) 40% glyoxal, HOAc, CH3CN, reflux, 6 h; c) Methanol/HCl (2:1 by vol.), r.t., 24 h, 73% (over two steps); (d) RMgBr, 60 ℃, 3 h; (e) Br2, 60 ℃, 1 h; (f) 20-30 mmHg, 195-210 ℃, 60 min; (g) NaH, mCPBA, HMPA, 3 h; (h) Triethylamine, CH3CN, 40 ℃, 2 h |
CBBR的合成路线与CPMT的路线一致。以CBBR为原料, 先与格氏试剂反应, 后经溴素氧化得到中间体8a、8b, 高温选择性脱除甲基得到目标物9a、9b[19]。以CBBR为原料, 高温选择性脱除甲基, 得到中间体10, 使其与相应的溴代烷烃反应得到目标物11[18]。然后, 以CBBR为原料, 经还原后与相应的取代苄溴反应后, 氧化得到目标物12a~12e, 对12d、12e高温选择性脱除甲基, 得到中间体13d、13e, 使其与相应的溴代烷烃反应得到目标物14a~14e (合成路线2)。所有目标化合物结构均经1H NMR、13C NMR以及HR-MS分析确证。目标化合物的收率、理化参数和波谱数据见表 1。

|
Scheme 2 Synthetic route of target compounds. Reagents and conditions: (a) 1) NaBH4, 5% NaOH/K2CO3, CH3OH, r.t., 3 h; 2) 40% glyoxal, HOAc/CH3CN, reflux, 6 h; 3) methanol/HCl (3:1 by vol.), r.t., 24 h, 52% (over three steps); (b) RMgBr, Br2, 60 ℃, 4 h; (c) 20-30 mmHg, 195-210 ℃, 60 min; (d) KOH, DMF, 71 ℃, 6-12 h; (e) 1) NaBH4, K2CO3, CH3OH, r.t., 2 h; 2) substituted benzyl bromide, K2CO3, CH3CN, reflux, 3-8 h |
| Table 1 Physical properties and spectra data of all synthesized compounds |
以左氧氟沙星(levofloxacin, Lev)为阳性对照, 评价了所有新合成的化合物对甲氧西林敏感的金黄葡球菌(methicillin-susceptible S. aureus, MSSA)、MRSA、VISA、甲氧西林敏感/耐药的表皮葡萄球菌(methicillin-susceptible, -resistant Staphylococcus epidermidis, MSSE/MRSE)在内的7株致病的革兰氏阳性菌的体外抑菌活性(表 2)。如表 2所示, 前期SAR表明CBBR单取代时, 其8-位引入OH (10)或7-位引入苯基或对氯苯基(4a、4b)利于活性提高[18, 20], 基于优势基团组合理念, 首先对其8-位保留羟基、7-位引入苯基和对氯苯基, 将CBBR亚甲二氧环打开, 得到以CPMT为母核的衍生物5a、5b, MIC介于16~32 μg·mL-1之间, 抗菌活性明显低于单取代化合物4a、4b和10。然后, 将CPMT的C环打开, 由此得到2个衍生物6和7, 其MIC > 64 μg·mL-1, 抑菌活性完全丧失, 提示环C为活性必需片段。其次, 保留CBBR母核, 同样对其8-位保留羟基、7-位引入乙基和苯基得到7, 8-双取代衍生物9a、9b, 9a的MIC介于1~8 μg·mL-1之间, 明显强于衍生物9b, 并且对MRSA和VISA的活性分别是Lev的16和4倍, 但是抗菌活性仍弱于单取代10[18]。
| Table 2 Antibacterial activities of the target compounds against drug-susceptible and drug-resistant gram-positive strains. aThe American Type Culture Collection (ATCC); bStrains isolated from patients in Chinese hospitals |
随后, 继续考察8, 13-双取代衍生物抗菌构效关系。对CBBR的8-位引入长链大基团取代基得到较弱活性衍生物11, MIC介于8~64 μg·mL-1之间。将苯环上含吸电子基的苄基引入CBBR的13-位得到目标物12a~12c, 经抗菌活性评价, MIC > 64 μg·mL-1, 抗菌活性丧失, 此和前期报道的构效关系一致[18, 19]。基于此, 保留CBBR 13-位为含供电子基, 将小基团乙基、正丙基、异丙基引入其8-位得到8, 13-位双取代的衍生物14a~14c, 发现其对除VISA外的其他测试菌株显示很强的抗菌活性, MIC介于1~8 μg·mL-1之间, 对临床分离的MRSA菌株强于Lev, 此与13-位引入含供电子的苄基的单取代衍生物活性相当。而8-位为3-羟基丙基衍生物14d、14e抗菌活性完全丧失。鉴于本文合成的所有化合物中, 9a具有良好的抗MRSA/VISA活性, 选其作为代表性化合物进行下一步体外药代稳定性研究和初步机制研究。
3 体外代谢稳定性评价为进一步探讨此类化合物的成药性特点, 对代表性化合物9a开展了体外全血稳定性试验研究。选择临床用前药依那普利马来酸盐(Enalapril maleate, Ems)作为阳性对照药, 在6个不同时间点测定其残余浓度[18, 19], 结果如表 3所示。前药Ems很容易被血液中的酯酶水解释放出原药, 在3 h时全部被酶解残余浓度为0;而化合物9a在24 h仍然有81%的残余率, 说明9a可能拥有较好的体外血浆稳定性。
| Table 3 Metabolic stability of 9a in whole blood |
随后, 以临床用药物睾丸酮(testosterone, Tes)为阳性对照, 评估了9a在人和大鼠的肝微粒体中的稳定性[20]。从表 4中可以看出, 对比Tes, 9a在上述肝微粒体中具有较长的半衰期和较高的残余率; 9a在人和大鼠的肝微粒体中半衰期分别长达76.2和105.9 min, 60 min后的体外残余率仍有62.1%和71.7%。综上, 认为9a可能具有较好的体外代谢稳定性。
| Table 4 Metabolic stability of tested compound in human, rat and mouse liver microsomes. t1/2 = half-life. CLint (mic) = microsomal intrinsic clearance. Liver weight: 20 g·kg-1 for humans |
鉴于CBBR与喹诺酮类抗菌药相似的平面刚性结构, 本课题组前期初步证实CBBR类通过抑制拓扑异构酶Ⅳ (Topo Ⅳ)活性发挥强抗MRSA作用[20, 21], 与喹诺酮类相似。然而CBBR类对喹诺酮耐药的MRSA仍显示良好活性, 推测两者的作用位点可能不同。Topo Ⅳ由两个亚基组成, 即亲水性的ParC亚基与疏水性的ParE亚基[24-27]。本研究使用Discovery Studio 4.5软件, 以分子对接方法模拟代表性化合物9a分别和ParC、ParE活性腔的相互作用。结果显示, 9a和ParE对接打分较高(-CDOCKER energy= 35.22), 如图 2所示, 主要通过分子间范德华力、碳氢键、π-烷基等产生强的相互作用, 很好地匹配ParE活性腔。而化合物9a (CLogP = 2.93)为疏水性小分子, 很难与喹诺酮的作用位点ParC亚基结合。因此, 推测化合物9a主要是通过靶向Topo Ⅳ的ParE亚基发挥强的抗MRSA活性。
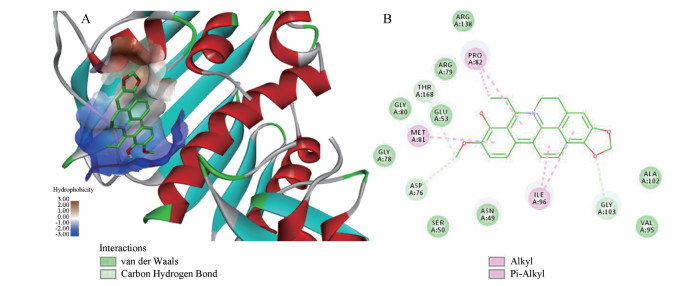
|
Figure 2 (A) Solid surface map of the interaction pocket with compound 9a. Red, blue, and white colored regions correspond to negatively charged, positively charged, and neutral areas, respectively. (B) Binding modes within the receptor S. aureus Topo Ⅳ active pocket. The receptor structure is shown in surface form. Key bonds are indicated by dashed lines between the atoms involved, and the colors of key bonds and residues are shown according to the interaction mode (van der Waals, light green; carbon hydrogen bond, celadon; amide-π stacked, amaranth; alkyl and π-alkyl, mauve pink) |
本研究针对CBBR母核分子中多个结构片段继续延伸开展结构修饰, 共设计合成了15个未见文献报道的全新化合物, 评价了其体外抗革兰氏阳性菌活性, 进一步补充CBBR类衍生物的抗菌构效关系: ① C环为必需片段; ②和7-, 8-, 或13-单取代衍生物活性相比, 7, 8-和8, 13-双取代衍生物活性较弱或者相当。其中代表性化合物9a对临床难治的MRSA的MIC值达1~2 μg·mL-1, 明显优于阳性对照药Lev, 并且具有较好的体外代谢稳定性。分子对接实验表明9a可能是通过靶向Topo Ⅳ的ParE亚基进而发挥抗临床耐药菌MRSA活性, 与临床用抗菌药作用机制完全不同。CBBR类衍生物组成了一类化学骨架新颖、作用机制独特的抗MRSA新型化合物, 值得进一步研究。
实验部分熔点用CXM-300型精密熔点仪测定, 温度未校正; 1H NMR和13C NMR用Bruker Avance Ⅲ 500和600核磁共振仪测定; HR-MS用Autospec Ultima-TOF质谱测定仪测定; Flash柱分离纯化用Combiflash Rf 200快速制备液相; 荧光检测用ZF-20D暗箱式紫外分析仪; 薄层色谱(TLC)采用E-Merck公司预铺硅胶铝箔卷; 试剂均为分析纯。
1 化学合成 1.1 化合物5a、5b、6和7的合成将溶有硼氢化钠(0.83 g, 22 mmol)的5%氢氧化钠溶液10 mL逐滴加入至含巴马亭(7.7 g, 20 mmol)和碳酸钾(8.3 g, 60 mmol)的250 mL甲醇溶液中, 室温搅拌3 h, 抽滤收集析出的黄绿色固体, 滤饼依次用蒸馏水(100 mL)和80%乙醇(100 mL)洗涤, 得到黄绿色二氢巴马亭1 (6.1 g, 87%)。将1 (6.0 g, 17 mmol)溶解在160 mL乙腈中, 分别加入乙酸40 mL和40%的乙二醛水溶液3 mL, 加热至85~90 ℃回流6 h, 将反应液浓缩得深红色油状物2, 然后加入体积比为1:3的浓盐酸与甲醇200 mL, 室温搅拌24 h。将反应液浓缩, 以二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得橙红色中间体CPMT (6.9 g, 74%)。
在0 ℃、N2保护条件下, 将相应格氏试剂(60 mmol)缓慢滴加到溶有CPMT (3.1 g, 7.5 mmol)的干燥THF溶液中, 0.5 h后将反应体系移至60 ℃条件下, 继续反应3 h后, 用丙酮淬灭反应, 减压旋干后的固体溶解于二氯甲烷中, 用饱和氯化铵萃取, 有机层用无水硫酸钠干燥, 旋干后得到黄色固体。将其溶于乙醇中, 滴加溶有Br2 (7.5 mmol)乙酸溶液5 mL, 移至60 ℃条件下继续反应1 h后, 冷却至室温, 抽滤, 用10% Na2S2O5洗涤滤渣, 用二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得4a、4b。
在195~210 ℃负压(20~30 mmHg, 1 mmHg = 133 Pa)下, 将4a、4b加热60 min得紫黑色固体。产物经5%盐酸/乙醇酸化, 减压除去溶剂, 以二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得紫红色固体5a、5b。
将CPMT (107 mg, 0.26 mmol)溶于10 mL HMPA中, 在0 ℃、N2保护条件下, 依次加入80% NaH (16 mg, 0.52 mmol)和70% mCPBA (100 mg, 0.4 mmol), 将反应体系移至室温继续反应3 h, 加入甲醇5 mL淬灭反应, 将旋干后的固体溶解于二氯甲烷中, 用饱和碳酸氢钠萃取, 有机层用无水硫酸钠干燥, 旋干后得到淡黄色固体, 以石油醚-乙酸乙酯为流动相, 经硅胶柱分离纯化得白色固体6。
将6 (100 mg, 0.24 mmol)溶于无水乙腈(5 mL)中, 加入三乙胺(66 µL, 0.48 mmol)和2-呋喃甲酰氯(0.36 mmol), 40 ℃反应2 h。加入水2 mL淬灭反应, 减压除去体系中溶剂, 将旋干后的固体溶解于二氯甲烷中, 用饱和碳酸氢钠萃取, 有机层用无水硫酸钠干燥, 以石油醚-乙酸乙酯为流动相, 经硅胶柱分离纯化得白色固体7。
1.2 化合物9a、9b、11、12a~12c和14a~14e的合成在0 ℃、N2保护条件下, 将相应格氏试剂(60 mmol)缓慢滴加到溶有CBBR (3.0 g, 7.5 mmol)的干燥THF溶液中, 0.5 h后将反应体系移至60 ℃条件下, 继续反应3 h后, 用丙酮淬灭反应体系, 减压除去体系中溶剂, 将旋干后的固体溶解于二氯甲烷中, 用饱和氯化铵萃取, 有机层用无水硫酸钠干燥, 旋干后得到黄色固体。将上述黄色固体溶于乙醇中, 滴加5 mL溶有Br2 (7.5 mmol)的乙酸溶液, 将反应体系移至60 ℃条件下继续反应1 h后, 冷却至室温, 抽滤, 用10% Na2S2O5洗涤滤渣, 再用二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得8a、8b。
在195~210 ℃负压(20~30 mmHg, 1 mmHg = 133 Pa)下, 将8a、8b加热60 min得紫黑色固体。产物经5%盐酸/乙醇酸化, 减压除去溶剂, 以二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得紫红色固体9a、9b。类似地, 将CBBR (3.95 g, 10 mmol)加热60 min得紫黑色固体, 得红色固体10 (3.5 g, 92%)。将化合物10 (198 mg, 0.52 mmol)和KOH (120 mg, 2.08 mmol)混悬与干燥N, N-二甲基甲酰胺(6 mL)中, 氮气保护下, 升温至71 ℃, 15 min后加入BocNH(CH2)3Br (2.08 mmol), 反应8 h, 充分冷却抽滤析出的固体, 以二氯甲烷/甲醇体系梯度洗脱得橘黄色产物11 (47%)。
将CBBR (0.79 g, 2 mmol)和碳酸钾(0.83 g, 6.0 mmol)溶于20 mL 95%的甲醇中, 分批次加入硼氢化钠(0.15 g, 4.5 mmol), 室温条件下反应2 h后, 抽滤体系中析出的固体, 分别用水(20 mL)和80%乙醇(20 mL)洗涤滤渣得到黄绿色固体。将该固体(361 mg, 1.0 mmol, 1.0 equiv)和碳酸钾(2.0 equiv)溶于20 mL无水乙腈中, 加入相应的苄溴(10.0 equiv), 反应体系回流3~8 h, 冷却, 抽滤体系中析出的固体, 以二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得目标物12a~12e。然后12d、12e在195~210 ℃负压(20~30 mmHg, 1 mmHg = 133 Pa)下, 加热60 min得紫黑色固体, 产物后经5%盐酸/乙醇酸化, 减压除去溶剂, 以二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得红色固体13d、13e。将13d、13e (0.52 mmol)和KOH (120 mg, 2.08 mmol)混悬于干燥N, N-二甲基甲酰胺(6 mL)中, 氮气保护下升温至71 ℃, 15 min后加入相应的溴代烷烃(2.08 mmol), 反应6~12 h, 充分冷却抽滤析出的固体, 以二氯甲烷/甲醇体系梯度洗脱得目标物14a~14e。
2 生物实验 2.1 抗阳性菌活性MIC测定参照CLSI标准, 采用平皿二倍稀释法(Agar dilution)进行药敏实验。试验菌用MH肉汤或脑心浸液增菌, 药液用MH肉汤二倍稀释成各种所需浓度, 分别加适量到平皿中, MH琼脂培养基熔化后定量注入含药液的平皿内混匀。样品终浓度分别为: 64、32……0.06、0.03 μg·mL-1。接种试验菌(接种量为104 cfu/点)后置35 ℃恒温培养18 h后观察结果, 无菌生长的平皿中所含药物最小的浓度即为MIC。
2.2 体外代谢稳定性实验 2.2.1 体外全血稳定性实验实验当天取SD大鼠新鲜血液于37 ℃水浴中保温, 选Enalapril为阳性对照药。用DMSO将化合物9a和Enalapril配置成10 mmol·L-1溶液, 后用45% MeOH/H2O稀释到100 μmol·L-1, 取2 μL稀释后的上述溶液置于98 μL新鲜血液中, 在37 ℃水浴中分别孵育0、1、5、10、30 min, 到达设置孵育时间后, 迅速加入100 μL水和800 μL孵育终止液(含200 ng·mL-1甲苯磺丁脲和20 ng·mL-1丁螺环酮乙腈溶液), 以4 000 r·min-1离心20 min。取100 μL上清液与200 μL水混合, 振荡10 min, 随后取样用LC-MS/MS分析。
2.2.2 肝微粒体稳定性实验肝微粒体来源于CD-1小鼠、SD大鼠和人, 每个孵育体系为200 μL, 包括0.1 mol·L-1的PBS缓冲液188 μL和NADPH发生系统12 μL, 冰浴中将1~2 μL药物加入孵育体系中, 37 ℃水浴中预热5 min, 然后冰浴上加入肝微粒体酶5 μL, 轻轻混匀, 37 ℃条件下孵育, 在0、5、10、20、30、60 min时间点采集样品, 按照标准方法, 加入含100 ng·mL-1甲糖宁和100 ng·mL-1拉贝洛尔的冰乙腈终止反应。样品用LC/MS/MS检测[20]。
2.3 分子对接实验本实验用以对接的活性腔选自Topo Ⅳ和化合物kibdelomycin共结晶中kibdelomycin所占的蛋白腔体(PDB code 4URL, resolution: 2.29 Å)[27]。对接软件为Discovery Studio 4.5工作站中LibDock[19]。对接之前先将小分子配体和目标蛋白进行预处理, 如小分子配体能量最低化、目标蛋白加氢、去水等[28]。最后选择Discovery Studio 4.5打分最高相互作用模式作为最终对接结果。
| [1] | Roberts S, Chambers S. Diagnosis and management of Staphylococcus aureus infections of the skin and soft tissue[J]. Intern Med J, 2005, 35: S97–105. DOI:10.1111/j.1444-0903.2005.00983.x |
| [2] | Mitchell DH, Howden BP. Diagnosis and management of Staphylococcus aureus bacteraemia[J]. Intern Med J, 2005, 35: S17–S24. DOI:10.1111/j.1444-0903.2005.00977.x |
| [3] | Murdoch DR, Corey GR, Hoen B, et al. Clinical presentation, etiology and outcome of infective endocarditis in the 21st century: the international collaboration on endocarditis- prospective cohort study[J]. Arch Intern Med, 2009, 169: 463–473. DOI:10.1001/archinternmed.2008.603 |
| [4] | Lowy FD. Staphylococcus aureus infections[J]. N Engl J Med, 1998, 339: 520–532. DOI:10.1056/NEJM199808203390806 |
| [5] | Levy SB. Multidrug resistance--a sign of the times[J]. N Engl J Med, 1998, 338: 1376–1378. DOI:10.1056/NEJM199805073381909 |
| [6] | Neu HC. The crisis in antibiotic resistance[J]. Science, 1992, 257: 1064–1073. DOI:10.1126/science.257.5073.1064 |
| [7] | Kong KF, Schneper LK. Beta-lactam antibiotics: from antibiosis to resistance and bacteriology[J]. APMIS, 2010, 118: 1–36. |
| [8] | Purrello SM, Garau J, Giamarellos E, et al. Methicillin-resistant Staphylococcus aureus infections: a review of the currently available treatment options[J]. J Glob Antimicrob Resist, 2016, 7: 178–186. DOI:10.1016/j.jgar.2016.07.010 |
| [9] | Auckland C, Teare L, Cooke F, et al. Linezolid-resistant enterococci: report of the first isolates in the United Kingdom[J]. J Antimicrob Chemother, 2002, 50: 743–746. DOI:10.1093/jac/dkf246 |
| [10] | Grundmann H, Airesdesousa M, Boyce J, et al. Emergence and resurgence of meticillin- resistant Staphylococcus aureus as a public-health threat[J]. Lancet, 2006, 368: 874–885. DOI:10.1016/S0140-6736(06)68853-3 |
| [11] | Kupferschmidt K. Infectious diseases. Genome study helps contain MRSA outbreak-and breeds new questions[J]. Science, 2012, 338: 1019. DOI:10.1126/science.338.6110.1019 |
| [12] | Antibiotic Resistance: The Global Threat. National Center for Emerging and Zoonotic Infectious Diseases (U.S.). http://stacks.cdc.gov/view/cdc/31340, 2015. |
| [13] | Hidayat LK, Hsu DI, Quist R, et al. High-dose vancomycin therapy for methicillin- resistant Staphylococcus aureus infections: efficacy and toxicity[J]. Arch Intern Med, 2006, 166: 2138–2144. DOI:10.1001/archinte.166.19.2138 |
| [14] | Hiramatsu K, Hanaki H, Ino T, et al. Methicillin-resistant Staphylococcus aureus clinical strain with reduced vancomycin susceptibility[J]. J Antimicrob Chemother, 1997, 40: 135–136. DOI:10.1093/jac/40.1.135 |
| [15] | Hiramatsu K, Aritaka N, Hanaki H, et al. Dissemination in Japanese hospitals of strains of Staphylococcus aureus heterogeneously resistant to vancomycin[J]. Lancet, 1997, 350: 1670–1673. DOI:10.1016/S0140-6736(97)07324-8 |
| [16] | Li YB, Zhao WL, Wang YX, et al. Discovery, synthesis and biological evaluation of cycloprotoberberine derivatives as potential antitumor agents[J]. Eur J Med Chem, 2013, 68: 463–472. DOI:10.1016/j.ejmech.2013.07.026 |
| [17] | Fan TY, Hu XX, Wang YX, et al. Design, synthesis and anti-MRSA activities of cycloberberine derivatives with a novel chemical scaffold[J]. Acta Pharm Sin (药学学报), 2018, 53: 887–894. |
| [18] | Fan TY, Hu XX, Tang S, et al. Discovery and development of 8-substituted cycloberberine derivatives as novel antibacterial agents against MRSA[J]. ACS Med Chem Lett, 2018, 9: 484–489. DOI:10.1021/acsmedchemlett.8b00094 |
| [19] | Fan TY, Wang YX, Tang S, et al. Synthesis and antibacterial evaluation of 13-substituted cycloberberine derivatives as a novel class of anti-MRSA agents[J]. Eur J Med Chem, 2018, 157: 877–886. DOI:10.1016/j.ejmech.2018.08.050 |
| [20] | Yang YS, Wei W, Hu XX, et al. Evolution and antibacterial evaluation of 8-hydroxy-cycloberberine derivatives as a novel family of antibacterial agents against MRSA[J]. Molecules, 2019, 24: 984. DOI:10.3390/molecules24050984 |
| [21] | Yang YS, Lu X, Zeng QX, et al. Synthesis and biological evaluation of 7-substituted cycloberberine derivatives as potent antibacterial agents against MRSA[J]. Eur J Med Chem, 2019, 168: 283–292. DOI:10.1016/j.ejmech.2019.02.058 |
| [22] | Garciá A, Castedo L, Dominguez D. Revision of the structures of linaresine and dihydrolinaresine[J]. Tetrahedron, 1996, 52: 5929–5932. DOI:10.1016/0040-4020(96)00223-2 |
| [23] | Ishii H, Ishikawa T, Lu ST, et al. Baeyer-Villiger-type oxidation of an lmmonium group: the structural establishment of naturally occurring amides related to benzo[c]phenanthridine alkaloids[J]. J Chem Soc Perkin Trans I, 1984, 1769-1774. DOI: 10.1039/P19840001769. |
| [24] | Badshah SL, Ullah A. New developments in non-quinolone-based antibiotics for the inhibition of bacterial gyrase and topoisomerase Ⅳ[J]. Eur J Med Chem, 2018, 152: 393–400. DOI:10.1016/j.ejmech.2018.04.059 |
| [25] | Champoux J. DNA topoisomerases: structure, function and mechanism[J]. J Annu Rev Biochem, 2001, 70: 369–413. DOI:10.1146/annurev.biochem.70.1.369 |
| [26] | Phillips JW, Goetz MA, Smith SK, et al. Discovery of kibdelomycin, a potent new class of bacterial type Ⅱ topoisomerase inhibitor by chemical-genetic profiling in Staphylococcus aureus[J]. Chem Biol, 2011, 18: 955–965. DOI:10.1016/j.chembiol.2011.06.011 |
| [27] | Sharma N, Sharma M, Shakeel E, et al. Molecular interaction and computational analytical studies of pinocembrin for its antiangiogenic potential targeting VEGFR-2: a persuader of metastasis[J]. Med Chem, 2018, 14: 626–640. DOI:10.2174/1573406414666180416125121 |
 2019, Vol. 54
2019, Vol. 54