2. 山西大学地产中药功效与物质研究与利用山西省重点实验室, 山西 太原 030006;
3. 山西大学体育学院, 山西 太原 030006;
4. 山西医科大学第一医院, 山西 太原 030001
2. Shanxi Key Laboratory of Active Constituents Research and Utilization of TCM, Shanxi University, Taiyuan 030006, China;
3. Physical Education Departments, Shanxi University, Taiyuan 030006, China;
4. First Hospital of Shanxi Medical University, Taiyuan 030001, China
亚健康(suboptional health status)是介于健康和疾病状态之间的第3类状态, 主要指未达到健康标准, 表现为一定时间内的活力降低、功能和适应能力减退的症状, 尚未达到器质性病变, 是机体生理活动失常的综合表现[1]。随着生活和工作压力的不断增加, 相关研究显示在中国目前约有17.8%~60.5%人群正处于亚健康状态[2]。该状态人群不断增加的现状逐渐引导人们的观念由单纯的生物医学模式过渡到生物-心理-社会复合医学模式[3]。
作为亚健康主要的分型之一, 心理亚健康(psychological suboptimal health state, PSHS)表现形式多样, 主要以抑郁寡欢、焦躁不安、恐惧和记忆力下降等心理症状为主[4]。该状态具有双向可逆性的特点, 如未及时干预, 严重者可诱发躯体疾病、精神疾病和心理危机, 严重地影响人们的工作和生活。由于心理亚健康处于中间游离状态的特殊性导致临床诊断界定难度增加。该状态临床评估、诊断主要借助相关量表, 主要有症状自评量表(SCL-90)和亚健康状态评价问卷(SHSQ-25)等[5]。个人行为和生活方式因素、环境因素、生物因素等方面都能够在不同的层面影响人的心理健康[6], 其临床表现复杂多样, 可能与多种因素有关。
人体微生态的动态平衡与健康息息相关, 微生态失调与多种疾病的发生发展有直接或间接的关系[7]。肠道菌群, 是人体存在的正常菌群系统之一, 在菌群系统中占有重要的比例, 被称为第二大基因组[8]。肠道菌群参与人体食物的消化、新陈代谢、生物拮抗、免疫刺激及生长发育和衰老等功能, 有效地形成人体内的功能器官。过去人们较为关注肠道菌群与功能性胃肠道疾病的关系, 其次还有某些代谢性疾病如肥胖、糖尿病和高血压等。近年来, 人们逐渐开始把焦点转移到神经系统疾病中, 肠道菌群还可以与大脑相互作用, 影响一些精神疾病比如焦虑、抑郁、精神分裂及神经退行性疾病的发生及发展。研究表明, 肠道微生物能通过“微生物-肠-脑”轴影响大脑神经生化和行为表型, 进而影响人们的情绪和行为[9]。
本研究通过对心理亚健康实验模型大鼠进行相应的模型评价, 并采用16S rRNA基因高通量测序法研究模型大鼠的肠道菌群变化及其规律, 为阐释心理亚健康状态的生理变化机制及制定相关干预措施提供重要参考依据。
材料和方法动物 Sprague Dawley雄性大鼠, SPF级。动物许可证[SCXK (京) 2016-0006]体重为180~220 g, 购买于北京维通利华实验动物技术有限公司。受试动物12 h明暗交替光照, 饲养温度(23 ± 2) ℃, 湿度50% ± 20%, 饲料每1天定期更换1次, 水和食物自由摄取, 正式实验开始前适应性喂养7天。动物福利和所有实验方案均按照中华人民共和国国家科学技术委员会“实验动物管理条例”的规定进行, 所有实验方案均经山西大学生物医学研究实验动物伦理委员会批准。
仪器与试剂 高架十字迷宫(ZS-DSG、北京众实迪创科技发展有限公司), 高功率数控超声波清洗器(KQ-400KDE, 昆山市超声仪器有限公司), 低速离心机(SC-3610, 安徽中科中佳科学有限公司), 全自动生化分析仪(Thermo Scientific公司, Konelab prime 30)。大鼠旷场实验行为测试箱(100 cm×100 cm×70 cm无顶部长方体), 内部四壁及底面涂成黑色, 底部用白线划出25个正方形小格(20 cm×20 cm)。
PCR扩增仪(ABI公司, 2720);酶标仪(BioTek公司, FLX800T); 琼脂成像系统、凝胶成像系统(北京百晶生物技术有限公司, BG-gdsAUTO (130)); Q5® High-Fidelity DNA Polymerase (NEB公司, M0491L); Quant-iT PicoGreen dsDNA Assay Kit (P7589)、Agarose (75510-019)、琼脂糖凝胶电泳缓冲液(AM9870) (Invitrogen公司); Marker (Takara公司, DL2000, DL15000); Nanodrop (Thermo Scientific公司, NC2000);琼脂糖电泳设备(北京六一生物科技有限公司, DYY-6C)。
丙氨酸胺基转移酶(ALT, 批号: 170913)、天冬氨酸氨基转移酶(AST, 批号: 170817)、尿素(BUN, 批号: 170901)、肌酐(CREA, 批号: 171215)、胆固醇(TCHO, 批号: 170906)、甘油三酯(TG, 批号: 170814)试剂盒, 均购于广州科方生物技术股份有限公司。
模型的建立 为消除动物个体之间差异, 根据糖水偏爱实验、旷场实验和体重基线测定的数据随机分为4组, 每组10~12只。分别为空白对照组(control), 心理亚健康大鼠模型组(PSHS), 抑郁大鼠模型组(depression), 焦虑大鼠模型组(anxiety)。
造模周期:分3个时间段:适应期和训练期各7天, 应激期21天。应激源主要包括:孤养、不确定性空瓶应激、昼夜紊乱、饮食不规律以及社会挫败应激, 用于模拟人类现实生活中因经常熬夜加班, 不规律生活, 以及不确定的负性事件等而造成的心理亚健康状态。
训练期:适应性喂养7天结束后, 每天仅在早上9:00~9:10和21:00~21:10两个时间段内给予喂水训练应激, 其余时间不给水, 持续7天。应激期:每日以上2个时间段内, 随机选取1个时间段给予空瓶刺激, 另一个时间段喂水。其余时间不给水。在此基础上, 模型组大鼠在应激21天内随机选3天(第2、9和12天)进行饮食不规律应激(连续饥饿24 h), 随机选3天(第7、11和15天)进行社会挫败应激(随机混养1 h, 每框5~6只), 随机选3天(5、13和18天)进行昼夜紊乱应激(连续光照24 h)。
从训练期开始所有模型组都进行单笼孤养, 而空白对照组则采用群养方式。每次在以上2个时间段内, 都要空瓶敲击3声, 予以声音提示。
为了尽可能客观评价所建立的心理亚健康实验大鼠模型, 本研究参考相应文献, 同时复制了抑郁症大鼠模型(depression), 即慢性温和不可预知性应激(chronic unpredicted mild stress, CUMS)模型[10], 以及焦虑症大鼠模型(anxiety)[11]。
模型的评价
外观行为观察以及体重测试 观察各组大鼠皮毛的色泽, 是否有攻击行为(尤其在不确定性空瓶应激期间, 是否出现撕咬瓶子或撞击笼子行为)和自主活动行为。造模开始后, 每周称重、每7天记录1次每只大鼠的体重。
糖水偏爱实验测定[12] 适应期第6天上午8:00孤养每只大鼠并给予1瓶饮用水, 一瓶现配的1%蔗糖水, 进行糖水偏爱训练实验。3 h后撤去糖水, 正常给予水。晚上8:00撤去水瓶, 禁水12 h。在适应期第7天上午8:00~11:00进行3 h的糖水偏爱基线测定。糖水偏爱率=1%质量体积分数的蔗糖水消耗量(mL)/总饮水消耗量(mL)×100%。造模成功后, 再次进行糖水测试。
旷场实验测定[13] 适应期第7天晚上利用自制大鼠旷场实验箱, 将大鼠平托置于旷场实验箱中央格, 开始计时5 min, 大鼠在旷场箱中适应1 min, 从4 min开始数据记录。穿越格数:大鼠在后4 min中跨越格子的总数。直立次数:大鼠在后4 min中大鼠前两爪抬起远离地面的次数。
其间每次测试后, 都要清洁旷场中粪便、尿液等杂质残留。且用10%乙醇溶液擦拭旷场中动物遗迹以及去除异味, 再用干布擦净。
高架十字迷宫测定[14] 高架十字迷宫测试前将每只大鼠放入1个塑料盒子中适应5 min。任由大鼠自由探究5 min后迅速放于高架十字迷宫的中央, 使其头部正对其任一开放臂, 释放后进行OE、OT、CE、CT 4个指标的测定。①进入到开放臂的次数(OE); ②进入到开放臂的时间(OT):单位(秒); ③进入到封闭臂的次数(CE); ④进入到封闭臂的时间(CT):单位(秒)。根据①②③④计算出: ⑤进入开放臂次数比例(OE%), 即OE/(OE+CE)×100%, ⑥进入开放臂时间比例(OT%), 即OT/(OT+CT)×100%。每只大鼠测试5 min。
其间每次测试后, 都要清洁高架十字迷宫中粪便、尿液等杂质残留。且用10%乙醇溶液擦拭迷宫清除动物遗迹以及去除异味, 再用干布擦净。
其他指标检测 通过对心理亚健康模型大鼠血生化、血常规、组织病理切片相关指标检测, 进一步排除大鼠机体的器质性病变, 进而从侧面客观评价模型的合理性。
样本收集 行为学测试结束后, 禁食12 h后, 采用10%水合氯醛麻醉大鼠, 腹主动脉取血, 室温静置30 min, 3 500 r·min-1离心15 min。取上层血清移入EP管中分装。其中血常规检测为含有EDTA抗凝剂后全血。收集大鼠肝脏和脾脏, 并将其固定于10%福尔马林溶液中, 进行组织病理学检测。同时收集大鼠直肠段的粪便颗粒, 置于灭菌冻存管中, 液氮冻存, 随后转置于-80 ℃冰箱保存, 待测。
粪便菌群基因组DNA提取与检测 利用粪便基因组DNA提取试剂盒, 参照说明书步骤提取大鼠粪便cDNA。之后对16S rRNA基因中的V3~V4区域片段利用通用引物进行PCR扩增。前引物序列ACTCC TACGGGAGGCAGCA, 后引物序列GGACTACHVG GGTWTCTAAT, 扩增条件: 98 ℃预变性2 min; 98 ℃变性15 s, 55 ℃退火30 s, 72 ℃延伸30 s, 25次循环; 72 ℃再延伸5 min。对于每个样本, 分别加上7 bp的标签序列。扩增体系(25 μL): 5×reaction buffer 5 μL, 5×GC buffer 5 μL, dNTP (2.5 mmol·L-1) 2 μL, 引物: (10 μmol·L-1) 1 μL, Reverse primer (10 μmol·L-1) 1 μL, DNA模板2 μL, ddH2O 8.75 μL, Q5 DNA Polymerase 0.25 μL, 10 ℃ 25~30循环。对目标条带进行扩增产物回收纯化、荧光定量, 荧光定量染料为Quant-iT PicoGreen dsDNA Assay Kit, 定量仪器为Microplate reader。将纯化后的扩增子等量混合, 根据Illumina MiSeq测序平台的标准流程进行高通量测序。以97%的序列相似度作为可操作分类单元(operational taxonomic unit, OUT)划分阈值, 并选取每个OTU中丰度最高的序列作为该OTU的代表序列。对于每个OTU的代表序列, 在QIIME软件中使用默认参数, 通过将OTU代表序列与对应数据库的模板序列相比对, 获取每个OTU所对应的分类学信息。
统计学方法 数据以x±s表示, 采用SPSS 18.0统计学软件进行分析, 两组间比较采用独立样本t检验, 多组间比较采用单因素方差分析, P < 0.05认为具有统计学差异。利用SIMCA 14.0软件进行多元统计分析。采用GraphPad Prism 6.0软件制图。
结果 1 外观行为观察及体重测试适应期大鼠均毛发柔顺光亮, 脾性温顺, 自主活动较多; 造模后, 空白对照组大鼠由于没有遭受不良事件处理, 整个过程中, 水和食物正常供给, 毛色光亮柔顺, 自主活动较多。与空白对照组相比, PSHS组大鼠皮毛略显蓬松, 自主活动较少, 精神略显倦怠。造模结束后, 与空白对照组相比, 所有模型组大鼠体重增长缓慢(P < 0.01, P < 0.05, 图 1A), 说明在应激刺激下易于影响大鼠的食欲, 从而影响大鼠的体重, 使其增长缓慢。

|
Figure 1 Rat behavioral test indicators. A: Changes in body weight of rats; B: Changes in sucrose preference of rats; C: Changes in the number of crossings; D: Changes in the number of rearing of rats; E: Entries of open arms; F: Time spent open arms. Control: Control group; PSHS: The group of rats with psychological suboptimal health state; Depression: The group of chronic unpredicted mild stress; Anxiety: The group of rats with anxiety disorder. *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs PSHS group |
在造模第0天, 各组大鼠糖水偏爱率基线值无显著性差异, 排除了各组大鼠个体对甜度感应差异的影响。造模结束后, 与空白对照组相比, 抑郁症组表现出糖水偏爱率降低, 具有极显著统计学差异(P < 0.01), 而焦虑症组则表现出糖水偏爱率升高, 具有统计学差异(P < 0.05)。与PSHS组大鼠相比, 抑郁症组大鼠表现出糖水偏爱率降低, 有极显著差异(P < 0.01), 见图 1B。实验表明, CUMS应激能够造成大鼠糖水偏爱率降低, 即该模型存在对甜度快感缺失的现象, 而PSHS组和焦虑症组并未表现该现象。
3 旷场测试旷场实验中的穿越格数和直立次数在一定程度上分别反映大鼠的活动能力及对新鲜环境的好奇程度。造模结束后, 观察应激对各组大鼠在旷场实验中穿越格数和直立次数的影响。如图 1C、D所示, 与空白对照组相比, 其余3组大鼠穿越格数和直立次数都减少(抑郁症组: P < 0.01;焦虑症组: P < 0.01; PSHS组: P < 0.05)。与PSHS组相比, 抑郁症组和焦虑症组大鼠穿越格数显著减少(P < 0.01)。结果表明, 造模过程会导致大鼠行为活动能力和对新鲜环境的好奇程度均下降。但是, 与抑郁症和焦虑症疾病模型相比, 心理亚健康模型组大鼠水平活动能力及对新鲜环境的好奇程度降低的程度较轻。
4 高架十字迷宫测试高架十字迷宫是利用大鼠对新奇环境的好奇和对高度的恐惧这两种感觉的冲突来反映焦虑情绪。因此, 大鼠在开臂内的指标如开臂次数、时间比例及向下探头次数都可在一定程度上反映大鼠的焦虑情绪。本研究主要采用开臂次数比例和开臂时间比例来反映大鼠的焦虑情绪。如图 1E、F所示, 与空白对照组相比, 其余3组大鼠进入开臂时间比例以及进入开臂次数比例显著减少(抑郁症组: P < 0.01;焦虑症组: P < 0.01; PSHS组: P < 0.05)。表明给予不同造模应激的大鼠都表现出一定程度的焦虑情绪。与PSHS组相比, 焦虑症组大鼠进入开臂时间比例和进入开臂次数比例显著减少(P < 0.05), 提示心理亚健康模型大鼠表现出较弱的焦虑情绪。
5 组织病理切片观察脾脏组织镜检结果显示(图 2), 空白对照组与PSHS两组之间无显著差异。肝脏镜检结果显示, 与空白对照组相比, PSHS组肝细胞仅有轻至中度肿胀, 水样变性, 肝索排列轻度紊乱, 未见肝细胞坏死及其他病理变化。综合以上结果表明, PSHS组大鼠并未出现肝脏和脾脏严重的组织病理变化。
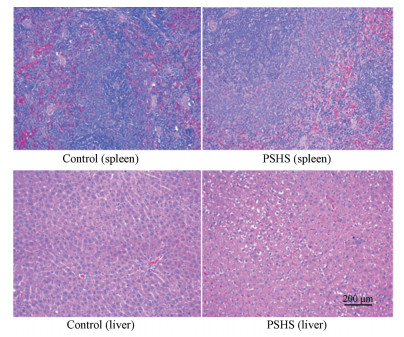
|
Figure 2 Observation of pathological sections of liver and spleen in the control and PSHS groups (HE×200, n = 3) |
心理亚健康模型大鼠血常规指标分析结果显示, 与空白对照组相比, PSHS组大鼠血细胞和相关血液生化指标都没有显著变化(P > 0.05)。结果表明, 心理亚健康模型组大鼠并未出现大鼠血液中血细胞和血生化指标的异常变化, 见表 1~3。
| Table 1 Effect of blood routine indicators in the control and PSHS groups. n = 12, x±s. WBC: White blood cells; LY: Lymphocytes; RBC: Red blood cells; HGB: Hemoglobin; HCT: Red blood cell specific volume; MCV: Erythrocyte mean corpuscular volume |
| Table 2 Effect of blood routine indicators in the control and PSHS groups. n = 12, x±s. MCH: Mean corpuscular hemoglobin; MCHC: Mean corpuscular hemoglobin concentration; RDW: Red blood cell distribution width; PLT: Platelet; MPV: Mean platelet volume |
| Table 3 Effect of determination of blood biochemical parameters in the control and PSHS groups. n = 12, x±s. AST: Aspartate aminotransferase; ALT: Alanine aminotransferase; BUN: Urea nitrogen; CREA: Creatinine; TG: Triglyceride; TCHO: Total cholesterol |
参考辅助模型评价的实验结果, 通过外观形态、体重、行为学指标以及生理生化指标相结合, 综合评价心理亚健康大鼠模型。结果显示, 与空白对照组相比, PSHS模型大鼠没有表现出器质性病变。心理亚健康模型大鼠体重增长缓慢, 活动能力及对新鲜环境好奇程度下降, 并表现出较弱的焦虑情绪。
7 菌群的分类学组成分析使用QIIME软件, 获取各样本在门、纲、目、科、属5个分类水平上的组成和丰度分布, 用饼状图和柱状图表示在门和属分类学水平上的菌群组成比例。在门水平上(图 3A), Firmicutes、Bacteroidetes和Actinobacteria在两组群落结构中占有绝对优势, 其中, 与空白对照组比, Actinobacteria在心理亚健康模型组中相对丰度较低, 有显著差异(P < 0.05)。在属分类水平上(图 3B), 两组中相对丰度较高的是Lactobacillus、Clostridiales_ukn、Ruminococcus、Ruminococcaceae_ukn和S24-7_ukn。
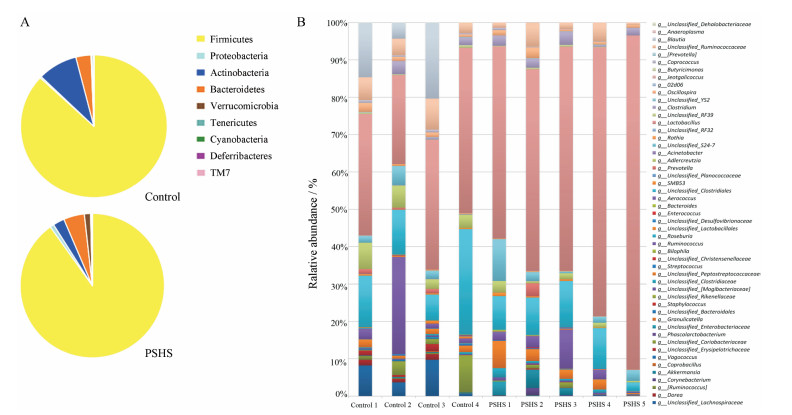
|
Figure 3 The differences in the community composition between the phylum (A) and the genus (B) units. The different colors indicate the relative abundance ratio of different species |
获得OTU丰度矩阵之后, 采用Alpha和Beta多样性分析来描述和评价菌群的整体结构。Alpha多样性反映单个样品内部的物种多样性, 通过群落多样性指数与群落丰度指数来衡量, 群落多样性指数包括Shannon与Simpson, 群落丰度指数包括Chao1和ACE。图 4A~D结果表明, Shannon和Simpson指数两组之间无统计学差异, Chao1和ACE指数显示, PSHS组该指数显著低于空白对照组(P < 0.05)。一般而言, Chao1或ACE指数越大, 表明群落的丰富度越高。即空白对照组群落丰富度较高。Beta多样性主要是利用各样本的物种组成及丰富信息来反映样本间关系。PCA结果显示, PSHS组和空白对照组大鼠菌群结构组成差异明显, 结果见图 4E。
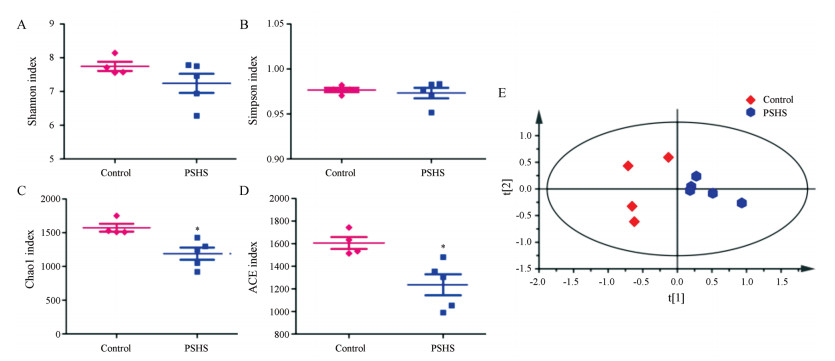
|
Figure 4 Analysis of bacterial diversity in control and PSHS. Alpha diversity analysis including Shannon index (A), Simpson index (B), Chao1 index (C), ACE index (D). E: Beta diversity analysis. *P < 0.05 vs control group |
为了进一步筛选差异菌群, 根据各菌群在样本中的相对丰度, 采用SIMCA-P软件在Beta多样性分析基础之上, 又进行深入的有监督正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA), 去除与实验观察无关的随机信息, 将二者之间存在的细微差异放大, 进行相应的VIP分析。根据分类的贡献度值(VIP > 1)结合独立样本t检验P < 0.05[15], 见表 4, 筛选得到10种差异菌。与空白对照组比较, 心理亚健康模型大鼠粪便肠道菌群中, 厚壁菌门中Bacilli菌纲, Lactobacillales菌目, Lactobacillaceae菌科, Lactobacillus菌属相对丰度升高; 而Clostridia菌纲, Clostridiales菌目, Blautia菌属相对丰度降低。放线菌门中Coriobacteriales菌目, Coriobacteriaceae菌科, Adlercreutzia菌属相对丰度降低, 如图 5所示。
| Table 4 Information on differential gut microbiota in control and PSHS group |
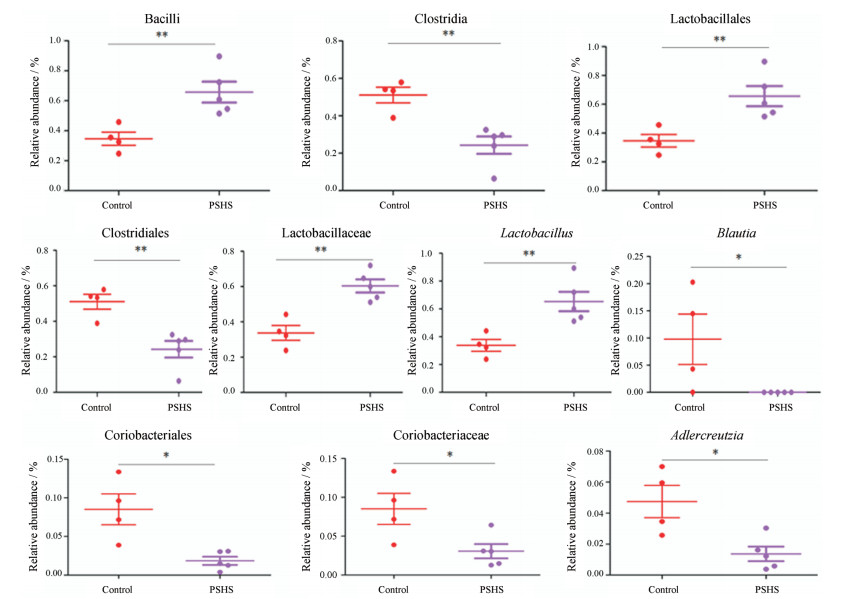
|
Figure 5 Average relative abundance of differential gut microbiota in control and PSHS rat's fecal samples. *P < 0.05, **P < 0.01 |
目前国内普遍认为亚健康是指人的身心情感处于疾病与健康之间的一种健康低质状态, 是机体虽无明确的疾病, 但在躯体、心理和人际交往上出现各种不适应的感觉和症状, 从而呈现出活力、反应能力和对外界适应能力降低的一种生理状态, 与人体多种慢性疾病有很密切的联系[16]。
虽然造成心理亚健康状态的诱因比较复杂, 但生活方式是影响健康状况的最重要因素之一[17]。中国人民大学进行的一项横断面研究中表明, 体重减轻与亚健康状态呈正相关[18]。本研究结果表明, 心理亚健康大鼠在造模结束后, 体重增长缓慢, 与上述调研结果相符。在旷场和高架十字迷宫相关指标测试中表明, 心理亚健康模型大鼠表现出一定程度的水平行动能力下降, 对陌生环境的好奇程度降低, 并伴随较轻的焦虑情绪。研究结果与心理亚健康状态临床表现在一定程度上具有一致性, 符合心理亚健康处于未病的“第三状态”的临床表现。
模型评价方面, 同时复制了抑郁和焦虑两种疾病模型, 用于间接辅助模型评价。由于肝脏负责许多生理过程, 如营养物质的代谢、胆汁生成和排泄、解毒和免疫等。此外, 中医认为, 罹患精神障碍, 隐情抑郁, 欲念不遂, 多思善虑; 或紧张焦虑, 均伤于脾。为了排除应激源对PSHS模型大鼠造成肝脏、脾脏的损伤, 观察肝脏和脾脏的组织病理切片。结果显示, PSHS模型组中肝细胞出现轻至中度水样变性可能与造模应激源有密切的关系。长期的饮食不节, 昼夜紊乱以及不确定的饮水应激等影响大鼠生理状态、情志变化以及心理健康。此外, 结合血生化和血常规等检测, 进一步验证该模型并未发生器质性病变。
有研究表明, 肠道与大脑之间存在的肠道菌群-肠-脑轴(MGBA), 肠道菌群可能通过此轴调控宿主的脑功能和行为活动等。肠道菌群的多样性与抑郁症、焦虑症、阿尔兹海默症等神经精神系统疾病的发生发展有密切的关系。通过对肠道菌群的多样性分析, 揭示心理亚健康模型大鼠肠道菌群结构发生改变。进一步分析发现10种菌群相对丰度发生显著改变。
Blautia菌属作为健康人体内观察到的细菌广泛存在。Blautia属是革兰阳性非运动细菌, 产生的乙酸作为葡萄糖发酵的主要终产物。乙酸是短链脂肪酸的主要成员之一, 而短链脂肪酸属菌群中间的代谢产物, 在肠道酶活性中发挥重要的作用, 具有维持人体健康的多重作用[19]。本研究中, 与空白对照组相比, PSHS组大鼠Blautia菌属相对丰度降低, 可能会干扰乙酸的合成, 从而影响短链脂肪酸的合成以及能量平衡、代谢功能紊乱等。
某些乳酸杆菌和双歧杆菌菌株分泌γ-氨基丁酸(GABA), 它是中枢神经系统中的关键抑制性神经递质, 不平衡或改变的GABA信号通路与焦虑症和抑郁症有密切关系[20]。有文献报道[21], 与空白对照组比较, 抑郁症模型组粪便中Lactobacillus菌属是降低的。而吴艳艳等[22]通过慢性温和不可预知应激联合孤养建立大鼠抑郁模型, 采用RT-PCR方法检测乳酸杆菌, 与空白对照组相比, 抑郁模型组大鼠盲肠中乳酸杆菌是显著增加的。在本实验结果中, 与空白对照组相比, PSHS组大鼠Lactobacillus菌属相对丰度显著升高。推测可能的原因是由于不同的应激源、不同的生理或病理状态、不同的检测手段、不同部位的样本等因素导致测试结果出现偏差, 该研究结果需要进一步重复验证。
综上所述, 本研究所建立的心理亚健康实验模型大鼠具有较好的表面效度, 对该模型肠道菌群结构多样性的初探有助于理解心理亚健康发生的生理机制, 并为临床开展心理亚健康合理干预措施提供参考依据。
| [1] | Yan YX, Liu YQ, Li M, et al. Development and evaluation of a questionnaire for measuring suboptimal health status in urban Chinese[J]. J Epidemiol, 2009, 19: 333–341. DOI:10.2188/jea.JE20080086 |
| [2] | Wang Y, Liu X, Qiu J, et al. Association between ideal cardiovascular health metrics and suboptimal health status in Chinese population[J]. Sci Rep, 2017, 7: 14975–14981. DOI:10.1038/s41598-017-15101-5 |
| [3] | Zhang X, Wu YF, Gao Y, et al. Establishment and evaluation of rat model with psychological sub-health[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 610–616. |
| [4] | Wang X, Wu YF. The treatment of 50 cases yin-deficiency type of psychological health groups with Baihe Dihuamg Decoction[J]. Guang Ming Zhong Yi (光明中医), 2014, 29: 2558–2559. |
| [5] | Tian JS, Xia XT, Wu YF, et al. Discovery, screening and evaluation of a plasma biomarker panel for subjects with psychological suboptimal health state using 1H-NMR-based metabolomics profiles[J]. Sci Rep, 2016, 6: 33820–33832. DOI:10.1038/srep33820 |
| [6] | Zhao L, Wu YF, Xiang H, et al. Research advances in psychological suboptimal health[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2017, 31: 590–596. |
| [7] | Xu HY, Wang YL, Wang DF, et al. Effect of Huangqin Tang on the gut microbiota in rats with ulcerative colitis model determined by high-throughput sequencing[J]. Acta Pharm Sin (药学学报), 2017, 52: 1673–1682. |
| [8] | Shu S, Chen N, Han YZ. Intestinal flora and central nervous system diseases[J]. Med Rev (医学综述), 2016, 22: 1891–1894. |
| [9] | Cussotto S, Sandhu KV, Dinan TG, et al. The Neuroendocrinology of the microbiota-gut-brain axis: a behavioural perspective[J]. Front Neuroendocrinol, 2018, 51: 80–101. DOI:10.1016/j.yfrne.2018.04.002 |
| [10] | Tian JS, Liu CC, Xiang H, et al. Investigation on the antidepressant effect of sea buckthorn seed oil through the GC-MS-based metabolomics approach coupled with multivariate analysis[J]. Food Funct, 2015, 6: 3585–3592. DOI:10.1039/C5FO00695C |
| [11] | Qu M, Zhao RZ, Tang QS. Based on 3 different models of generalized anxiety rats observing the effect of Anshen Decoction on organ index and inflammatory cytokines[J]. Beijing J Tradit Chin Med (北京中医药), 2018, 37: 118–121. |
| [12] | Gao X, Liang M, Fang Y, et al. Deciphering the differential effective and toxic responses of Bupleuri Radix following the induction of chronic unpredictable mild stress and in healthy rats based on serum metabolic profiles[J]. Front Pharmacol, 2018, 8: 995–1017. DOI:10.3389/fphar.2017.00995 |
| [13] | Tian JS, Shi BY, Xiang H, et al. 1H-NMR-based metabonomic studies on the anti-depressant effect of genipin in the chronic unpredictable mild stress rat model[J]. PLoS One, 2013, 8: e75721. DOI:10.1371/journal.pone.0075721 |
| [14] | Lam VYY, Raineki C, Wang LY, et al. Role of corticosterone in anxiety- and depressive-like behavior and HPA regulation following prenatal alcohol exposure[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2019, 90: 1–15. DOI:10.1016/j.pnpbp.2018.10.008 |
| [15] | Wang J, Ye F, Cheng X, et al. The effects of LW-AFC on intestinal microbiome in senescence-accelerated mouse prone 8 strain, a mouse model of Alzheimer's disease[J]. J Alzheimers Dis, 2016, 53: 907–919. DOI:10.3233/JAD-160138 |
| [16] | Sun Y, Liu YR, Wand H, et al. Prevention and treatment of middle-aged sub-health state of liver stagnation and spleen deficiency guiding by the thoughts of "prevention of disease"[J]. J Basic Chin Med (中国中医基础医学杂志), 2017, 23: 349–350, 110. |
| [17] | Bi J, Huang Y, Xiao Y, et al. Association of lifestyle factors and suboptimal health status: a cross-sectional study of Chinese students[J]. BMJ Open, 2014, 4: e005156. DOI:10.1136/bmjopen-2014-005156 |
| [18] | Ma C, Xu W, Zhou L, et al. Association between lifestyle factors and suboptimal health status among Chinese college freshmen: a cross-sectional study[J]. BMC Public Health, 2018, 18: 105–114. DOI:10.1186/s12889-017-5002-4 |
| [19] | Park SK, Kim MS, Bae JW. Blautia faecis sp. nov., isolated from human feces[J]. Int J Syst Evol Microbiol, 2013, 63: 599–603. DOI:10.1099/ijs.0.036541-0 |
| [20] | Zalar B, Haslberger A, Peterlin B. The role of microbiota in depression- a brief review[J]. Psychiatr Danub, 2018, 30: 136–141. DOI:10.24869/spsih.2018.136 |
| [21] | Yu M, Jia H, Zhou C, et al. Variations in gut microbiota and fecal metabolic phenotype associated with depression by 16S rRNA gene sequencing and LC/MS-based metabolomics[J]. J Pharm Biomed Anal, 2017, 138: 231–239. DOI:10.1016/j.jpba.2017.02.008 |
| [22] | Wu YY, Dou M, Ma GG, et al. Effect of lactobacillus cases on behavior and intestinal flora in rats with depression[J]. Acta Acad Med Qingdao Univ (青岛大学医学院学报), 2019, 53: 163–167. |
 2019, Vol. 54
2019, Vol. 54


