2. 中国科学院昆明动物研究所 云南省活性多肽研究与利用重点实验室, 云南 昆明 650223;
3. 昆明医科大学药学院暨云南省天然药物药理重点实验室, 云南 昆明 650500;
4. 苏州大学-中国科学院昆明动物研究所疾病动物模型与新药研发联合实验室, 江苏 苏州 215021
2. Key Laboratory of Bioactive Peptides of Yunnan Province, Kunming Institute of Zoology, Chinese Academy of Sciences, Kunming 650223, China;
3. School of Pharmaceutical Science and Yunnan Key Laboratory of Pharmacology for Natural Products, Kunming Medical University, Kunming 650500, China;
4. KIZ-SU Joint Laboratory of Animal Model and Drug Development, College of Pharmaceutical Sciences, Soochow University, Suzhou 215021, China
寨卡病毒(Zika virus, ZIKV)是一种虫媒传播病毒, 主要通过伊蚊叮咬进行传播。该病毒最早于1947年科学家在乌干达寨卡森林中的恒河猴血清中分离得到, 因此被命名为寨卡病毒[1]。ZIKV的颗粒呈球形, 直径约40 nm, 是不分节段的单股正链RNA病毒。ZIKV基因组全长约11 kb, 仅含有1个开放阅读框, 编码3个结构蛋白和7个非结构(non-structural, NS)蛋白。结构蛋白分别为衣壳蛋白(capsid, C)、前体膜蛋白/膜蛋白(premembrane and membrane, prM/M)及包膜蛋白(envelope, E), 非结构蛋白包括NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5。结构蛋白在病毒颗粒形成、病毒吸附、融合和进入宿主细胞等环节中发挥着重要作用, 非结构蛋白参与病毒复制、释放及逃逸宿主免疫反应。
由ZIKV感染引起的疾病称为寨卡病毒病(Zika virus disease), 也称为寨卡热。大多数寨卡病毒病都较轻微并且是自限性的, 但ZIKV感染也有可能造成患者严重的神经系统、生殖系统、胎儿及胎盘等器官损伤及并发症, 如格林-巴利综合征(Guillian-Barré syndrome)[2-4], 孕妇感染ZIKV则可导致胎儿脑部先天性发育畸形, 引起新生儿小头畸形[5, 6]。自2015年来, ZIKV感染在巴西爆发及其与新生儿小头症的关联, 引起了全球的高度关注。据统计, 目前全球已有148个国家及地区报道了经蚊媒传播的ZIKV感染[7]。我国也是ZIKV传播潜在风险最大的国家之一[8]。因此, 防治ZIKV感染与传播已成为当务之急。由于ZIKV的致病机制尚不完全清楚, 至今仍无特效的药物或疫苗批准上市用于治疗ZIKV感染, 急需寻找有效的抗ZIKV药物。
核苷类似物是一类广谱抗病毒药物, 可治疗多种病毒感染, 如疱疹病毒、人类免疫缺陷病毒(human immunodeficiency virus, HIV)、乙型肝炎病毒(hepatitis B virus, HBV)以及流感和呼吸系统病毒等DNA和RNA病毒。在目前使用的抗病毒药物中近50%是核苷类药物[9]。本课题组曾报道核苷类似物阿兹夫定不仅具有抗HIV活性还具有抗登革病毒(dengue virus, DENV)活性[10, 11]。此外, 还有很多核苷类似物具有抗黄病毒作用[12]。富马酸替诺福韦二吡呋酯(tenofovir disoproxil fumarate, TDF)也是一种核苷类似物, 已分别于2001年和2008年获得美国FDA批准上市用于治疗HIV-1和HBV感染。至今尚未见TDF抗ZIKV感染作用的研究报道。本研究就TDF是否具有抗ZIKV活性进行了研究, 期望为临床治疗ZIKV感染导致的严重疾病奠定基础。
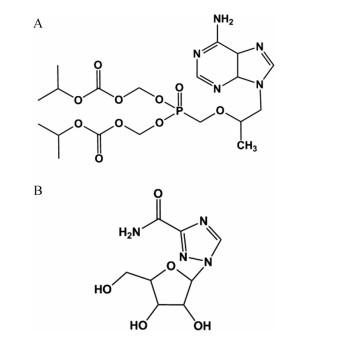
材料与方法药品 TDF由南京安赛莱医药科技有限公司提供, 石家庄龙泽制药股份有限公司生产, 利巴韦林(ribavirin)购自大连美仑生物技术有限公司。TDF和利巴韦林的结构式如图 1所示。
|
Figure 1 The structures of tenofovir disoproxil fumarate (TDF, A) and ribavirin (B) |
主要试剂 培养基、胎牛血清(fetal bovine serum, FBS) (Thermo Fisher公司); 低熔点琼脂糖、SDS (Amresco公司); 结晶紫(北京索莱宝公司); MTT (Sigma公司), DMF (西陇化工股份有限公司); RNA提取试剂盒Roche High Pure Viral RNA Kit (Roche公司); 一步法定量试剂盒RNA-directTM Realtime PCR Master Mix (TOYOBO公司); 引物及TaqMan探针(Takara公司); ZIKV NS2B蛋白抗体(Gene Tex公司); β-actin抗体(北京康为世纪公司)。
细胞与病毒 非洲绿猴肾细胞(Vero)和白纹伊蚊细胞(C6/36)分别购自中国科学院上海细胞库和中国科学院昆明细胞库。Vero细胞培养于含有10% FBS的DMEM中, C6/36细胞采用含有10% FBS的RPMI-1640培养。所有细胞置于37 ℃恒温、5% CO2培养箱中培养。细胞维持液含4% FBS。根据细胞生长状态及细胞密度进行传代和实验。ZIKV SZ-WIV01株(GenBank: KU963796)由中国科学院武汉病毒研究所张波研究员惠赠。采用C6/36细胞进行病毒扩增并采用噬斑法对所扩增病毒进行滴度测定。
噬斑抑制实验 将Vero细胞种于12孔板中, 每孔3×105个细胞, 于37 ℃恒温、5% CO2培养箱中过夜培养。待细胞长成单层后, 弃培养上清, 用PBS洗涤1次, 加入ZIKV病毒(MOI ≈ 0.1)吸附2 h后弃病毒液, 用PBS洗3次后加入含有梯度稀释TDF的2%低熔点琼脂糖-DMEM (4% FBS)培养基。37 ℃、5% CO2培养4天后采用4%多聚甲醛固定15 min, 清洗3次, 加入0.8%结晶紫染色10 min, 清洗3次并烘干。采用酶联荧光斑点分析仪(CTL, Immunospot S6 Universal)进行图片采集并对噬斑进行统计。根据噬斑数绘制剂量反应曲线, 计算半数有效浓度EC50, 即对ZIKV感染Vero细胞后噬斑形成抑制率为50%时的药物浓度。
病毒产量降低实验 将Vero细胞种于24孔板中, 每孔1.5×105个细胞, 于37 ℃、5% CO2培养箱中过夜培养。待细胞长成单层后, 弃培养上清, 用PBS洗1次, 加入ZIKV病毒(MOI ≈ 1)吸附2 h后弃病毒液, 用PBS洗3次后加入含有梯度稀释的TDF, 37 ℃、5% CO2培养箱中培养72 h后收集病毒上清并立刻置于-80 ℃冰箱保存。根据不同浓度TDF对ZIKV RNA复制的抑制率计算出TDF的EC50。
RNA提取及实时荧光定量PCR 采用试剂盒Roche High Pure Viral RNA Kit提取病毒上清中的RNA, 具体实验步骤遵循试剂盒说明书。使用定量PCR试剂盒RNA-directTM Realtime PCR Master Mix和TaqMan探针在ViiA 7系统(Life technologies)下进行实时荧光定量PCR。ZIKV NS5片段通过引物5'-CCGCTGCC CAACACAAG-3'和3'-TACAGACGTTTTCTTGCAAT CACC-5'及TaqMan探针5'-FAM-AGCCTACCTTGAC AAGCAGTCAGACACTCAA-TAMRA-3'进行扩增。实时荧光定量PCR的扩增程序为: 90 ℃预变性30 s; 61 ℃ 20 min; 95 ℃ 30 s; 95 ℃ 15 s; 60 ℃ 1 min。
蛋白印迹实验 将Vero细胞种于24孔板中, 每孔1.5×105个细胞, 于37 ℃、5% CO2培养箱中过夜培养。待细胞长成单层后, 经ZIKV感染和TDF处理后于37 ℃、5% CO2培养箱培养72 h, 倒掉培养上清, 用PBS清洗3次, 加入含有蛋白酶抑制剂的蛋白裂解液, 每孔200 μL, 冰上裂解30 min。将细胞吹下, 转移至1.5 mL EP管内, 12 000 r·min-1离心5 min (4 ℃), 收集蛋白上清。将蛋白上清变性制成样品后进行SDS-PAGE电泳, 经过转膜、牛奶封闭、一抗孵育、二抗孵育后显影。
MTT检测 采用MTT法检测药物的细胞毒性[13]。将Vero细胞种于96孔板中, 每孔4×104个细胞, 于37 ℃、5% CO2培养箱中过夜培养。待细胞长成单层, 弃培养上清, 加入含梯度稀释TDF的培养基, 每个浓度设置3个重复孔, 并设置不含药物的对照组。于37 ℃、5% CO2培养箱中培养4天后, 每孔加入20 μL 5 mg·mL-1 MTT。37 ℃孵育4 h, 弃100 μL上清, 加入100 μL 12% SDS-50% DMF溶液, 37 ℃孵育过夜。待结晶甲臢完全溶解, 选用Elx800酶标仪检测OD值, 测定波长为570 nm, 参考波长为630 nm。计算出半数细胞毒浓度CC50, 即对50% Vero细胞产生毒性时的药物浓度。
统计学方法 实验数据采用GraphPad Prism 6软件进行分析, 数据以x±s表示, 组间比较采用LSD-t检验, 以P < 0.05为差异有统计学意义。
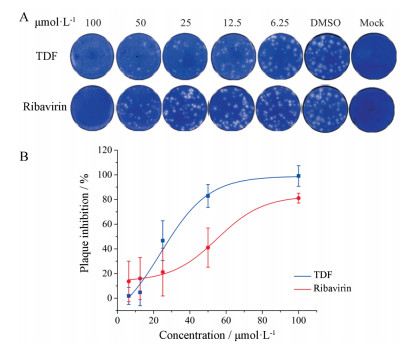
结果 1 噬斑抑制实验证明TDF具有抗ZIKV活性本研究以利巴韦林为阳性对照药, 采用噬斑抑制实验证明了TDF具有抗ZIKV活性(图 2A), 对不同药物浓度下的噬斑个数进行统计并与DMSO组进行比较, 算出TDF对ZIKV的抑制率(图 2B), 从图中可以看出TDF呈剂量依赖关系抑制ZIKV的复制。计算得出TDF对ZIKV的半数有效浓度(50% effective concentration, EC50)为27.47 ± 8.07 μmol·L-1。利巴韦林对ZIKV的EC50为56.01 ± 12.16 μmol·L-1。TDF抗ZIKV活性明显优于利巴韦林。
|
Figure 2 Plaque reduction assay to determine anti-ZIKV activity. A: Plaque reduction assay for TDF and ribavirin in Vero cells; B: Plaque inhibition curves. Mock: Non-infected cells; DMSO: ZIKV infected cells. n = 3, x±s |
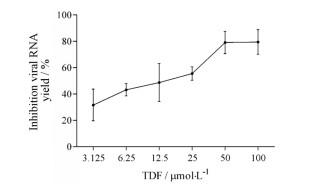
为了进一步确认TDF的抗ZIKV活性, 接着通过实时荧光定量PCR实验在RNA水平检测了TDF对ZIKV RNA复制的抑制作用。将含有梯度稀释TDF的培养基与感染了ZIKV的细胞共培养72 h后收集上清检测TDF对ZIKV RNA复制的抑制作用, 结果表明, 随着TDF药物浓度的升高, TDF对ZIKV病毒RNA复制的抑制作用逐渐增强, 当TDF浓度为25 μmol·L-1时对ZIKV RNA拷贝数的抑制率已大于50% (图 3)。因此, TDF可有效降低ZIKV的病毒产量, 计算得出其对ZIKV的EC50为14.96 ± 8.29 μmol·L-1。
|
Figure 3 Dose-dependent reduction of ZIKV yield by TDF. Viral RNA levels were quantified by means of real time quantitative PCR. n = 3, x±s |
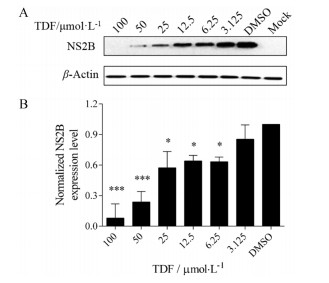
通过病毒产量降低实验确定TDF的抗ZIKV活性后, 本研究又进一步通过Western blot在蛋白水平检测了TDF是否具有抗ZIKV活性。将感染了ZIKV的细胞与含有梯度稀释TDF的培养基共培养72 h后收集细胞, 提取细胞内总蛋白并进行蛋白印迹检测, 结果发现, 随着药物浓度升高, TDF对ZIKV NS2B蛋白表达的抑制作用逐渐增强(图 4A), 当TDF浓度为6.25 μmol·L-1时, 已可显著抑制ZIKV NS2B蛋白表达(图 4B)。
|
Figure 4 Effects of TDF on ZIKV NS2B protein expression by Western blot. A: Representative Western blot images of Vero cells after treatment with TDF; B: Quantification of NS2B protein band intensities, relative to those for β-actin. Mock: Non-infected cells; DMSO: ZIKV infected cells. n = 3, x±s. *P < 0.05, ***P < 0.001 vs DMSO |
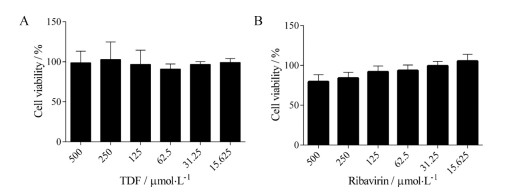
通过MTT实验检测了TDF对Vero细胞的毒性从而确定TDF抗ZIKV的治疗指数。结果表明, 当TDF浓度为500 μmol·L-1时, 细胞存活率依然大于50% (图 5A), TDF对Vero细胞毒性很小, 半数细胞毒浓度(50% cytotoxic concentration, CC50)大于500 μmol·L-1。阳性药物利巴韦林对Vero细胞的CC50也大于500 μmol·L-1 (图 5B)。通过CC50/EC50计算出TDF的治疗指数大于18.20, 明显高于利巴韦林的治疗指数(表 1)。
|
Figure 5 Cytotoxicity of TDF (A) and ribavirin (B) in Vero cells which were determined by MTT assay. n = 3, x±s |
| Table 1 Antiviral activity of TDF and ribavirin against ZIKV strain SZ-WIV01 (n = 3). EC50: 50% Effective concentration; CC50: 50% Cytotoxic concentration; PA: Plaque reduction assay; VY: Virus yield reduction assay; TI: Therapeutic index |
大量研究表明, ZIKV感染可造成胎儿小头畸形和成年人的格林-巴利综合征[2-6]。ZIKV的爆发流行严重危害了人类健康, 研发有效的抗ZIKV治疗药物迫在眉睫。TDF是由美国Gilead Sciences公司生产的一种新型核苷类抑制剂, 已广泛用于临床治疗HIV和HBV感染。本研究首次在体外细胞、RNA及蛋白水平发现TDF具有抗ZIKV活性。本研究通过噬斑抑制实验首先在细胞水平证明了TDF具有抗ZIKV活性, 随后通过病毒产量降低实验和蛋白质印迹实验分别在RNA和蛋白水平进一步验证了其对ZIKV的抑制作用。噬斑抑制和病毒产量降低实验均表明TDF以剂量依赖方式抑制ZIKV复制。MTT检测结果表明, TDF对Vero细胞的毒性很小, 通过CC50/EC50计算出TDF的治疗指数发现其治疗指数高于阳性对照药利巴韦林。因此, TDF有望成为抗ZIKV感染的潜在治疗药物。
虽然目前针对抗ZIKV药物的研究也发现和报道了不少具有抗ZIKV活性的已上市药物, 但很多药物属于抗肿瘤药物和免疫调节剂, 这些药物可能具有免疫抑制作用并不适合孕妇使用[14, 15]。此外, 还有很多未批准上市的化合物被发现具有抗ZIKV活性[12, 16, 17], 但这些化合物的药效学、药代动力学、使用剂量及安全性均有待进一步研究, 距离批准上市并应用于临床仍需时日。据美国FDA的药物妊娠期危险性分类, 将药品的安全性分为A、B、C、D、X五类, 妊娠期妇女用药应尽可能选择A类及B类药, 但分类A等级的药物极少。TDF为已批准上市药物且为妊娠B级药物, 已被各大指南推荐为妊娠期首选抗病毒药物[18, 19]。目前TDF已广泛用于妊娠期妇女HBV感染母婴阻断治疗[20, 21], 也有研究表明TDF可用于妊娠期妇女HIV感染母婴阻断治疗[22]。因此, TDF有望用于妊娠期妇女抗ZIKV治疗。
TDF为FDA已批准上市药物, 临床试验研究结果显示, 在健康志愿者和HIV感染患者中TDF的药代动力学相似。在空腹状态下, HIV感染患者单次口服TDF 75~600 mg后可在0.8~1.0 h内达到最大血药浓度(Cmax), Cmax为68.6~618 μg·L-1 (0.11~0.97 μmol·L-1), 而TDF以3 mg·kg-1剂量静脉注射给药后Cmax可达8.5 mg·L-1 (13.38 μmol·L-1)。TDF的药代动力学和剂量呈比例关系, 不受重复给药影响[23, 24]。虽然TDF体外抗ZIKV的EC50高于单次口服TDF 600 mg后的Cmax, 但是与TDF静脉注射给药后的Cmax接近。尽管很难从药物的体外活性推测出药物体内活性, 但本研究结果表明, TDF有用于临床治疗ZIKV感染的可能性。
TDF系替诺福韦的前药, 经口服后迅速水解为替诺福韦。替诺福韦可被细胞内的腺苷酸激酶磷酸化成为单磷酸, 然后被快速转化为活性二磷酸形式。替诺福韦二磷酸盐通过竞争性地与天然底物5'-脱氧腺苷三磷酸结合而抑制HIV-1逆转录酶和HBV聚合酶的活性, 并在与DNA整合后阻止DNA链延长从而发挥抗病毒作用[25, 26]。RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase, RdRp)是黄病毒RNA合成的关键酶, 具有高度保守性, 因此是抗黄病毒药物研发最有前景的靶点之一。研究表明, 核苷类似物可通过作用于ZIKV RdRp产生抗ZIKV作用[27, 28]。核苷类似物可经细胞内激酶磷酸化成为三磷酸盐形式后与天然底物竞争性结合RdRp的活性位点并整合进入子代病毒RNA链中, 最终终止病毒RNA的复制从而发挥抗ZIKV、DENV、HCV等黄病毒科病毒活性[27-30]。TDF也属于核苷类似物, 因此推测其作用靶点可能是ZIKV RdRp, 但尚需通过实验验证。此外, TDF体内抗ZIKV活性也需要通过动物实验或临床试验进行验证。
本研究首次发现TDF在体外具有抗ZIKV活性, 其对ZIKV的抑制作用明显优于利巴韦林, 有望成为研发抗ZIKV感染治疗药的新型先导化合物, 尤其为临床治疗ZIKV感染引起的严重疾病奠定了基础。
| [1] | Faye O, Freire CC, Iamarino A, et al. Molecular evolution of Zika virus during its emergence in the 20th century[J]. PLoS Negl Trop Dis, 2014, 8: e2636. DOI:10.1371/journal.pntd.0002636 |
| [2] | Cao-Lormeau VM, Blake A, Mons S, et al. Guillain-Barre syndrome outbreak associated with Zika virus infection in French Polynesia: a case-control study[J]. Lancet, 2016, 387: 1531–1539. DOI:10.1016/S0140-6736(16)00562-6 |
| [3] | Brasil P, Sequeira PC, Freitas AD, et al. Guillain-Barre syndrome associated with Zika virus infection[J]. Lancet, 2016, 387: 1482. DOI:10.1016/S0140-6736(16)30058-7 |
| [4] | Tang QJ, Pang W, Zheng CB. Zika virus infection and organ injury[J]. Int J Immunol (国际免疫学杂志), 2018, 41: 559–564. |
| [5] | Garcez PP, Loiola EC, Madeiro Da Costa R, et al. Zika virus impairs growth in human neurospheres and brain organoids[J]. Science, 2016, 352: 816–818. DOI:10.1126/science.aaf6116 |
| [6] | Li C, Xu D, Ye Q, et al. Zika virus disrupts neural progenitor development and leads to microcephaly in mice[J]. Cell Stem Cell, 2016, 19: 120–126. DOI:10.1016/j.stem.2016.04.017 |
| [7] | World Health Organization. Zika situation report[EB/OL]. (2017-03-10)[2018-12-18]. https://www.who.int/emergencies/zika-virus/situation-report/10-march-2017/en/. |
| [8] | Bogoch Ⅱ, Brady OJ, Kraemer MUG, et al. Potential for Zika virus introduction and transmission in resource-limited countries in Africa and the Asia-Pacific region: a modelling study[J]. Lancet Infect Dis, 2016, 16: 1237–1245. DOI:10.1016/S1473-3099(16)30270-5 |
| [9] | Zhang ST, Ni MX, Ruan QP. Enzymatic synthesis of nucleoside drugs[J]. Prog Pharma Sci (药学进展), 2005, 29: 56–62. |
| [10] | Wang RR, Yang QH, Luo RH, et al. Azvudine, a novel nucleoside reverse transcriptase inhibitor showed good drug combination features and better inhibition on drug-resistant strains than lamivudine in vitro[J]. PLoS One, 2014, 9: e105617. DOI:10.1371/journal.pone.0105617 |
| [11] | Zhang CT, Luo RH, Chen H, et al. The study of azvudine activity against dengue viruses in vitro[J]. Acta Pharm Sin (药学学报), 2018, 53: 944–949. |
| [12] | Eyer L, Nencka R, Huvarova I, et al. Nucleoside inhibitors of Zika virus[J]. J Infect Dis, 2016, 214: 707–711. DOI:10.1093/infdis/jiw226 |
| [13] | Xiang SY, Chen M, Chen H, et al. The combined anti-HIV-1 effects of chloroquine and antiretroviral drugs in vitro[J]. Acta Pharm Sin (药学学报), 2018, 53: 227–235. |
| [14] | Barrows NJ, Campos RK, Powell ST, et al. A screen of FDA-approved drugs for inhibitors of Zika virus infection[J]. Cell Host Microbe, 2016, 20: 259–270. DOI:10.1016/j.chom.2016.07.004 |
| [15] | Xu M, Lee EM, Wen Z, et al. Identification of small-molecule inhibitors of Zika virus infection and induced neural cell death via a drug repurposing screen[J]. Nat Med, 2016, 22: 1101–1107. DOI:10.1038/nm.4184 |
| [16] | Deng YQ, Zhang NN, Li CF, et al. Adenosine analog NITD008 is a potent inhibitor of Zika virus[J]. Open Forum Infect Dis, 2016, 3: ofw175. DOI:10.1093/ofid/ofw175 |
| [17] | Julander JG, Siddharthan V, Evans J, et al. Efficacy of the broad-spectrum antiviral compound BCX4430 against Zika virus in cell culture and in a mouse model[J]. Antiviral Res, 2017, 137: 14–22. DOI:10.1016/j.antiviral.2016.11.003 |
| [18] | Zou H, Chen Y, Duan Z, et al. Protective effect of hepatitis B vaccine combined with two-dose hepatitis B immunoglobulin on infants born to HBsAg-positive mothers[J]. PLoS One, 2011, 6: e26748. DOI:10.1371/journal.pone.0026748 |
| [19] | Terrault NA, Bzowej NH, Chang KM, et al. AASLD guidelines for treatment of chronic hepatitis B[J]. Hepatology, 2016, 63: 261–283. DOI:10.1002/hep.28156 |
| [20] | Pan CQ, Duan Z, Dai E, et al. Tenofovir to prevent hepatitis B transmission in mothers with high viral load[J]. N Engl J Med, 2016, 374: 2324–2334. DOI:10.1056/NEJMoa1508660 |
| [21] | Hyun MH, Lee YS, Kim JH, et al. Systematic review with meta-analysis: the efficacy and safety of tenofovir to prevent mother-to-child transmission of hepatitis B virus[J]. Aliment Pharmacol Ther, 2017, 45: 1493–1505. DOI:10.1111/apt.14068 |
| [22] | Gibb DM, Kizito H, Russell EC, et al. Pregnancy and infant outcomes among HIV-infected women taking long-term ART with and without tenofovir in the DART trial[J]. PLoS Med, 2012, 9: e1001217. DOI:10.1371/journal.pmed.1001217 |
| [23] | Barditch-Crovo P, Deeks SG, Collier A, et al. Phase Ⅰ/Ⅱ trial of the pharmacokinetics, safety, and antiretroviral activity of tenofovir disoproxil fumarate in human immunodeficiency virus-infected adults[J]. Antimicrob Agents Chemother, 2001, 45: 2733–2739. DOI:10.1128/AAC.45.10.2733-2739.2001 |
| [24] | Deeks SG, Barditch-Crovo P, Lietman PS, et al. Safety, pharmacokinetics, and antiretroviral activity of intravenous 9-[2-(R)-(phosphonomethoxy)propyl]adenine, a novel anti-human immunodeficiency virus (HIV) therapy, in HIV-infected adults[J]. Antimicrob Agents Chemother, 1998, 42: 2380–2384. DOI:10.1128/AAC.42.9.2380 |
| [25] | Delaney WE 4th, Ray AS, Yang H, et al. Intracellular metabolism and in vitro activity of tenofovir against hepatitis B virus[J]. Antimicrob Agents Chemother, 2006, 50: 2471–2477. DOI:10.1128/AAC.00138-06 |
| [26] | Kearney BP, Flaherty JF, Shah J. Tenofovir disoproxil fumarate: clinical pharmacology and pharmacokinetics[J]. Clin Pharmacokinet, 2004, 43: 595–612. DOI:10.2165/00003088-200443090-00003 |
| [27] | Xu HT, Hassounah SA, Colby-Germinario SP, et al. Purification of Zika virus RNA-dependent RNA polymerase and its use to identify small-molecule Zika inhibitors[J]. J Antimicrob Chemother, 2017, 72: 727–734. |
| [28] | Hercik K, Kozak J, Sala M, et al. Adenosine triphosphate analogs can efficiently inhibit the Zika virus RNA-dependent RNA polymerase[J]. Antiviral Res, 2017, 137: 131–133. DOI:10.1016/j.antiviral.2016.11.020 |
| [29] | Latour DR, Jekle A, Javanbakht H, et al. Biochemical characterization of the inhibition of the dengue virus RNA polymerase by beta-d-2'-ethynyl-7-deaza-adenosine triphosphate[J]. Antiviral Res, 2010, 87: 213–222. DOI:10.1016/j.antiviral.2010.05.003 |
| [30] | Deval J, Symons JA, Beigelman L. Inhibition of viral RNA polymerases by nucleoside and nucleotide analogs: therapeutic applications against positive-strand RNA viruses beyond hepatitis C virus[J]. Curr Opin Virol, 2014, 9: 1–7. DOI:10.1016/j.coviro.2014.08.004 |
 2019, Vol. 54
2019, Vol. 54


