纳米医学主要涉及具有纳米尺度的材料和技术的开发与应用, 近年来受到越来越多的关注。纳米医学的研究涉及多个领域, 包括药物输送、疫苗开发、抗菌、诊断和成像工具等[1]。随着纳米医学的不断探索和发展, 不同结构和组成的纳米材料均可能成为纳米药物载体。
纳米药物载体功能多样、种类繁多, 按材料类型可分为合成高分子材料(如聚酰胺-胺树枝状大分子、聚乙二醇、聚己内酯、聚乳酸)、天然材料(如蛋白、多糖、凝胶)及脂质体等[2]。这些纳米药物载体均可装载不同种类的造影剂或治疗剂, 为疾病的诊断和治疗提供了准确依据和手段。但事实上, 大多数纳米药物载体会因其本身的毒性、免疫原性等, 难以应用于临床[3]。因此, 一系列具有良好生物相容性的基于生物内源性大分子的“纳米笼”结构, 激起了研究人员的极大兴趣。其中, 铁蛋白纳米笼因其独特的结构和特性, 已被作为纳米药物载体广泛应用于药物递送、医学成像和疾病诊疗等领域。
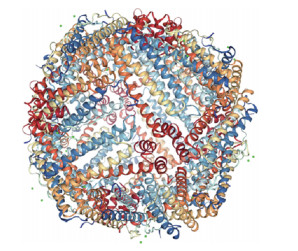
1 铁蛋白纳米笼的结构及生理功能铁蛋白纳米笼是一种在真核生物中高度保守, 且广泛存在于哺乳动物、植物、真菌和细菌中的生命活动所必需的蛋白[4]。哺乳动物铁蛋白在细胞内外均存在, 胞内铁蛋白主要分布于胞质、细胞核和线粒体中, 胞外铁蛋白则主要存在于如血清、滑膜和脑脊液等液体中[5]; 植物铁蛋白主要存在于质体中[6]。不同物种中, 铁蛋白纳米笼的笼状结构类似且序列同源性极高[7]。铁蛋白纳米笼主要负责体内铁的储存和释放, 其可将Fe2+(一种有毒的活性氧物质源)转化为Fe3+, 进而保护细胞免受Fenton反应在氧化应激过程中造成的损害[8], 其内核可储存高达4 500个铁原子[9]。天然存在的铁蛋白纳米笼由蛋白质外壳和矿物质内核组成, 其蛋白外壳的四级结构由8个亲水通道和6个疏水通道组成, 主要负责蛋白笼内外的物质交换[10], 将其矿物质内核除去, 即得去铁蛋白纳米笼(apoferritin, AFt)[4]。去铁蛋白纳米笼通常是由24个亚基自组装形成的外径为12 nm, 内径为8 nm的球形笼状结构[11], 该结构通常由重链亚基(ferritin heavy chain, FTH, 21 kDa)和轻链亚基(ferritin light chain, FTL, 19 kDa)两种亚基共同组成[12], 总分子质量约450 kDa[13]。其中, FTL仅在铁离子的矿化过程中发挥辅助作用; 而FTH含有亚铁氧化酶活性位点, 可将Fe2+氧化为Fe3+[8], 且其可与肿瘤细胞表面高度表达的转铁蛋白受体1 (transferrin receptors 1, TfR1)发生特异性识别, 实现铁蛋白纳米笼的主动靶向[14]。此外, 铁蛋白纳米笼中这两种亚基的比例根据组织类型的不同而有很大差异。例如, 对于人铁蛋白, 其中FTH在心脏中占优势, 而FTL在肝脏中占优势[15]。铁蛋白纳米笼是天然存在的, 也可借助其亚基自组装的性质经原核表达系统大批量生产制备重组铁蛋白。将全部由FTH组成的铁蛋白称为重链铁蛋白(heavy chain ferritin, HFn), 其结构如图 1[16]所示。
|
Figure 1 Crystal structure of human H chain ferritin (PDB code 2FHA)[16] |
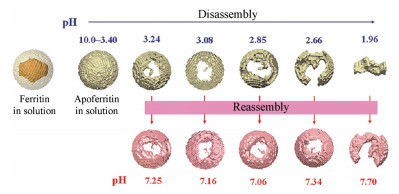
除其独特的结构外, 铁蛋白纳米笼还具有独特的理化性质。铁蛋白纳米笼不同于其他大多数蛋白, 其耐受高温(70~80 ℃)且能在低浓度变性剂如尿素或氯化胍中稳定存在[5], 且其在很宽的pH值范围内(pH 3.4~10.0)均可稳定存在。此外, 其还具有独特的自组装性质。通过改变溶液pH值可使蛋白笼亚基发生解聚与组装聚集的相互转化。在极度酸性或碱性条件下, 蛋白亚基发生解聚, 而当溶液pH值恢复到中性时, 解聚的亚基又可以重新自组装恢复成笼状结构, 如图 2[17]。这种pH值依赖的解聚/重组特性, 更利于其对药物的包载。
|
Figure 2 Overall scheme of apoferritin disassembly/reassembly under the influence of pH changes [17] |
综上, 铁蛋白纳米笼是一种广泛存在于有机体内储存铁的蛋白, 故较其他外源性纳米药物载体, 其具有较好的生物相容性及安全性; 粒径较小(约12 nm), 故易于逃脱网状内皮系统的吞噬作用, 从而可在体内实现长循环[18, 19]且可通过增强渗透与保留效应有效地富集于肿瘤组织[20]; 尤其HFn可与TfR1相互作用进而通过受体介导的内吞作用主动靶向进入肿瘤细胞[14]。此外, 其可基于耐热性质经天然来源分离纯化获得或经原核表达系统(如细菌和古细菌)大批量生产[21], 且其独特的自组装性能十分有利于载药。故铁蛋白纳米笼是一种较为理想的药物递送载体, 已广泛应用于肿瘤及其他多种疾病的诊断与治疗中。
2 铁蛋白纳米笼的表面修饰对铁蛋白纳米笼进行功能化修饰, 可实现铁蛋白纳米笼的多种用途。值得注意的是, 去铁蛋白纳米笼为球形中空结构, 故其具有3个可修饰界面, 即内表面、外边面及亚基间接触面[22]。外表面可连接具有特殊功能的配体, 如实现靶向功能; 内表面可作为纳米反应器用于纳米复合材料的合成; 亚基间接触面则可用于指导铁蛋白纳米笼的解聚与重组、合成两种不同亚基比的铁蛋白纳米笼及打破铁蛋白纳米笼的对称性结构[23]。已报道的修饰方法主要有两种:化学修饰和基因修饰[7]。
2.1 化学修饰化学修饰法可以通过与纳米笼表面的氨基酸偶联来实现。据报道, 染料分子[24]、猝灭剂分子[25]、肽[26]和抗体片段[27]均可成功化学缀合到铁蛋白纳米笼表面。
Zhen等[28]以1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺盐酸盐及N-羟基琥珀酰亚胺(N-hydroxysuccinimide, NHS)为交联剂, 将叶酸作为肿瘤靶向配体偶联到铁蛋白纳米笼表面, 并最终负载光敏剂ZnF16Pc。该纳米缀合物静脉注射进入血液后, 可聚集于肿瘤部位; 光照后可有效抑制肿瘤生长, 同时最小程度地影响正常组织, 最终达到良好的治疗效果。
Dostalova等[29]首先经由pH值改变的解聚/重组法在去铁蛋白纳米笼空腔包载多柔比星(doxorubicin, Dox), 之后在其表面修饰金纳米粒或金(Ⅲ)氯化物水合物, 为增强其靶向性, 最终通过精确的控温搅拌将抗前列腺特异性膜抗原的抗体七肽HWRGWVC缀合到该复合物表面。实验结果显示, 所构建的纳米载体具有优异的血液相容性和靶向性, 且其药效较Dox无太大差异。
2.2 基因修饰已有文献[20, 21]报道, 可通过基因融合进行修饰, 即通过铁蛋白序列的遗传修饰将基序引入铁蛋白纳米笼表面。
Fracasso等[30]构建了一种名为“FTH-MP-PAS”的结构, 该结构以FTH为基础, 以含有基质金属蛋白酶切割位点的短肽MP (metalloprotease)为linker, 连接长度为40或75个脯氨酸(P)、丙氨酸(A)和丝氨酸(S)的残基(PAS)。该结构经全基因合成组装, 克隆到表达载体pET-11a中, 导入大肠杆菌BL21 (DE3)中表达, 并最终在其空腔中载入Dox。给药后, PAS作为临时屏障, 可阻碍该载药系统与正常细胞表达的TfR1间的相互作用, 减少脱靶效应; 一旦纳米载体到达肿瘤微环境, PAS屏蔽可通过肿瘤特异性蛋白酶去除, 且未掩蔽的FTH可自由与过表达的TfR1相互作用并被细胞内化。该研究小组构建的载药系统在人胰腺癌模型中显示出极好的治疗功效, 显著增加了动物的整体存活率。
目前, 对铁蛋白纳米笼的表面修饰大多是为了增强其靶向性, 但也有研究人员致力于通过基因修饰使铁蛋白纳米笼改性。在常规的体外包封过程中, 铁蛋白必须在极端pH值条件下解聚, 且在高浓度负载分子存在的条件下重新组装。这一过程可能导致不具有pH值抵抗材料分子的包载质量较差且这一pH值跳跃的过程仅部分可逆, 进而导致重组可能不完全。基于此, de Turris等[31]设计了一种古细菌铁蛋白嵌合结构(humanized Archaeoglobus ferritin, HumAfFt), 其中将连接铁蛋白B和C螺旋外部的12个氨基酸环突变且重建一个与人H链均聚物蛋白相应区域的类似物, 并通过基因工程表达获得。实验结果表明, HumAfFt在HeLa细胞中的摄取性质优异, 是TfR1的优质配体, 且其解聚与重组均可在中性pH值条件实现。这为其对药物的包载提供了极大的便利。
3 铁蛋白纳米笼在药物递送中的应用铁蛋白纳米笼的高度稳定性、生物相容性、能以形状记忆的方式解聚和重组、易于进行表面修饰等性质使其成为一种理想的药物递送载体[21]。据报道, 目前铁蛋白纳米笼负载药物的方式主要可分为以下3种: ①物理孵育法[32]:因去铁蛋白纳米笼具有8个亲水通道和6个疏水通道(宽度约0.3~0.4 nm), 其为金属离子及其他小分子药物进入蛋白笼提供了有效途径[7], 因此可直接将去铁蛋白纳米笼与所需装载的分子进行混合孵育而完成装载; ② pH值改变的解聚/重组法[33, 34]:因去铁蛋白纳米笼的独特自组装性质, 可通过简单改变溶液的pH值实现蛋白笼解聚与重组装的相互转化。在极度酸性或碱性条件下, 蛋白亚基发生解聚, 而当溶液pH值恢复到中性时, 解聚的亚基又可以重新自组装恢复成笼状结构[17]。按具体条件改变, 又可分为酸裂解/碱聚合的pH值改变法和碱裂解/酸聚合的pH值改变法。综上, 可通过调节去铁蛋白纳米笼溶液的pH值使其解聚, 之后加入所需装载的分子, 最终调节pH值使蛋白笼重组而完成包载; ③尿素梯度法[35]:去铁蛋白纳米笼在低浓度变性剂中可稳定存在, 而在高浓度变性剂存在下变性。将蛋白笼与不同浓度尿素溶液混合, 通过使其先变性后复性的过程实现药物装载。具体来讲:首先将蛋白笼与高浓度尿素溶液混合而使其亚基解聚完全, 之后将所需装载的分子加入其中, 最终将尿素溶液浓度逐步递减, 逐渐完成蛋白笼的复性而完成药物装载。综上, 关于铁蛋白纳米笼用于药物装载的相关研究已较为成熟, 铁蛋白纳米笼作为一种性能优良的药物载体, 已被应用作为众多小分子化学药物[36, 37]及大分子核酸药物[38, 39]的载体。
3.1 铁蛋白纳米笼装载小分子化学药物目前, 大多数研究仍致力于铁蛋白纳米笼对小分子化学药物的装载, 其可避免药物在体循环过程中被快速清除, 降低药物的使用剂量, 同时能够增强细胞的摄取效果, 提高靶向性。
3.1.1 金属药物去铁蛋白纳米笼内腔中天然存在的金属结合位点, 为其稳定包封金属药物奠定了基础[21]。
Yang等[40]分别通过酸裂解/碱聚合的pH值改变法和物理孵育原位生成法两种方法, 将临床常用治疗恶性肿瘤的顺铂(cisplatin, CDDP)和卡铂(carboplatin, CBDCA)载入去铁蛋白纳米笼空腔中, 制得AFt-CDDP和AFt-CBDCA。通过电感耦合等离子体原子发射光谱法、非变性聚丙烯酰胺凝胶电泳及透射电子显微镜等手段对该结构的成功合成进行表征。采用MTT法初步测试了AFt-CDDP和AFt-CBDCA对大鼠嗜铬细胞瘤细胞系(PC12)的细胞毒性。结果表明, 经原位生成法制备的载药蛋白纳米笼对PC12细胞系具有良好的杀伤作用。
Falvo等[41]设计制备了一种新的抗体-药物偶联物。首先经基因工程表达获得重组HFn; 之后同样采用酸裂解/碱聚合的pH值改变法制得包封CDDP的HFn纳米粒(HFn-CDDP); 再利用NHS酯和具有马来酰亚胺基团的双功能交联剂共价缀合含胺的人黑色素瘤特异性抗原CSPG4的单克隆抗体(monoclonal antibody, mAb) Ep1和含巯基的HFn-CDDP; 最终制备得到了平均每个去铁蛋白纳米笼可嵌合3个mAb Ep1且包封约50个顺铂分子的HFn-CDDP-Ep1。结果表明, HFn-CDDP-Ep1纳米粒分子质量约900 kDa, 粒径约33 nm; 流式细胞术证明了所构建的纳米粒可与CSPG4+黑色素瘤细胞系特异性结合; 与仅含有顺铂的HFn-CDDP相比, HFn-CDDP-Ep1纳米粒对黑色素瘤细胞的靶向性高出25倍, 且在建模裸鼠静脉注射使用HFn-CDDP-Ep1时, 也同样观察到了对黑色素瘤的极强靶向性。
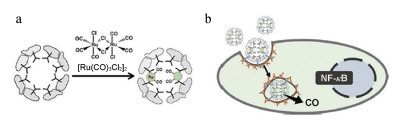
Fujita等[42]经物理孵育法制备得到了一种包封钌羰基配合物[Ru(CO)3Cl2]2的重组轻链去铁蛋白(recombinant L-chain apoferritin from horse liver, apo-rHLFr)复合物(图 3a)。[Ru(CO)3Cl2]2是一种一氧化碳(CO)释放分子(carbon monoxide releasing molecules, CORM), 其与apo-rHLFr内表面上暴露的氨基酸残基结合。该复合物通过内吞作用进入细胞后, 释放CO以激活核因子κB (nuclear factor κB, NF-κB) (图 3b), 其通过受CO调节的信号传导途径在细胞蛋白质的表达中起重要作用, 最终发挥抗炎、抗凋亡和细胞保护等作用。实验表明, 制得的复合物具有较高的摄取效率且大大增加了CO释放的半衰期, 其释放速率是典型CORM的1/18。
|
Figure 3 CO releasing protein cage for induction of intracellular signaling. a: Schematic representation of recombinant L-chain apoferritin from horse liver (apo-rHLFr) with Ru carbonyl complexes ([Ru(CO)3Cl2]2·apo-rHLFr); b: Endocytic uptake and nuclear factor κB (NF-κB)activation in HEK293/κB-Fluc cell by the CO release[42] |
Tesarova等[43]构建了一种新型Ni (Ⅱ)配位化合物, 之后将其包封到经叶酸表面修饰的AFt中。结果表明, AFt的包封可明显降低游离Ni化合物的血液毒性, 且其可通过叶酸与叶酸受体(folate receptor, FR)间的主动靶向入胞, 进而以非选择性方式与DNA相互作用而发挥显著的细胞毒性。其对FR+的乳腺癌细胞的穿梭效率显著增强, 同时脱靶效应较低。
3.1.2 非金属药物目前普遍使用的药物并非铂类等的金属药物, 铁蛋白纳米笼在对其他非金属药物的包载中也具有广泛的应用空间。
Bellini等[34]经酸裂解/碱聚合的pH值改变法将Dox包封于HFn中。共聚焦显微镜和DNA损伤测定的结果证明, 在HFn中包载Dox (HFn-Dox)增加了药物的核递送, 从而增强了Dox的药效。值得关注的是, 激光共聚焦实验结果显示, 与游离Dox相比, HFn-Dox在癌细胞中可更快更有效地内化入胞, 包封的Dox在细胞质中部分释放引起DNA损伤后, HFn-Dox整体可迅速转移到细胞核中, 即HFn-Dox充当“特洛伊木马”, 实现了自触发的易位, 该机制允许药物直接在核内释放并发挥作用, 为在核内发挥治疗作用的药物提供了新的入核途径。
Liang等[35]利用尿素梯度法将Dox载入HFn中, 制得HFn-Dox。HFn-Dox通过与肿瘤细胞表面过表达的TfR1相互作用入胞, 并在溶酶体中释放Dox。在小鼠体内, HFn-Dox显示出比游离Dox高10倍以上的瘤内药物浓度, 且在单剂量注射后可显著抑制肿瘤生长。与游离的Dox相比, HFn-Dox显示出极佳的安全性。
除了递送抗肿瘤药物外, 铁蛋白纳米笼也可作为其他多种类型药物的递送载体。Ruozi等[44]通过酸裂解/碱聚合的pH值改变法、完备的处方工艺筛选, 最终制备得到载有链霉素的去铁蛋白纳米粒, 并以期将其用于细菌耐药性感染(结核病)的治疗。Lei等[37]通过pH值改变的解聚/重组法将激活神经活动的卡巴胆碱(carbachol, Cab)和阻断神经活动的阿托品(atropine, Ato)包载于铁蛋白纳米笼中, 用来调节神经微环境以控制胰腺癌的进展。载药蛋白纳米笼(Nano-Cab NPs和Nano-Ato NPs)可经增强渗透与保留效应的被动靶向和TfR1介导的主动靶向实现对胰腺癌细胞的有效靶向进而在酸性肿瘤微环境中触发释药。结果表明, 通过Nano-Cab NPs实现神经微环境的激活可明显加快胰腺癌进展; 而通过Nano-Ato NPs阻断神经通路可显著抑制肿瘤的神经传导及减缓胰腺癌的进展。该研究以铁蛋白纳米笼为载体, 构建了一种安全有效、可用于抗肿瘤治疗的神经药物递送途径。
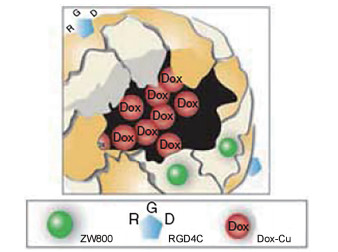
虽然有大量研究致力于铁蛋白纳米笼对非金属药物的包载, 但不可忽视的是, 不含金属的药物因与蛋白笼作用有限, 因此将其包载在铁蛋白纳米笼中是困难和复杂的。为弥补此缺陷, 研究人员采用不同途径, 主要致力于形成药物与过渡金属复合物[2, 45]。Zhen等[20]设计了一种经RGD4C (Cys-Asp-Cys-Arg-Gly-Asp-Cys- Phe-Cys)修饰的去铁蛋白纳米笼(RGD4C-modified ferritin, RFRT), 其可与整合素αvβ3识别, 且最终在其空腔中包载Dox。为方便后续实验定位追踪, 在RFRT表面标记近红外染料ZW800。该制剂制备方法简单易行, 首先将Dox与Cu(Ⅱ)形成预复合物, 最终通过与去铁蛋白纳米笼简单孵育而得到制剂(Dox-loaded RFRTs, D-RFRTs) (图 4)。实验结果表明, 在与Cu(Ⅱ)预复合后, Dox可以高效率(高达73.49 wt%)装载到RGD修饰的去铁铁蛋白纳米笼中。U87MG皮下肿瘤模型研究发现, D-RFRTs显示出比游离Dox更长的循环半衰期、更高的肿瘤摄取、更好的肿瘤生长抑制效果和更低的心脏毒性。
|
Figure 4 Schematic illustration of D-RFRTs (Dox-loaded RFRTs). Dox was precomplexed with Cu, and then encapsulated into RFRTs [20] |
目前, 化学治疗和基因治疗已成为治疗肿瘤的重要手段, 但化疗总体上仍存在缺乏特异性和选择性, 不良反应大且安全性差等缺陷[46]。因此, 基因治疗作为一种治疗肿瘤的新手段已逐渐引起人们的广泛关注[47]。近来, 已有研究人员提出将铁蛋白纳米笼作为小干扰RNA (small interfering RNA, siRNA)的递送载体[38, 39]。
Li等[38]经pH值改变法将siRNA分别包封于H亚基聚合去铁蛋白(H-去铁蛋白)及L亚基聚合去铁蛋白(L-去铁蛋白)纳米笼空腔中, 制得H-siRNA和L-siRNA。实验结果表明, 当去铁蛋白(尤其是H-去铁蛋白)包载siRNA后, 在血清中稳定, 表明去铁蛋白可有效保护siRNA在体内不受核酸酶的破坏; 且4 ℃储存1个月后检测未见泄露、也未观察到沉淀。这些表明去铁蛋白纳米笼可作为siRNA递送和储存的有力载体。基因沉默结果表明, H-siRNA可降低目的蛋白85%的表达; L-siRNA可降低目的蛋白70%的表达, 两种载药系统均具有良好的基因沉默效率。
Lee等[39]构建了一种修饰不同功能肽的、由24个人铁蛋白重链亚基组成的蛋白纳米笼用于siRNA的递送。利用基因重组技术, 在FTH上有序修饰多种功能肽的基因, 最终使得这些功能肽在蛋白笼表面暴露:阳离子肽(cationic peptide, CAP)以捕获siRNA, 肿瘤细胞靶向肽(tumor cell targeting peptide, CTP)、穿透肽(cell penetrating peptide, CPP)及酶促切割肽(enzymatically cleaved peptide, ECP)以在肿瘤细胞内释放siRNA。实验结果表明, 修饰的去铁蛋白/siRNA复合物已成功形成, 且其结构紧密、性质稳定; 暴露在蛋白表面的靶向肽, 驱使了该复合物与细胞的相互作用, 进而siRNA积累进入胞质, 最终实现有效的基因沉默。本研究再次证明了去铁蛋白纳米笼在癌症基因治疗中应用的巨大潜力。
因此, 铁蛋白纳米笼在药物载体方面有着广泛的应用, 可以作为基因药物及众多小分子化学药物等的载体, 通过修饰还可以实现靶向入胞, 应用具有普遍性和适应性。
4 铁蛋白纳米笼的其他应用铁蛋白纳米笼除在药物递送中具有良好的应用前景, 其作为磁性物质[48]、成像剂[49]和光热剂[50]等的载体也已有大量研究。
4.1 体内外成像可通过蛋白生物工程和化学修饰等手段, 在铁蛋白纳米笼中插入探针分子用于成像[51]。
核磁共振成像(magnetic resonance imaging, MRI)是一种用于诊断的非侵入性成像方法, 然而大多数诊断试剂在给药后均缺乏选择性、具有低的质子弛豫度和较高的毒性[52]。铁蛋白纳米笼可作为一种双功能工具, 在使蛋白笼靶向肿瘤的同时, 可在其内腔中载入成像探针。目前, 载有磁性物质的铁蛋白纳米粒已被开发用于肿瘤MRI成像。Fantechi等[48]设计了一种人铁蛋白纳米笼内矿化的磁性纳米粒。以HFn为基础, 通过基因工程在各亚基N端连接黑色素瘤靶向肽(MSH), 随后在表面共轭连接PEG (聚乙二醇, polyethylene glycol), 最终在其空腔中填充金属Fe或Co。该递药系统(HFn-NPs)对黑素瘤细胞具有优异的靶向性, 且HFn与PEG分子的缀合增加了其体内稳定性。对HFn-NPs的高温性质研究表明, 5% Co掺杂足以强烈地增强磁各向异性, 从而相对于未掺杂的样品具有高温效率。对B16黑色素瘤细胞系进行的体外实验表明, 用Co掺杂的HFn-NPs处理并暴露于交变磁场后, 细胞活力大大降低。免疫细胞化学分析也明确观察到凋亡晚期的迹象。
Fan等[53]通过将氧化铁纳米粒包裹在HFn空腔中而获得磁铁蛋白(magnetoferritin nanoparticles, M-HFn)纳米粒。M-HFn能够靶向TfR1并且通过氧化铁核心的过氧化物酶活性使肿瘤组织可视化。异种移植肿瘤的组织学染色实验结果表明, HFn具备一定的肿瘤结合反应性; 且在铁负载和氧化后, M-HFn纳米粒显示出强烈的过氧化物酶活性。共定位结果及免疫组化染色结果表明, 铁负载不影响HFn的肿瘤结合活性。经来自9种癌症患者的474个临床标本检查, 证实了这些纳米粒可以区分癌细胞及正常细胞, 灵敏度高达98%, 特异性高达95%。
Cao等[49]经大肠杆菌原核表达系统获得HFn, 在此基础上, 合成了两种HFn衍生物:一种用近红外发射染料Cy5.5标记的HFn纳米笼(Cy5.5-HFn, ~8分子/笼), 作为近红外荧光成像造影剂; 另一种为含有负载磁性氧化铁内核的HFn (M-HFn), 作为MRI造影剂。成像结果清楚表明, 每个HFn分子上大约可以附着8个荧光染料分子, 且M-HFn纳米粒表现出高达224 m(mol·L-1)-1·s-1的极高弛豫率(r2); 其次, 基于HFn的纳米粒可以穿过内皮、上皮和血脑屏障。综上, 基于HFn的纳米粒可用于在脑和外周器官中过表达TfR1肿瘤的特异性和超灵敏检测。
4.2 光热治疗铁蛋白纳米笼除作为药物递送载体用于疾病治疗外, 也可负载光热剂用于疾病治疗。
Wang等[54]设计了一种以铁蛋白矿化为基础, 尺寸可控, 用于临床肿瘤诊断治疗的独特光热治疗剂。实验结果显示, 合成的硫化铜纳米粒(CuS-Fn NCs)具有良好的生物相容性、明显的近红外吸收、强烈的光声对比和较高的光热转化效率。将放射性同位素64Cu引入后, 64CuS-Fn NCs因具有较高的组织内积累特性而成为了一种良好的正电子发射型计算机断层显像(positron emission computed tomography, PET)成像剂。均一的CuS-Fn NCs可同时通过光声成像/PET双模态成像实现光热治疗, 其具有长期的治疗安全性。
Huang等[50]构建了一种负载近红外染料(新菁绿, IR820)的铁蛋白纳米笼结构, 可用于光声/荧光多模态成像指导的光热疗法(photothermal therapy, PTT)。550 nm用于荧光成像, 808 nm用于光声成像和PTT, 且具有高光热转换效率。
4.3 免疫治疗铁蛋白纳米笼亚基提供了不同的耐受多肽插入区域, 因此, 可将这些区域修饰以制得能保持可重组形成球形纳米笼的表达外源成分的蛋白质。采用此方法, 取代基的数量和位置都被受控地修饰于纳米笼上。通过筛选蛋白质的插入位点, 可实现表面抗原或内外抗原的暴露。为评估这些新实体与灭活疫苗的疗效差异, 对其进行了不同的体内外研究。小鼠体内给药后, 这些在外表面暴露抗原的纳米笼增加了CD8+和CD4+ T细胞的增殖反应, 促进了其向功能化T细胞的转化[55]。
Wang等[56]开发了一系列具有不同位置和长度的工程化表位的、基于铁蛋白纳米笼的疫苗。在铁蛋白纳米笼的C、N末端和环区显示表位EV71 (肠病毒71)的具有不同长度的模型抗原。结果显示, 融合到铁蛋白环区的肽可以诱导强烈的免疫应答。该研究增加了疫苗平台的多功能性, 并为稳定构建体的生产提供了更多选择, 表明基于铁蛋白纳米笼的抗原递送纳米平台存在潜在的临床适用性。
5 结语铁蛋白纳米笼是一种生理系统中天然存在的纳米粒, 具有高度稳定性和良好的生物相容性; 其具有可复制结构, 使之合成简单; 独特的自组装性能利于其对诊疗分子的包载; 优异的靶向性可实现高效入胞; 并且, 通过化学或基因修饰等手段可实现靶向给药、蛋白改性等功能。自首次将其用作药物递送材料至今虽不足20年, 但近年来, 铁蛋白纳米笼已成为研究众多且在现代纳米医学中应用较为广泛的结构。
虽然已有大量研究采用各种策略成功实现了铁蛋白纳米笼对不同药物及诊疗剂的装载, 但目前仍存在一些尚未解决的问题:注射后, 铁蛋白纳米笼及其衍生物的体内命运; 进入细胞后, 所包载分子从铁蛋白纳米笼释放的动力学特征; 对铁蛋白纳米笼修饰后稳定性、自组装性质是否变化及是否增加其免疫原性等。这些问题严重阻碍了铁蛋白纳米笼药物递送系统向临床推进。故对相关机制和动力学性质进行完善的研究是铁蛋白纳米笼在各领域得到更为广泛应用的前提, 是今后研究的重点方向之一。相信随着这些问题的有效解决, 铁蛋白纳米笼将在药物递送及疾病诊疗等众多领域发挥更大的优势。
| [1] | Pelaz B, Alexiou CH, Alvarez-puebla RA, et al. Diverse applications of nanomedicine[J]. ACS Nano, 2017, 11: 2313–2381. DOI:10.1021/acsnano.6b06040 |
| [2] | Maham A, Tang ZW, Wu H, et al. Protein-based nanomedicine platforms for drug delivery[J]. Small, 2009, 5: 1706–1721. DOI:10.1002/smll.200801602 |
| [3] | Truffi M, Fiandra L, Sorrentino L, et al. Ferritin nanocages: a biological platform for drug delivery, imaging and theranostics in cancer[J]. Pharmacol Res, 2016, 107: 57–65. DOI:10.1016/j.phrs.2016.03.002 |
| [4] | Harrison PM, Arosio P. Ferritins: molecular properties, iron storage function and cellular regulation[J]. Biochim Biophys Acta, 1996, 1275: 161–203. DOI:10.1016/0005-2728(96)00022-9 |
| [5] | Fan KL, Gao LZ, Yan XY. Human ferritin for tumor detection and therapy[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2013, 5: 287–298. DOI:10.1002/wnan.1221 |
| [6] | Theil EC, Behera RK, Tosha T. Ferritins for chemistry and for life[J]. Coord Chem Rev, 2013, 257: 579–586. DOI:10.1016/j.ccr.2012.05.013 |
| [7] | Zhen ZP, Tang W, Todd T, et al. Ferritins as nanoplatforms for imaging and drug delivery[J]. Expert Opin Drug Deliv, 2014, 11: 1913–1922. DOI:10.1517/17425247.2014.941354 |
| [8] | Arosio P, Ingrassia R, Cavadini P. Ferritins: a family of molecules for iron storage, antioxidation and more[J]. Biochim Biophys Acta, 2009, 1790: 589–599. DOI:10.1016/j.bbagen.2008.09.004 |
| [9] | Heger Z, Skalickova S, Zitka O, et al. Apoferritin applications in nanomedicine[J]. Nanomedicine, 2014, 9: 2233–2245. DOI:10.2217/nnm.14.119 |
| [10] | Surguladze N, Patton S, Cozzi A, et al. Characterization of nuclear ferritin and mechanism of translocation[J]. Biochem J, 2005, 388: 731–740. DOI:10.1042/BJ20041853 |
| [11] | Uto K, Yamamoto K, Kishimoto N, et al. Characterization of stable, electroactive protein cage/synthetic polymer multilayer thin films prepared by layer-by-layer assembly[J]. J Nanopart Res, 2013, 15: 1516. DOI:10.1007/s11051-013-1516-6 |
| [12] | Theil EC. Ferritin: structure, gene regulation, and cellular function in animals, plants, and microorganisms[J]. Annu Rev Biochem, 1987, 56: 289–315. DOI:10.1146/annurev.bi.56.070187.001445 |
| [13] | Lee EJ, Lee NK, Kim IS. Bioengineered protein-based nanocage for drug delivery[J]. Adv Drug Deliv Rev, 2016, 106: 157–171. DOI:10.1016/j.addr.2016.03.002 |
| [14] | Li L, Fang CJ, Ryan JC, et al. Binding and uptake of H-ferritin are mediated by human transferrin receptor-1[J]. Proc Natl Acad Sci U S A, 2010, 107: 3505–3510. DOI:10.1073/pnas.0913192107 |
| [15] | Torti FM, Torti SV. Regulation of ferritin genes and protein[J]. Blood, 2002, 99: 3505–3516. DOI:10.1182/blood.V99.10.3505 |
| [16] | 2FHA: Human H chain ferritin[DB/OL]. New York: Brookhaven National Laboratory, 1997[2019-07-08]. http://www.rcsb.org/structure/2FHA. |
| [17] | Kim M, Rho Y, Jin KS, et al. pH-dependent structures of ferritin and apoferritin in solution: disassembly and reassembly[J]. Biomacromolecules, 2011, 12: 1629–1640. DOI:10.1021/bm200026v |
| [18] | Belletti D, Pederzoli F, Forni F, et al. Protein cage nanostructure as drug delivery system: magnifying glass on apoferritin[J]. Expert Opin Drug Deliv, 2017, 14: 825–840. DOI:10.1080/17425247.2017.1243528 |
| [19] | Molino NM, Wang SW. Caged protein nanoparticles for drug delivery[J]. Curr Opin Biotechnol, 2014, 28: 75–82. DOI:10.1016/j.copbio.2013.12.007 |
| [20] | Zhen ZP, Tang W, Chen HM, et al. RGD-modified apoferritin nanoparticles for efficient drug delivery to tumors[J]. ACS Nano, 2013, 7: 4830–4837. DOI:10.1021/nn305791q |
| [21] | He D, Marles-Wright J. Ferritin family proteins and their use in bionanotechnology[J]. New Biotechnol, 2015, 32: 651–657. DOI:10.1016/j.nbt.2014.12.006 |
| [22] | Uchida M, Kang S, Reichhardt C, et al. The ferritin superfamily: supramolecular templates for materials synthesis[J]. Biochim Biophys Acta, 2010, 1800: 834–845. DOI:10.1016/j.bbagen.2009.12.005 |
| [23] | Yang CY, Cao CQ, Cai Y, et al. The surface modification of ferritin and its applications[J]. Prog Chem (化学进展), 2016, 28: 91–102. |
| [24] | Lin X, Xie J, Niu G, et al. Chimeric ferritin nanocages for multiple function loading and multimodal imaging[J]. Nano Lett, 2011, 11: 814–819. DOI:10.1021/nl104141g |
| [25] | Lin X, Xie J, Zhu L, et al. Hybrid ferritin nanoparticles as activatable probes for tumor imaging[J]. Angew Chem Int Ed, 2011, 50: 1569–1572. DOI:10.1002/anie.201006757 |
| [26] | Marchesi VT, Tillack TW, Jackson RL, et al. Chemical characterization and surface orientation of the major glycoprotein of the human erythrocyte membrane[J]. Proc Natl Acad Sci U S A, 1972, 69: 1445–1449. DOI:10.1073/pnas.69.6.1445 |
| [27] | Hainfeld JF. Uranium-loaded apoferritin with antibodies attached-molecular design for uranium neutron-capture therapy[J]. Proc Natl Acad Sci U S A, 1992, 89: 11064–11068. DOI:10.1073/pnas.89.22.11064 |
| [28] | Zhen ZP, Tang W, Zhang WZ, et al. Folic acid conjugated ferritins as photosensitizer carriers for photodynamic therapy[J]. Nanoscale, 2015, 7: 10330–10333. DOI:10.1039/C5NR01833A |
| [29] | Dostalova S, Cerna T, Hynek D, et al. Site-directed conjugation of antibodies to apoferritin nanocarrier for targeted drug delivery to prostate cancer cells[J]. ACS Appl Mater Interfaces, 2016, 8: 14430–14441. DOI:10.1021/acsami.6b04286 |
| [30] | Fracasso G, Falvo E, Colotti G, et al. Selective delivery of doxorubicin by novel stimuli-sensitive nano-ferritins overcomes tumor refractoriness[J]. J Control Release, 2016, 239: 10–18. DOI:10.1016/j.jconrel.2016.08.010 |
| [31] | de Turris V, Trabuco MC, Peruzzi G, et al. Humanized archaeal ferritin as a tool for cell targeted delivery[J]. Nanoscale, 2017, 9: 647–655. DOI:10.1039/C6NR07129E |
| [32] | Luo YN, Wang X, Du D, et al. Hyaluronic acid-conjugated apoferritin nanocages for lung cancer targeted drug delivery[J]. Biomater Sci, 2015, 3: 1386–1394. DOI:10.1039/C5BM00067J |
| [33] | Pontillo N, Pane F, Messori L, et al. Cisplatin encapsulation within a ferritin nanocage: a high-resolution crystallographic study[J]. Chem Commun, 2016, 52: 4136–4139. DOI:10.1039/C5CC10365G |
| [34] | Bellini M, Mazzucchelli S, Galbiati E, et al. Protein nanocages for self-triggered nuclear delivery of DNA-targeted chemotherapeutics in cancer cells[J]. J Control Release, 2014, 196: 184–196. DOI:10.1016/j.jconrel.2014.10.002 |
| [35] | Liang MM, Fan KL, Zhou M, et al. H-ferritin-nanocaged doxorubicin nanoparticles specifically target and kill tumors with a single-dose injection[J]. Proc Natl Acad Sci U S A, 2014, 111: 14900–14905. DOI:10.1073/pnas.1407808111 |
| [36] | Ghosh S, Mohapatra S, Thomas A, et al. Apoferritin nanocage delivers combination of microtubule and nucleus targeting anticancer drugs[J]. ACS Appl Mater Interfaces, 2016, 8: 30824–30832. DOI:10.1021/acsami.6b11798 |
| [37] | Lei YF, Hamada Y, Li J, et al. Targeted tumor delivery and controlled release of neuronal drugs with ferritin nanoparticles to regulate pancreatic cancer progression[J]. J Control Release, 2016, 232: 131–142. DOI:10.1016/j.jconrel.2016.03.023 |
| [38] | Li L, Mu oz-Culla M, Carmona U, et al. Ferritin-mediated siRNA delivery and gene silencing in human tumor and primary cells[J]. Biomaterials, 2016, 98: 143–151. DOI:10.1016/j.biomaterials.2016.05.006 |
| [39] | Lee EJ, Lee SJ, Kang YS, et al. Engineered proteinticles for targeted delivery of siRNA to cancer cells[J]. Adv Funct Mater, 2015, 25: 1279–1286. DOI:10.1002/adfm.201403680 |
| [40] | Yang Z, Wang XY, Diao HJ, et al. Encapsulation of platinum anticancer drugs by apoferritin[J]. Chem Commun, 2007(33): 3453–3455. DOI:10.1039/b705326f |
| [41] | Falvo E, Tremante E, Fraioli R, et al. Antibody-drug conjugates: targeting melanoma with cisplatin encapsulated in protein-cage nanoparticles based on human ferritin[J]. Nanoscale, 2013, 5: 12278–12285. DOI:10.1039/c3nr04268e |
| [42] | Fujita K, Tanaka Y, Sho T, et al. Intracellular CO release from composite of ferritin and ruthenium carbonyl complexes[J]. J Am Chem Soc, 2014, 136: 16902–16908. DOI:10.1021/ja508938f |
| [43] | Tesarova B, Charousova M, Dostalova S, et al. Folic acid-mediated re-shuttling of ferritin receptor specificity towards a selective delivery of highly cytotoxic nickel(Ⅱ) coordination compounds[J]. Int J Biol Macromol, 2019, 126: 1099–1111. DOI:10.1016/j.ijbiomac.2018.12.128 |
| [44] | Ruozi B, Veratti P, Vandelli MA, et al. Apoferritin nanocage as streptomycin drug reservoir: technological optimization of a new drug delivery system[J]. Int J Pharm, 2017, 518: 281–288. DOI:10.1016/j.ijpharm.2016.12.038 |
| [45] | Maham A, Wu H, Wang J, et al. Apoferritin-based nanomedicine platform for drug delivery: equilibrium binding study of daunomycin with DNA[J]. J Mater Chem, 2011, 21: 8700–8708. DOI:10.1039/c0jm04321d |
| [46] | Zhang P, Xu N, Zhou L, et al. A linear polyethylenimine mediated siRNA-based therapy targeting human epidermal growth factor receptor in SPC-A1 xenograft mice[J]. Transl Resp Med, 2013, 1: 2. DOI:10.1186/2213-0802-1-2 |
| [47] | Naldini L. Gene therapy returns to centre stage[J]. Nature, 2015, 526: 351–360. DOI:10.1038/nature15818 |
| [48] | Fantechi E, Innocenti C, Zanardelli M, et al. A smart platform for hyperthermia application in cancer treatment: cobalt-doped ferrite nanoparticles mineralized in human ferritin cages[J]. ACS Nano, 2014, 8: 4705–4719. DOI:10.1021/nn500454n |
| [49] | Cao CQ, Wang XX, Cai Y, et al. Targeted in vivo imaging of microscopic tumors with ferritin- based nanoprobes across biological barriers[J]. Adv Mater, 2014, 26: 2566–2571. DOI:10.1002/adma.201304544 |
| [50] | Huang P, Rong PF, Jin A, et al. Dye-loaded ferritin nanocages for multimodal imaging and photothermal therapy[J]. Adv Mater, 2014, 26: 6401–6408. DOI:10.1002/adma.201400914 |
| [51] | Crich SG, Bussolati B, Tei L, et al. Magnetic resonance visualization of tumor angiogenesis by targeting neural cell adhesion molecules with the highly sensitive gadolinium-loaded apoferritin probe[J]. Cancer Res, 2006, 66: 9196–9201. DOI:10.1158/0008-5472.CAN-06-1728 |
| [52] | Aime S, Cabella C, Colombatto S, et al. Insights into the use of paramagnetic Gd(Ⅲ) complexes in MR-molecular imaging investigations[J]. J Magn Reson Imaging, 2002, 16: 394–406. DOI:10.1002/jmri.10180 |
| [53] | Fan KL, Cao CQ, Pan YX, et al. Magnetoferritin nanoparticles for targeting and visualizing tumour tissues[J]. Nat Nanotechnol, 2012, 7: 459–464. DOI:10.1038/nnano.2012.90 |
| [54] | Wang ZT, Huang P, Jacobson O, et al. Biomineralization-inspired synthesis of copper sulfide-ferritin nanocages as cancer theranostics[J]. ACS Nano, 2016, 10: 3453–3460. DOI:10.1021/acsnano.5b07521 |
| [55] | Kanekiyo M, Wei CJ, Yassine HM, et al. Self-assembling influenza nanoparticle vaccines elicit broadly neutralizing H1N1 antibodies[J]. Nature, 2013, 499: 102–106. DOI:10.1038/nature12202 |
| [56] | Wang ZT, Xu LF, Yu H, et al. Ferritin nanocage-based antigen delivery nanoplatforms: epitope engineering for peptide vaccine design[J]. Biomater Sci, 2019, 7: 1794–1800. DOI:10.1039/C9BM00098D |
 2019, Vol. 54
2019, Vol. 54


