纳米递药系统和传统制剂相比具有明显的优势, 纳米结构的尺寸效应颠覆性地改变了药物的体内递送方式, 在靶向治疗、缓控释给药、克服递送障碍及降低药物不良反应等方面表现出良好的应用前景[1]。纳米粒优异的生物学效应来源于纳米粒的物理化学性质, 包括形状、粒径、表面电荷、亲疏水性及内部结构等, 如纳米粒粒径可以影响巨噬细胞对颗粒的摄取行为[2], 正电荷纳米载体通过静电作用可增强与细胞的结合能力[3]。其中, 纳米粒表面亲疏水性对递药体系的体内行为影响更大。对黏膜给药而言, 黏液中含有的多种疏水性成分可以与制剂表面的疏水性基团结合, 使纳米粒表现出黏膜黏附性[4]; 疏水性的表面使纳米粒更易被机体淋巴细胞捕获, 实现在淋巴结中的富集[5]; 此外, 两亲性纳米粒表面的亲疏水性变化还能够改变颗粒与细胞膜及细胞器膜间的相互作用, 对颗粒的细胞摄取及胞内分布产生重要影响[6]。因此, 对纳米粒表面亲疏水性影响体内递送过程的基础规律的探究对于新型递药系统的开发和设计具有重大指导意义。然而, 目前调节纳米粒表面亲疏水性常采用的化学合成法极难实现对制剂表面亲疏水性的单一调控, 新接枝的嵌段材料在改变纳米粒亲疏水性的同时可能引起其他性质如电荷分布、粒径大小等发生变化, 难以准确阐明亲疏水性的作用规律[7], 而且合成过程中还存在操作复杂和难以控制的缺陷。有文献[8]报道指出使用单油酸甘油酯和壳聚糖经探头超声制备装载肝素的聚合物-脂质纳米粒, 与肝素-壳聚糖纳米粒相比颗粒表面的疏水性显著提高, 表明该递送系统在调节纳米粒表面疏水性方面具有一定潜力。
聚合物-脂质纳米粒是一种通过物理自组装方法制备, 同时包含聚合物和脂质材料的新型纳米递药系统[9]。常用的聚合物材料包括壳聚糖、聚乳酸羟基乙酸共聚物(PLGA)和Soluplus等, 常用的脂质材料包括磷脂、脂肪酸类及甘油酯类, 选择合适的聚合物及脂质材料可以结合聚合物纳米粒和脂质纳米粒各自的优势[10]。Soluplus是由聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇三嵌段共聚物组成的非离子型表面活性剂, 临界胶束浓度为7.6×10-3 mg·mL-1, 具有良好的抑晶和增溶效果[11]。对脂质材料而言, 碳链在12~22之间的单甘油酯常用于对大分子材料进行疏水性修饰[12]。
帕比司他(panobinostat, PNB)是一种组蛋白脱乙酰基酶抑制剂, 能够治疗多发性骨髓瘤、白血病及艾滋病等多种免疫系统疾病。作为一种BCSⅡ类药物, PNB溶解度仅为8.34×10-4 mg·mL-1, 但溶解度具有pH值依赖性, 在酸性条件(pH < 2.0)下具有较高溶解度, 随pH值升高溶解度迅速下降。
本研究以PNB为模型药物, Soluplus为聚合物载体制备载药胶束, 以不同种类的单甘油酯, 即单油酸甘油酯(glycerly monooleate, GMO)、亚油酸甘油酯(glycerly linoleate, GML)和亚麻酸甘油酯(glycerly linolenate, GMLO)对单一Soluplus载药胶束进行疏水性修饰得到聚合物-脂质纳米粒, 考察了甘油酯种类和用量对载药胶束基本性质的影响, 探究采用自组装法制备表面疏水性可调控型聚合物-脂质载药纳米粒的可行性。
材料与方法材料 PNB (批号: J0510A, 大连美仑生物技术有限公司); Soluplus (德国巴斯夫公司); GMO、GML、GMLO (丹东科海食品科技有限公司); 乙腈为色谱纯, 其他试剂为分析纯。
主要仪器 1100高效液相色谱仪(安捷伦科技有限公司); Nano ZS90型激光粒度仪(英国Malvern公司)。
载药聚合物-脂质纳米粒的制备 精密称取PNB 10 mg和Soluplus 100 mg, 用0.1 mol·L-1 HCl溶液6 mL溶解, 0.1 mol·L-1 NaOH溶液调节pH值至6.0, 记录溶液体积; 精密称取一定量脂质材料, 用乙醇溶解, 得到不同质量浓度(100~300 mg·mL-1)的脂质乙醇溶液; 吸取10 μL加至上述溶液中, 搅拌至乙醇挥干, 过0.8 μm滤膜除去游离药物。单一Soluplus载药胶束的制备过程中不加脂质。
载药聚合物-脂质纳米粒粒径及电位的测定 取样品溶液1 mL, 使用马尔文纳米粒度仪Nano ZS90以动态光散射法测定粒子粒径分布和zeta电位, 测定温度均为25 ℃。
载药聚合物-脂质纳米粒包封率和载药量的测定 采用高效液相色谱(HPLC)法测定PNB浓度, 色谱条件: C18色谱柱(Purospher® STAR, 5 μm), 流动相为0.2% H3PO3溶液-乙腈(77:23, v/v), 流速1.0 mL·min-1, 进样量10 μL, 检测波长283 nm, 柱温25 ℃。在5.05~80.8 μg·mL-1内具有良好线性(A = 44.664 C - 18.752, r = 1, n = 5), 低、中、高(5.05、50.5、80.8 μg·mL-1) 3种质量浓度的日内精密度RSD小于2.0%, 方法回收率在98%~102%, 均符合体外分析方法学要求。精密吸取样品溶液200 μL, 用甲醇稀释20倍, 涡旋10 min后高速离心(10 000 r·min-1, 3 min), 取上清液按上述HPLC法测定药物浓度, 按公式(1)和(2)分别计算包封率(entrapment efficiency, EE)和载药量(drug loading, DL):
| $ {\rm{EE = }}\frac{{{W_1}}}{{{W_2}}} \times 100\% $ | (1) |
| $ {\rm{DL = }}\frac{{{W_1}}}{{{W_1} + W}} \times 100\% $ | (2) |
其中, W1、W2、W分别表示样品溶液中PNB质量、加入PNB总质量及载体材料质量。
载药聚合物-脂质纳米粒表面疏水性评价 采用玫瑰红结合法[13]考察纳米粒表面疏水性, 吸取不同体积(0.1~0.6 mL)样品溶液与对应两倍体积的0.3 mg·mL-1玫瑰红溶液于室温下孵育2 h, 高速离心(14 000 r·min-1, 30 min)后取上清液, 用紫外可见光分光光度计(λmax = 548 nm)检测上清液中玫瑰红含量, 与纳米粒结合的玫瑰红含量等于总量减去上清液的含量, 采用Scatchard-plot公式(3)计算结合常数:
| $ \mathit{r}/\mathit{a} = \mathit{KN} - \mathit{Kr} $ | (3) |
其中, r为与纳米粒结合的玫瑰红浓度, a为平衡时玫瑰红浓度, K为结合常数, N为最大玫瑰红结合量。
载药聚合物-脂质纳米粒黏附性考察 采用黏附素法[14]评价纳米粒的黏附性, 配制含1%黏附素Ⅱ粗品的10 mmol·L-1 Tris缓冲液(pH 6.8), 室温下搅拌10 h后于37 ℃水浴中孵化过夜得到黏附素分散液, 对分散液探头超声10 min (200 W, 超声3 s, 停3 s), 制备粒径范围为200 ± 20 nm的亚粒子, 低速离心(4 000 r·min-1, 20 min)后取上清液备用。取样品溶液0.6 mL与亚粒子溶液1 mL, 于37 ℃孵育2 h, 测定孵育后混合物粒径。与亚粒子相比, 混合物粒径增幅越大, 表明纳米粒的黏膜黏附性越强。
载药聚合物-脂质纳米粒形态学研究 将样品溶液稀释100倍后吸取10 μL滴至镀碳支持膜铜网上, 挥干后用醋酸双氧铀染液染色90 s, 干燥3 h后用透射电镜观察纳米粒形态。
载药聚合物-脂质纳米粒的体外释放实验 取样品溶液2 mL, 分别置于2.0 kDa孔径的透析袋中, 两端扎紧后放入100 mL离心管中, 加入pH 6.8磷酸盐缓冲液(含1% Tween 80) 50 mL作为释放介质。将离心管置于恒温气浴振荡器中, 37 ℃、80 r·min-1振荡释放。分别于0.167、0.333、0.5、1、2、4和8 h各吸取1 mL透析外液并及时补充等体积新鲜释放介质。用HPLC法测定释放液中药物浓度, 绘制累积释放曲线(采用f2因子法比较不同体系间释放行为的相似性)。
统计学分析 采用Excel (Microsoft office 2010)进行统计学分析, 计量数据用均值±标准差表示, 组间均数差异采用单因素方差分析进行检验, 显著水平为P < 0.05。
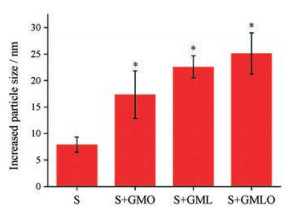
结果与讨论 1 单甘油酯种类的影响固定载药量为10%, 依据PNB溶解度具有pH值依赖性的特点, 采用pH值调节法制备了单一Soluplus载药胶束(粒径为77.97 ± 0.78 nm, zeta电位为0.44 ± 0.29 mV, 包封率为99.45% ± 1.47%)。固定甘油酯用量为Soluplus的1%, 考察了单甘油酯种类对载药胶束理化性质的影响, 采用玫瑰红法研究了单甘油酯种类对载药胶束表面亲疏水性的影响(表 1)。采用黏附素法考察了单甘油酯种类对黏附性的影响(图 1)。玫瑰红是一种疏水性染料, 可以与纳米粒表面的疏水性基团发生疏水性作用结合到纳米粒表面, K值越大说明结合越紧密, 即粒子表面疏水性越强[15]。黏附素是从猪胃黏液中提纯得到的非均质多糖蛋白, 含有多种疏水性组分, 可与其他疏水材料相互结合, 材料疏水性越强结合力也越强, 黏附素亚粒子与具有疏水性表面的纳米粒孵育后发生疏水性聚集引起混合粒子粒径增长, 增幅越大说明纳米粒疏水性越强。
| Table 1 Effect of lipid type on the characteristics and surface hydrophobicity of panobinostat-Soluplus micelles. PDI: Polydispersity index; EE: Entrapment efficiency; DL: Drug loading; K: Rose Bengal binding constant value; S: Soluplus; GMO: Glycerly monooleate; GML: Glycerly linolenate; GMLO: Glycerly linolenate. n = 3, x ± s. *P < 0.05 vs S |
|
Figure 1 The increased particle size of mucin particles upon mixing with panobinostat-Soluplus micelles modified by different monoglycerides. n = 3, x ± s. *P < 0.05 vs S |
与单一Soluplus载药胶束相比, 经GMO改性得到的聚合物-脂质纳米粒的表面疏水性显著增强(P < 0.05), 粒径略有增大(P < 0.05), zeta电位和包封率无明显改变; 经GML改性后疏水性显著增强(P < 0.05), 粒径略有增大(P < 0.05), zeta电位无明显改变, 包封率下降(P < 0.05);经GMLO改性后疏水性显著增强(P < 0.05), 粒径、zeta电位及包封率均无明显改变。不同种类单甘油酯对应的K值无统计学差异(P > 0.05), 说明甘油酯种类对聚合物-脂质纳米粒表面疏水性影响不大。
与黏附素亚粒子共同孵育后, 与单一Soluplus载药胶束相比, 经单甘油酯改性后得到的聚合物-脂质纳米粒的粒径显著增加(P < 0.05), 说明此时纳米粒表面疏水性显著增强; 不同种类甘油酯改性后纳米粒的粒径增幅没有统计学差异(P > 0.05), 说明单甘油酯种类对纳米粒表面疏水性影响不大, 该结果与玫瑰红法一致。
经GMLO表面改性后得到的聚合物-脂质纳米粒与单一Soluplus载药胶束相比, 其粒径、zeta电位及包封率无显著改变, 同时纳米粒表面疏水性显著增强。因此, 固定甘油酯种类为GMLO, 考察GMLO用量对载药胶束性质的影响。
2 GMLO用量的影响在上述研究基础上, 考察了GMLO用量分别为Soluplus的1%、2%和3%对单一Soluplus载药胶束理化性质的影响(表 2)。结果显示, 在所考查察的范围内, 随着GMLO用量增大, 纳米粒的理化性质均无明显改变。
| Table 2 Effect of the mass ratio of GMLO to Soluplus on the characteristics of panobinostat-loaded polymer-lipid hybrid nanoparticles. n = 3, x ± s |
采用玫瑰红法考察了GMLO用量对载药胶束表面疏水性的影响(图 2), 结果显示, 随着GMLO用量增大, 聚合物-脂质纳米粒表面疏水性不断增强。纳米粒K值随GMLO占Soluplus用量百分比(m)增大呈近线性增长趋势(K = 5.936 4 m + 0.000 4, r = 0.984)。

|
Figure 2 Effect of the mass ratio of GMLO to Soluplus on the K value of panobinostat-loaded polymer-lipid hybrid nanoparticles. n = 3, x ± s |
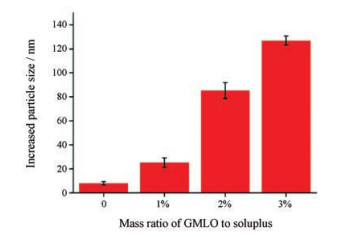
采用黏附素法考察了GMLO用量对载药胶束黏附性的影响(图 3), 结果显示, 与黏附素亚粒子共同孵育后, 随着GMLO用量增加, 混合物粒径增幅不断增大, 说明随GMLO用量增加, 聚合物-脂质纳米粒的表面疏水性增强。粒径增幅(I)随GMLO占Soluplus用量m增大呈近线性增长(I = 5 091.7 m - 22.7, r = 0.995), 该结果与玫瑰红法一致。出现此现象的原因是加入的GMLO部分分布在聚合物外层, 部分进入聚合物内核。分布在外层的GMLO形成脂质外壳, 引起纳米粒表面疏水性增强, 同时分布在外层和进入内核的脂质比接近恒定常数, 表现为纳米粒表面疏水性与GMLO用量呈近线性相关。
|
Figure 3 Effect of the mass ratio of GMLO to Soluplus on the increased size of mucin particles upon mixing with panobinostat-loaded polymer-lipid hybrid nanoparticles. n = 3, x ± s |
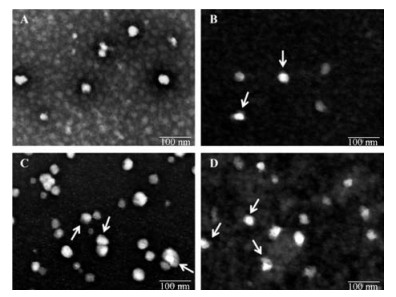
采用透射电镜观察了载药聚合物-脂质纳米粒形貌, 验证了经GMLO改性后纳米粒的核-壳结构, 不同GMLO用量改性的载药聚合物-脂质纳米粒形貌(图 4)。不同纳米粒的粒径相似, 与马尔文测量结果相符。与单一Soluplus载药胶束的球形结构相比, 加入GMLO改性得到的聚合物-脂质纳米粒形状变为类球形, 同时出现清晰的核-壳结构。证实了经GMLO改性后体系由单一Soluplus载药胶束变为聚合物材料构成载药内核、脂质材料构成外壳的聚合物-脂质纳米粒结构, 增大GMLO用量引起外壳中脂质增多, 表现为纳米粒疏水性增强(结构示意图见图 5)。
|
Figure 4 Transmission electron microscope (TEM) image of panobinostat-Soluplus micelles (A), panobinostat-Soluplus micelles modified by GMLO 1% (B), 2% (C), 3% (D). The lipid shell was indicated by arrows (scare bar = 100 nm) |

|
Figure 5 Illustration structure of panobinostat (PNB)-loaded polymer-lipid hybrid nanoparticles |
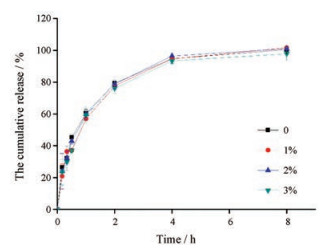
GMLO的加入对Soluplus载药胶束进行表面疏水性修饰的同时, 是否会对药物释放产生影响?因此, 进一步考察了GMLO用量对载药胶束体外释放行为的影响。药物累积释放曲线见图 6, f2因子法计算结果表明, 不同GMLO用量的给药体系的释放行为均高度相似。单一Soluplus载药胶束与经GMLO (用量为Soluplus的1%、2%、3%)改性后得到的载药聚合物-脂质纳米粒f2相似因子分别为65.47、90.96和71.03;用量为1%与2%和3%的f2相似因子分别为69.38和74.33;用量为2%与3%的f2相似因子为77.22。所有f2相似因子均大于50, 说明在考察范围内GMLO用量对药物的释放行为无影响。
|
Figure 6 Effect of the mass ratio of GMLO to Soluplus on the cumulative release of panobinostat from drug-loaded nanoparticles in 1% Tween 80 PBS (pH 6.8). PBS: Phosphate buffer saline. n = 3, x ± s |
本研究采用自组装法成功制备了基于Soluplus和GMLO的表面疏水性可调控型载药聚合物-脂质纳米粒, 通过改变GMLO用量即可实现对纳米粒表面疏水性的单一调控。与化学合成法相比, 本研究所用方法操作更加简便, 制备的纳米粒表面亲疏水性易于控制, 而且不会引起载药体系粒径、zeta电位、包封率及体外释放行为的明显改变, 可用于纳米粒表面亲疏水性对递药系统体内的递送过程影响的基础规律探究。
| [1] | Wu L, Zhang J, Watanabe W. Physical and chemical stability of drug nanoparticles[J]. Adv Drug Deliv Rev, 2011, 63: 456–469. DOI:10.1016/j.addr.2011.02.001 |
| [2] | Fang C, Shi B, Hong MH, et al. Influence of particle size and MePEG molecular weight on in vitro macrophage uptake and in vivo long circulating of stealth nanoparticles in rats[J]. Acta Pharm Sin (药学学报), 2006, 41: 305–312. |
| [3] | Semple SC, Akin A, Chen JX, et al. Rational design of cationic lipids for siRNA delivery[J]. Nat Biotechnol, 2010, 28: 172–176. DOI:10.1038/nbt.1602 |
| [4] | Sonia TA, Rekha MR, Sharma CP. Bioadhesive hydrophobic chitosan microparticles for oral delivery of insulin:in vitro characterization and in vivo uptake studies[J]. J Appl Polym Sci, 2010, 119: 2902–2910. |
| [5] | Nishioka Y, Yoshino H. Lymphatic targeting with nanoparticulate system[J]. Adv Drug Deliv Rev, 2001, 47: 55–64. DOI:10.1016/S0169-409X(00)00121-6 |
| [6] | Cong HS. Structure Modification and Gene Delivery Efficiency of Amphiphilic Polymer Nanoparticles Based on Poly(2-dimethylaminoethyl methacrylate) (基于聚甲基丙烯酸二甲氨基乙酯的两亲性聚合物纳米粒的结构修饰与基因递送功效的研究)[D]. Tianjin: Tianjin University, 2015. |
| [7] | Mistry A, Stolnik S, Illum L. Nose-to-brain delivery:investigation of the transport of nanoparticles with different surface characteristics and sizes in excised porcine olfactory epithelium[J]. Mol Pharm, 2015, 12: 2755–2766. DOI:10.1021/acs.molpharmaceut.5b00088 |
| [8] | Dong W, Wang X, Liu C, et al. Chitosan based polymer-lipid hybrid nanoparticles for oral delivery of enoxaparin[J]. Int J Pharm, 2018, 547: 499–505. DOI:10.1016/j.ijpharm.2018.05.076 |
| [9] | Raemdonck K, Braeckmans K, Demeester J, et al. Merging the best of both worlds:hybrid lipid-enveloped matrix nanocomposites in drug delivery[J]. Chem Soc Rev, 2014, 45: 444–472. |
| [10] | Date T, Nimbalkar V, Kamat J, et al. Lipid-polymer hybrid nanocarriers for delivering cancer therapeutics[J]. J Control Release, 2018, 271: 60–73. DOI:10.1016/j.jconrel.2017.12.016 |
| [11] | Alam MA, Ali R, Al-Jenoobi FI, et al. Solid dispersions:a strategy for poorly aqueous soluble drugs and technology updates[J]. Expert Opin Drug Deliv, 2012, 9: 1419–1440. DOI:10.1517/17425247.2012.732064 |
| [12] | Tian Y, Shi C, Zhang X, et al. Nanomicelle based peroral delivery system for enhanced absorption and sustained release of 10-hydrocamptothecin[J]. J Biomed Nanotechnol, 2015, 11: 262–273. DOI:10.1166/jbn.2015.1909 |
| [13] | Liu C, Kou Y, Zhang X, et al. Enhanced oral insulin delivery via surface hydrophilic modification of chitosan copolymer based self-assembly polyelectrolyte nanocomplex[J]. Int J Pharm, 2018, 554: 36–47. |
| [14] | Wang L, Li L, Sun Y, et al. Exploration of hydrophobic modification degree of chitosan-based nanocomplexes on the oral delivery of enoxaparin[J]. Eur J Pharm Sci, 2013, 50: 263–271. DOI:10.1016/j.ejps.2013.07.009 |
| [15] | Doktorovova S, Shegokar R, Martins-Lopes P, et al. Modified Rose Bengal assay for surface hydrophobicity evaluation of cationic solid lipid nanoparticles (cSLN)[J]. Eur J Pharm Sci, 2012, 45: 606–612. DOI:10.1016/j.ejps.2011.12.016 |
 2019, Vol. 54
2019, Vol. 54


