2. 山西大学化学化工学院, 山西 太原 030006;
3. 山西广誉远国药有限公司, 山西 太谷 030800
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Shanxi Guangyuyuan Traditional Chinese Medicine Co., Ltd., Taigu 030800, China
龟龄集(Guilingji, GLJ)是国家中药保密品种, 是中华民族养生瑰宝。龟龄集方药组成源于道家, 凝集数千年中医药文化智慧之精髓。全方由28味药组成, 涵盖植物药、动物药和矿物药, 具有强身补脑、固肾补气、增进食欲之功效[1]。有关龟龄集疗效的文献, 以临床男科疾病为主流, 如肾阳虚证、勃起功能障碍、肾病综合征等[2], 有关其药理作用的报道较少, 影响了龟龄集的开发利用。因此, 本文对龟龄集改善大鼠肾阳虚证的作用展开研究。
肾阳虚证是问诊中常见证型, 是诸多疾病的基本证型, 患者的症状主要包括面色发白、四肢冰冷、精神萎靡、遗精尿频、四肢浮肿、胸闷气短、痰多心悸、虚弱无力等, 该临床表现及其病理机制与多种代谢途径紊乱密切相关并会催发各类疾病, 为诸多病症的根源所在[3]。大鼠注射大剂量外源性糖皮质激素(如氢化可的松)是一种模拟肾阳虚证的经典方法, 被广泛用于评价补肾益阳中药及其制剂的疗效及作用机制[4, 5]。代谢组学作为系统生物学的重要分支, 以其整体、全局、动态的特点使其在研究内源性小分子代谢物改变规律上具有独特优势, 为同样强调整体调节的中药复方的作用机制研究提供了有效的方法[6, 7]。LC-MS以其分析速度快、分辨率高、灵敏度高等优点成为代谢组学研究的有效手段[8]。本研究结合传统药效学和基于LC-MS的代谢组学, 阐释龟龄集对大鼠肾阳虚证的改善作用和发挥药效的代谢调控通路。
材料与方法仪器及试剂 Dionex UltiMate 3000超高效液相色谱及四级杆-静电场轨道阱高分辨质谱联用仪、Xcalibur工作站(美国Thermo Fisher Scientific公司); 电子分析天平BS210S (南京莱步科技实业有限公司); 大鼠旷场测试箱(100 cm×100 cm×40 cm), 黑色, 25格, 实验室自制; Infinite M200 Pro多功能酶标仪(瑞士Tecan公司); SC-3160低速离心机(安徽中科中佳科学仪器有限公司); Legend Micro 17R高速低温离心机(美国赛默飞公司); 皮质酮(corticosterone, CORT)酶联免疫试剂盒(批号: BS6R181120748A)、睾酮(testosterone, T)酶联免疫试剂盒(批号: BS6R181020653A)、甲状腺素(thyroxine 4, T4)酶联免疫试剂盒(批号: BS6R181120784A) (Bio-Swamp公司); 氢化可的松注射液(天津金耀药业有限公司, 批号: 1801151); 0.9%氯化钠注射液(石家庄四药有限公司, 批号: 1805163202); LC-MS级乙腈、HPLC级甲酸(美国Thermo Fisher Scientific公司)。
药物 龟龄集(山西广誉远国药有限公司, 规格:每粒0.3 g, 批号: 103170714);金匮肾气丸(北京同仁堂科技发展股份有限公司制药厂, 批号: 17032072)。
动物 成年雄性SPF级SD大鼠(200 ± 20 g)购于北京维通利华实验动物技术有限公司, 许可证号: SCXK (京) 2016-0006。实验期间动物保持自由饮水和进食, 饲养环境温度为(24 ± 1) ℃, 湿度为(50 ± 5) %, 12 h明暗交替光照, 实验前适应性饲养1周。动物实验获得山西大学论理委员会的批准。
分组、造模及给药 将36只大鼠随机分为6组(n = 6), 即正常对照组(CON)、模型组(MOD)、龟龄集低、中、高剂量(37.5、75、150 mg·kg-1)组, 金匮肾气丸组(1.2 g·kg-1)。除正常对照组外, 其他组每日腹腔注射氢化可的松, 剂量为10 mg·kg-1; 正常对照组注射等体积生理盐水, 连续20天[5, 9]。各给药组灌胃给予相应药物, 对照组和模型组给予等剂量空白溶剂, 10 mL·kg-1, 连续30天。实验第31天按每只大鼠的体质量, 用10%水合氯醛(5 mL·kg-1)腹腔注射麻醉大鼠后腹主动脉取血, 放置30 min后, 3 500 r·min-1离心20 min, 取上清液, 分装, -80 ℃保存。
药效学评价外观和体重实验 每天观察动物脱毛、竖毛、拱背蜷缩程度、精神状态等体征, 每3天和第20天称一次大鼠体质量。
旷场实验 在实验第30天将大鼠平托放于旷场实验行为测试箱中央格, 适应1 min后, 记录大鼠4 min内穿越格子的数量和直立次数。
生化实验 按照试剂盒说明操作检测大鼠血清中CORT、T4、T的水平。
LC-MS代谢组学数据采集血清LC-MS样本的制备 从-80 ℃冰箱取出血清样本, 于4 ℃下解冻, 分别取出血清100 μL置于2 mL EP管, 加入0.1%甲酸乙腈200 μL, 涡旋2 min, 在4 ℃下以13 000 r·min -1离心15 min, 取上清液待进样分析。另各取上述6组血清样本10 μL, 混合, 按样品备样方法制备, 作QC样本。
LC-MS分析液相条件 流动相: A (水, 含0.1%甲酸), B (乙腈, 含0.1%甲酸); 流动相梯度: 0~2 min, 2% B; 2~3 min, 2%~35% B; 3~17 min, 35%~70% B; 17~18 min, 70% B; 18~29 min, 70%~98% B; 29~31 min, 98% B; 31~33 min, 98%~2% B; 33~35 min, 2% B。0.2 mL·min -1流速, 5 μL进样量, 40 ℃柱温, Waters Acquity UPLC HSS T3色谱柱(2.1 mm×100 mm, 1.7 μm)。
LC-MS分析质谱条件 采用ESI电喷雾离子化方式; 以正负离子切换采集模式, 扫描模式: Full Scan/dd-MS2, m/z采集范围为100~1 500。喷雾电压正极为3.5 kV; 负极为2.5 kV。毛细管温度为320 ℃; 加热器温度300 ℃; 鞘气流速: 35 arb, 辅助气流速: 10 arb; 分辨率设定为MS Full Scan 35000 FWHM以及MS/MS 17500 FWHM, NCE设定为12.5、25和37.5 eV。
LC-MS数据处理 将采集所得的LC-MS/MS数据原始文件导入Compound Discoverer 3.0软件(Thermo Fisher公司, 美国), 以获取匹配和对齐的峰值数据, 设置参数如下:质量范围100~1 500, 质量偏差5×10-6; 保留时间偏差0.05 min; 信噪比阈值3。将峰面积归一化后的数据导入SIMCA-P 13.0 (Umetrics公司, 瑞典)进行偏最小二乘判别分析(PLS-DA)和正交偏最小二乘判别分析(OPLS-DA)。结合S-plot图中的VIP > 1和独立样本t检验的P < 0.05筛选贡献最大的差异性变量。通过HMDB数据库并结合二级碎片离子对差异性变量进行鉴定指认, 通过Metabo Analyst 3.0进行通路富集分析并利用KEGG在线数据库以及相关文献报道对差异代谢物所涉及的相关代谢通路进行分析。
结果 1 药效学评价 1.1 外观和体重实验对照组大鼠活动正常, 体质量正常增加(图 1A); 模型组大鼠体质量增长缓慢, 体毛竖起、稀疏、无光泽, 精神萎顿, 躬背蜷缩现象严重, 表明肾阳虚模型复制成功; 与肾阳虚模型组比较, 给药组有不同程度的改善。第20天(图 1B), 与对照组相比, 模型组和给药组体质量显著低于对照组(P < 0.01), 与模型组相比, 给药组体质量明显高于模型组(P < 0.01)。第30天(图 1C), 与对照组相比, 模型组体质量显著低于对照组(P < 0.01), 龟龄集高剂量组、金匮肾气丸组与对照组无显著性差异, 与模型组相比, 龟龄集低、高剂量组、金匮肾气组体质量明显高于模型组(P < 0.05), 龟龄集中剂量组体质量高于模型组但无统计学差异。表明龟龄集对肾阳虚大鼠的生长迟缓有一定的改善作用, 且高剂量组效果较优。
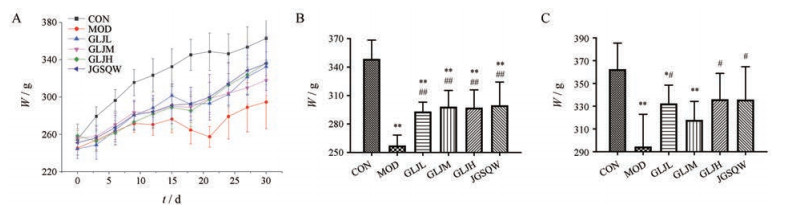
|
Figure 1 The data of rats' weight of control (CON), model (MOD), low-dose Guilingji (GLJL), medium-dose Guilingji (GLJM), high-dose Guilingji (GLJH), Jinkui Shenqi Wan (JGSQW). The trend of rats' weight in 30 days (A); weight of rats on 20 day (B); weight of rats on 30 day (C). x±s, n = 6. *P < 0.05, **P < 0.01 vs CON; #P < 0.05, ##P < 0.01 vs MOD |
与对照组相比, 模型组大鼠穿越格数显著减少(P < 0.01)、直立次数显著减少(P < 0.05), 表明氢化可的松造模引起大鼠活动、探索能力下降, 精神萎靡。与模型组相比, 各给药组改善模型大鼠穿越格数的作用明显(P < 0.05), 提示给予药物干预后, 肾阳虚大鼠的运动能力有所回调; 在增加直立次数方面, 给药组具此作用但无统计学差异(图 2)。
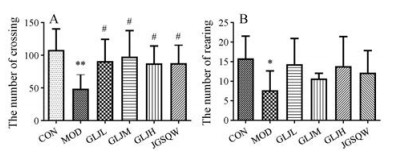
|
Figure 2 The numbers of crossing (A) and rearing (B) of CON, MOD, GLJL, GLJM, GLJH, JGSQW in open field test. x±s, n = 6. *P < 0.05, **P < 0.01 vs CON; #P < 0.05 vs MOD |
与对照组相比, 模型组大鼠血清中CORT、T4、T水平显著降低(P < 0.05);与模型组相比, 金匮肾气丸组和龟龄集低剂量组血清CORT (P < 0.01)、T (P < 0.05)的水平显著升高, T4水平升高但无统计学差异; 龟龄集中剂量组血清T4 (P < 0.01)水平显著升高, 血清CORT、T水平升高但无统计学差异; 龟龄集高剂量组血清CORT (P < 0.01)、T (P < 0.01)、T4 (P < 0.01)的含量显著回升(图 3)。提示龟龄集可改善肾阳虚大鼠体内激素水平。
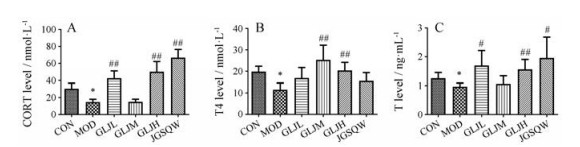
|
Figure 3 Contents of corticosterone (CORT, A), thyroxine4 (T4, B) and testosterone (T, C) of CON, MOD, GLJL, GLJM, GLJH, JGSQW. x±s, n = 6. *P < 0.05 vs CON; #P < 0.05, ##P < 0.01 vs MOD |
在批量样本进样分析过程中, 每随机进6针样品进一针QC, 以监测LC-MS稳定性。用PCA对QC样本进行了聚类分析并对6针QC样品分别提取10个离子, 分别计算10个离子的保留时间(tR)和质荷比(m/z)的RSD值, 用来监督LC-MS系统的稳定性。结果显示, QC样品聚集在一起, 10个提取离子tR的RSD为0.06%~1.26%, m/z的RSD为1.45×10-7~8.57×10-7, 相对峰面积的RSD为3.61~13.81 (表 1), 结果表明本研究所建立的分析方法的重复性和稳定性符合大批量血清样本代谢组学的分析要求。
| Table 1 The stability of UHPLC-MS method using QC samples |
采用UHPLC-Q Exactive Orbitrap MS方法分别对各组大鼠血清样品进行数据采集, 得到内源性代谢物轮廓。
2.3 统计分析为了获取更加理想的组间分离及增强对分类贡献大的变量的识别[10], 采用PLS-DA对各组样本数据进行主成分分析。PLS-DA得分图显示模型组和对照组明显分开, 表明肾阳虚疾病对机体血清内源性代谢轮廓产生了影响。给药组也均与模型组明显分开。其中, 龟龄集低剂量组与模型组分离较明显, 且更趋于对照组, 表明龟龄集对肾阳虚模型大鼠血清代谢轮廓具有一定的调控作用, 且低剂量作用稍强。模型参数R2X、R2Y、Q2表示数据对模型的解释能力。模型、对照和龟龄集低剂量组PLS-DA模型的R2X=0.649, R2Y=0.742, Q2=0.455 (图 4A); 模型、对照和龟龄集中剂量组PLS-DA模型的R2X=0.69, R2Y=0.92, Q2=749 (图 4C); 模型、对照和龟龄集高剂量组PLS-DA模型的R2X=0.369, R2Y=0.829, Q2=0.466 (图 4E), 模型、对照和金匮肾气丸组PLS-DA模型的R2X=0.718, R2Y=0.991, Q2=0.842 (图 4G), 以上模型参数表明PLS-DA模型能够准确地描述数据。为了验证模型可靠性, 对以上模型数据进行200次随机排列实验, 结果表明, R2与Q2参数接近, 模型斜率稍大且与纵轴截距为负值(图 4B、4D、4F、4H), 表明模型未产生过分拟合, 而是反映了所产生的代谢变化, 表明模型可靠。对模型组和空白组数据进行OPLS-DA分析, 以筛选出与肾阳虚证相关的差异变量。OPLS-DA得分显示模型组和对照组显著分离(图 4I), 表明肾阳虚机体血清代谢轮廓发生显著改变, 并结合S-plot图(图 4J)中的VIP > 1和独立样本t检验的P < 0.05筛选贡献最大的差异性变量。

|
Figure 4 PCA scores plots, PLS-DA scores plots of rat serum from CON, MOD and GLJL (A), permutation test form PLS-DA (B); PLS-DA scores plots (C) of rat serum from CON, MOD and GLJM (C), permutation test form PLS-DA (D); PLS-DA scores plots (E) of rat serum from CON, MOD and GLJH (E), permutation test form PLS-DA (F); PLS-DA scores plots (G) of rat serum from CON, MOD and JGSQW (G), permutation test form PLS-DA (H); OPLS-DA scores plots (I) of rat serum from CON and MOD (I), S-plot form OPLS-DA (J) |
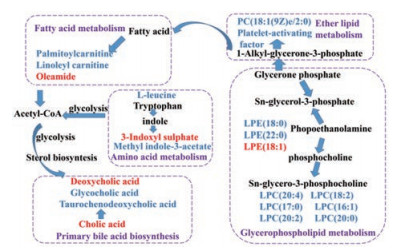
对与疾病和药效相关的血清样本的差异变量通过HMDB数据库并结合二级碎片离子进行鉴定指认。共鉴定指认出22个与肾阳虚证和龟龄集疗效相关的差异代谢物(表 2)。结合相对含量热图(图 5)可知, 龟龄集低剂量干预后可回调19个代谢物, 显著回调LPC(20:4)、PC(0:0/18:1)、LPC(18:2)、LPC(20:0)、血小板活化因子(platelet-activating factor, PAF); 龟龄集中剂量干预后可回调17个代谢物, 显著回调L-亮氨酸、LPC(20:4)、油酰胺、PAF, 龟龄集高剂量干预后可回调19个代谢物, 显著回调L-亮氨酸、LPC(18:2)、PAF、油酰胺; 金匮肾气丸干预后可回调14个代谢物, 显著回调L-亮氨酸、LPC(20:4)、PAF, 并用回调率(regulatory ratio)表示龟龄集对肾阳虚证的回调作用, 回调率=(相对峰面积给药组-相对峰面积模型组)/(相对峰面积空白组-相对峰面积模型组)×100% (表 2)。表明龟龄集对肾阳虚证大鼠的血清代谢轮廓具有一定的调控作用。采用Metabo Analyst对差异代谢物所涉及代谢通路进行富集分析, 代谢通路影响值(impact value) > 0.1以及-logP > 4的代谢通路被视为贡献最大的代谢途径(图 6), 主要包括缬氨酸、亮氨酸和异亮氨酸的生物合成、醚酯代谢、初级胆汁酸的生物合成。利用KEGG数据库和Metabo Analyst对22个差异代谢物进行代谢通路关联分析(图 7), 可见肾阳虚证涉及多个代谢途径紊乱, 经龟龄集治疗后有回调趋势, 提示龟龄集可使代谢通路的紊乱得到有效调节。
| Table 2 Differential metabolites related to effects of GLJ on rats with Kidney-Yang deficiency. ↑ and ↓ represent higher and lower level; *P < 0.05; MOD/CON, MOD group compared with CON group; L/MOD, GLJL group compared with MOD group; M/MOD, GLJM group compared with MOD group; H/MOD, GLJH group compared with MOD group; J/MOD, JGSQW group compared with MOD group; Ratio of L, regulation ratio of GLJL group; Ratio of M, regulation ratio of GLJM group; Ratio of H, regulation ratio of GLJH group; Ratio of J, regulation ratio of JGSQW group |
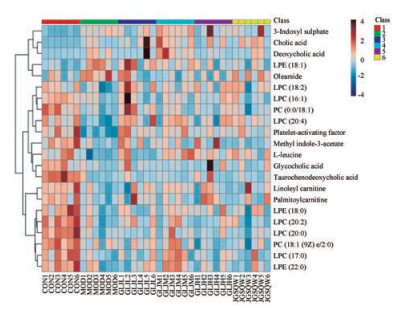
|
Figure 5 Heatmap of relative peak areas of metabolites in serum of rats. The ribbon -4 - 4 represents the relative content of the differential metabolites from low to high |

|
Figure 6 Pathways analysis of differential metabolites |
|
Figure 7 The metabolic network involved in MOD group and CON group; red fonts represent up-regulated metabolites, and blue fonts represent down-regulated metabolites in the MOD vs CON; purple fonts represent the metabolic pathways |
本研究采用大剂量注射氢化可的松导致大鼠肾阳虚模型, 探讨龟龄集对大鼠肾阳虚证的作用机制。利用体质量、行为学和生化指标等指标对龟龄集进行药效学评价, 同时采用LC-MS代谢组学技术对各组大鼠的血清样本进行代谢轮廓分析, 筛选差异代谢物和相关代谢通路。代谢组学鉴定了22个与肾阳虚证相关的血清生物标志物, 龟龄集干预后对21个代谢物有回调作用, 其中7个代谢物可显著回调。综合多方面评价结果, 龟龄集高剂量的调节作用较明显(略优于金匮肾气丸组)。但由于肾阳虚证有广泛的病理基础[11], 还应结合毒理学和临床中医进一步探索最优剂量。
亮氨酸是蛋白质合成的必需氨基酸, 亮氨酸的碳骨架可用于产生ATP。支链氨基酸亮氨酸、异亮氨酸和缬氨酸对于脑氮稳态, 神经递质再循环非常重要, 并且可以作为三羧酸(TCA)循环中的能量底物[12, 13]。中枢神经系统是调节食物摄入、能量平衡和葡萄糖稳态的重要场所, 有研究报道, 亮氨酸通过激活雷帕霉素靶蛋白(mTOR), 调节下丘脑mTOR/S6K1信号调节食物摄入和能量平衡[14-16]。色氨酸是维持人体蛋白质生物合成和确保神经递质(血清素和褪黑激素)合成的必要条件[17]。微生物酶对色氨酸代谢产生一系列吲哚硫酸盐, 吲哚硫酸酯作为肠道微生物群代谢活性的标志物, 对肠黏膜稳态和肠屏障功能的维持起着重要作用, 同时也具有抗氧化、神经保护作用。但其过度积累会诱导炎症过程, 促进肾缺血及肾小管上皮间质转变, 增加肾的氧化应激, 是造成慢性肾病的原因之一[18-20]。给药组异亮氨酸水平回调提示龟龄集对能量代谢和中枢神经系统有一定的调控作用, 吲哚硫酸盐水平回调提示其对色氨酸代谢有一定调控作用, 对神经递质和肠道稳态有调节作用。
醚酯是由过氧化物衍生的甘油磷脂[21], 醚酯类物质为内源性抗氧化剂, 参与细胞分化和信号传导途径, 在神经系统疾病、癌症和代谢紊乱中具有一定生物性能[22]。溶血性甘油磷脂(LPC)调节多种生物学过程, 包括细胞增殖和炎症, 可以激活多种免疫细胞。LPC可以通过其在心磷脂合成途径中的作用影响线粒体氧化能力, 进而影响能量代谢[23, 24]。肉毒碱的主要生物学作用是通过可溶性结合辅酶A (CoA)的酰基来运输脂肪酸穿过线粒体内膜进行脂肪酸氧化并释放能量[25]。肉毒碱的缺陷可能导致线粒体功能障碍, 是导致许多神经退行性疾病的原因[26]。油酰胺是一种作用于中枢系统的脂肪酸酰胺, 属于内源性脂质信号分子, 已被确定为哺乳动物大脑中的内源性睡眠诱导剂[27]。龟龄集对脂质代谢的调节作用提示其可能与改善抗氧化能力、免疫状况、能量代谢和维持神经系统稳态相关。
胆汁酸是肝细胞内胆固醇的转化产物。异常升高的胆汁酸可导致肝内有毒胆汁酸的积聚, 从而产生病理生理效应, 包括线粒体功能失调, 活性氧和氮的过度产生。胆汁酸的不同形式在肝肠循环起着重要的作用, 甘氨酸有助于促进脂溶性维生素的吸收, 在促进胃肠系统消化, 运输和代谢营养素方面起着至关重要的作用[28]。牛磺酸脱氧胆酸是一种具有强效抗细胞凋亡和存活特性的分子, 已被报道可用于预防大鼠和细胞培养模型中的急性肾损伤[29]。肾阳虚模型中胆汁酸和脱氧胆酸含量较对照组显著上升, 提示肾阳虚证可能致肝毒性并造成线粒体功能的失调, 而甘氨酸和牛磺酸脱氧胆酸下降提示肾阳虚证可能导致肠胃系统的失衡和肾上腺损伤。龟龄集可回调提示其可能通过调节线粒体稳态、肠胃稳态, 缓解肾上腺损伤来发挥作用。
综上, 龟龄集对大鼠肾阳虚证有明显的改善作用, 起效机制涉及能量代谢、肠道稳态、氧化应激和免疫功能。
| [1] | Zhao XZ, Zhao SJ, Tian JS, et al. Research progress on material basis of Guilingji based on pharmacodynamical effect[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 1424–1431. |
| [2] | Li K, Zhao SJ, Qin XM, et al. Development thoughts of GuiLing-Ji based on development strategies of traditional chinese medicine secret varieties[J]. World Sci Technol/Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2014, 16: 2493–2499. |
| [3] | Zheng YL, Guo CR, Sun ZM, et al. Advances in the biological basis of kidney yang deficiency syndrome[J]. Chin J Tradit Med Sci Technol (中国中医药科技), 2019, 26: 318–319. |
| [4] | Huang D, Yang J, Lu X, et al. An integrated plasma and urinary metabonomic study using UHPLC-MS:intervention effects of Epimedium koreanum on 'Kidney-Yang Deficiency syndrome' rats[J]. J Pharm Biomed Anal, 2013, 76: 200–206. DOI:10.1016/j.jpba.2012.12.022 |
| [5] | Lu X, Xiong Z, Li J, et al. Metabonomic study on 'Kidney-Yang Deficiency syndrome' and intervention effects of Rhizoma Drynariae extracts in rats using ultra performance liquid chromatography coupled with mass spectrometry[J]. Talanta, 2011, 83: 700–708. DOI:10.1016/j.talanta.2010.09.026 |
| [6] | Puchades-Carrasco L, Pineda-Lucena A. Metabolomics in pharmaceutical research and development[J]. Curr Opin Biotechnol, 2015, 35: 73–77. DOI:10.1016/j.copbio.2015.04.004 |
| [7] | Zhang AH, Sun H, Qiu S, et al. Recent highlights of metabolomics in Chinese medicine syndrome research[J]. Evid Based Compl Alternat Med, 2013, 2013: 402159. |
| [8] | Liang ML, Zhao F, Fang Y, et al. Hippocampus metabolomic research on antidepressant mechanism of petroleum ether fraction of Bupleuri Radix by LC-MS in rats[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 2291–2301. |
| [9] | An R, Li B, You L, et al. Improvement of kidney yang syndrome by icariin through regulating hypothalamus-pituitary-adrenal axis[J]. Chin J Integr Med, 2015, 21: 765–771. DOI:10.1007/s11655-015-2063-z |
| [10] | Wang DF, Wang YL, Wang YW, et al. Effect of Huangqin Tang on serum metabolic profile in rats with ulcerative colitis based on UHPLC-MS[J]. Acta Pharm Sin (药学学报), 2017, 52: 1306–1312. |
| [11] | Zhang A, Liu Q, Zhao H, et al. Phenotypic characterization of nanshi oral liquid alters metabolic signatures during disease prevention[J]. Sci Rep, 2016, 6: 19333. DOI:10.1038/srep19333 |
| [12] | Andersen JV, Skotte NH, Aldana BI, et al. Enhanced cerebral branched-chain amino acid metabolism in R6/2 mouse model of Huntington's disease[J]. Cell Mol Life Sci, 2019, 76: 2449–2461. DOI:10.1007/s00018-019-03051-2 |
| [13] | Shimomura Y, Harris RA. Metabolism and physiological function of branched-chain amino acids:discussion of session 1[J]. J Nutr, 2006, 136: 232S–233S. DOI:10.1093/jn/136.1.232S |
| [14] | Morton GJ, Meek TH, Schwartz MW. Neurobiology of food intake in health and disease[J]. Nat Rev Neurosci, 2014, 15: 367–378. |
| [15] | Cota D, Proulx K, Smith KAB, et al. Hypothalamic mTOR signaling regulates food intake[J]. Science, 2006, 312: 927–930. DOI:10.1126/science.1124147 |
| [16] | Pedroso J, Zampieri T, Donato J. Reviewing the effects of L-leucine supplementation in the regulation of food intake, energy balance, and glucose homeostasis[J]. Nutrients, 2015, 7: 3914–3937. DOI:10.3390/nu7053914 |
| [17] | Pavlova T, Vidova V, Bienertova-Vasku J, et al. Urinary intermediates of tryptophan as indicators of the gut microbial metabolism[J]. Anal Chim Acta, 2017, 987: 72–80. DOI:10.1016/j.aca.2017.08.022 |
| [18] | Veldeman L, Vanmassenhove J, Van Biesen W, et al. Evolution of protein-bound uremic toxins indoxyl sulphate and p-cresyl sulphate in acute kidney injury[J]. Int Urol Nephrol, 2019, 51: 293–302. DOI:10.1007/s11255-018-2056-x |
| [19] | Kaminski TW, Pawlak K, Karbowska M, et al. The impact of antihypertensive pharmacotherapy on interplay between proteinbound uremic toxin (indoxyl sulfate) and markers of inflammation in patients with chronic kidney disease[J]. Int Urol Nephrol, 2019, 51: 491–502. DOI:10.1007/s11255-018-02064-3 |
| [20] | Kamiński TW, Pawlak K, Karbowska M, et al. Indoxyl sulfatethe uremic toxin linking hemostatic system disturbances with the prevalence of cardiovascular disease in patients with chronic kidney disease[J]. BMC Nephrol, 2017, 18: 35–46. DOI:10.1186/s12882-017-0457-1 |
| [21] | Dean JM, Lodhi IJ. Structural and functional roles of ether lipids[J]. Protein Cell, 2018, 9: 196–206. DOI:10.1007/s13238-017-0423-5 |
| [22] | Kawanishi N, Kato Y, Yokozeki K, et al. Effects of aging on serum levels of lipid molecular species as determined by lipidomics analysis in Japanese men and women[J]. Lipids Health Dis, 2018, 17: 135–142. DOI:10.1186/s12944-018-0785-6 |
| [23] | Légrádi A, Chitu V, Szukacsov V, et al. Lysophosphatidylcholine is a regulator of tyrosine kinase activity and intracellular Ca2+ level in Jurkat T cell line[J]. Immunol Lett, 2004, 91: 17–21. DOI:10.1016/j.imlet.2003.10.009 |
| [24] | Semba RD, Zhang P, Adelnia F, et al. Low plasma lysophosphatidylcholines are associated with impaired mitochondrial oxidative capacity in adults in the Baltimore Longitudinal Study of Aging[J]. Aging Cell, 2019, 18: e12915. |
| [25] | Cristofano A, Sapere N, La Marca G, et al. Serum levels of acyl-carnitines along the continuum from normal to Alzheimer's dementia[J]. PLoS One, 2016, 11: e0155694. DOI:10.1371/journal.pone.0155694 |
| [26] | Reuter SE, Evans AM. Long-chain acylcarnitine deficiency in patients with chronic fatigue syndrome. Potential involvement of altered carnitine palmitoyltransferase-I activity[J]. J Intern Med, 2011, 270: 76–84. DOI:10.1111/j.1365-2796.2010.02341.x |
| [27] | Yamamoto S, Takehara M, Ushimaru M. Inhibitory action of linoleamide and oleamide toward sarco/endoplasmic reticulum Ca2+-ATPase[J]. Biochim Biophys Acta Gen Subj, 2017, 1861: 3399–3405. DOI:10.1016/j.bbagen.2016.09.001 |
| [28] | Zhou H, Hylemon PB. Bile acids are nutrient signaling hormones[J]. Steroids, 2014, 86: 62–68. DOI:10.1016/j.steroids.2014.04.016 |
| [29] | Gupta S, Li S, Abedin MJ, et al. Prevention of acute kidney injury by tauroursodeoxycholic acid in rat and cell culture models[J]. PLoS One, 2012, 7: e48950. DOI:10.1371/journal.pone.0048950 |
 2019, Vol. 54
2019, Vol. 54


