2. 安徽中医药大学药学院, 安徽 合肥 230012
2. College of Pharmacy, Anhui University of Chinese Medicine, Hefei 230012, China
缺血性脑卒中是由多种原因所致的局部脑组织区域血液供应障碍, 导致严重的代谢应激并引发缺血级联, 产生一系列病理性损伤, 如氧化应激、兴奋性氨基酸毒性、钙超载、炎症反应等, 引起神经元凋亡或死亡并产生不可逆的组织损伤(缺血核心)[1]。组织型纤溶酶原激活剂(t-PA)是迄今为止唯一被美国食品和药品管理局(FDA)批准用于治疗急性缺血性脑卒中的溶栓药物, 但较窄的治疗时间窗及较高的出血转化(HT)发生率限制了t-PA的临床应用, 只有约3.4%~5.2%的急性脑卒中患者能够接受t-PA治疗[2]。除再灌注策略外, 神经保护一直是脑卒中研究的一个重要领域, 其目标是增强神经元存活率并改善脑卒中的预后。在患者有小血管闭塞的情况下, 采用t-PA治疗或自发再灌注时迫切需要神经保护剂。在较大动脉阻塞引起的缺血性脑卒中患者中, 血管内血栓切除术可提高血管再通率, 但对于神经保护和神经恢复剂同样需求迫切[3]。
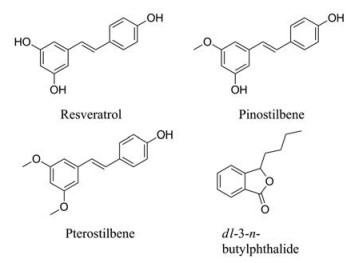
白藜芦醇(resveratrol, 图 1)是具有二苯乙烯结构的天然产物。研究表明, 白藜芦醇具有抗炎和抗氧化特性, 能够增加β-淀粉样蛋白(Aβ)清除率, 调节参与神经细胞存活/死亡的细胞内效应物, 在多种细胞毒性模型中显示出神经保护活性[4]。天然白藜芦醇衍生物松芪(pinostilbene, 图 1)在SH-SY5Y神经母细胞瘤细胞中发挥有效的神经保护作用, 其有效浓度范围比白藜芦醇更宽[5]。紫檀芪(pterostilbene, 图 1)低剂量时能显著改善SAMP8小鼠的径向臂水迷宫功能, 以及炎症和细胞应激的正调节, 而白藜芦醇显示无效[6]。因此, 对白藜芦醇羟基结构修饰能够提高白藜芦醇的神经保护能力。
|
Figure 1 Resveratrol, pinostilbene, pterostilbene and dl-3-n-butylphthalide (NBP) |
丁苯酞(dl-3-n-butylphthalide, NBP, 图 1)是我国研制的具有自主知识产权的抗脑缺血药物, 于2002年被批准用作缺血性卒中的治疗。药理学研究表明, NBP在抑制血小板聚集改善微循环的同时, 又能改善线粒体功能, 抑制谷氨酸释放, 阻止神经细胞凋亡, 可作用于脑卒中的多个病理环节。在临床上, 其可作为神经保护剂与其他药物联合使用。此外, 研究表明NBP的衍生物对氧化损伤和细胞凋亡具有很好的保护作用, 丁苯酞可作为神经细胞保护的活性片段, 运用于抗脑缺血药物的研发中[7-9]。
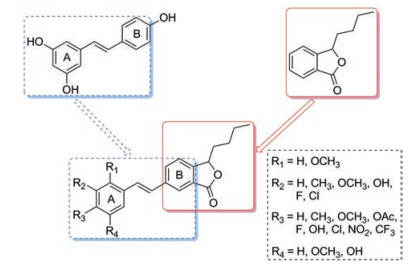
基于白藜芦醇和丁苯酞良好的神经细胞保护作用, 将两者的结构进行拼合, 期望获得一类新型的神经细胞保护剂。因此, 本文以白藜芦醇为先导化合物, 将丁苯酞替代其结构中的B环片段, 设计合成了20个白藜芦醇-丁苯酞杂合物(图 2), 通过氧糖剥夺/复氧(oxygen-glucose deprivation/reoxygenation, OGD/R)模型检测化合物对神经细胞的保护活性, 并采用Western印迹法对其作用机制进行初步探究。同时对该系列化合物的构效关系进行总结。
|
Figure 2 The design of target compounds |
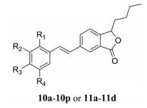
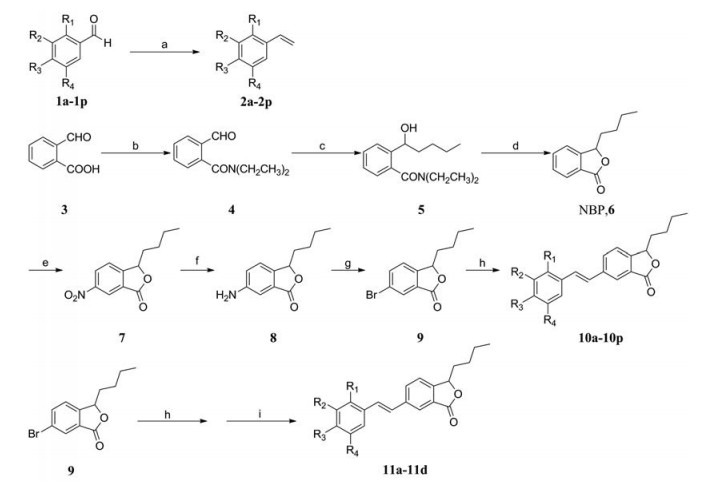
目标化合物的合成如合成路线1所示。以市售的邻羧基苯甲醛3为原料, 二乙胺保护羧基, 与正丁基溴化镁反应, 对甲苯磺酸催化得到丁苯酞6; 与硝酸钾和浓硫酸发生硝化反应, 铁粉/氯化铵还原硝基, 桑德迈尔反应得到化合物6-溴丁苯酞9, 该方法与已报道化合物9的合成方法[10]相比操作简单, 收率更高。化合物1a~1p通过Wittig反应得到化合物2a~2p, 再与9进行Heck反应得到目标化合物10a~10p, 三溴化硼脱甲氧基得到目标化合物11a~11d。所有目标化合物结构均经1H NMR、13C NMR和ESI-MS确证, 其收率、理化常数及波谱数据分别见表 1、2。
| Table 1 Structures and properties of compounds 10a-10p, 11a-11d |
| 表 2 Spectral data of target compounds |
体外抗氧糖剥夺诱导大鼠脑皮层神经元损伤的保护实验结果如表 3所示, 化合物10a~10c、10g~10i、10p和11a~11d与OGD/R相比, 在低中高3种剂量下均能够显著提高细胞存活率(P < 0.05);其中化合物10h与10i的神经保护作用最为突出, 其细胞存活率显著高于先导化合物白藜芦醇以及阳性药丁苯酞, 尤其在剂量为1 μmol·L-1时, 优于白藜芦醇(67.44 ± 2.41 μmol·L-1)和丁苯酞(72.12 ± 1.52 μmol·L-1), 显示出良好的神经保护作用。
| Table 3 Neuroprotective effects of target compounds against OGD/R-induced neurotoxicity in rat cortical neurons. *P < 0.05, **P < 0.01 vs OGD/R; #P < 0.05, ##P < 0.01 vs NBP; △P < 0.05, △△P < 0.01 vs resveratrol |
依据上述测试结果, 选择化合物10h和10i进一步评价其神经保护作用机制。Western blot结果(图 3)显示, 化合物10h和10i均可呈浓度依赖性地上调Akt磷酸化水平, 化合物在10 μmol·L-1下可极显著上调Akt磷酸化水平(P < 0.001), 而化合物10h则在低浓度(0.1 μmol·L-1)下对Akt磷酸化无显著影响; 此外, Control组、OGD/R组和各浓度化合物组中Akt表达无明显差异。结果提示化合物10h和10i可能通过激活PI3K/Akt通路, 上调Akt磷酸化水平起到神经元保护作用。
|
Scheme 1 Synthetic route of target compounds. Reagents and conditions: a: CH3PPh3Br, NaNH2, THF, 0 ℃; b: 1) SOCl2, toluene; 2) HN(Et)2, CH2Cl2, 0 ℃; c: Mg, I2, Br(CH2)3CH3, THF, -20 ℃; d: p-TsOH·H2O, toluene, 80 ℃; e: K2NO3, H2SO4 (Conc.), 0 ℃; f: Fe, NH4Cl, EtOH, H2O, 80 ℃; g: NaNO2, HBr (40%), CuBr; h: Pd(OAc)2, P(O-Tol)3, Et3N, DMF, 100 ℃; i: BBr3, CH2Cl2, -20 ℃ |

|
Figure 3 Effect of different compounds on the phosphorylation levels of Akt and Akt expressions. A: The phosphorylation levels of Akt and Akt expressions were measured with Western blot assay; B, C: Results were mean ± SD for two individual experiments which, for each condition, were performed in triplicate. *P < 0.05, **P < 0.01, ***P < 0.001 vs control |
本文采用药效团拼合原理将白藜芦醇和丁苯酞进行拼接, 并设计合成了20个白藜芦醇-丁苯酞杂合物, 目标化合物经1H NMR、13C NMR、ESI-MS确证。经OGD/R模型初步检测目标化合物的神经细胞保护活性, 结果表明大多数化合物都具有良好的神经细胞保护活性, 其中化合物10h和10i在0.1 μmol·L-1、1 μmol·L-1剂量下的细胞保护活性, 显著高于先导化合物白藜芦醇以及阳性药丁苯酞。通过初步的机制研究表明, 该系列化合物可能通过激活PI3K/Akt通路实现神经细胞保护活性。初步构效关系表明:剂量为1 μmol·L-1时(图 4), 除了三氟甲基外, 在目标化合物的A环中引入单个取代基团都会降低化合物的活性(10a > 11a > 10b > 10d > 10n > 10k), 当引入基团为吸电子基团时, 对化合物的活性降低程度更为明显; 针对取代基为甲氧基而言, A环中取代基数量的增加, 化合物的活性明显增强(10d = 10e > 10f > 10g > 10h > 10i), 其中化合物10i表现出最强的细胞保护活性(81.75 ± 1.07 μmol·L-1)。本研究结果为进一步优化白藜芦醇-丁苯酞杂合物作为神经细胞保护剂提供理论依据。
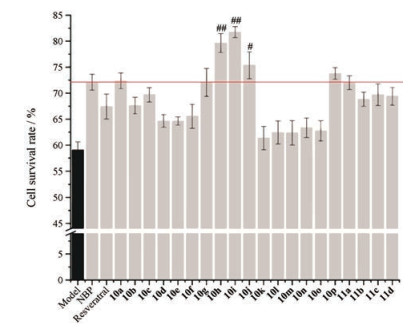
|
Figure 4 Neuroprotective effects of target compounds at the dose 1 μmol·L-1. #P < 0.05, ##P < 0.01 vs NBP group |
实验动物 SPF级SD大鼠乳鼠, 购自安徽医科大学实验动物中心, 动物合格证号: SCXK (皖) 2017-001。动物实验程序均按照国家科学技术委员会发布的《实验动物管理条例》进行, 且经安徽中医药大学实验动物伦理委员会批准。
试剂及仪器 Thermo Scientific MSQ Plus液质联用质谱仪, Agilent 6120 Quadrupole液质联用质谱仪, Bruker 400 MHz超导核磁共振仪(DMSO-d6为溶剂, TMS为内标); WRS-1B数字熔点仪(上海精密科学仪器有限公司, 温度未校正); 所用试剂均为市售分析纯; 柱色谱所用硅胶均为烟台德信生物科技有限公司产品。无糖EBSS培养基(Gibco, Grand Island, NY, USA); 青霉素(Sigma-Aldrich, St. Louis, MO); 链霉素(Sigma-Aldrich, St. Louis, MO); 胰蛋白酶(Gibco, Grand Island, NY, USA); 胎牛血清(Hyclone, Logan, UT, USA); D-Hank's液(Sigma-Aldrich, St. Louis, MO); Anti-phos-Akt antibody, Anti-Akt antibody, Anti-β-actin antibody (CST, Boston, USA); PVDF膜(0.45 μm) (Millipore, Schwalbach, Germany); 预染蛋白Marker (MBI Fermentas, Vilnius, Lithuania); 蛋白裂解液(碧云天生物技术研究所, 上海)。
1 化合物合成 1.1 苯乙烯的合成[11](2a)在一圆底烧瓶中, 加入甲基三苯基溴化膦(6.73 g, 18.85 mmol)、氨基钠(0.74 g, 18.85 mmol)和无水四氢呋喃(20 mL), 氮气保护, 室温反应0.5 h。取苯甲醛(2.0 g, 18.85 mmol)溶于无水四氢呋喃(10 mL), 冰浴下缓慢滴入反应液中, 滴加完毕后继续反应4 h, TLC [V (石油醚):V (乙酸乙酯)=20:1为展开剂]显示反应基本完全。将反应液过滤, 滤液减压浓缩, 经硅胶柱分离得无色油状物1.5 g, 收率76.40%。
类似方法合成化合物2b~2p。
1.2 N, N-二乙基-2-甲酰基苯甲酰胺的合成(4)在一圆底烧瓶中, 加入邻羧基苯甲醛(10.0 g, 66.6 mmol)、氯化亚砜(25 mL)和甲苯(20 mL), 80 ℃下反应4 h, 减压浓缩, 得淡黄色油状物, 备用。在一圆底烧瓶中, 加入二乙胺(19.5 g, 266.4 mmol)和二氯甲烷(80 mL), 将制得的酰氯溶于二氯甲烷(30 mL), 冰浴条件下缓慢滴入反应液中, 滴加完毕后继续反应5 h, TLC [V (石油醚):V (乙酸乙酯)=2:1为展开剂]显示反应基本完全。向反应液中加入二氯甲烷(100 mL)稀释, 经水(2× 100 mL)、0.5 mol·L-1盐酸(100 mL)、饱和碳酸氢钠水溶液(100 mL)和饱和氯化钠水溶液(100 mL)洗涤, 无水硫酸钠干燥, 过滤, 滤液减压浓缩, 经硅胶柱分离得淡黄色油状物12.0 g, 收率87.78 %。
1.3 N, N-二乙基-2-(1-羟戊基)苯甲酰胺的合成(5)在一干燥的三颈瓶中, 加入镁屑(2.13 g, 87.69 mmol)、碘(2粒)和无水四氢呋喃(40 mL), 氮气保护。取溴代正丁烷(12.0 g, 87.69 mmol)溶于无水四氢呋喃(40 mL), 缓慢滴入反应液中, 室温下搅拌, 保持反应温度不超过60 ℃, 滴加完毕后50 ℃下继续反应1 h, 将反应液降至室温后移入-20 ℃冷却液中。取N, N-二乙基-2-甲酰基苯甲酰胺(12.0 g, 58.46 mmol)溶于无水四氢呋喃(40 mL), 缓慢滴入格式试剂中, 滴加完毕后回温反应, TLC [V (石油醚):V (乙酸乙酯)=2:1为展开剂]显示反应基本完全。向反应液中滴加饱和氯化铵水溶液(80 mL), 滴加完毕后将反应液减压浓缩, 经乙酸乙酯(3× 60 mL)萃取, 合并有机相, 饱和氯化钠水溶液(100 mL)洗涤, 无水硫酸钠干燥, 过滤, 滤液减压浓缩得黄色油状物, 直接投入下一步反应。
1.4 3-丁基-异苯并呋喃-1(3H)-酮的合成(6)在一圆底烧瓶中, 加入N, N-二乙基-2-(1-羟戊基)苯甲酰胺(粗品)、对甲苯磺酸一水合物(11.12 g, 58.46 mmol)和甲苯(50 mL), 80 ℃下反应1 h, TLC [V (石油醚):V (乙酸乙酯)=10:1为展开剂]显示反应基本完全。向反应液中加入乙酸乙酯(100 mL)稀释, 经水(2×100 mL)和饱和氯化钠水溶液(100 mL)洗涤, 无水硫酸钠干燥, 过滤, 滤液减压浓缩, 经硅胶柱分离得淡黄色油状物8.67 g。
1.5 3-丁基-6-硝基异苯并呋喃-1(3H)-酮的合成[12] (7)在一圆底烧瓶中, 加入3-丁基-异苯并呋喃-1(3H)-酮(11.0 g, 57.82 mmol)和浓硫酸(50 mL), 冰浴条件下搅拌。取硝酸钾(6.43 g, 63.60 mmol)溶于浓硫酸(20 mL), 缓慢滴入反应液中, 滴加完毕后继续反应2 h, TLC [V (石油醚):V (乙酸乙酯)=10:1为展开剂]显示反应基本完全。将反应液缓慢倒入冰水(200 mL)中, 经乙酸乙酯(3×50 mL)萃取, 合并有机相, 饱和氯化钠水溶液(100 mL)洗涤, 无水硫酸钠干燥, 过滤, 滤液减压浓缩得黄色油状物, 直接投入下一步反应。
1.6 3-丁基-6-氨基异苯并呋喃-1(3H)-酮的合成(8)在一圆底烧瓶中, 加入3-丁基-6-硝基异苯并呋喃-1(3H)-酮(粗品)、还原铁粉(12.92 g, 231.28 mmol)、氯化铵(18.56 g, 346.92 mmol)、乙醇(90 mL)和水(10 mL), 80 ℃下反应4 h, TLC [V (二氯甲烷):V (甲醇)=20:1为展开剂]显示反应基本完全。将反应液过滤, 滤饼经乙醇洗涤数次, 合并滤液, 减压浓缩。浓缩液加入二氯甲烷(100 mL)稀释, 经水(2×100 mL)和饱和氯化钠水溶液(100 mL)洗涤, 无水硫酸钠干燥, 过滤, 滤液减压浓缩, 经硅胶柱分离得黄色固体9.0 g。
1.7 3-丁基-6-溴异苯并呋喃-1(3H)-酮的合成[10] (9)在一圆底烧瓶中, 加入3-丁基-6-氨基异苯并呋喃-1(3H)-酮(5.0 g, 24.36 mmol)和40%氢溴酸(30 mL)。取亚硝酸钠(1.85 g, 26.8 mmol)溶于水(5 mL), 冰浴下缓慢加入反应液中, 保持反应温度0~5 ℃, 滴加完毕后继续反应0.5 h, 备用。在一圆底烧瓶中, 加入溴化亚铜(3.5 g, 24.36 mmol)和40%氢溴酸(80 mL), 75 ℃下搅拌, 将制得的重氮盐溶液加入反应中, 继续反应2 h, TLC [V (石油醚):V (乙酸乙酯)=10:1为展开剂]显示反应基本完全。反应液降至室温后倒入分液漏斗中, 经乙酸乙酯(3×60 mL)萃取, 合并有机相, 饱和氯化钠水溶液(100 mL)洗涤, 无水硫酸钠干燥, 过滤, 滤液减压浓缩, 经硅胶柱分离得白色固体5.2 g, 收率79.31%。
1.8 (E)-3-丁基-6-苯乙烯基异苯并呋喃-1(3H)-酮的合成[13] (10a)在一圆底烧瓶中, 加入3-丁基-6-溴异苯并呋喃-1(3H)-酮(0.5 g, 1.86 mmol)、苯乙烯(0.3 g, 2.88 mmol)、醋酸钯(9.0 mg, 0.04 mmol)、三(邻甲基苯基)磷(24.3 mg, 0.08 mmol)、三乙胺(0.6 g, 5.93 mmol)和N, N-二甲基甲酰胺(20 mL), 氮气保护, 100 ℃下反应4 h, TLC [V (石油醚):V (乙酸乙酯)=10:1为展开剂]显示反应基本完全。将反应液降至室温, 倒入冰水(100 mL)中, 经乙酸乙酯(3×50 mL)萃取, 合并有机相, 饱和氯化钠水溶液(100 mL)洗涤, 无水硫酸钠干燥, 过滤, 滤液减压浓缩, 经硅胶柱分离, 无水乙醇重结晶得淡黄色固体0.42 g, 收率77.23%, mp 96.8~99.6 ℃。
类似方法合成化合物10b~10p。
1.9 (E)-3-丁基-6-(3-羟基苯乙烯基)异苯并呋喃-1(3H)-酮的合成[14] (11a)在一圆底烧瓶中, 加入(E)-3-丁基-6-(3-甲氧基苯乙烯基)异苯并呋喃-1(3H)-酮(1.0 g, 3.1 mmol)和二氯甲烷(20 mL), -20 ℃条件下缓慢滴加三溴化硼的二氯甲烷溶液(1 mol·L-1, 12.4 mL), 滴加完毕后回温反应3 h, TLC [V (石油醚):V (乙酸乙酯)=2:1为展开剂]显示反应基本完全。将反应液倒入冰水(100 mL)中, 经二氯甲烷(3×50 mL)萃取, 合并有机相, 饱和氯化钠水溶液(100 mL)洗涤, 无水硫酸钠干燥, 过滤, 滤液减压浓缩, 经硅胶柱分离, 乙醇重结晶得白色固体0.68 g, 收率71.13%, mp 117.2~120.3 ℃。
类似方法合成化合物11b~11d。
2 目标化合物生物活性评价 2.1 大鼠大脑皮层神经元的原代培养取SD大鼠乳鼠(0~1天), 左手紧握乳鼠颈肩部及四肢, 使头部固定, 常规消毒头皮后, 右手持眼科剪沿正中线剪开头皮与颅骨, 用眼科镊迅速取出整个脑组织, 放入冰上盛有D-Hank's液的玻璃培养皿中, 用镊子仔细剥离脑组织表面血管及脑膜, 再用D-Hank's液反复冲洗脑组织。用眼科剪分别剪取大鼠大脑皮质、海马体, 移入玻璃培养皿中, 剪碎大脑皮质、大鼠海马体, 再加入胰酶, 巴氏管反复吸取脑组织、海马体组织与胰酶混合物, 将两者混匀, 置于37 ℃恒温水浴箱中消化后, 加入含有血清的培养基终止消化, 然后用200目筛网过滤, 滤液离心(800 r·min-1, 10 min), 弃去上清液, 加适量培养液悬浮沉淀, 接种于6孔塑料培养板, 置37 ℃、5% CO2孵箱中培养。
2.2 化合物对大鼠脑皮层神经元缺氧缺糖损伤的保护选取生长到第7天左右的细胞进行体外OGD/R模型。调节细胞密度, 以4×104的细胞密度接种于48孔培养板中。使用分别含有1% FBS以及对应浓度的含药DMEM培养基, 常规培养24 h后开始制备OGD/R模型。首先将培养基更换为不含葡萄糖与血清的DMEM培养基, 同时将细胞置于含有5% CO2、95% N2三气培养箱中培养2 h, 完成缺氧过程; 随后将细胞培养基更换为完全DMEM培养基, 同时将细胞置于含有5% CO2、20% O2培养箱中培养24 h, 完成复氧过程, 孵育结束前4 h, 每孔加入MTT溶液(5 mg·mL-1) 20 μL。孵育结束后, 弃去各孔上清液, 每孔加入DMSO 150 μL, 细胞振荡仪上振荡10 min, 待结晶物充分溶解后用酶标仪测定OD570。通过设置模型对照组, 计算不同组别脑皮层神经元细胞存活率, 结果采用mean ± SD形式表示。数据组间统计学差异采用one-way ANOVA和Dunnett's检验, P值小于0.05认为有显著性差异。公式:存活率=(实验组OD值/空白对照组OD值)×100%。
2.3 Western blot实验细胞复氧培养24 h后, 弃去培养基, 加入预冷4 ℃ PBS, 轻柔洗涤3次, 然后将PBS甩干后置于冰面上, 在具有PMSF的RIPA裂解缓冲液中裂解30 min, 使用BCA蛋白质测定试剂盒测定蛋白质浓度。通过10%~15% (w/v) SDS-PAGE分离蛋白质的等分试样(每泳道30 μg), 然后转移到PVDF膜上。将膜在含有5% (w/v)脱脂乳的TBST中在室温下封闭2 h, 并与p-Akt (Ser 473)、Akt和β-肌动蛋白(β-actin, 1:5 000)在4 ℃过夜。用TBST洗涤3次后, 将膜与HRP缀合的山羊抗兔IgG二抗(1:1 000)在室温下孵育1 h, 然后用TBST洗涤3次。等体积混合化学发光试剂A液和B液, 将膜蛋白面向下与此混合液充分接触; 使用Tanon 6600发光成像工作站进行检测, 并使用Image Pro Plus 6.0软件对光密度值进行分析, 将待测蛋白水平与内参照β-actin/非磷酸化蛋白水平进行对比, 表示蛋白相对表达水平/磷酸化水平。
| [1] | Ayuso MI, Gonzalo-Gobernado R, Montaner J. Neuroprotective diets for stroke[J]. Neurochem Int, 2017, 107: 4–10. DOI:10.1016/j.neuint.2017.01.013 |
| [2] | Sifat AE, Vaidya B, Abbruscato TJ. Blood-brain barrier protection as a therapeutic strategy for acute ischemic stroke[J]. AAPS J, 2017, 19: 957–972. DOI:10.1208/s12248-017-0091-7 |
| [3] | Vaidya B, Sifat AE, Karamyan VT, et al. The neuroprotective role of the brain opioid system in stroke injury[J]. Drug Discov Today, 2018, 23: 1385–1395. DOI:10.1016/j.drudis.2018.02.011 |
| [4] | Bastianetto S, Menard C, Quirion R. Neuroprotective action of resveratrol[J]. Biochim Biophys Acta, 2015, 1852: 1195–1201. DOI:10.1016/j.bbadis.2014.09.011 |
| [5] | Chao J, Li H, Cheng KW, et al. Protective effects of pinostilbene, a resveratrol methylated derivative, against 6-hydroxydopamine-induced neurotoxicity in SH-SY5Y cells[J]. J Nutr Biochem, 2010, 21: 482–489. DOI:10.1016/j.jnutbio.2009.02.004 |
| [6] | Chang J, Rimando A, Pallas M, et al. Low-dose pterostilbene, but not resveratrol, is a potent neuromodulator in aging and Alzheimer's disease[J]. Neurobiol Aging, 2012, 33: 2062–2071. DOI:10.1016/j.neurobiolaging.2011.08.015 |
| [7] | Yin W, Lan L, Huang Z, et al. Discovery of a ring-opened derivative of 3-n-butylphthalide bearing NO/H2S-donating moieties as a potential anti-ischemic stroke agent[J]. Eur J Med Chem, 2016, 115: 369–380. DOI:10.1016/j.ejmech.2016.03.044 |
| [8] | Barta-Szalai G, Borza I, Bozó E, et al. Oxamides as novel NR2B selective NMDA receptor antagonists[J]. Bioorg Med Chem Lett, 2004, 14: 3953–3956. DOI:10.1016/j.bmcl.2004.05.053 |
| [9] | Wang X, Wang L, Li T, et al. Novel hybrids of optically active ring-opened 3-n-butylphthalide derivative and isosorbide as potential anti-ischemic stroke agents[J]. J Med Chem, 2013, 56: 3078–3089. DOI:10.1021/jm4001693 |
| [10] | Wang W, Cha XX, Reiner J, et al. Synthesis and biological activity of n-butylphthalide derivatives[J]. Eur J Med Chem, 2010, 45: 1941–1946. DOI:10.1016/j.ejmech.2010.01.036 |
| [11] | Sun B, Hoshino J, Jermihov K, et al. Design, synthesis, and biological evaluation of resveratrol analogues as aromatase and quinone reductase 2 inhibitors for chemoprevention of cancer[J]. Bioorg Med Chem, 2010, 18: 5352–5366. DOI:10.1016/j.bmc.2010.05.042 |
| [12] | Wang X, Wang L, Huang Z, et al. Synthesis and biological evaluation of nitric oxide releasing derivatives of 6-amino-3-n-butylphthalide as potential antiplatelet agents[J]. Bioorg Med Chem Lett, 2013, 23: 1985–1988. DOI:10.1016/j.bmcl.2013.02.035 |
| [13] | Nobre SM, Muniz MN, Seferin M, et al. The synthesis of non-symmetrical stilbene analogs of trans-resveratrol using the same Pd catalyst in a sequential double-Heck arylation of ethylene[J]. Appl Org Chem, 2011, 25: 289–293. DOI:10.1002/aoc.1756 |
| [14] | Uzura S, Sekine-Suzuki E, Nakanishi I, et al. A facile and rapid access to resveratrol derivatives and their radioprotective activity[J]. Bioorg Med Chem Lett, 2016, 26: 3886–3891. DOI:10.1016/j.bmcl.2016.07.018 |
 2019, Vol. 54
2019, Vol. 54